Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Betriebs- und Biocontainment-Verfahren einer Anlage für Labormäuse mit natürlichem Mikrobiom: Immunphänotypisierungsverfahren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir den Aufbau und die Betriebsabläufe, einschließlich mikrobieller Eindämmungsmaßnahmen einer Anlage zur "Wilding von Mäusen" am Beispiel von Blutproben zur Immunphänotypisierung.
Zusammenfassung
Die Verwendung von Labormäusen mit natürlichem Mikrobiom, wie z.B. "Wildling-Mäusen", bietet aufgrund ihrer großen Ähnlichkeit mit dem menschlichen Superorganismus ein vielversprechendes Forschungswerkzeug sowohl für die Grundlagen- als auch für die angewandte Wissenschaft. Die Zucht und der Erhalt dieser Mäuse, die ein vielfältiges Mikrobiom aus Bakterien, Viren und Parasiten beherbergen, stellen die Tierhaltungseinrichtungen an Forschungseinrichtungen jedoch vor große Herausforderungen. Um diesen Herausforderungen zu begegnen, wurde an der Charité - Universitätsmedizin Berlin ein spezielles Anlagenkonzept für die Unterbringung von "Wildling-Mäusen" entwickelt. Bei diesem Ansatz wurde eine Einrichtung mit spezifischen strukturellen Merkmalen und Betriebsprotokollen entworfen, um das natürliche Mikrobiom effektiv einzudämmen und so Bereiche mit höheren Hygienestandards zu schützen.
Es wird eine Methodik für die Blutentnahme sowohl von spezifizierten erregerfreien (SPF) als auch von "Wildling-Mäusen" für die Immunphänotypisierung demonstriert, wobei der Arbeitsablauf und die in der Einrichtung implementierten Biocontainment-Maßnahmen hervorgehoben werden. Bemerkenswerte Ergebnisse zeigen, dass "Wildling-Mäuse", die einem natürlichen Mikrobiom ausgesetzt sind, ausgeprägte Immunzellpopulationen entwickeln, die bei Mäusen, die gezüchtet und unter strengen Hygienebedingungen gehalten werden, deutlich reduziert sind.
Die Bedeutung dieser Studie liegt in ihrem Potenzial, Forschern Zugang zu Mäusen zu verschaffen, die ein natürliches Mikrobiom und ein ausgereiftes Immunsystem besitzen, das dem von erwachsenen Menschen ähnelt. Dieser Ansatz könnte die Übertragbarkeit präklinischer Erkenntnisse in die klinische Praxis verbessern und damit das Feld der biomedizinischen Forschung voranbringen.
Einleitung
Experimente an Mäusen sind in der Grundlagen- und angewandten Wissenschaft, wie z.B. in der präklinischen und toxikologischen Forschung, nach wie vor unverzichtbar. Die Standardisierung der Hygiene in Laborumgebungen, die darauf abzielt, biologisches Rauschen zu reduzieren und die Variabilität der Versuchsergebnisse zu minimieren, hat jedoch dazu geführt, dass die natürliche Mikrobiota weitgehend ausgeschlossen wurde. So unterscheiden sich die Bedingungen, unter denen hygienisch standardisierte, spezifizierte pathogenfreie (SPF) Labormäuse geboren und gehalten werden, von den realen Bedingungen, denen Mensch und Tier normalerweise ausgesetzt sind. Diese Diskrepanz zwischen Laborbedingungen und der natürlichen Umgebung, in der menschliche Krankheiten auftreten, führt zu dem "Standardisierungsirrtum": Die Annahme, dass die Minimierung der Variation der experimentellen Bedingungen die translationalen Ergebnisse verbessert. In der Realität schränkt sie jedoch die biologische Relevanz der Befunde ein 1,2. So hat die Forschung beispielsweise gezeigt, dass das Fehlen einer mikrobiellen und umweltbedingten Vielfalt bei SPF-Mäusen zu einem unterentwickelten Immunsystem führen kann, was die Gültigkeit immunologischer und präklinischer Studien untergräbt3.
Es wurden mehrere Ansätze vorgeschlagen, um die biologische Variation in Mausmodellen zu berücksichtigen, jeder mit seinen eigenen Vorteilen und Einschränkungen, einschließlich der gemeinsamen Unterbringung mit verwilderten Mäusen und Mäusen aus dem Zoohandel 3,4,5,6,7,8, der sequentiellen Exposition gegenüber Kommensalen9, der Haltung der Tiere in Außengehegen10 oder auf Einstreu von Großtieren11 und Kottransplantationen von wilden Mäusen12. Ein vielversprechendes neues Mausmodell für die präklinische und toxikologische Forschung ist das Modell "Wildling-Mäuse", das aus Standard-Labormausstämmen besteht, die ein natürliches Mikrobiom beherbergen13. Diese "Wildling-Mäuse" werden durch die Transplantation von Embryonen von Labormausstämmen in wild gefangene Mäuse erzeugt. Während der Geburt erwerben die Labormausstämme das natürliche Mikrobiom ihrer Leihmütter und ahmen die natürliche Impfung nach, die bei der Entbindung beim Menschen stattfindet13. "Wildling-Mäuse" können wie jeder andere Labormausstamm gezüchtet werden, wobei ihr natürliches Mikrobiom über Generationen hinweg erhalten bleibt.
"Wildling-Mäuse" beherbergen eine vielfältige Mikrobiota - darunter Bakterien, Viren und Parasiten -, die normalerweise von SPF-Mausanlagen ausgeschlossen sind. Folglich stellt die Aufrechterhaltung eines natürlichen Mikrobioms in Forschungseinrichtungen eine Herausforderung dar, da diese Mikroben eingedämmt werden müssen, ohne die allgemeinen SPF-Hygienestandards zu beeinträchtigen.
An der Charité - Universitätsmedizin Berlin wurde eine eigene Einrichtung für "Wildling-Mäuse" eingerichtet, die durch strenge Biocontainment-Maßnahmen von den SPF-Bereichen getrennt ist. Die Einrichtung umfasst Zucht- und Versuchsräume, die sicherstellen, dass das natürliche Mikrobiom der "Wildling-Mäuse" erhalten bleibt, während die SPF-Bereiche geschützt werden (Abbildung 1).
Die Gründerpaare der Charité-Kolonie wurden aus der Kolonie "Wilding mice" importiert, die an der Abteilung für Mikrobiomforschung des Universitätsklinikums Erlangen der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) etabliert wurde. Sie werden vor dem Import der Koloniegründer mit einem Gesundheitszeugnis versehen und mit einem erweiterten Panel auf Zoonoseerreger überwacht. Sentinels werden eingesetzt, um das Mikrobiom im Laufe der Zeit zu überwachen. Sowohl SPF als auch "Wildling-Mäuse" werden unter den gleichen Bedingungen gehalten. Die Mäuse werden gezüchtet und bevorzugt in individuell beatmeten Käfigen (IVC) Typ II lange in Gruppen von fünf Mäusen gehalten. Die Temperatur in der Anlage beträgt 22 °C und der Hell-Dunkel-Zyklus 12 Stunden. Die Mäuse erhalten handelsübliches Getreide- und Leitungswasser. Eine Sterilisation von Einstreu und Anreicherungsgegenständen ist für "Wildling-Mäuse" nicht erforderlich. Das Autoklavieren dieser Gegenstände verhindert jedoch Materialverwechslungen in Bereichen, in denen SPF-Mäuse untergebracht sind.
In diesem Protokoll werden die Immunphänotypisierungsverfahren sowohl für SPF- als auch für "Wildling-Mäuse" demonstriert, wobei die strengen mikrobiellen Containment-Protokolle in der "Wildling-Maus"-Anlage hervorgehoben werden. Diese Maßnahmen gewährleisten die Integrität der SPF-Umgebung und bieten gleichzeitig die Vorteile der Arbeit mit Mäusen, die ein natürliches Mikrobiom tragen.
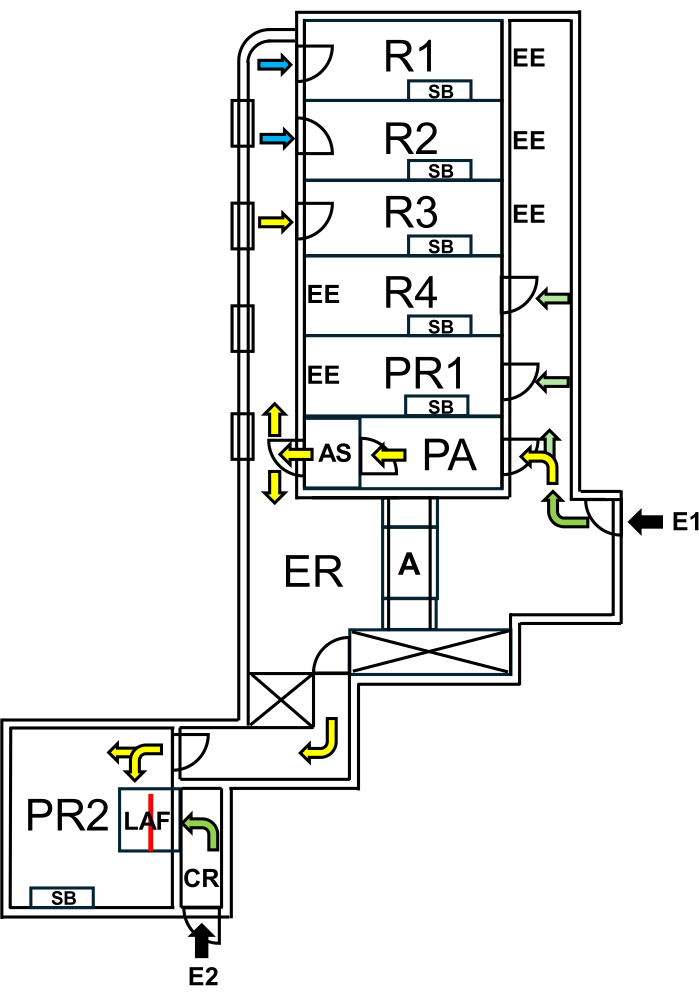
Abbildung 1: Layout der Anlage für Wildling-Mäuse. E1 = Zugang zur Anlage. Pfeile zeigen den Eingangsweg in die Anlage an. E2 = Zugang zur Laminar-Airflow-Kabine von außerhalb der Anlage. PA = Personenschleuse mit Luftdusche. AS = Luftdusche. R1, R2 = Räume für die Zucht von Wildlingmäusen. R3 = Platz für die Haltung von Wilding-Mäusen. R4 = Platz für die Haltung von SPF-Mäusen. PR1 = Behandlungsraum für SPF-Mäuse. PR2 = Behandlungsraum für Wildling-Mäuse. SB = sterile Arbeitsbank. EE = Notausgänge. CR = Umkleideraum vor der LAF-Kabine. LAF = laminare Luftstromkabine für Eingriffe unter schützender Luftströmung. A = Autoklav. ER = Technikraum. Grüne Pfeile stellen Routen dar, die bei der Arbeit mit SPF-Tieren zugänglich sind, und gelbe Pfeile zeigen Wege an, die für die Arbeit mit Wildling-Mäusen nach dem Luftduschen verfügbar sind. Blaue Pfeile zeigen den Zugang nur für das Haltungspersonal an. Die rote Linie markiert die Glaswand im Inneren der LAF-Kabine, die den Raum in zwei Bereiche unterteilt, die entweder von E1 über PR2 oder von E2 über CR zugänglich sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Die Anlage zur "Wildhaltung von Mäusen" und Verfahren mit lebenden Tieren wurden vom zuständigen Landesamt für Gesundheit und Soziales Berlin (LAGeSo) genehmigt. Die wichtigsten Schritte des Protokolls sind in Abbildung 2 zusammengefasst.
1. Zugang zur Anlage Wilding erhalten
- Erhalten Sie eine persönliche Einführung in die Betriebs- und Bioabdichtungsabläufe der Anlage durch den zuständigen Tierschutzbeauftragten.
- Holen Sie sich den Transponderschlüssel für den Zutritt zur Einrichtung für "Wildling-Mäuse" und buchen Sie die Eingriffsräume über das Online-Buchungssystem.
2. Betreten der Anlage für "Wildling-Mäuse"
- Deponieren Sie die Kleidung in der Umkleidekabine.
- Wechseln Sie in die Bereichskleidung: Hose, Kasak und Einweg-Überschuhe (Abbildung 3).
3. Blutentnahme von SPF-Mäusen im SPF-Bereich
- Die SPF-Mäuse (männlich und weiblich, 8-20 Wochen) werden aus dem Raum, in dem sie gehalten werden (R4), in den Behandlungsraum für SPF-Tiere (PR1) in einen geschlossenen IVC-Käfig überführt.
- Schalten Sie die Laminar-Flow-Bank ein und desinfizieren Sie die Arbeitsfläche mit 70% Vol.-Ethanol. Arbeiten Sie im Inneren der Bank.
- Überprüfen Sie die Kapillarrohre auf gebrochene oder abgebrochene Abschnitte, um ein erhöhtes Risiko von Bruch oder Beschädigung zu vermeiden.
- Unter kurzer Vollnarkose mit Isofluran (Induktion bei 5 % Isofluran in sauerstoffangereicherter medizinischer Luft, gefolgt von 1,5 %-2,0 % zur Erhaltung) nach Verlust des Pedalentzugsreflexes (wie durch Zehenkneifen angezeigt) die Halsvenen der Mäuse durch Greifen des Nackens komprimieren.
- Befestigen Sie den Kopf des Tieres mit einer Hand mit Daumen und Zeigefinger. Führen Sie eine frische Kapillare in den medialen Canthus des Auges unter der Nickhaut im Winkel von 45° ein. Stellen Sie sicher, dass sich die Kapillare zwischen dem Augapfel und der knöchernen Augenhöhle befindet.
HINWEIS: Um ein Trauma zu vermeiden, lassen Sie die Spitze des Kapillarrohrs nicht die Oberfläche des Auges berühren. - Führen Sie die Kapillare mit einer sanften axialen Drehbewegung durch die Sinusmembran ein. Drehen Sie den Schlauch an der Rückseite der Orbita weiter, bis das Blut fließt. Sammeln Sie mindestens 15 μl Blut in einem Blutentnahmeröhrchen, das Ethylendiamintetraessigsäure (EDTA) enthält (ca. 1 Tropfen).
- Lösen Sie vor dem Entfernen der Kapillare den Griff am Nacken, um Blutungen in das Gewebe auf ein Minimum zu beschränken. Um eine gute Blutstillung zu gewährleisten, verwenden Sie ein sauberes Mullkissen oder einen Tupfer, um die Blutung zu stoppen.
- Drehen Sie den Schlauch leicht, um Blut und EDTA zu mischen. Schütteln Sie die Tube nicht. Lagern Sie die Blutprobe auf Eis.
- Desinfizieren Sie die Arbeitsfläche und schalten Sie die Laminar-Flow-Bank aus. Bringen Sie SPF-Mäuse in einer geschlossenen IVC in den SPF-Haltungsraum zurück (R4).
4. Betreten des Bereichs für "Wildling-Mäuse"
- Ziehen Sie Schuhe und Socken im Vorraum der Luftdusche (PA) aus. Ziehen Sie Bereichssocken und persönliche Ganzkörperschutzausrüstung (PSA) an, die aus einem Tyvek-Overall, einem Haarnetz, falls erforderlich, Baumwollhandschuhen, Nitrilhandschuhen und Gesichtsmasken besteht (Abbildung 3).
- Betreten Sie die Luftdusche in Socken über den selbstklebenden Bodenbelag. Hebe beim Luftduschen die Arme an und führe eine 360°-Drehung aus.
- Verlassen Sie die Luftdusche und ziehen Sie auf der anderen Seite Bereichsschuhe an.
5. Blutentnahme von "wilden Mäusen"
- "Wildling-Mäuse" (männlich und weiblich, 8 - 20 Wochen) werden aus dem Raum, in dem sie in einem geschlossenen IVC-Käfig gehalten werden (R3), in den Eingriffsraum (PR2) überführt.
- Schalten Sie die Laminar-Flow-Bank ein und desinfizieren Sie die Arbeitsfläche.
- Befolgen Sie die für die Probenahme von SPF-Mäusen in Abschnitt 3, Schritte 2-8 beschriebenen Verfahren.
- Wechseln Sie nach Abschluss der Blutentnahme die Handschuhe. Desinfizieren Sie alle Materialien und Oberflächen. Schalten Sie die Laminar-Flow-Bank aus.
6. Export von Blutproben aus dem Bereich "Wildling-Mäuse" über den Laminar-Airflow-Schrank (LAF)
HINWEIS: Der Operationssaal (PR2) enthält einen LAF-Schrank, der als Materialschleuse und steriler Interventionsraum dient. Die Proben werden über die LAF-Kabine abtransportiert. Der Innenraum ist sowohl von innen (über E1 und PR2) als auch von außen (über E2 und CR) über das Wildling-Areal zugänglich und wird in der Mitte durch eine Glaswand mit Schiebetür geteilt (Bild 1). Für den Export von Materialien sind zwei Personen erforderlich: Person 1 (innerhalb des Wildling-Bereichs [über PR2]) führt die Schritte 6.1 und 6.2 aus. Person 2 (außerhalb des Wildling-Bereichs [über E2]) führt die Schritte 6.3-6.5 aus.
- Desinfizieren Sie Probenbehälter. Entnehmen Sie Probenbehälter über die Schiebetür in der Glaswand der LAF-Kabine.
- Nachdem die Übergabe der Probenbehälter an Person 2 abgeschlossen ist, nehmen Sie Schutzkleidung von Person 2 (trägt Schutzkleidung im Kittelschloss der Kabine) auf der anderen Seite der LAF-Kabine entgegen und entsorgen Sie diese. Desinfizieren Sie alle Oberflächen.
- Ziehen Sie Schutzkleidung im Zugangsbereich LAF vor der LAF-Kabine an (CR, Abbildung 1).
- Nehmen Sie desinfizierte Probenbehälter aus dem Wildling-Bereich berührungslos durch die Schiebetür in der Glaswand der LAF-Kabine entgegen.
- Entfernen Sie die Schutzkleidung und führen Sie sie durch die Schiebetür in den Innenbereich der LAF-Kabine zur Entsorgung.
7. Verlassen der Anlage für "Wildling-Mäuse"
- Lassen Sie Einweg-Overalls und Bereichsschuhe im Bereich. Entsorgen Sie Haarnetz, Gummihandschuhe und Gesichtsmaske.
HINWEIS: Schuhe und Overalls können wiederverwendet werden. - Betreten Sie die Luftdusche sofort in den Bereichssocken. Heben Sie die Arme und führen Sie eine 360°-Drehung aus, während Sie an der Luft duschen.
- Lassen Sie die Luftdusche und legen Sie die Socken in den Wäscheauffangbehälter. Ziehen Sie die Socken und Schuhe sowie Einweg-Überschuhe an. Legen Sie die Kleidung im Bereich der Umkleidekabine im Wäschesammler ab. Anziehen in der Umkleidekabine
8. Aufbereitung und Analyse von Blutproben
- Bringen Sie Blutproben ins Labor.
- Bereiten Sie einen Fluorophor-konjugierten Antikörper-Färbecocktail vor: Fügen Sie für jede Probe 0,25 μl Alexa Fluor 700 Anti-Maus-CD45, 0,25 μl Brilliant Violet 605 Anti-Maus-TCR-β-Kette, 0,25 μl APC Anti-Maus-CD4, 0,25 μl Brilliant Violet 785 Anti-Maus-CD8, 0,25 μl FITC Anti-Maus-CD44 und 0,25 μl PerCP/Cyanin5,5 Anti-Maus-CD62L-Antikörper zu 50 μl Durchflusszytometrie-Puffer (phosphatgepufferte Kochsalzlösung, 2 mM EDTA, 0,1 % Rinderserumalbumin, 4 °C). Im Dunkeln auf Eis bis Schritt 8.8 aufbewahren.
HINWEIS: Die verwendeten Fluorophore können an die Konfiguration des Durchflusszytometers angepasst werden, das für die Probenentnahme verwendet wird.
- Bereiten Sie einen Fluorophor-konjugierten Antikörper-Färbecocktail vor: Fügen Sie für jede Probe 0,25 μl Alexa Fluor 700 Anti-Maus-CD45, 0,25 μl Brilliant Violet 605 Anti-Maus-TCR-β-Kette, 0,25 μl APC Anti-Maus-CD4, 0,25 μl Brilliant Violet 785 Anti-Maus-CD8, 0,25 μl FITC Anti-Maus-CD44 und 0,25 μl PerCP/Cyanin5,5 Anti-Maus-CD62L-Antikörper zu 50 μl Durchflusszytometrie-Puffer (phosphatgepufferte Kochsalzlösung, 2 mM EDTA, 0,1 % Rinderserumalbumin, 4 °C). Im Dunkeln auf Eis bis Schritt 8.8 aufbewahren.
- Desinfizieren Sie die Blutentnahmeröhrchen. Geben Sie 2 ml eiskalten Durchflusszytometriepuffer in ein 5 ml-Polystyrolröhrchen mit rundem Boden. Lege das Rohr auf Eis.
- Öffnen Sie das Blutentnahmeröhrchen. Geben Sie 10 μl Blut in das Röhrchen, das den Durchflusszytometriepuffer und den Pulswirbel enthält.
- Bei 400 x g 5 min bei 4 °C runterschleudern.
- Aspirieren Sie den Überstand. Fügen Sie 1 ml Lysepuffer für rote Blutkörperchen (RBC) hinzu, pulsieren Sie den Vortex und inkubieren Sie ihn 3 Minuten lang bei Raumtemperatur (RT).
- Fügen Sie 100 μl 10x PBS hinzu. Bei 400 x g 5 min bei 4 °C runterschleudern.
- Wiederholen Sie die Schritte 8.5-8.6.
- Aspirieren Sie den Überstand. 50 μl Antikörper-Färbecocktail hinzufügen, vortexen und 20 Minuten im Dunkeln auf Eis inkubieren.
- Fügen Sie 1 ml Durchflusszytometrie-Puffer hinzu. Bei 400 x g 5 min bei 4 °C runterschleudern.
- Aspirieren Sie den Überstand. Fügen Sie 180 μl Durchflusszytometrie-Puffer hinzu.
- Fügen Sie 20 μl SYTOX Blue Dead Cell Stain (Endkonzentration 1:1000) für die Unterscheidung zwischen lebenden und toten Zellen hinzu.
- Erfassen Sie Proben auf einem Durchflusszytometer und analysieren Sie die Daten mit der Durchflusszytometer-Erfassungssoftware oder dem Datenanalyseprogramm für Durchflusszytometrie.
Ergebnisse
"Wilde Mäuse" beherbergen möglicherweise Mikroorganismen, die normalerweise von SPF-Anlagen ausgeschlossen sind, was eine Herausforderung für die Tierhaltung in Forschungseinrichtungen darstellt, die strenge Hygienestandards einhalten. In den letzten 4 Jahren haben Wissenschaftler und Tierärzte der Charité - Universitätsmedizin Berlin und des Deutschen Zentrums zum Schutz von Labortieren (Bf3R) eine Einrichtung für Mäuse mit einem natürlichen Mikrobiom entwickelt, die in Zusamme...
Diskussion
Mäuse mit einem natürlichen Mikrobiom sind aufgrund ihrer größeren Ähnlichkeit mit dem menschlichen Superorganismus ein vielversprechendes Forschungsinstrument für die Grundlagen- und angewandte Wissenschaft 3,9,10,11,12. Versuche, biologische Komplexität in Mausmodelle zu integrieren, haben zur Entwicklung verschiedene...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt von Charité 3R| Ersetzen - Reduzieren - Verfeinern. S.P.R. wurde gefördert durch die Deutsche Forschungsgemeinschaft (DFG) Emmy Noether-Programm RO 6247/1-1 (Projekt-ID 446316360), das DFG-SFB1160 IMPATH (Projekt-ID 256073931) und den TRR 359 PILOT (Projekt-ID 491676693). S.J. wurde gefördert von der Deutschen Forschungsgemeinschaft (DFG) JO 1216/2-1 und der Deutschen Multiple Sklerose Gesellschaft (DMSG e.V.).
Materialien
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Referenzen
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345 (2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119 (2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108 (2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069 (2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361 (2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143 (2018).
- . Premier Available from: https://premier-qms.org/ (2024)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten