Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Procédures d’exploitation et de bioconfinement d’une installation pour souris de laboratoire avec un microbiome naturel : procédure d’immunophénotypage
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous décrivons la structure et les procédures de fonctionnement, y compris les mesures de confinement microbien d’une installation pour les « souris sauvages » en utilisant des prélèvements sanguins pour l’immunophénotypage à titre d’exemple.
Résumé
L’utilisation de souris de laboratoire dotées d’un microbiome naturel, telles que les « souris sauvageons », offre un outil de recherche prometteur pour les sciences fondamentales et appliquées en raison de leur ressemblance étroite avec le superorganisme humain. Cependant, l’élevage et l’entretien de ces souris, qui abritent un microbiome diversifié comprenant des bactéries, des virus et des parasites, posent des défis importants pour les installations d’élevage des établissements de recherche. Pour relever ces défis, un concept d’installation spécialisé a été développé pour loger les « souris sauvageons » à la Charité - Universitätsmedizin Berlin. Cette approche impliquait de concevoir une installation avec des caractéristiques structurelles et des protocoles opérationnels spécifiques pour contenir efficacement le microbiome naturel, protégeant ainsi les zones où les normes d’hygiène sont plus élevées.
Une méthodologie d’échantillonnage sanguin de souris exemptes d’agents pathogènes spécifiés (SPF) et de « souris sauvageons » pour l’immunophénotypage est démontrée, mettant en évidence le flux de travail et les mesures de bioconfinement mises en œuvre dans l’installation. Des résultats remarquables révèlent que les « souris sauvageons » exposées à un microbiome naturel développent des populations de cellules immunitaires distinctes, qui sont considérablement réduites chez les souris élevées et maintenues dans des conditions d’hygiène strictes.
L’importance de cette étude réside dans son potentiel à fournir aux chercheurs un accès à des souris qui possèdent un microbiome naturel et un système immunitaire mature similaire à celui des adultes humains. Cette approche pourrait améliorer la traduisibilité des résultats précliniques dans la pratique clinique, faisant ainsi progresser le domaine de la recherche biomédicale.
Introduction
L’expérimentation chez la souris est encore indispensable dans les sciences fondamentales et appliquées, telles que la recherche préclinique et toxicologique. Cependant, la standardisation de l’hygiène dans les environnements de laboratoire, visant à réduire le bruit biologique et à minimiser la variabilité des résultats expérimentaux, a conduit à l’exclusion du microbiote naturel dans une large mesure. Ainsi, les conditions dans lesquelles naissent et gardent des souris de laboratoire exemptes d’agents pathogènes (FPS) normalisées sur le plan de l’hygiène diffèrent des conditions réelles auxquelles les humains et les animaux sont normalement exposés. Ce décalage entre les conditions de laboratoire et les environnements naturels dans lesquels les maladies humaines se produisent donne lieu à l'« erreur de standardisation » : supposer que la minimisation de la variation des conditions expérimentales améliore les résultats translationnels. Cependant, en réalité, cela limite la pertinence biologique des résultats 1,2. Par exemple, des recherches ont montré que l’absence de diversité microbienne et environnementale chez les souris SPF peut entraîner un système immunitaire sous-développé, ce qui compromet la validité des études immunologiques et précliniques3.
Plusieurs approches ont été proposées pour aborder la variation biologique dans des modèles murins, chacune ayant ses propres avantages et limites, notamment la cohabitation avec des souris sauvages et des souris d’animalerie 3,4,5,6,7,8, l’exposition séquentielle aux commensaux9, le maintien des animaux dans des enclos extérieurs10 ou sur de la litière de grands animaux11, et les transplantations fécales de souris sauvages12. Un nouveau modèle de souris prometteur pour la recherche préclinique et toxicologique est le modèle des « souris sauvageons », qui consiste en des souches de souris de laboratoire standard hébergeant un microbiome naturel13. Ces « souris sauvageons » sont générées par la transplantation d’embryons de souches de souris de laboratoire dans des souris capturées dans la nature. Au cours de la naissance, les souches de souris de laboratoire acquièrent le microbiome naturel de leurs mères porteuses, imitant l’inoculation naturelle qui se produit lors de l’accouchement humain13. Les « souris sauvageons » peuvent être élevées comme n’importe quelle autre souche de souris de laboratoire, avec leur microbiome naturel préservé à travers les générations.
Les « souris sauvageons » hébergent un microbiote diversifié - y compris des bactéries, des virus et des parasites - qui sont généralement exclus des installations de souris SPF. Par conséquent, le maintien d’un microbiome naturel dans les installations de recherche présente des défis, car ces microbes doivent être contenus sans compromettre les normes d’hygiène globales du SPF.
À la Charité - Universitätsmedizin Berlin, une installation dédiée aux « souris sauvageons » a été créée, séparée des zones SPF par des mesures strictes de bioconfinement. L’installation comprend des salles de reproduction et d’expérimentation, ce qui permet de maintenir le microbiome naturel des « souris sauvageons » tout en protégeant les zones de protection contre les incendies (figure 1).
Les couples fondateurs de la colonie de Charité ont été importés de la colonie de « souris sauvages » établie au Département de recherche sur le microbiome de l’hôpital universitaire d’Erlangen, à la Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), en Allemagne. Ils sont munis d’un certificat sanitaire et suivis à l’aide d’un panel élargi pour détecter les agents pathogènes zoonotiques avant l’importation des fondateurs de la colonie. Des sentinelles seront utilisées pour surveiller le microbiome au fil du temps. Les souris SPF et les « souris sauvageons » sont logées dans les mêmes conditions. Les souris sont élevées et gardées préférentiellement dans des cages ventilées individuellement (CVI) de type II de long en groupes de cinq souris. La température à l’intérieur de l’installation est de 22 °C et le cycle lumière/obscurité est de 12 h. Les souris reçoivent de la nourriture standard à base de céréales et de l’eau du robinet. La stérilisation de la litière et des articles d’enrichissement n’est pas nécessaire pour les « souris sauvageons ». Cependant, l’autoclave de ces articles empêche les mélanges de matériaux dans les zones où les souris SPF sont hébergées.
Dans ce protocole, les procédures d’immunophénotypage pour les souris SPF et les « souris sauvageons » sont démontrées, mettant en évidence les protocoles stricts de confinement microbien de l’installation de la souris sauvageon. Ces mesures garantissent l’intégrité des environnements SPF tout en offrant les avantages de travailler avec des souris porteuses d’un microbiome naturel.
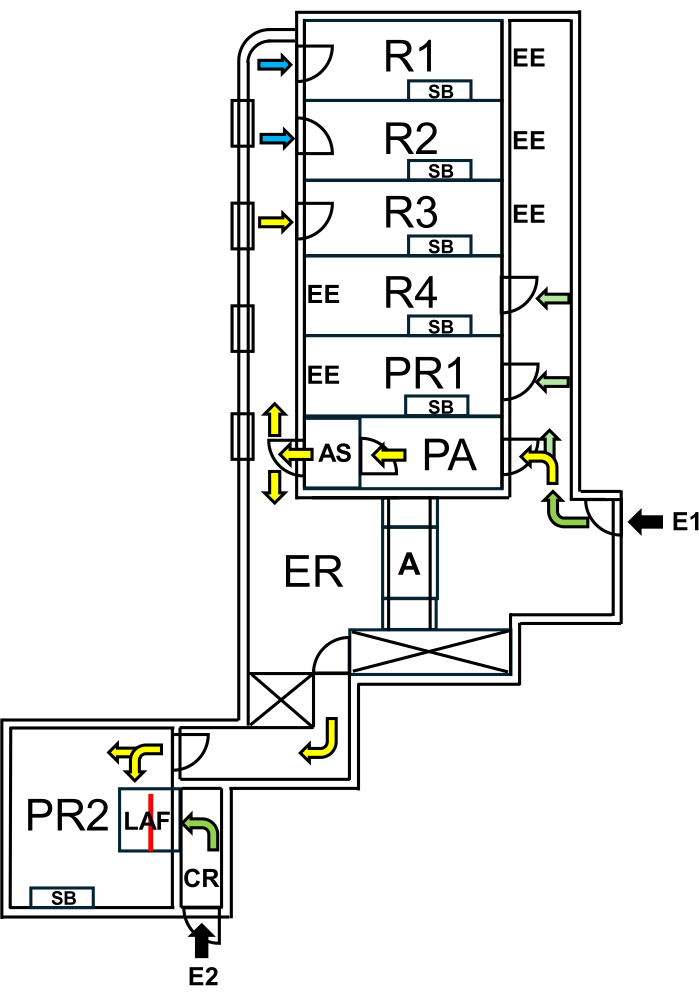
Figure 1 : Aménagement de l’installation pour les souris sauvageons. E1 = accès à l’installation. Les flèches indiquent la voie d’entrée dans l’installation. E2 = accès à la cabine à flux d’air laminaire depuis l’extérieur de l’installation. PA = sas personnel avec douche d’air. AS = douche à air. R1, R2 = salles pour la reproduction des souris sauvageons. R3 = espace pour garder des souris Wilding. R4 = espace pour garder des souris SPF. PR1 = salle d’intervention pour souris SPF. PR2 = salle d’intervention pour les souris sauvageons. SB = banc de travail stérile. EE = issues de secours. CR = vestiaire devant la cabine LAF. LAF = cabine à flux d’air laminaire pour les interventions sous flux d’air protecteur. A = autoclave. ER = salle d’équipement. Les flèches vertes représentent les itinéraires accessibles lorsque vous travaillez avec des animaux SPF, et les flèches jaunes indiquent les chemins disponibles pour travailler avec des souris sauvageons après une douche d’air. Les flèches bleues indiquent l’accès réservé au personnel d’élevage. La ligne rouge marque la paroi vitrée à l’intérieur de la cabine LAF, qui divise l’espace en deux sections accessibles soit depuis E1 via PR2, soit depuis E2 via CR. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
L’installation pour les « souris sauvages » et les procédures impliquant des animaux vivants ont été approuvées par l’office national compétent pour l’expérimentation animale, « Landesamt für Gesundheit und Soziales Berlin » (LAGeSo). Les étapes les plus importantes du protocole sont résumées à la figure 2.
1. Accéder à l’installation Wilding
- Obtenez une introduction personnelle aux procédures d’exploitation et de bioconfinement de l’installation auprès de l’agent responsable du bien-être animal.
- Procurez-vous la clé du transpondeur pour entrer dans l’installation des « souris sauvageons » et réservez les salles d’intervention via le système de réservation en ligne.
2. Entrée dans l’installation des « Souris sauvageons »
- Déposez les vêtements dans la cabine d’essayage.
- Enfilez des vêtements de zone : pantalon, kasak et couvre-chaussures jetables (Figure 3).
3. Prélèvement sanguin de souris SPF dans la zone SPF
- Transférez les souris SPF (mâles et femelles, 8 à 20 semaines) de la pièce où elles sont gardées (R4) à la salle d’intervention pour les animaux SPF (PR1) dans une cage IVC fermée.
- Allumez le banc à flux laminaire et désinfectez la surface de l’espace de travail avec de l’éthanol à 70 % vol. Travaillez à l’intérieur du banc.
- Inspectez les tubes capillaires pour détecter les sections brisées ou ébréchées afin d’éviter un risque accru de bris ou de dommages.
- Sous une brève anesthésie générale à l’isoflurane (induction à 5 % d’isoflurane dans l’air médical enrichi en oxygène, suivie de 1,5 % à 2,0 % pour l’entretien), après la perte du réflexe de retrait de la pédale (comme indiqué par pincement de l’orteil), comprimez les veines du cou des souris en saisissant la peau du cou.
- D’une main, fixez la tête de l’animal à l’aide du pouce et de l’index. Insérez un capillaire frais dans le canthus médial de l’œil sous la membrane nictitante à un angle de 45°. Assurez-vous que le capillaire est positionné entre le globe oculaire et l’orbite osseuse de l’œil.
REMARQUE : Pour éviter un traumatisme, ne laissez pas l’extrémité du tube capillaire toucher la surface de l’œil. - Insérez le capillaire à travers la membrane du sinus avec un léger mouvement de rotation axiale. Continuez à faire pivoter le tube à l’arrière de l’orbite jusqu’à ce que le sang circule. Prélever un minimum de 15 μL de sang dans un tube de prélèvement sanguin contenant de l’acide éthylènediaminetétraacétique (EDTA) (environ 1 goutte).
- Avant de retirer le capillaire, desserrez la prise sur la peau du cou pour réduire au minimum les saignements dans les tissus. Pour assurer une bonne hémostase, utilisez une compresse de gaze ou un écouvillon propre pour arrêter le saignement.
- Faites pivoter légèrement le tube pour mélanger le sang et l’EDTA. Ne secouez pas le tube. Conservez l’échantillon de sang sur de la glace.
- Désinfectez la surface de travail et éteignez le banc à flux laminaire. Renvoyez les souris SPF dans une IVC fermée dans la pièce du logement SPF (R4).
4. Entrée dans la zone des « Souris sauvageons »
- Enlevez les chaussures et les chaussettes dans l’antichambre de la douche d’air (PA). Enfilez des chaussettes de zone et un équipement de protection individuelle (EPI) complet composé d’une combinaison en Tyvek, d’un filet à cheveux, si nécessaire, de gants en coton, de gants en nitrile et de masques faciaux (figure 3).
- Entrez dans la douche d’air en chaussettes via le revêtement de sol adhésif. Pendant la douche à l’air, levez les bras et effectuez un virage à 360°.
- Sortez de la douche d’air et mettez des chaussures de zone de l’autre côté.
5. Prélèvement de sang de « souris sauvages »
- Transférez les « souris sauvageons » (mâles et femelles, 8 à 20 semaines) de la pièce où elles sont gardées (R3) dans une cage IVC fermée à la salle d’intervention (PR2).
- Allumez le banc à flux laminaire et désinfectez la surface de l’espace de travail.
- Suivez les procédures décrites pour l’échantillonnage des souris SPF à la section 3, étapes 2 à 8.
- Après avoir terminé le prélèvement sanguin, changez de gants. Désinfectez tous les matériaux et surfaces. Éteignez le banc d’écoulement laminaire.
6. Exportation d’échantillons de sang de la zone « Souris sauvageons » via l’armoire à flux d’air laminaire (LAF)
REMARQUE : La salle d’intervention (PR2) contient une armoire LAF, qui sert de verrou de matériel et de salle d’intervention stérile. Les échantillons sont transférés via la cabine LAF. L’intérieur est accessible à la fois de l’intérieur (via E1 et PR2) et de l’extérieur (via E2 et CR) de la zone Wildling et est divisé au milieu par une paroi vitrée avec une porte coulissante (Figure 1). Deux personnes sont nécessaires pour exporter les matériaux : la personne 1 (à l’intérieur de la zone du sauvageon [via PR2]) effectuera les étapes 6.1 et 6.2. La personne 2 (en dehors de la zone du sauvageon [via E2]) effectuera les étapes 6.3-6.5.
- Désinfectez les contenants d’échantillons. Retirez les récipients d’échantillons par la porte coulissante dans la paroi vitrée de la cabine LAF.
- Une fois le transfert des contenants d’échantillons à la personne 2 terminé, recevoir des vêtements de protection de la personne 2 (porte des vêtements de protection dans le verrou de la cabine) de l’autre côté de la cabine des FAL et jetez-les. Désinfectez toutes les surfaces.
- Mettez des vêtements de protection dans le LAF d’accès devant la cabine LAF (CR, Figure 1).
- Recevez des conteneurs d’échantillons désinfectés de la zone des sauvageons sans contact par la porte coulissante dans la paroi vitrée de la cabine LAF.
- Retirez les vêtements de protection et passez-les à travers la porte coulissante dans la zone intérieure de la cabine des LAF pour les éliminer.
7. Sortie de l’installation pour les « souris sauvageons »
- Laissez les combinaisons et les chaussures jetables à l’intérieur de la zone. Jetez le filet à cheveux, les gants en caoutchouc et le masque facial.
REMARQUE : Les chaussures et les combinaisons peuvent être réutilisées. - Entrez immédiatement dans la douche d’air en chaussettes de zone. Levez les bras et effectuez un virage à 360° pendant la douche à l’air.
- Quittez la douche à air et placez les chaussettes dans le collecteur de linge. Mettez les chaussettes et les chaussures et les couvre-chaussures jetables. Déposez les vêtements dans le vestiaire dans le collecteur de linge. Enfilez les vêtements dans le vestiaire
8. Traitement et analyse des échantillons de sang
- Apportez des échantillons de sang au laboratoire.
- Préparez un cocktail de coloration d’anticorps conjugués aux fluorophores : Pour chaque échantillon, ajoutez 0,25 μL de CD45 anti-souris Alexa Fluor 700, 0,25 μL de chaîne TCR-β anti-souris Brilliant Violet 605, 0,25 μL de CD4 anti-souris APC, 0,25 μL de CD8 anti-souris Brilliant Violet 785, 0,25 μL de CD44 anti-souris FITC et 0,25 μL d’anticorps anti-souris CD62L PerCP/Cyanine5.5 à 50 μL de tampon de cytométrie en flux (solution saline tamponnée au phosphate, 2 mM d’EDTA, 0,1 % d’albumine sérique bovine, 4 °C). Garder dans l’obscurité sur de la glace jusqu’à l’étape 8.8.
REMARQUE : Les fluorophores utilisés peuvent être adaptés à la configuration du cytomètre en flux qui sera utilisé pour l’acquisition d’échantillons.
- Préparez un cocktail de coloration d’anticorps conjugués aux fluorophores : Pour chaque échantillon, ajoutez 0,25 μL de CD45 anti-souris Alexa Fluor 700, 0,25 μL de chaîne TCR-β anti-souris Brilliant Violet 605, 0,25 μL de CD4 anti-souris APC, 0,25 μL de CD8 anti-souris Brilliant Violet 785, 0,25 μL de CD44 anti-souris FITC et 0,25 μL d’anticorps anti-souris CD62L PerCP/Cyanine5.5 à 50 μL de tampon de cytométrie en flux (solution saline tamponnée au phosphate, 2 mM d’EDTA, 0,1 % d’albumine sérique bovine, 4 °C). Garder dans l’obscurité sur de la glace jusqu’à l’étape 8.8.
- Désinfectez les tubes de prélèvement sanguin. Ajouter 2 ml de tampon de cytométrie à flux glacé dans un tube de polystyrène à fond rond de 5 ml. Placez le tube sur de la glace.
- Ouvrez le tube de prélèvement sanguin. Ajoutez 10 μL de sang dans le tube contenant le tampon de cytométrie en flux et le vortex d’impulsion.
- Essorer à 400 x g pendant 5 min à 4 °C.
- Aspirez le surnageant. Ajouter 1 ml de tampon de lyse des globules rouges (GR), un vortex d’impulsion et incuber pendant 3 min à température ambiante (RT).
- Ajouter 100 μL de 10x PBS. Essorer à 400 x g pendant 5 min à 4 °C.
- Répétez les étapes 8.5-8.6.
- Aspirez le surnageant. Ajouter 50 μL de cocktail de coloration d’anticorps, vortex et incuber pendant 20 min sur de la glace dans l’obscurité.
- Ajouter 1 mL de tampon de cytométrie en flux. Essorer à 400 x g pendant 5 min à 4 °C.
- Aspirez le surnageant. Ajouter 180 μL de tampon de cytométrie en flux.
- Ajouter 20 μL de colorant bleu à cellules mortes SYTOX (concentration finale 1:1000) pour la distinction entre les substances vivantes et mortes.
- Acquérez des échantillons sur un cytomètre en flux et analysez les données à l’aide du logiciel d’acquisition de cytomètre en flux ou du programme d’analyse de données de cytométrie en flux.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les « souris sauvages » hébergent potentiellement des micro-organismes généralement exclus des installations SPF, ce qui pose un défi aux pratiques d’élevage des animaux au sein des institutions de recherche qui respectent des normes d’hygiène strictes. Au cours des 4 dernières années, des scientifiques et des vétérinaires de la Charité - Universitätsmedizin Berlin et du Centre allemand pour la protection des animaux de laboratoire (Bf3R) ont mis au point une installati...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les souris dotées d’un microbiome naturel sont un outil de recherche prometteur pour les sciences fondamentales et appliquées en raison de leur ressemblance plus étroite avec le super-organisme humain 3,9,10,11,12. Les tentatives d’incorporer la complexité biologique dans des modèles murins ont conduit au développeme...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par la Charité 3R| Remplacer - Réduire - Affiner. S.P.R. a été soutenu par la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche) Emmy Noether-Programm RO 6247/1-1 (numéro de projet 446316360), la DFG SFB1160 IMPATH (256073931 de projet) et le TRR 359 PILOT (491676693 de projet). S.J. a été soutenu par la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche) JO 1216/2-1 et la Société allemande de la sclérose en plaques (DMSG e.V.).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Références
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345(2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119(2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108(2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069(2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361(2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143(2018).
- Dirnagl, U., Kurreck, C., Bernard, R., Przesdzing, I. Premier. , https://premier-qms.org/ (2024).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon