Method Article
使用立体定位装置建立脑肿瘤的原位患者来源的异种移植模型
摘要
原位儿童脑肿瘤模型的开发需要一丝不苟的精确性,使用立体定位装置精确植入癌细胞。这里介绍的方法概述了准备脑肿瘤细胞、进行颅内注射和实施术后监测系统以评估脑肿瘤植入所涉及的步骤。
摘要
中枢神经系统 (CNS) 肿瘤临床相关且可靠的模型的开发对于推动神经肿瘤学领域的发展至关重要。最广泛使用的技术之一是原位颅内注射,这种方法允许在受控环境中研究肿瘤的生长、侵袭和播散。该技术涉及将肿瘤细胞从特定患者区域移植到动物的相应解剖部位。通过这样做,这些原位脑肿瘤模型提供了独特的优势,因为它们更准确地复制了癌症的生物行为及其与人类患者大脑环境的相互作用。这使得它们对于临床前治疗测试特别有价值,因为临床前治疗测试与临床场景非常相似对于评估潜在治疗至关重要。该协议分享了为儿科脑肿瘤开发患者来源的异种移植物 (PDX) 模型的经验,包括弥漫性中线神经胶质瘤 (DMG)、胶质母细胞瘤 (GBM)、髓母细胞瘤和室管膜瘤。该方法描述了在小鼠中进行颅内立体定位注射的程序,确保正确定位大脑内的注射部位。此外,我们描述了用于检测肿瘤成功植入迹象的术后监测系统。肿瘤注射后,实施严格的监测系统以观察动物是否有任何神经损伤、行为变化和/或体重减轻的迹象,这些都是肿瘤进展的常见指标。该系统允许及时干预并提供有关肿瘤生长动态的关键数据。通过改进这些模型和方案,我们的目标是提高临床前研究的可靠性和转化潜力,为开发更有效的小儿 CNS 肿瘤治疗方法做出贡献。
引言
小儿中枢神经系统 (CNS) 肿瘤是儿童最常见的实体瘤,约占原发性小儿肿瘤的 20%-25%,在发病率和对治疗的反应方面与成人肿瘤具有不同的特征 1,2。高级别神经胶质瘤 (HGG),如胶质母细胞瘤 (GBM) 和弥漫性脑桥脑胶质瘤/弥漫性中线神经胶质瘤 (DIPG/DMG),特别具有侵袭性,预后不佳,尽管治疗方式取得了进步,但存活率仍然很低 3,4,5。髓母细胞瘤占儿科 CNS 肿瘤的近 20%,在标准治疗下实现了较高的 5 年生存率,但某些亚型带来了挑战,尤其是在复发情况下 6,7。室管膜瘤约占儿科 CNS 肿瘤的 10%,根据分子特征和肿瘤位置的不同,预后不同,复发会带来重大的临床挑战 8,9。了解分子图谱和开发原位脑瘤 (BT) 模型为开发有效疗法以改善儿科患者的预后提供了希望。
开发临床相关的 BT 模型对于推进神经肿瘤学研究和治疗发现至关重要。使用立体定位装置的原位注射在这种方法中至关重要,因为它们允许将肿瘤细胞精确放置在大脑内,与脑肿瘤的自然环境非常相似10。这种方法提高了肿瘤模型的可靠性和可重复性,有助于更准确地研究肿瘤生物学和关键特征,如侵袭和血管生成,以及治疗干预的评估11。立体定位装置能够控制细胞注射的确切位置和深度,确保肿瘤细胞始终位于预期的大脑区域,从而提高实验结果的有效性10。皮下模型为治疗药物的初步筛选提供了一种更容易获得且更具成本效益的选择。在这些模型中,肿瘤细胞被植入皮肤下,能够直接监测肿瘤生长和治疗反应12。尽管它们缺乏复制大脑复杂微环境的能力,但皮下模型对于高通量药物筛选和初步疗效评估仍然非常有价值12,13。
多项研究表明,从脑肿瘤样本中成功开发了原位患者来源的异种移植模型 (PDX),包括从尸检或活检样本和原发性脑肿瘤培养物中直接植入组织 11,14,15。然而,重要的是要承认肿瘤解离组织或肿瘤细胞的颅内注射并不总是保证植入,失败的原因尚不完全清楚15。有趣的是,与其他脑肿瘤亚型相比,HGG 活检样本的成功率往往更高。例如,He 等人证明 HGG 原位模型的成功率为 56%,而 Brabetz 等人的研究报告了其他儿科脑肿瘤样本(如室管膜瘤和髓母细胞瘤)的植入率较低,分别为 43% 和 30% 11,14,16。值得注意的是,脑肿瘤 PDX 模型显示出广泛的潜伏期,从 1 个月到 11 个月不等,后期植入显示出临床前效用降低。尽管它们能够在分子水平上概括疾病,但已经观察到活检和已建立模型之间的一些基因组差异14,16。
PDX 模型是寻求针对儿科 BT 的新型治疗策略不可或缺的工具。它们被认为是进行药物疗效研究的金标准,因为这些模型忠实地概括了由于血脑屏障 (BBB) 的存在而导致的肿瘤生长、症状和药物药代动力学方面的人类疾病。小儿脑干神经胶质瘤领域的研究表明,保持 BBB 完整性和缺乏药物渗透是导致这些肿瘤治疗效果降低的一个特征 17,18,19。然而,在证明药物具有足够渗透性的选定治疗中可以观察到疗效,例如表观遗传学和代谢抑制剂 17,20。
本研究提出了一种在免疫功能低下的动物中进行脑肿瘤细胞颅内注射的方法,旨在评估植入 PDX 开发和/或评估治疗药物疗效。还提供了监测肿瘤进展直至达到伦理实验终点的综合工具。
研究方案
以下概述的方案遵循新南威尔士大学概述的动物护理和使用道德准则,并且所有程序均已获得机构动物护理和使用委员会的批准。动物福利被优先考虑,并尽一切努力尽量减少颅内注射过程中使用的动物的痛苦。
1. 扩增形成神经球的脑肿瘤培养物
注意:具体要求可能因所使用的脑培养物而异。以下步骤概述了作为神经球的原代脑肿瘤细胞的一般培养方案。脑肿瘤培养物可从商业供应商处获得,也可作为患者脑肿瘤活检或尸检的原代培养物。已发表的文献15,21 中概述了从患者活检或尸检样本中建立原代培养物的程序。
- 将冻存的储备液样品瓶置于 37 °C 水浴中,直至内容物解冻。用 70% 乙醇擦拭样品瓶的外表面以确保无菌。
- 如 Mayoh 等人 21 所述,为原发性脑肿瘤细胞准备神经球培养基。在生物安全柜 (BSC) 中,使用无菌 1 mL 移液器将解冻的细胞转移到含有 5 mL 预热神经球培养基的无菌 15 mL 锥形管中。
- 将锥形管以 300 x g 离心 3 分钟以沉淀细胞。用 10 mL 移液器小心丢弃尽可能多的上清液。
- 将细胞沉淀重悬于 10 mL 或 25 mL 神经球培养基中。将细胞悬液接种到 T25 或 T75 培养瓶中,具体取决于冻存的预期细胞数量。通常,将密度为 5x 105 个细胞的起始细胞置于 T25 培养瓶中。
- 将培养瓶置于 37 °C 和 5% CO2 的培养箱中。每周 1 次或 2 次用新鲜介质更换介质。或者,根据细胞的生长速率,根据需要补充生长因子和 B27。
- 一旦神经球在 T25 培养瓶中形成,它们就可以在 T75 培养瓶中扩增。用 10 mL 移液器将 T25 培养瓶中的内容物转移到 15 mL 锥形管中。在光学显微镜下观察神经球,一旦它们长得足够大(约 500 μm),它们也可能是肉眼可见的。
- 将试管以 300 x g 离心 3-5 分钟。吸出细胞沉淀上方的培养基,在试管中留下约 1 mL。
- 用 1 mL 移液器轻轻上下移液细胞 12 次至 15 次,以解离细胞沉淀。使用细胞过滤器 (40 μm) 将神经球解离成单细胞混合物。
- 将过滤器放在 50 mL 锥形管的顶部,然后用 10 mL 移液器将解离的球体添加到过滤器上。大多数单个单元会将网格传递到管中,而成束材料将保留在网格上。
- 使用细胞计数室对细胞进行计数。通过将等量的细胞悬液(例如 5 μL)与台盼蓝 (5 μL) 混合来评估细胞活力。死细胞在光学显微镜下呈蓝色,而活细胞则保持未染色。
- 按如下方式计算细胞密度:
细胞浓度 = 每个网格的平均细胞数 × 稀释因子/一个网格的体积 (mL)。标准细胞计数室的网格体积为 0.0001 mL。 - 要传代细胞,将 1 x 106 个细胞重悬于 T75 培养瓶中的 25 mL 新鲜、加热的培养基中。将细胞置于 T75 培养瓶中后,将它们在 37 °C 下在 5% CO2 加湿培养箱中孵育,直到神经球生长。
- 为了冻存脑肿瘤细胞,将 1 x 106 个细胞重悬于 1 mL 冻存溶液中,并在受控速率的冷冻容器中放置过夜,并在 -80 °C 下储存。 将冻存的原液置于 -180 °C 液氮罐中进行长期储存。
注:冻存培养基由 90% 胎牛血清和 10% 二甲基亚砜 (DMSO) 组成。
2. 颅内注射用脑肿瘤细胞的制备
注:虽然以下方案概述了从已建立或短期培养物中制备用于颅内注射的培养细胞,但它也可以适用于其他细胞类型,包括来自人脑肿瘤的新鲜解离组织22,23。
- 在生物安全柜中,用血清移液管小心地将细胞和培养基从组织培养瓶中转移到 50 mL 锥形管中。
- 在室温下以 300 x g 离心锥形管长达 5 分钟。用 25 mL 移液器吸出沉淀上方的培养基,在试管中留下约 0.5 mL。
- 用 1 mL 移液器轻轻上下移液细胞 10 次,以解离细胞沉淀。使用台盼蓝和血细胞计数器对细胞进行计数。
- 将所需的细胞计数等分到新管中后,通过重悬细胞并在 4 °C 下以 300 x g 沉淀 5 分钟,用 PBS 洗涤 2 次。
注意:细胞计数可以按说明确定。例如,如果需要以 200,000 个细胞的细胞密度注射 10 只动物,那么所需的最小细胞数为 2 x 106。 - 在最后一次洗涤过程中,尽可能多地去除 PBS。将细胞沉淀和 50 μL 细胞外基质 (ECM) 水凝胶等分试样轻轻置于冰上。
注:ECM 水凝胶可以使用 4 °C 冷却的移液管在冰上预先分装成 50 μL 部分,并储存在 -80 °C 以备需要。ECM 水凝胶可以暂时保存在冰上缓慢解冻,以供后续实验使用。 - 将细胞沉淀与注射用 ECM 水凝胶混合,目的是在开始颅内注射之前尽快完成此步骤。作为标准程序,使用 2 μL 含有悬浮在 ECM 水凝胶中的 200,000 个细胞的悬浮液。
注意:如果颅内注射时间超过 2-3 小时,则应准备新的细胞储备,因为在冰上长时间孵育可能会降低细胞的活力。可以颅内注射多达 1,000,000 个细胞,体积高达 10 μL;然而,这将需要将细胞重悬于 PBS 而不是 ECM 水凝胶中,并以非常缓慢的注射速率添加。
3. 建立立体定位和麻醉设备
注意:下面列出的程序可能略有不同,具体取决于立体定位设备的制造商和首选的麻醉类型。
- 首先用聚山梨酯 20 清洁剂对其表面进行消毒,然后静置 10 分钟,以启动 BSC。随后,用 80% 乙醇擦拭表面。在放入 BSC 罩内之前,用 80% 乙醇擦拭每台设备(避免弄湿任何电源输入)。
- 根据 图 1 将底板放置在 BSC 罩内,鼻锥位于右侧(适用于惯用右手的用户)。确保 XYZ 机械手已固定到底板上并固定。
- 将数字显示控制台连接到底板后部的入口,并将其电源线插入 BSC 护罩内提供的电源(请参阅 图 1)。此控制台记录 XYZ纵器移动的坐标。
- 将碳过滤器罐(用于麻醉剂输出)和麻醉剂输入固定到可拆卸物镜转盘上的两个阀门。将鼻锥件滑到安装部分,并将螺钉拧紧到立体定位装置上。
- 将耳杆连接到安装部分两侧各自的支架上,通过拧紧固定在支架上的螺钉将其固定到位。耳杆可以用纱布垫或电工胶带覆盖。
- 将手术床引入设备中,调整其高度以与耳杆对齐,从而将动物固定到位。用测量垫包裹手术床以保持动物温暖。
- 将加热垫连接到电源并将其放置在动物下方,以在麻醉过程中保持温暖。
- 在 BSC 罩内,放置无菌棉签、20 μL 移液器吸头、眼膏、独立包装的异丙醇湿巾、手术胶水和 20 μL 移液器。用 80% 乙醇蘸湿纱布垫,然后将无菌镊子和手术刀放在上面。
- 通过在 80% 冷乙醇中冲洗 5 次,然后在 0.9% 冷盐水溶液中冲洗玻璃微量注射器来清洁玻璃微量注射器。
- 为了钻孔,将钻头电机连接到电源并将钻头安装到 XYZ 机械手上,通过拧紧螺丝确保牢固贴合。
- 将钻头组件更换为玻璃微量注射器支架,以便进行细胞注射。松开 XYZ 机械手上的螺丝,然后用注射器支架替换,取下钻头。在将玻璃微量注射器与先前钻孔对齐之前,确保拧紧螺钉。
- 使用立体定位设备后,拆卸所有组件并用 80% 乙醇消毒,然后存放在干净的储物箱或无尘柜中。将所有尖锐物品安全适当地丢弃到指定的尖锐容器中。
4. 颅内注射
注意:雄性和雌性小鼠都可以进行颅内注射,但通常首选雌性小鼠,因为它们不易因雄性攻击性而引起伤口并发症。该程序通常在 7-10 周龄的小鼠中进行,为肿瘤发展留出足够的时间。通常,动物被随机分组,每笼 4-6 只。免疫功能低下的菌株(如 BALB/c Nude、NOD-SCID 和 NSG)通常用于患者来源的异种移植物 (PDX) 开发,因为它们的免疫缺陷状态支持肿瘤植入和生长24。虽然该方案规定了使用异氟醚进行麻醉诱导,但也可以使用氯胺酮和甲苯噻嗪等替代麻醉剂25。如果不使用异氟醚,则可以从程序中省略涉及麻醉室和相关设备的步骤。
- 在颅内手术前称重并监测动物的整体健康状况。在开始颅内注射之前,一次给动物一个笼子施用镇痛药(例如,丁丙诺啡 0.05 mg/kg,腹膜内)长达 1 小时。
- 根据仪器随附的指南设置麻醉设备。在开始该程序之前,请确保蒸发器至少装满一半。确保氧气供应打开。
- 如果动物有皮毛,可以在颅内手术前一天或同时去除。用电动剪刀或剃须刀去除背部或小鼠颅骨手术部位的皮毛。
- 将动物转移到麻醉诱导室。确保麻醉机上的流量计设置为 1 L/min 流量,并且氧气调节器在 40-50 psi 之间。通过检查肌肉是否放松且没有反射,确保维持中度麻醉。
- 监测动物对刺激的反应并观察胸壁运动以确保呼吸稳定。如果颅内注射超过 10 分钟,请使用直肠探头和温度监测系统监测温度,并使用脉搏血氧仪跟踪脉搏
- 将动物安装在立体定位装置上,确保门牙固定在切口杆中,并且鼻锥已将动物固定到位。
- 用浸有碘的棉签消毒小鼠的头部,然后用异丙醇湿巾消毒。将角膜眼膏涂抹在双眼上,以防止手术过程中干燥。
- 从小脑底部开始切开,将其穿过颅骨延伸到中点,沿着颅骨的上部做一个大约 1 厘米长的小切口。
- 收紧耳朵之间的皮肤,露出头骨,并通过收紧耳杆固定头部。清洁颅骨表面并用棉签擦干。
- 将钻头固定到立体定位框架上,并使用钻头定位前囟(或 lambdoid 结构)。
注意:根据植入研究所需的解剖区域选择特定的立体定位坐标。这些精确的坐标可以来自已发表的文献,也可以使用立体定位坐标26 图谱中的小鼠大脑等资源确定,从而确保准确定位成功植入。 - 确定坐标后,使用钻头在弥漫性中线胶质瘤 (DMG) 的指定部位小心地在骨中开一个小毛刺孔:X = +0.5,Y = -5.5,Z = -3.1 来自前囟;幕上脑瘤(GBM 或室管膜瘤):前囟 X = +1.5、Y = +1、Z = -3;幕下脑肿瘤(髓母细胞瘤、室管膜瘤):X = +2、Y = - 2、Z = -2 来自 lambdoid 结构。
- 用移液管多次重悬细胞,同时避免气泡。将 2 μL 细胞混合物吸入预洗的冷玻璃微型注射器中。将注射器连接到立体定位框架上,并将针头调整到颅骨尖端。
- 在 30 秒内将细胞注射到钻孔区域,在注射过程中干燥任何回流的细胞悬液。
注:由于细胞悬浮在 ECM 水凝胶中,因此注射速度需要足够快,以便细胞悬液不会在注射器中凝固。不同的细胞密度可用于评估不同的植入率,较高的细胞密度通常会导致更快的肿瘤植入。 - 将注射器留在原位 1 分钟以避免回流并让 ECM 水凝胶沉降。取出注射器并用异丙醇湿巾擦拭伤口。如有必要,使用皮肤胶或伤口夹密封切口。
- 将动物斜躺在带有加热灯的干净恢复笼中或放在加热垫上,以保持温暖直到恢复。持续监测动物,直到它开始自行移动,此后经常监测,直到它表现出正常行为。
- 如果发现动物在恢复过程中重新打开了先前密封的伤口,请再次麻醉动物,用异丙醇湿巾清洁伤口以去除任何残留的胶水,然后用订书钉重新固定。
5. 术后植入监测
- 颅内注射后,开始每周监测小鼠 5 天(如果需要,可以更长时间)。在颅内注射后的最初几周内提供术后护理,例如种子或糊状食物。仔细监测动物是否有任何潜在的伤口开口。
注意:如果雌性动物的伤口被剪掉,它们会留在猫砂盆中,因为它们很少表现出攻击性。对于雄性动物,我们在笼子里提供两个冰屋以及额外的营养丰富物,以帮助减少攻击性。在极少数情况下,发生攻击性并导致伤口重新开放,用订书钉重新固定伤口,并将攻击者从群体中移出并单独存放。 - 在监测表上记录一般健康参数,例如体重减轻、活动水平、姿势、脱水迹象和皮毛状况。
- 在监测表上记录间歇性、轻度或严重的神经系统症状,例如头部倾斜、共济失调和/或盘旋行为。
- 按如下方式识别神经系统症状:
- 观察以下情况并将其分类为间歇性症状: 头部倾斜:在 5 分钟的检查中观察 1-2 次,总体健康状况令人满意。共济失调:在 5 分钟的检查中观察 1-2 次;总体健康状况令人满意。盘旋:在 5 分钟的检查期间观察 1-2 次;总体健康状况令人满意。行为:老鼠表现出正常的行为,能够接触到食物/水和攀爬。
- 观察以下症状并将其分类为轻微症状: 头部倾斜:在 5 分钟的检查中定期显示,整体健康状况令人满意。共济失调:在 5 分钟检查期间定期显示,整体健康状况令人满意。盘旋:在 5 分钟的检查期间定期显示,整体健康状况令人满意。行为:小鼠可能有荷叶边的皮毛或干燥的皮肤,但仍然可以表现出正常的行为、进食和攀爬。
- 观察以下情况并将其归类为严重症状: 头部倾斜:检查过程中持续显示,近 90° 倾斜,皮毛褶皱,活动较少。共济失调:检查时持续显示,醉酒动作,荷叶边外套,不太活跃。盘旋:检查过程中持续显示,荷叶边外套,不太活跃。行为:小鼠的皮毛可能非常皱巴巴的或皮肤干燥。他们的体重可能会减轻超过 15%。在这个阶段为动物提供种子或糊状食物。
- 当小鼠表现出以下任何表明影响其健康的肿瘤生长的临床体征时,为小鼠建立人道终点:体重从初始体重减轻 20% 或更多、严重头部倾斜、严重共济失调、严重盘旋、嗜睡或呼吸困难。在这个阶段,使用 CO2 窒息对小鼠进行人道安乐死。
6. 收获大脑
- 确保动物通过 CO2 窒息或宫颈脱位进行人道安乐死。
- 用剪刀或手术刀沿着头皮做一个 2 厘米的中线切口。小心地分离并剥开皮肤,露出头骨。
- 使用细剪刀或手术刀,沿着颅骨中线小心地切开 2 厘米。用镊子轻轻撬开颅骨,从后脑勺朝鼻子方向工作。
- 继续沿着颅骨的侧面切割,确保不会损坏下面的脑组织。颅骨完全打开后,使用镊子和剪刀小心地将大脑从颅神经和血管中分离出来。
- 轻轻地将大脑从颅腔中抬起,从后面开始,向前移动。根据后续实验程序的要求,如快速冷冻或固定,将大脑储存在适当的条件下。大脑的免疫组织化学分析可能因实验室而异。增殖细胞标志物 KI67 的典型工作流程在已发表的文献20 中进行了描述。
结果
使用立体定位装置的原位注射对于开发脑肿瘤模型至关重要。该技术允许精确和可重复地放置肿瘤细胞,这对于在神经肿瘤学研究中生成一致和可靠的数据至关重要。原位注射的成功实施在很大程度上取决于立体定位设备的准确设置,其中通常包括立体定位框架、用于精确运动的数字显微作器、注射注射器和用于固定动物的麻醉系统(图 1A、B)。使用玻璃微量注射器可以进行小体积的颅内注射,通常在 2-5 μL 之间。适当的维护和频繁清洗对于防止生物材料的堆积至关重要,生物材料会阻塞注射(图 1C)。
使用立体定位设备对小鼠进行脑肿瘤细胞颅内注射的程序涉及几个关键步骤。首先,对鼠标进行麻醉,以在整个过程中保持静止和舒适。表明动物被麻醉的典型线索包括脚趾捏时没有运动和反射,以及存在规律的呼吸模式。然后,将鼠标放置在立体定位框架中,将其头部固定在固定位置(图 2A)。使用颅骨上的标志,如前囟和 lambda,确定注射的精确坐标。在头皮上做一个小切口,并在选定的坐标处在颅骨上钻一个毛刺孔(图 2B)。通过钻孔插入连接到立体定位臂的显微注射针,以将肿瘤细胞输送到所需的大脑区域(皮层、小脑或脑干; 图 2C)。仔细监测和调整针头位置可确保准确定位。注射后,缓慢抽出针头,并关闭切口(图 2D)。预计密封的伤口将在颅内注射后两周内愈合。
颅内注射后,动物需要仔细监测整体健康状况和神经系统症状的发展,这通常表明肿瘤进展(补充表 1)。通常,动物在注射后第 1 周可能会有轻微的体重减轻(高达其最高体重的 10%),一旦注射部位在第 2 周结束时完全密封,这种减轻通常会稳定下来。一般来说,动物的体重会稳步增加并保持良好的整体健康状况,直到肿瘤进展发生。神经系统症状的表现因脑肿瘤类型、注射部位和动物品系等因素而异。例如,皮质神经胶质瘤或室管膜瘤可能表现为进行性体重减轻和潜在的前脑肿大,而脑干胶质瘤和髓母细胞瘤可能表现出共济失调和头部倾斜等症状,尤其是在免疫功能低下的动物中(图 3A)。此外,在患有脑干肿瘤的动物中可能会观察到盘旋行为,尤其是在 NSG 或 NOD/SCID 菌株中。神经系统症状的进展通常与体重逐渐减轻同时发生。适当的后期护理措施,例如提供带有长喷嘴的水瓶或提供软食(糊状食物颗粒)或种子,对于支持动物的健康至关重要。在达到实验终点和随后对动物进行人道安乐死后,大脑的潜在变化可能会变得明显,包括注射部位的扩大和/或出血区域的存在(图 3B)。
Kaplan-Meier 图通常用于描述脑肿瘤动物模型的生存结果。它们直观地描述了颅内注射或抗癌治疗后随时间推移的生存概率。这些图表是在临床前研究环境中分析和呈现生存数据的重要工具15,27。我们在小脑中以不同的细胞密度进行了髓母细胞瘤细胞培养物 D425 的颅内注射。所有颅内注射的动物都发展为肿瘤。我们的结果表明,更高的细胞密度,特别是每只小鼠 50,000 和 100,000 个细胞,比每只小鼠 10,000 个细胞植入得更快(图 4)。此外,我们将患者来源的高级别神经胶质瘤 (HGG) 细胞颅内注射到皮层和脑干中,以比较这些不同位置的总生存期和肿瘤生长模式以及免疫组织化学特征。无论位置如何,所有动物都注射了颅内发育的肿瘤。HGG 细胞的培养按照步骤 1.1 至 1.10 中详述的方案进行。按照步骤 2.1 至 2.6 中的说明制备用于颅内注射的细胞,而颅内注射程序遵循步骤 4.1 至 4.16 中概述的方法27。当注射到皮层时,HGG 细胞在颅内注射后显示出大约 25 天的中位生存期(图 5A)。按照步骤 5.1 至 5.4 中的概述监测动物。这些动物没有表现出任何神经系统症状,但确实表现出进行性体重减轻。动物在达到步骤 5.5 中概述的人道终点时被人道安乐死。按照步骤 6.1 至 6.5 中详述的方案采集大脑并送去进一步分析27。免疫组织化学分析显示一个大的、高核的肿瘤块,有证据表明血管形成增加(图 5B)和许多增殖的 Ki67 细胞(图 5C)。当注射到脑干时,HGG 细胞在颅内注射后显示中位生存期约为 26 天(图 5D)。免疫组织化学分析表明第 4 脑室/脑桥上区有较大的肿瘤肿块,以及软脑膜浸润到侧脑室(图 5E)。进一步的免疫组织化学分析表明脑干和其他浸润区域有许多增殖细胞(图 5F)。该实验强调,将相同的肿瘤细胞注射到不同的解剖位置不会影响肿瘤生长速率,尽管观察到生长模式的一些差异。

图 1:用于颅内注射脑肿瘤细胞的立体定位装置的代表性图像。 (A) 麻醉装置通常位于 BSC 罩旁边,需要对诱导室和立体定位装置进行双重麻醉。(B) 玻璃微量注射器清洗站和立体定位支架;注射器需要在每次颅内注射后用生理盐水、乙醇冲洗,然后用水冲洗。(C) BSC 罩内的立体定位设置,说明麻醉室、钻孔机、立体定位装置、立体定位坐标控制台、棉签、手术刀、镊子、移液管和尖端。 请单击此处查看此图的较大版本。

图 2:对免疫功能低下的小鼠进行颅内注射的代表性图像。 (A) 位于麻醉锥中的麻醉动物。(B) 切开皮肤,然后用耳杆将皮肤固定在两侧。(C) 位于钻孔顶部的玻璃微量注射器,用于注射。(D) 皮肤粘合后形成莫霍克风格。 请单击此处查看此图的较大版本。
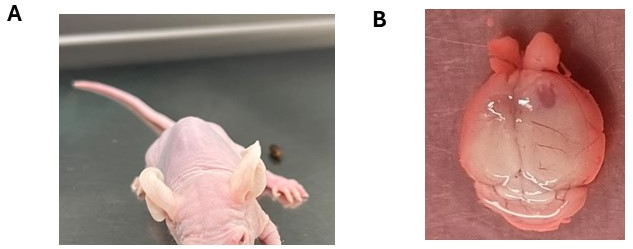
图 3:植入脑肿瘤细胞后观察到的潜在神经系统症状。 (A) 动物在脑干颅内注射 DMG 细胞后表现出头部倾斜。(B) 右侧皮质半球扩大,注射侧显示肿瘤形成。该动物被注射室管膜瘤细胞。 请单击此处查看此图的较大版本。
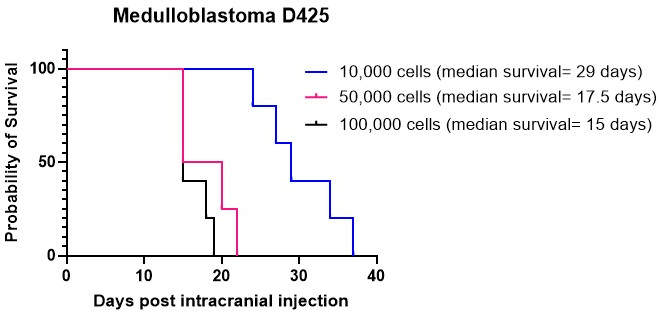
图 4:不同细胞密度的髓母细胞瘤培养物 D425 的植入。 使用立体定位设备以 10,000 个细胞的密度在 2 μL ECM 水凝胶、50,000 个细胞和 100,000 个细胞中注射髓母细胞瘤细胞。监测动物的体重是否逐渐减轻,并在它们达到比最高记录体重低 20% 时进行人道安乐死。注射 10,000 个细胞的动物的中位生存期为 29 天,而注射较高细胞密度(50,000 个和 100,000 个细胞)的动物的中位生存期分别为 17.5 天和 15 天。本研究中注射的所有动物都成功发展为肿瘤。 请单击此处查看此图的较大版本。

图 5:在皮层和脑干颅内注射 HGG 细胞的 NSG 动物的代表性生存曲线和组织学分析。 使用立体定位设备将大约 100,000 个 HGG 细胞(第 3 代)注射到 2 μL ECM 水凝胶中。监测动物的体重是否逐渐减轻,并在它们达到比最高记录体重低 20% 时进行人道安乐死。未观察到这种脑肿瘤亚型的神经系统症状。(A) 将 HGG 细胞注射到皮层的动物的中位存活率约为注射后 25 天 (N=2)。(B) 皮层的 H&E 染色显示一个高度有核的区域,血管形成增加,表现为红细胞的存在。(C) 皮层中的肿瘤移植区域显示出高水平的增殖细胞,如 KI67 染色所示。(D) 将 HGG 细胞注射到脑干的动物的中位存活率约为注射后 26 天 (N=2)。本研究中注射的所有动物都成功发展为肿瘤。(E) 脑干的 H&E 染色显示一个高核区域,在侧脑室的软脑膜中观察到肿瘤浸润。(F) 脑干中的肿瘤移植区域显示出高水平的增殖细胞,如 KI67 染色所示。主图中的黑色比例尺表示 2 mm,而放大的插入图像表示 20 μm。 请点击此处查看此图的较大版本。
补充表 1: 用于检查动物颅内注射后和可能的抗癌剂治疗的监测表。 请点击此处下载此表格。
讨论
虽然本研究中详述的颅内注射技术为建立小儿脑肿瘤的原位人源异种移植物 (PDX) 模型提供了一种强大的方法,但有几个领域需要改进。改进该技术的一种方法涉及优化肿瘤细胞制备过程。这包括改进用于植入肿瘤细胞的材料。虽然 ECM 水凝胶被认为是金标准,但利用由更接近大脑或肿瘤 ECM 的成分组成的水凝胶可以提高 BT 细胞的存活和植入。这种方法特别有益于植入时间较长的肿瘤类型,例如髓母细胞瘤和室管膜瘤。例如,胶原蛋白已被证明在 3 组髓母细胞瘤的生长中起关键作用,而层粘连蛋白支持 SHH 型髓母细胞瘤28。此外,ECM 的刚度也可能影响肿瘤生长。例如,与正常脑组织相比,高级别胶质母细胞瘤的核心表现出更高的刚度,这可能支持肿瘤生长和存活29。通过定制 ECM 组成和刚度以满足不同肿瘤类型的特定要求,可以显着改善 PDX 模型的植入和生长。
最近的一些研究为患者肿瘤样本处理和 PDX 模型的开发提供了有价值的见解。Tsoli 等人强调,直接植入 DMG 组织通常比原代培养物产生更高的植入率15。Smith 等人通过颅内注射脑肿瘤活检或尸检样本建立了 37 个 PDX 模型,报告总体成功率为 43%,其中 HGG 的植入率最高 (100%),其次是髓母细胞瘤 (45%) 和室管膜瘤 (25%)。肿瘤潜伏期差异很大,从 1 个月到 11 个月不等,更具侵袭性的肿瘤移植更快11。相比之下,Brabetz 等人报告的总体成功率较低,为 30%,HGG 的植入率为 31%,髓母细胞瘤 (37%) 和室管膜瘤 (17%) 的植入率较低16。尽管存在这些差异,但 Smith 等人和 Brabetz 等人进行的最后两项研究证实,PDX 模型通常在免疫组织化学和分子水平上概括了患者肿瘤,尽管在原始肿瘤样本和已建立的模型之间观察到微小的基因组差异。这些发现强调了开发具有代表性的 PDX 模型的挑战,并强调了不同肿瘤类型植入成功的差异11,16。
原位方法的一个重大局限性是,如果肿瘤细胞用荧光素酶或磁共振成像 (MRI) 标记,除非使用成像系统,例如 Xenogen 成像,否则无法准确测量肿瘤大小。用荧光素酶标记肿瘤细胞可以提供一种解决方案,它允许生物发光成像来确认植入和非侵入性监测肿瘤进展。这种方法将增强动态跟踪对治疗反应的能力,从而提供更精确的治疗效果评估17,30。另一种方法涉及利用 MRI 技术;然而,肿瘤的可检测性取决于它们的大小。较大的肿瘤更容易识别,这通常位于实验终点,并且检测也可能根据肿瘤的亚型而有所不同,GBM 比弥漫性神经胶质瘤更容易检测27,31。特别是对于弥漫性神经胶质瘤,完整血脑屏障 (BBB) 的存在导致缺乏对比增强。然而,在 GBM 中,脉管系统渗漏和水肿的存在会放大肿瘤组织与周围健康脑组织之间的对比,可能有助于检测过程。通常需要造影剂来提高检测能力 30,31,32。弥散加权成像 (DWI) 和液体衰减反转恢复 (FLAIR) 等替代成像技术有时用于改善对非增强肿瘤区域的检测。然而,这些方法也有其局限性,可能并不总是提供肿瘤边界的精确描绘33。酰胺质子转移加权 (APTw) 成像是一种无创 MRI 技术,通过跟踪蛋白质-水质子交换来检测弥漫性神经胶质瘤,有助于肿瘤分级。虽然前景广阔,但它面临着诸如易受伪影影响等挑战,并且尚未适应小动物成像,限制了其更广泛的应用34。
使用原位 BT PDX 模型进行药物疗效研究时要考虑的另一个关键方面是所用 PDX 模型中的 BBB 完整性。BBB 的通透性显着影响药物递送和脑肿瘤治疗的疗效。例如,脑干神经胶质瘤中维持的 BBB 完整性通常会导致药物渗透不良,从而限制全身治疗的有效性17。另一方面,在第 3 组髓母细胞瘤中,在 MRI 成像上观察到 BBB 完整性是异质性的,并且在患者来源的异种移植物 (PDX) 模型中也同样发现它是渗漏的35。因此,在每个 PDX 模型中表征 BBB 状态(无论是完整还是渗漏)对于设计适当的治疗策略和准确解释药物疗效研究的结果至关重要。
总体而言,概述的颅内注射程序为建立 BT PDX 模型和进行治疗药物的疗效研究提供了一种稳健的方法。不断的改进,加上对这些模型的全面理解,将增强它们的实用性,并促进儿科 BT 患者治疗干预措施的开发。
披露声明
作者没有什么可披露的。
致谢
作者感谢悉尼儿童医院网络、悉尼儿童肿瘤库网络和零儿童癌症计划的患者、临床医生和研究人员慷慨地为建立该方法提供了必要的样本。澳大利亚儿童癌症研究所隶属于新南威尔士大学悉尼分校和悉尼儿童医院网络。该协议源于国家卫生与医学研究委员会(协同赠款 #2019056,领导赠款APP2017898给 DZ)和癌症研究所新南威尔士州计划赠款(TPG2037 给 DZ 和 MT)的支持,以及 Levi's Project、The Kids Cancer Project、The Cure Starts Now、DIPG Collaborative、 治愈脑癌基金会、罗伯特康纳道斯基金会和本尼威尔斯基金会。
材料
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
参考文献
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。