Method Article
脳腫瘍に対する同所性患者由来異種移植モデルの確立
要約
同所性小児脳腫瘍モデルの開発には、がん細胞を正確に移植するための定位固定装置を使用するという、細心の注意を払った精度が必要です。ここで紹介する方法論は、脳腫瘍細胞の調製、頭蓋内注射の実施、および脳腫瘍の生着を評価するための術後モニタリングシステムの実装に関連するステップを概説しています。
要約
中枢神経系(CNS)腫瘍の臨床的に関連性があり信頼性の高いモデルの開発は、神経腫瘍学の分野を前進させる上で極めて重要です。最も広く使用されている技術の1つは、同所性頭蓋内注射であり、制御された環境内で腫瘍の成長、浸潤、および播種を調査できる方法です。この技術では、特定の患者領域から腫瘍細胞を動物の対応する解剖学的部位に移植します。これにより、これらの同所性脳腫瘍モデルは、がんの生物学的挙動とヒト患者に見られる脳環境との相互作用をより正確に再現するため、独自の利点を提供します。そのため、臨床シナリオとの類似性が潜在的な治療法の評価に不可欠である前臨床治療試験に特に価値があります。このプロトコルは、びまん性正中神経膠腫 (DMG)、神経膠芽腫 (GBM)、髄芽腫、上衣腫などの小児脳腫瘍の患者由来異種移植片 (PDX) モデルの開発経験を共有しています。この方法は、マウスで頭蓋内定位固定装置注射を行う手順を説明し、脳内の注射部位の正しい標的化を確保します。さらに、腫瘍の生着が成功した兆候を検出するために採用された処置後モニタリングシステムについても説明します。腫瘍注射後、腫瘍進行の一般的な指標である神経障害、行動の変化、および/または体重減少の兆候がないか動物を観察するために、厳格なモニタリングシステムが実施されます。このシステムは、タイムリーな介入を可能にし、腫瘍の成長ダイナミクスに関する重要なデータを提供します。これらのモデルとプロトコルを改良することにより、前臨床試験の信頼性とトランスレーショナルポテンシャルを高め、小児CNS腫瘍のより効果的な治療法の開発に貢献することを目指しています。
概要
小児中枢神経系(CNS)腫瘍は、小児に多くみられる固形腫瘍であり、小児原発腫瘍の約20%-25%を占め、治療に対する発生率および反応の点で成人腫瘍とは異なる特徴を有する1,2。膠芽腫(GBM)やびまん性内因性橋グリオーマ/びまん性正中神経膠腫(DIPG/DMG)などの高悪性度グリオーマ(HGG)は特に侵攻性が高く、予後が不良であり、治療法の進歩にもかかわらず、生存率は低いままです3,4,5。小児CNS腫瘍の約20%を占める髄芽腫は、標準治療で高い5年生存率を達成しているが、特定のサブタイプは、特に再発シナリオで課題を提起している6,7。上衣腫は、小児中枢神経系腫瘍の約10%を占め、分子特性および腫瘍の位置によってさまざまな予後を示し、再発は重大な臨床的課題をもたらす8,9。分子ランドスケープを理解し、同所性脳腫瘍(BT)モデルを開発することで、小児患者の転帰を改善する効果的な治療法の開発が期待できます。
臨床的に関連性のあるBTモデルの開発は、神経腫瘍学の研究と治療法の発見を進めるために不可欠です。定位固定装置を用いた同所性注射は、脳内の腫瘍細胞の正確な配置を可能にし、脳腫瘍の自然環境を密接に模倣するため、このアプローチにおいて極めて重要である10。この方法は、腫瘍モデルの信頼性と再現性を向上させ、腫瘍の生物学と浸潤や血管新生などの主要な特性のより正確な研究、および治療的介入の評価を容易にします11。細胞注入の正確な位置と深さを制御する定位固定装置の能力により、腫瘍細胞が意図した脳領域に一貫して配置されることが保証され、それによって実験結果の有効性が向上する10。皮下モデルは、治療薬の初期スクリーニングにおいて、よりアクセスしやすく、費用対効果の高い選択肢を提供します。これらのモデルでは、腫瘍細胞が皮下に埋め込まれるため、腫瘍の増殖と治療反応を容易にモニタリングできる12。彼らは脳の複雑な微小環境を再現する能力を欠いていますが、皮下モデルは、ハイスループットの薬物スクリーニングと予備的な有効性評価12,13にとって非常に価値があります。
複数の研究により、剖検または生検サンプルからの直接組織移植および原発性脳腫瘍培養を含む、脳腫瘍サンプルからの同所性患者由来異種移植モデル(PDX)の開発が成功したことが実証されています11,14,15。ただし、腫瘍解離組織または腫瘍細胞の頭蓋内注射は必ずしも生着を保証するとは限らず、失敗の理由は完全には理解されていないことを認識することが重要です15。興味深いことに、HGG生検サンプルは、他の脳腫瘍サブタイプと比較して高い成功率を示す傾向があります。例えば、HeらはHGG同所性モデルで56%の成功率を示しましたが、Brabetzらの研究では、上衣腫や髄芽腫などの他の小児脳腫瘍サンプルでは、生着率がそれぞれ43%と30%と低いと報告されています11,14,16。特に、脳腫瘍のPDXモデルは、1カ月から11カ月までの幅広い潜伏期間を示し、その後の生着では前臨床の有用性が低下します。分子レベルで疾患を再現する能力があるにもかかわらず、生検と確立されたモデルとの間にはゲノムの差異が認められている14,16。
PDXモデルは、小児BTに対する新しい治療戦略を探求する上で不可欠なツールとして機能します。これらのモデルは、血液脳関門(BBB)の存在による腫瘍の成長、症状、薬物動態の観点からヒトの疾患を忠実に再現するため、薬効研究を実施するためのゴールドスタンダードと考えられています。研究は、小児脳幹神経膠腫の分野で、維持されたBBBの完全性と薬物浸透の欠如が、これらの腫瘍の治療効果の低下につながる特徴であることを示しました17,18,19。しかし、有効性は、エピジェネティックおよび代謝阻害剤17,20のような適切な薬物浸透を示す選択された治療において観察することができる。
この研究は、免疫不全動物の脳腫瘍細胞の頭蓋内注射を行う方法を提示し、PDX開発のための生着の評価および/または治療薬の有効性の評価を目的としています。倫理的な実験エンドポイントに到達するまで腫瘍の進行を監視するための包括的なツールも提供されています。
プロトコル
以下に概説するプロトコルは、ニューサウスウェールズ大学によって概説された動物の世話と使用に関する倫理ガイドラインに従っており、すべての手順は施設の動物管理および使用委員会によって承認されています。動物福祉が優先され、頭蓋内注射手順で使用される動物の苦痛を最小限に抑えるためにあらゆる努力が払われました。
1. ニューロスフェア形成脳腫瘍培養の拡大に向けた培養
注:特定の要件は、使用する脳の培養によって異なる場合があります。次の手順では、ニューロスフェアとしての初代脳腫瘍細胞の一般的な培養プロトコルの概要を示します。脳腫瘍培養物は、商業業者から入手することも、患者の脳腫瘍生検または剖検から初代培養物として確立することもできます。患者の生検または剖検サンプルから初代培養を確立する手順は、公開された文献15,21に概説されています。
- 凍結保存したストックバイアルを、内容物が解凍されるまで37°Cのウォーターバスに入れます。バイアルの外面を70%エタノールで拭いて、無菌性を確保します。
- Mayoh et al.21に記載されているように、初代脳腫瘍細胞用のNeurosphere培地を調製します。生物学的安全キャビネット(BSC)で、滅菌済みの1 mLピペットを使用して、解凍した細胞を、5 mLの予熱済みニューロスフェア培地が入った滅菌済みの15 mLコニカルチューブに移します。
- コニカルチューブを300 x g で3分間遠心分離し、細胞をペレット化します。上清は10mLのピペットでできるだけ多く慎重に捨ててください。
- 細胞ペレットを10 mLまたは25 mLのニューロスフェア培地に再懸濁します。細胞懸濁液をT25またはT75フラスコにプレートします(凍結保存から予想される細胞数に応じて)。典型的には、密度が5×105 細胞の開始細胞をT25フラスコに入れる。
- フラスコを37°Cにセットし、5%CO2で設定したインキュベーターに入れます。メディアは週に1回または2回、新しいメディアと交換します。あるいは、細胞の増殖速度に基づいて、必要に応じて成長因子とB27を補充します。
- T25フラスコでニューロスフェアが形成されたら、T75フラスコでニューロスフェアを拡張できます。T25フラスコの内容物を10 mLピペットで15 mLコニカルチューブに移します。ニューロスフェアを光学顕微鏡で観察し、十分に大きくなると(約500μm)、肉眼でも見えるようになるかもしれません。
- チューブを300 x g で3〜5分間遠心分離します。細胞ペレットの上に培地を吸引し、チューブ内に約1 mLを残します。
- 1mLピペットで細胞を12倍から15倍に優しく上下にピペットで動かし、細胞ペレットを解離します。セルストレーナー(40 μm)を使用して、ニューロスフェアを単一セル混合物に解離します。
- 50 mLのコニカルチューブの上にストレーナーを置き、10 mLピペットで解離したスフェロイドをストレーナーに加えます。ほとんどの単一セルはメッシュをチューブに渡し、凝集マテリアルはメッシュ上に留まります。
- 細胞計数チャンバーで細胞をカウントします。等量の細胞懸濁液(5 μLなど)をTrypan Blue(5 μL)と混合して、細胞生存率を評価します。死んだ細胞は光学顕微鏡下で青く見えますが、生きている細胞は染色されないままです。
- セル密度を次のように計算します。
細胞濃度 = グリッドあたりの平均細胞数 × 希釈係数 / 1グリッドの容量 (mL)。標準的な細胞計数チャンバーからのグリッド容量は0.0001mLです。 - 細胞を継代するには、1 x 106 細胞をT75フラスコ内の新鮮な温めた培地25 mLに再懸濁します。細胞をT75フラスコに入れたら、ニューロスフェアが増殖するまで、5% CO2 加湿インキュベーターで37°Cでインキュベートします。
- 脳腫瘍細胞を凍結保存するには、1 x 106 細胞を1 mLの凍結保存溶液に再懸濁し、制御された速度の凍結容器に一晩置いて-80°Cで保存します。 凍結保存したストックを-180°Cの液体窒素タンクに入れて長期保存します。
注:凍結保存培地は、90%のウシ胎児血清と10%のジメチルスルホキシド(DMSO)で構成されています。
2. 頭蓋内注射用脳腫瘍細胞の作製
注:以下のプロトコルは、頭蓋内注射のための確立されたまたは短期の培養物からの培養細胞の調製を概説しているが、それはまた、ヒト脳腫瘍22,23からの新たに解離した組織を含む他の細胞型にも適応することができる。
- バイオセーフティキャビネット内で、細胞と培地を組織培養フラスコから血清学的ピペットで50 mLのコニカルチューブに慎重に移します。
- コニカルチューブを300 x g で室温で最大5分間遠心分離します。25 mLピペットでペレットの上の培地を吸引し、チューブ内に約0.5 mLを残します。
- 1 mLピペットで細胞を10倍にゆっくりと上下にピペットで動かし、細胞ペレットを解離します。トリパンブルーと血球計算盤を使用して細胞をカウントします。
- 目的の細胞数を新しいチューブに分注したら、細胞を再懸濁し、300 x g で4°Cで5分間ペレット化することにより、PBSで2回洗浄します。
注:セル数は、説明したように決定できます。例えば、200,000個の細胞密度で10匹の動物を注入する必要がある場合、必要な細胞の最小数は2 x 106です。 - 最終洗浄時には、できるだけ多くのPBSを取り除いてください。細胞ペレットと50 μLの細胞外マトリックス(ECM)ハイドロゲルアリコートを氷上に静かに置きます。
注:ECMハイドロゲルは、4°C冷却ピペットを使用して氷上で50μLの部分に事前に分注し、必要になるまで-80°Cで保存できます。ECMハイドロゲルは、一時的に氷上に置いてゆっくりと解凍し、その後の実験に使用することができる。 - 細胞ペレットをECMハイドロゲルと混合して注射し、頭蓋内注射を開始する前にこのステップをできるだけ早く完了することを目指しています。標準的な手順として、ECMハイドロゲルに懸濁した200,000個の細胞を含む懸濁液を2μL使用します。
注:頭蓋内注射に2〜3時間以上かかる場合は、氷上での長時間のインキュベーションが細胞の生存率を低下させる可能性があるため、新しい細胞ストックを準備する必要があります。最大1,000,000個の細胞を、最大10μLの容量で頭蓋内注入することが可能です。ただし、これには、細胞をECMヒドロゲルではなくPBSに再懸濁し、非常に遅い注入速度で添加する必要があります。
3. 脳定位固定装置および麻酔器具のセットアップ
注意: 以下にリストされている手順は、脳定位固定装置の製造元と推奨される麻酔の種類によって若干異なる場合があります。
- BSCは、最初にポリソルベート20洗剤で表面を消毒し、10分間放置して開始します。続いて、80%エタノールで表面を拭きます。BSCフード内に配置する前に、各機器を80%エタノールで拭いてください(電気入力を濡らさないでください)。
- 図1に従って、ベースプレートをBSCフード内に配置し、ノーズコーンを右側に配置します(右利きのユーザーの場合)。XYZマニピュレーターがすでにベースプレートに取り付けられ、固定されていることを確認してください。
- デジタルディスプレイコンソールをベースプレートの背面にあるインレットに接続し、その電源ケーブルをBSCフード内の付属の電源に差し込みます( 図1を参照)。このコンソールは、XYZマニピュレータの動きの座標を登録します。
- カーボンフィルターキャニスター(麻酔薬出力用)と麻酔薬入力を取り外し可能なノーズピースの2つのバルブに固定します。ノーズコーンピースを取り付け部にスライドさせ、ネジを定位固定装置に締めます。
- イヤーバーを取り付けセクションの両側にあるそれぞれのホルダーに取り付け、ホルダーに固定されているネジを締めて所定の位置に固定します。イヤーバーはガーゼパッドまたは電気テープで覆うことができます。
- 手術用ベッドをデバイスに導入し、動物を所定の位置に固定するイヤーバーに合わせて高さを調整します。手術用ベッドをゲージパッドで包み、動物を暖かく保ちます。
- ヒーティングパッドを電源に接続し、動物の下に配置して、麻酔処置中の暖かさを維持します。
- BSCフードの内側に、滅菌綿チップ、20μLピペットチップ、眼軟膏、個別包装されたイソプロパノールワイプ、外科用接着剤、および20μLピペットを配置します。ガーゼパッドを80%エタノールで湿らせ、その上に滅菌鉗子とメスを置きます。
- ガラスマイクロシリンジを冷たい80%エタノールで5回洗い流し、続いて冷たい0.9%生理食塩水で洗浄します。
- 穴あけの目的で、ドリルモーターを電源に接続し、ドリルをXYZマニピュレータに取り付けて、しっかりとねじ込むことでしっかりとフィットします。
- ドリルコンポーネントを、細胞注入用のガラス製マイクロシリンジホルダーと交換します。XYZマニピュレーターのネジを緩め、シリンジホルダーと交換してドリルを取り外します。ガラスマイクロシリンジを前に開けた穴に合わせる前に、ネジが締められていることを確認してください。
- 定位固定装置を使用した後、すべてのコンポーネントを分解し、80%エタノールで消毒してから、清潔な収納ボックスまたはほこりのないキャビネットに保管してください。すべての鋭利物は、指定された鋭利物容器に安全かつ適切に廃棄してください。
4.頭蓋内注射
注:頭蓋内注射は、雄と雌の両方のマウスで行うことができますが、雄の攻撃性によって引き起こされる創傷合併症を起こしにくいため、一般的に雌マウスが好まれます。この手順は通常、7〜10週齢のマウスで行われ、腫瘍の発生に十分な時間を確保します。通常、動物はケージごとに4〜6頭のグループにランダム化されます。BALB/c Nude、NOD-SCID、NSGなどの免疫不全株は、その免疫不全状態が腫瘍の生着と成長をサポートするため、患者由来異種移植片(PDX)の開発に一般的に使用されています24。このプロトコルは、麻酔導入のためのイソフルランの使用を指定していますが、ケタミンやキシラジンなどの代替麻酔薬も使用できます25。イソフルランを使用しない場合、麻酔室および関連機器を含む手順は手順から省略できます。
- 頭蓋内処置の前に、動物の全体的な健康状態を比較検討し、モニタリングしてください。動物に一度に1ケージずつ鎮痛剤を投与します(例:.、ブプレノルフィン0.05 mg / kg、腹腔内)頭蓋内注射を開始する前に最大1時間。.
- 器具に付属のガイドラインに従って麻酔器具を設置してください。手順を開始する前に、気化器が少なくとも半分満たされていることを確認してください。酸素供給が開いていることを確認してください。
- 動物に毛皮がある場合は、頭蓋内処置の前日または同時に取り除くことができます。背側またはマウスの頭蓋骨の手術部位から、電動バリカンまたはカミソリで毛皮を取り除きます。
- 動物を麻酔誘導室に移します。麻酔器の流量計が1 L / minの流量に設定され、酸素レギュレーターが40〜50psiであることを確認します。筋肉が弛緩し、反射神経がないことを確認することにより、中程度の麻酔が維持されていることを確認します。
- 刺激に対する動物の反応を監視し、胸壁の動きを観察して、安定した呼吸を確保します。頭蓋内注射が10分を超える場合は、直腸プローブと温度監視システムで温度を監視し、パルスオキシメータを使用してパルスを追跡します
- 動物を定位固定装置に取り付け、前歯が切開バーに固定され、ノーズコーンが動物を所定の位置に固定されていることを確認します。
- マウスの頭部をヨウ素を染み込ませた綿先で消毒し、次にイソプロパノールワイプで消毒します。手術中の乾燥を防ぐために、角膜眼軟膏を両目に塗布します。
- 小脳の基部から切開を開始し、頭蓋骨を横切って中点まで伸ばし、頭蓋骨の上面に沿って長さ約1cmの小さな切り込みを入れます。
- 耳の間の皮膚を引き締めて頭蓋骨を露出させ、イヤーバーを締めて頭を固定します。頭蓋骨の表面をきれいにし、綿棒で乾かします。
- ドリルを脳定位固定装置フレームに固定し、ドリルを使用してブレグマ(またはラムドイド構造)の位置を特定します。
注: 特定の定位固定座標は、生着研究に必要な解剖学的領域に基づいて選択されます。これらの正確な座標は、公開された文献から取得するか、Stereotaxic Coordinates26 atlasのMouse Brainなどのリソースを使用して決定することができ、移植を成功させるための正確なターゲティングを保証します。 - 座標が確立されたら、ドリルを使用して、びまん性正中神経膠腫(DMG)の指定された部位の骨に小さなバリ穴を慎重に作成します:ブレグマからX = + 0.5、Y = -5.5、Z = -3.1。テント上脳腫瘍(GBMまたは上衣腫):ブレグマからのX = + 1.5、Y = + 1、Z = -3;テント下脳腫瘍(髄芽腫、上衣腫):ラムドイド構造からX = + 2、Y = -2、Z = -2。
- 気泡を避けながら、ピペットで細胞を複数回再懸濁します。2 μLの細胞混合物を、あらかじめ洗浄した冷たいガラス製マイクロシリンジに引き込みます。シリンジを脳定位固定装置フレームに取り付け、針を頭蓋骨の先端に合わせます。
- 30秒以内に細胞をドリル領域に注入し、注入中に逆流した細胞懸濁液を乾燥させます。
注:細胞はECMハイドロゲルに懸濁されているため、細胞懸濁液がシリンジ内で固まらないように、注入は十分に速く行う必要があります。さまざまな細胞密度を使用して、さまざまな生着率を評価でき、一般に、細胞密度が高いほど腫瘍の生着が速くなります。 - シリンジを1分間そのままにして、逆流を防ぎ、ECMヒドロゲルを沈殿させます。シリンジを取り外し、イソプロパノールワイプで傷口を拭きます。.必要に応じて、皮膚のりまたは傷口クリップを使用して切開部を密封します。
- 動物を熱ランプ付きの清潔な回復ケージまたは加熱パッドの上に横臥位にして、回復するまで暖かく保ちます。動物が自力で動き始めるまで継続的に監視し、その後は正常な行動を示すまで頻繁に監視します。
- 回復中に以前に塞がれた傷口が再び開いていることが判明した場合は、動物に再度麻酔をかけ、イソプロパノールワイプで傷口を洗浄して残っている接着剤を取り除き、ステープルで再度固定します。
5. 生着のための術後モニタリング
- 頭蓋内注射後、マウスのモニタリングを週5日(または必要に応じてそれ以上)開始します。.頭蓋内注射後の最初の数週間は、種子やどろどろした食べ物などのアフターケアを提供します。潜在的な傷口がないか動物を注意深く監視してください。
注:雌の動物が傷口を切られている場合、攻撃性を示すことはめったにないため、トイレに残ります。雄の動物には、ケージ内に2つのイグルーと、攻撃性を軽減するための追加のエンリッチメントを提供します。まれに攻撃性が生じて傷口が再び開くことになった場合、傷口をホッチキスで再度固定し、攻撃者をグループから取り除いて別々に収容します。 - 体重減少、活動レベル、姿勢、脱水症状の兆候、毛皮の状態などの一般的な健康状態のパラメーターをモニタリングシートに記録します。
- 頭を傾ける、運動失調、旋回行動などの断続的、軽度、または重度の神経学的症状をモニタリングシートに記録します。
- 次のように神経学的症状を特定します。
- 以下を断続的な症状として観察および分類します: 頭の傾き: 5 分間の検査中に 1 回から 2 回観察され、全体的な健康状態は満足のいくものです。運動失調:5分間の検査中に1〜2回観察されます。全体的に満足のいく健康状態。旋回:5分間の検査中に1〜2回観察されます。全体的に満足のいく健康状態。行動:マウスは正常な行動を示し、食べ物や水に到達したり、登ったりすることができます。
- 軽度の症状として以下を観察し、分類します:頭の傾き:5分間の検査中に定期的に表示され、全体的な健康状態は満足のいくものです。運動失調:5分間の検査中に定期的に表示され、全体的な健康状態は満足のいくものです。サークリング:5分間の検査中に定期的に表示され、全体的な健康状態は満足のいくものです。行動:マウスは毛皮がフリルになったり、肌が乾燥したりすることがありますが、それでも正常な行動を示し、餌を食べ、登ることができます。
- 以下を観察し、重篤な症状として分類します:頭の傾き:検査中に継続的に表示される、90°近く傾く、コートがフリルになる、活動性が低い。運動失調:検査中に継続的に表示され、酔った動き、コートがフリルになり、活動性が低下します。サークリング:検査中に連続して表示され、コートがフリルになり、活動性が低下します。行動:マウスの被毛は非常にフリルになっているか、乾燥肌である可能性があります。彼らは15%以上の体重減少を示すことがあります。この段階で動物に種やどろどろした食べ物を提供します。
- マウスが健康に影響を与える腫瘍の成長を示す次の臨床徴候のいずれかを示す場合、マウスの人道的なエンドポイントを確立します:初期体重から20%以上の体重減少、重度の頭の傾き、重度の運動失調、重度の旋回、無気力、または呼吸困難。この段階で、CO2 窒息を使用してマウスを人道的に安楽死させます。
6.脳の収穫
- 動物がCO2 窒息または子宮頸部脱臼のいずれかによって人道的に安楽死させられることを確認してください。
- ハサミまたはメスを使用して、頭皮に沿って2cmの正中線を切開します。慎重に皮膚を分離して剥がし、頭蓋骨を露出させます。
- 細いハサミまたはメスを使用して、頭蓋骨の正中線に沿って慎重に2cmの切開を行います。鉗子を使用して頭蓋骨をそっとこじ開け、後頭部から鼻に向かって作業します。
- 頭蓋骨の側面に沿って切断を続け、下の脳組織に損傷を与えないようにします。頭蓋骨が完全に開いたら、鉗子とはさみを使用して脳を脳神経と血管から慎重に切り離します。
- 脳を頭蓋腔から静かに持ち上げ、背中から始めて前進させます。脳は、スナップ凍結や固定など、その後の実験手順の要件に基づいて適切な条件下で保管します。脳の免疫組織化学的解析は、研究室によって異なる場合があります。増殖性細胞マーカーKI67の典型的なワークフローは、公開された文献20に記載されている。
結果
脳腫瘍モデルの開発には、脳定位固定装置を用いた同所性注射が不可欠となっています。この技術により、腫瘍細胞の正確で再現性のある配置が可能になり、神経腫瘍学の研究で一貫性のある信頼性の高いデータを生成するために重要です。同所性注射の成功は、定位固定装置フレーム、正確な動きのためのデジタルマイクロマニピュレーター、注射器、動物を固定するための麻酔システムなど、定位固定装置の正確なセットアップに大きく依存しています(図1A、B)。ガラス製マイクロシリンジを使用すると、通常2〜5μLの少量の頭蓋内注射が可能になります。適切なメンテナンスと頻繁な洗浄は、注射をブロックする可能性のある生物学的材料の蓄積を防ぐために不可欠です(図1C)。
マウスの定位固定装置を使用した脳腫瘍細胞の頭蓋内注射の手順には、いくつかの重要なステップが含まれます。まず、マウスは、手順全体を通して静止して快適に保つために麻酔をかけられます。動物が麻酔をかけられていることを示す典型的な手がかりには、つま先をつまむときの動きや反射の欠如、および規則的な呼吸パターンの存在が含まれます。次に、マウスを脳定位固定装置フレームに配置し、頭を固定位置に固定します(図2A)。ブレグマやラムダなどの頭蓋骨のランドマークを使用して、注射の正確な座標が決定されます。頭皮に小さな切開を行い、選択した座標で頭蓋骨にバリ穴を開けます(図2B)。定位固定装置アームに取り付けられたマイクロインジェクション針をバリ穴に挿入して、腫瘍細胞を目的の脳領域(皮質、小脳、または脳幹; 図2C)。針の位置を注意深く監視および調整することで、正確なターゲティングが保証されます。注射後、針をゆっくりと引き抜き、切開部を閉じます(図2D)。密封された創傷は、頭蓋内注射後2週間以内に治癒する見込みです。
頭蓋内注射後、動物は全体的な健康状態と神経学的症状の発症を注意深く監視する必要があり、これはしばしば腫瘍の進行を示します(補足表1)。通常、動物は注射後1週間目にわずかな体重減少(最大体重の最大10%)を経験することがあり、通常、注射部位が2週 目の終わりまでに完全に密閉されると安定します。一般に、動物は着実に体重が増加し、腫瘍の進行が起こるまで全身の健康状態を良好に保ちます。神経症状の発現は、脳腫瘍の種類、注射部位、動物系統などの要因によって異なります。例えば、皮質神経膠腫や上衣腫は進行性の体重減少や前脳肥大の可能性を呈することがありますが、脳幹神経膠腫や髄芽腫は、特に免疫不全の動物では運動失調や頭の傾きなどの症状を示すことがあります(図3A)。さらに、脳幹腫瘍を有する動物、特にNSGまたはNOD/SCID株において、旋回行動が観察されることがある。神経学的症状の進行は、多くの場合、段階的な体重減少と一致します。長いノズル付きのウォーターボトルを提供したり、柔らかい食べ物(どろどろした食品ペレット)や種子を提供したりするなど、適切なケア後の対策は、動物の健康をサポートするために不可欠です。実験エンドポイントに到達し、その後の動物の人道的な安楽死に到達すると、注射部位の肥大や出血領域の存在など、脳の潜在的な変化が明らかになる可能性があります(図3B)。
Kaplan-Meierグラフは、脳腫瘍動物モデルの生存結果を表現するために一般的に使用されます。これらは、頭蓋内注射または抗がん治療後の経時的な生存確率を視覚的に描写しています。これらのグラフは、前臨床研究の現場で生存データを分析および提示するための重要なツールとして機能します15,27。髄芽腫細胞培養D425の頭蓋内注射を小脳のさまざまな細胞密度で行いました。頭蓋内注射されたすべての動物は腫瘍を発症しました。その結果、細胞密度が高いほど、特にマウスあたり50,000個および100,000個の細胞が、マウスあたり10,000個の細胞よりも急速に生着することが示されました(図4)。さらに、患者由来の高悪性度神経膠腫(HGG)細胞を皮質と脳幹に頭蓋内注射し、これらの異なる部位での全生存期間と腫瘍増殖パターン、免疫組織化学的特徴を比較しました。場所に関係なく、すべての動物に頭蓋内に発生した腫瘍を注射しました。HGG細胞の培養は、ステップ1.1〜1.10で詳述したプロトコルに従って行った。頭蓋内注射のための細胞の調製は、ステップ2.1〜2.6に記載したように行ったが、頭蓋内注射手順は、ステップ4.1〜4.16で概説した方法に固執した27。皮質に注射すると、HGG細胞は頭蓋内注射後約25日間の生存期間の中央値を示しました(図5A)。動物は、ステップ5.1から5.4で概説されているようにモニターした。これらの動物は神経学的症状を示さなかったが、進行性の体重減少を示した。動物は、ステップ5.5で概説した人道的なエンドポイントに到達したときに人道的に安楽死させられました。脳は、ステップ6.1から6.5で詳述されたプロトコルに従って採取され、さらなる分析27のために送られた。免疫組織化学的分析により、血管新生の増加(図5B)および多数の増殖性Ki67細胞(図5C)の証拠を伴う、大きくて高度に核化された腫瘍塊が明らかになりました。脳幹に注射すると、HGG細胞は頭蓋内注射後約26日間の生存期間の中央値を示しました(図5D)。免疫組織化学的分析では、第4脳室/上部橋領域に大きな腫瘍塊があり、側脳室への軟髄膜浸潤が示されました(図5E)。さらなる免疫組織化学的分析により、脳幹およびその他の浸潤領域に多くの増殖性細胞が示されました(図5F)。この実験は、同じ腫瘍細胞を異なる解剖学的位置に注入しても腫瘍の増殖速度に影響を与えないことを強調していますが、成長パターンにはいくつかの違いが観察されます。

図1:脳腫瘍細胞の頭蓋内注射のための定位固定装置の代表的な画像 (A)麻酔装置は通常、BSCフードの隣に配置されるため、誘導室と定位固定装置の両方に麻酔を二重に投与する必要があります。(B)ガラス製マイクロシリンジ洗浄ステーションと定位固定装置ホルダー。シリンジは、各頭蓋内注射後に生理食塩水、エタノール、続いて水で洗い流す必要があります。.(C)BSCフード内の定位固定装置、麻酔室、ボール盤、定位固定装置、定位固定装置、固定装置、綿チップ、メス、ピンセット、ピペット、チップを示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:免疫不全マウスに対して頭蓋内注射を行っている代表的な画像(A)麻酔円錐体に配置された麻酔動物。(B)皮膚を切開した後、耳のバーで両側に皮膚を固定します。(C)注射用のドリル穴の上に配置されたガラスマイクロシリンジ。(D)皮膚は接着するとモヒカンスタイルを形成します。この図の拡大版を表示するには、ここをクリックしてください。
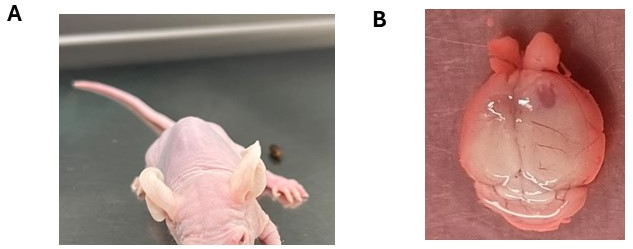
図3:脳腫瘍細胞の生着後に観察された潜在的な神経学的症状(A)脳幹にDMG細胞を頭蓋内注射した後に頭部が傾いた動物。(B)注射側が腫瘍形成を明らかにする右皮質半球の拡大。動物に上衣腫細胞を注射した。この図の拡大版を表示するには、ここをクリックしてください。
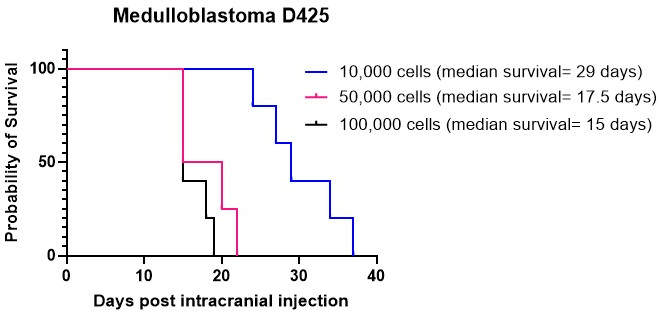
図4:異なる細胞密度での髄芽腫培養D425の生着。 髄芽腫細胞を、2 μL の ECM ハイドロゲル、50,000 細胞、および 100,000 細胞に 10,000 細胞の密度で定位固定装置を使用して頭蓋内注射しました。動物は漸進的な体重減少について監視され、記録された最高体重を20%下回ると人道的に安楽死させられました。10,000個の細胞を注入した動物の生存期間の中央値は29日でしたが、細胞密度が50,000個と100,000個の細胞を注入した動物の生存期間の中央値は、それぞれ17.5日と15日でした。この研究で注射されたすべての動物は、腫瘍を成功裏に発症しました。 この図の拡大版を表示するには、ここをクリックしてください。

図5:皮質および脳幹にHGG細胞を頭蓋内注射したNSG動物の代表的な生存曲線および組織学的解析。 約100,000個のHGG細胞(継代3)を2μLのECMハイドロゲルに脳定位固定装置を用いて注入しました。動物は漸進的な体重減少のために監視され、記録された最高体重を20%下回ると人道的に安楽死させられました。この脳腫瘍亜型では神経学的症状は観察されなかった。(A)HGG細胞を皮質に注入した動物の生存期間の中央値は、注射後約25日(N=2)です。(B)皮質のH&E染色は、血管新生の増加を伴う高度に核化された領域を示しており、これは赤血球の存在によって示される。(C)皮質の腫瘍生着領域は、KI67染色で示されるように、高レベルの増殖性細胞を示します。(D)HGG細胞を脳幹に注入した動物の生存期間の中央値は、注射後約26日(N = 2)です。この研究で注射されたすべての動物は、腫瘍を成功裏に発症しました。(E)脳幹のH&E染色は、側脳室の軟髄膜に腫瘍浸潤が観察される高度に核化された領域を示している。(F)脳幹の腫瘍生着領域は、KI67染色で示されるように、高レベルの増殖性細胞を示します。メイン画像の黒いスケールバーは2mmを示し、拡大挿入された画像は20μmを示しています 。この図の拡大版を表示するには、ここをクリックしてください。
補足表1: 動物の頭蓋内注射および抗がん剤による治療の可能性の検査に使用されるモニタリングフォーム。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
この研究で詳述されている頭蓋内注射技術は、小児脳腫瘍の同所性患者由来異種移植片(PDX)モデルを確立するための堅牢な方法を提供しますが、いくつかの領域を改善する必要があります。この技術を改善するための1つのアプローチには、腫瘍細胞の調製プロセスを最適化することが含まれます。これには、腫瘍細胞の移植に使用される材料の精製が含まれます。ECMハイドロゲルはゴールドスタンダードと考えられていますが、脳や腫瘍のECMにより類似した成分で構成されたハイドロゲルを利用すると、BT細胞の生存と生着が向上する可能性があります。このアプローチは、髄芽腫や上衣腫など、生着期間が長い腫瘍タイプに特に有益です。例えば、コラーゲンはグループ3の髄芽腫の成長に重要な役割を果たすことが示されていますが、ラミニンはSHH型の髄芽腫28をサポートします。さらに、ECMの硬さも腫瘍の成長に影響を与える可能性があります。例えば、高悪性度膠芽腫は、正常な脳組織と比較してその中心部の硬直性が高く、これが腫瘍の成長と生存を支えている可能性がある29。ECMの組成と剛性をさまざまな腫瘍タイプの特定の要件に合わせて調整することで、PDXモデルの生着と成長を大幅に改善できる可能性があります。
最近のいくつかの研究は、患者の腫瘍サンプルの取り扱いとPDXモデルの開発に関する貴重な洞察を提供しました。Tsuliらは、DMG組織を直接移植すると、通常、初代培養よりも生着率が高くなることを強調しました15。Smith らは、脳腫瘍生検または剖検サンプルの頭蓋内注射を通じて 37 の PDX モデルを確立し、全体の成功率は 43% であると報告し、HGG が最も高い生着率 (100%) を示し、次いで髄芽腫 (45%) と上衣腫 (25%) を示しました。腫瘍の潜伏期間は1か月から11か月まで大きく異なり、より攻撃的な腫瘍はより迅速に生着します11。対照的に、Brabetzらは、HGGが31%の生着率を示し、髄芽腫(37%)および上衣腫(17%)のより低い全成功率を報告しました16。これらの違いにもかかわらず、SmithらおよびBrabetzらによって実施された最後の2つの研究では、PDXモデルが一般に免疫組織化学的および分子レベルで患者の腫瘍を再現することが確認されましたが、元の腫瘍サンプルと確立されたモデルとの間にはわずかなゲノムの不一致が観察されました。これらの知見は、代表的なPDXモデルの開発における課題を強調し、腫瘍タイプ間での生着成功のばらつきを強調しています11,16。
同所性アプローチの大きな制限の1つは、腫瘍細胞がルシフェラーゼまたは磁気共鳴画像法(MRI)でタグ付けされている場合、Xenogen Imagingなどの画像システムを使用しない限り、腫瘍サイズを正確に測定できないことです。腫瘍細胞をルシフェラーゼで標識すると、生着を確認し、腫瘍の進行を非侵襲的に監視するための生物発光イメージングが可能になり、解決策が得られる可能性があります。この方法は、治療に対する反応を動的に追跡する能力を強化し、それにより治療効果のより正確な評価を提供するであろう17,30。別の方法には、MRI技術の利用が含まれます。ただし、腫瘍の検出可能性は、腫瘍のサイズに依存します。より大きな腫瘍はより容易に同定され、これはしばしば実験エンドポイントにあり、検出は腫瘍のサブタイプによっても異なる場合があり、GBMはびまん性神経膠腫よりも検出が容易である27,31。特にびまん性神経膠腫の場合、無傷の血液脳関門(BBB)の存在は、造影剤の増強の欠如につながります。しかし、GBMでは、漏出性のある血管系と浮腫の存在により、腫瘍組織と周囲の健康な脳組織との間のコントラストが増幅され、検出プロセスに役立つ可能性があります。一般に、検出を改善するためには、造影剤が必要である30、31、32。拡散強調イメージング(DWI)や流体減衰反転回復(FLAIR)などの代替イメージング技術は、非増強腫瘍領域の検出を改善するために時々使用されます。しかし、これらの方法にも限界があり、腫瘍の境界33の正確な描写を常に提供するとは限らない。Amide Proton Transfer-weighted(APTw)イメージングは、タンパク質と水のプロトン交換を追跡することによりびまん性神経膠腫を検出し、腫瘍の等級付けを支援する非侵襲的MRI技術です。有望ではあるが、人工物に対する感受性などの課題に直面しており、小動物のイメージングにはまだ適応されておらず、その広範な応用は限られている34。
また、薬効研究に同所性BT PDXモデルを利用する際に考慮すべきもう一つの重要な側面は、使用するPDXモデルのBBBの完全性です。BBBの透過性は、脳腫瘍治療における薬物送達と有効性に大きく影響します。例えば、脳幹神経膠腫におけるBBBの完全性の維持は、しばしば薬物の浸透不良をもたらし、全身療法の有効性を制限する17。一方、グループ3の髄芽腫では、MRI画像でBBBの完全性が不均一であることが観察されており、患者由来異種移植片(PDX)モデルでも同様に漏れていることがわかった35。したがって、各PDXモデルにおけるBBBステータス(無傷か漏れているか)を特徴づけることは、適切な治療戦略を設計し、薬効試験の結果を正確に解釈するために不可欠です。
全体として、概説された頭蓋内注射手順は、BT PDXモデルを確立し、治療薬の有効性研究を実施するための堅牢なアプローチを提供します。これらのモデルの包括的な理解と相まって、継続的な改良により、その有用性が増大し、小児BT患者に対する治療介入の開発が促進されます。
開示事項
著者は何も開示していません。
謝辞
著者らは、この方法論を確立するための必須サンプルを惜しみなく提供してくれたSydney Children's Hospital Network、Sydney Children's Tumour Bank Network、およびZero Childhood Cancer Programの患者、臨床医、研究者に感謝します。Children's Cancer Institute Australiaは、ニューサウスウェールズ大学シドニー校およびSydney Children's Hospital Networkと提携しています。このプロトコルは、National Health and Medical Research Council(Synergy Grant #2019056、Leadership Grant APP2017898 to DZ)およびCancer Institute New South Wales Program Grant(TPG2037 DZおよびMT)からの助成金によって支援された研究努力、およびLevi's Project、The Kids Cancer Project、The Cure Starts Now、DIPG Collaborative、 キュア脳腫瘍財団、ロバート・コナー・ドーズ財団、ベニー・ウィルズ財団。
資料
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
参考文献
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved