Method Article
Establecimiento de modelos ortotópicos de xenoinjertos derivados de pacientes para tumores cerebrales utilizando un dispositivo estereotáxico
En este artículo
Resumen
El desarrollo de modelos ortotópicos de tumores cerebrales pediátricos requiere una precisión meticulosa, utilizando un dispositivo estereotáxico para implantar células cancerosas con precisión. La metodología presentada aquí describe los pasos involucrados en la preparación de las células tumorales cerebrales, la realización de inyecciones intracraneales y la implementación de un sistema de monitoreo postoperatorio para evaluar el injerto de tumor cerebral.
Resumen
El desarrollo de modelos clínicamente relevantes y fiables para los tumores del sistema nervioso central (SNC) ha sido fundamental para el avance del campo de la neurooncología. Una de las técnicas más utilizadas es la inyección intracraneal ortotópica, un método que permite investigar el crecimiento, la invasión y la diseminación del tumor en un entorno controlado. Esta técnica consiste en trasplantar células tumorales de una región específica del paciente al sitio anatómico correspondiente en un animal. Al hacerlo, estos modelos ortotópicos de tumores cerebrales ofrecen una ventaja única, ya que replican con mayor precisión el comportamiento biológico del cáncer y sus interacciones con el entorno cerebral observados en pacientes humanos. Esto los hace especialmente valiosos para las pruebas terapéuticas preclínicas, donde una gran semejanza con el escenario clínico es esencial para evaluar posibles tratamientos. Este protocolo comparte experiencias en el desarrollo de modelos de xenoinjertos derivados del paciente (PDX) para tumores cerebrales pediátricos, como el glioma difuso de la línea media (DMG), el glioblastoma (GBM), el meduloblastoma y el ependimoma. Este método delinea el procedimiento para realizar inyecciones estereotáxicas intracraneales en ratones, asegurando la correcta orientación del sitio de inyección dentro del cerebro. Además, describimos el sistema de monitorización post-procedimiento empleado para detectar signos de éxito de injerto tumoral. Después de la inyección del tumor, se implementa un riguroso sistema de monitoreo para observar a los animales en busca de signos de deterioro neurológico, cambios de comportamiento y/o pérdida de peso, que son indicadores comunes de la progresión del tumor. Este sistema permite una intervención oportuna y proporciona datos críticos sobre la dinámica de crecimiento del tumor. Al refinar estos modelos y protocolos, nuestro objetivo es mejorar la confiabilidad y el potencial traslacional de los estudios preclínicos, contribuyendo al desarrollo de tratamientos más efectivos para los tumores pediátricos del SNC.
Introducción
Los tumores del sistema nervioso central (SNC) pediátricos son los tumores sólidos más comunes en los niños, comprendiendo alrededor del 20-25% de los tumores pediátricos primarios, con características distintas de los tumores de adultos en términos de incidencia y respuesta al tratamiento 1,2. Los gliomas de grado alto (HGG), como el glioblastoma (GBM) y el glioma pontino intrínseco difuso/glioma difuso de la línea media (DIPG/DMG), son particularmente agresivos, con pronósticos sombríos, y a pesar de los avances en las modalidades de tratamiento, las tasas de supervivencia siguen siendo bajas 3,4,5. Los meduloblastomas, que representan casi el 20% de los tumores infantiles del SNC, han logrado una alta tasa de supervivencia a 5 años con el tratamiento estándar, sin embargo, ciertos subtipos plantean desafíos, especialmente en escenarios de recaída 6,7. Los ependimomas, que constituyen alrededor del 10% de los tumores pediátricos del SNC, exhiben pronósticos variados según las características moleculares y la localización del tumor, y la recidiva plantea desafíos clínicos significativos 8,9. La comprensión del panorama molecular y el desarrollo de modelos de tumores cerebrales ortotópicos (BT) son prometedores para el desarrollo de terapias efectivas para mejorar los resultados de los pacientes pediátricos.
El desarrollo de modelos de BT clínicamente relevantes es vital para avanzar en la investigación neurooncológica y el descubrimiento terapéutico. Las inyecciones ortotópicas que utilizan un dispositivo estereotáxico son fundamentales en este enfoque, ya que permiten la colocación precisa de células tumorales dentro del cerebro, imitando de cerca el entorno natural de los tumores cerebrales10. Este método mejora la fiabilidad y la reproducibilidad de los modelos tumorales, facilitando estudios más precisos de la biología tumoral y características clave como la invasión y la angiogénesis, así como la evaluación de las intervenciones terapéuticas11. La capacidad del dispositivo estereotáxico para controlar la ubicación exacta y la profundidad de las inyecciones celulares garantiza que las células tumorales se coloquen de manera consistente en las regiones cerebrales previstas, mejorando así la validez de los resultados experimentales10. Los modelos subcutáneos proporcionan una opción más accesible y rentable para el cribado inicial de agentes terapéuticos. En estos modelos, las células tumorales se implantan debajo de la piel, lo que permite un seguimiento sencillo del crecimiento tumoral y las respuestas al tratamiento12. A pesar de carecer de la capacidad de replicar el complejo microambiente del cerebro, los modelos subcutáneos siguen siendo muy valiosos para el cribado de fármacos de alto rendimiento y las evaluaciones preliminares de la eficacia12,13.
Múltiples estudios han demostrado el desarrollo exitoso de modelos ortotópicos de xenoinjertos derivados del paciente (PDX) a partir de muestras de tumores cerebrales, incluyendo la implantación directa de tejido a partir de muestras de autopsia o biopsia y cultivos de tumores cerebrales primarios 11,14,15. Sin embargo, es crucial reconocer que la inyección intracraneal de tejido disociado tumoral o células tumorales no siempre garantiza el injerto, y las razones del fracaso no se comprenden completamente15. Curiosamente, las muestras de biopsia de HGG tienden a exhibir una tasa de éxito más alta en comparación con otros subtipos de tumores cerebrales. Por ejemplo, He et al. demostraron una tasa de éxito del 56% para los modelos ortotópicos de HGG, mientras que el estudio de Brabetz et al. reportó tasas de injerto más bajas, como 43% y 30%, respectivamente, para otras muestras de tumores cerebrales pediátricos como el ependimoma y el meduloblastoma 11,14,16. En particular, los modelos PDX de tumores cerebrales muestran una amplia gama de períodos de latencia, que varían de 1 mes a 11 meses, y los injertos posteriores muestran una utilidad preclínica disminuida. A pesar de su capacidad para recapitular la enfermedad a nivel molecular, se han observado algunas disparidades genómicas entre las biopsias y los modelos establecidos14,16.
Los modelos PDX sirven como herramientas indispensables en la búsqueda de nuevas estrategias terapéuticas contra los BT pediátricos. Se consideran el estándar de oro para realizar estudios de eficacia de medicamentos, ya que los modelos recapitulan fielmente la enfermedad humana en términos de crecimiento tumoral, síntomas y farmacocinética de medicamentos debido a la presencia de la barrera hematoencefálica (BBB). La investigación ha demostrado en el campo del glioma de tronco encefálico pediátrico que la integridad mantenida de la BHE y la falta de penetración del fármaco es una característica que conduce a una disminución de la eficacia terapéutica para estos tumores 17,18,19. Sin embargo, se puede observar eficacia en tratamientos seleccionados que demuestran una adecuada penetración de fármacos, como los inhibidores epigenéticos y metabólicos17,20.
Este estudio presenta un método para realizar inyecciones intracraneales de células tumorales cerebrales en animales inmunocomprometidos, con el objetivo de evaluar el injerto para el desarrollo de PDX y/o evaluar la eficacia de fármacos terapéuticos. También se proporcionan herramientas completas para monitorear la progresión tumoral hasta que se alcanza el criterio de valoración experimental ético.
Protocolo
El protocolo que se describe a continuación sigue las pautas éticas para el cuidado y uso de animales según lo descrito por la Universidad de Nueva Gales del Sur, y todos los procedimientos han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales. Se priorizó el bienestar de los animales y se hicieron todos los esfuerzos posibles para minimizar el sufrimiento de los animales utilizados durante el procedimiento de inyección intracraneal.
1. Cultivo para la expansión de cultivos de tumores cerebrales formadores de neurosfera
NOTA: Los requisitos específicos pueden variar en función de los cultivos cerebrales que se utilicen. En los siguientes pasos se describe un protocolo general de cultivo para células tumorales cerebrales primarias como neurosferas. Los cultivos de tumores cerebrales pueden obtenerse de proveedores comerciales o establecerse como cultivos primarios a partir de biopsias o autopsias de tumores cerebrales de pacientes. El procedimiento para establecer cultivos primarios a partir de muestras de biopsia o autopsia del paciente se describe en la literatura publicada15,21.
- Coloque el vial de culata criopreservado en un baño de agua a 37 °C hasta que se descongele el contenido. Limpie las superficies externas del vial con etanol al 70% para garantizar la esterilidad.
- Prepare los medios de Neurosphere para las células tumorales cerebrales primarias como se describe en Mayoh et al.21. En una cabina de seguridad biológica (BSC), utilice una pipeta estéril de 1 mL para transferir las células descongeladas a un tubo cónico estéril de 15 mL que contenga 5 mL de medios de neurosfera precalentados.
- Centrifugar el tubo cónico a 300 x g durante 3 min para peletizar las células. Deseche cuidadosamente la mayor cantidad posible del sobrenadante con una pipeta de 10 ml.
- Vuelva a suspender el pellet celular en 10 mL o 25 mL de medio neurosphere. Coloque la suspensión de células en un matraz T25 o T75, dependiendo del número de células esperado de la criopreservación. Normalmente, las células iniciales con una densidad de 5x 105 células se colocan en un matraz T25.
- Coloque el matraz en una incubadora a 37 °C con 5% de CO2. Intercambie los medios por medios nuevos 1 o 2 veces por semana. Alternativamente, rellene los factores de crecimiento y la vitamina B27 según sea necesario, en función de la tasa de crecimiento de las células.
- Una vez que las neuroesferas se han formado en un matraz T25, pueden expandirse en matraces T75. Transfiera el contenido del matraz T25 con una pipeta de 10 mL a un tubo cónico de 15 mL. Observe las neuroesferas bajo un microscopio óptico y, una vez que crezcan lo suficiente (aproximadamente 500 μm), también pueden ser visibles a simple vista.
- Centrifugar el tubo a 300 x g durante 3-5 min. Aspire el medio por encima del gránulo de la celda, dejando aproximadamente 1 mL en el tubo.
- Pipetear suavemente las células hacia arriba y hacia abajo 12x-15x con una pipeta de 1 mL para disociar el pellet de la célula. Utilice un filtro de células (40 μm) para disociar las neuroesferas en una mezcla de una sola célula.
- Coloque el colador en la parte superior de un tubo cónico de 50 mL y agregue esferoides disociados con una pipeta de 10 mL en el colador. La mayoría de las células individuales pasarán la malla al tubo, y los materiales del grupo permanecerán en la malla.
- Cuente las células con una cámara de recuento de células. Evalúe la viabilidad celular mezclando una cantidad igual de suspensión celular (por ejemplo, 5 μL) con azul de tripán (5 μL). Las células muertas aparecerán azules bajo el microscopio óptico, mientras que las células vivas permanecerán sin teñir.
- Calcule la densidad de celdas de la siguiente manera:
Concentración de celdas = Número promedio de celdas por cuadrícula × Factor de dilución/ Volumen de una cuadrícula (mL). El volumen de la rejilla de una cámara de recuento de células estándar es de 0,0001 mL. - Para el paso de las células, resuspenda 1 x 106 células en 25 mL de medio fresco y calentado en un matraz T75. Una vez colocadas las células en un matraz T75, incubarlas a 37 °C en una incubadora humidificada con 5% deCO2 hasta que crezcan las neurosferas.
- Para criopreservar células tumorales cerebrales, resuspenda 1 x 106 células en 1 ml de solución de criopreservación y colóquelas durante la noche en un recipiente de congelación de velocidad controlada y almacene a -80 °C. Coloque las existencias criopreservadas en un tanque de nitrógeno líquido a -180 °C para su almacenamiento a largo plazo.
NOTA: El medio de criopreservación está compuesto por un 90% de suero de ternera fetal y un 10% de dimetilsulfóxido (DMSO).
2. Preparación de células tumorales cerebrales para inyección intracraneal
NOTA: Si bien el siguiente protocolo describe la preparación de células cultivadas a partir de cultivos establecidos o a corto plazo para inyección intracraneal, también se puede adaptar para otros tipos de células, incluido el tejido recién disociado de tumores cerebrales humanos22,23.
- En una cabina de bioseguridad, transfiera cuidadosamente las células y el medio de cultivo del matraz de cultivo de tejidos con una pipeta serológica a un tubo cónico de 50 mL.
- Centrifugar el tubo cónico a 300 x g durante un máximo de 5 minutos a temperatura ambiente. Aspire con una pipeta de 25 mL el medio por encima del pellet, dejando aproximadamente 0,5 mL en el tubo.
- Pipetear suavemente las células hacia arriba y hacia abajo 10 veces con una pipeta de 1 ml para disociar el pellet de la célula. Cuente las células con azul de tripán y un hemocitómetro.
- Una vez que el recuento de células deseado se haya alícuota en un tubo nuevo, lavar 2 veces con PBS resuspendiendo las células y granulándolas a 300 x g durante 5 min a 4 °C.
NOTA: el recuento de células se puede determinar como se describe. Por ejemplo, si es necesario inyectar 10 animales con una densidad celular de 200.000 células, el número mínimo de células necesarias es 2 x 106. - Durante el lavado final, elimine la mayor cantidad posible de PBS. Coloque suavemente el pellet celular y la alícuota de hidrogel de matriz extracelular (ECM) de 50 μL sobre hielo.
NOTA: El hidrogel ECM puede prealícuota en porciones de 50 μL en hielo utilizando pipetas refrigeradas a 4 °C y almacenarse a -80 °C hasta que se necesite. El hidrogel ECM se puede mantener temporalmente en hielo para descongelarse lentamente para su posterior uso experimental. - Mezcle el pellet celular con el hidrogel ECM para la inyección, con el objetivo de completar este paso lo antes posible antes de iniciar las inyecciones intracraneales. Como procedimiento estándar, utilice 2 μL de la suspensión que contiene 200.000 células suspendidas en hidrogel ECM.
NOTA: Si las inyecciones intracraneales duran más de 2-3 h, se debe preparar una nueva reserva de células, ya que la incubación prolongada en hielo puede reducir la viabilidad de las células. Es posible inyectar intracranealmente hasta 1.000.000 de células y en volúmenes de hasta 10 μL; sin embargo, esto requerirá que las células se resuspendan en PBS en lugar de hidrogel ECM y se agreguen a una tasa de inyección muy lenta.
3. Instalación de equipos estereotáxicos y anestésicos
NOTA: El procedimiento que se indica a continuación puede variar ligeramente según el fabricante del equipo estereotáxico y el tipo de anestesia preferido.
- Comience el BSC desinfectando su superficie primero con detergente polisorbato 20 y dejándolo reposar durante 10 minutos. Posteriormente, limpie la superficie con etanol al 80%. Antes de colocarlo dentro del capó BSC, limpie cada pieza del equipo con etanol al 80% (evite mojar las entradas eléctricas).
- Coloque la placa base dentro del capó BSC de acuerdo con la Figura 1, con el cono de la nariz colocado en el lado derecho (para usuarios diestros). Asegúrese de que los manipuladores XYZ ya estén fijados a la placa base y asegurados.
- Conecte la consola de visualización digital a la entrada en la parte posterior de la placa base y conecte su cable de alimentación a la fuente de alimentación provista dentro del capó BSC (consulte la Figura 1). Esta consola registra las coordenadas de los movimientos del manipulador XYZ.
- Asegure el cartucho del filtro de carbón (para la salida de anestésico) y la entrada de anestésico a las dos válvulas de la boquilla desmontable. Deslice la pieza de la nariz en la sección de montaje y apriete el tornillo en el aparato estereotáxico.
- Fije las barras para las orejas a sus respectivos soportes a cada lado de la sección de montaje, asegurándolas en su lugar apretando los tornillos fijados a los soportes. Las barras para los oídos se pueden cubrir con gasas o cinta aislante.
- Introduzca la cama quirúrgica en el dispositivo, ajustando su altura para alinearla con las barras de las orejas, que aseguran al animal en su posición. Envuelva la cama quirúrgica con una almohadilla medidora para mantener al animal caliente.
- Conecte la almohadilla térmica a la fuente de alimentación y colóquela debajo del animal para mantener el calor durante el procedimiento anestésico.
- Dentro de la capucha BSC, coloque puntas de algodón estériles, puntas de pipeta de 20 μL, ungüento para los ojos, toallitas de isopropanol empaquetadas individualmente, pegamento quirúrgico y una pipeta de 20 μL. Humedece una gasa con etanol al 80% y coloca encima unas pinzas estériles y un bisturí.
- Limpie la microjeringa de vidrio enjuagándola 5 veces con etanol frío al 80% y, posteriormente, con solución salina fría al 0,9%.
- Para fines de perforación, conecte el motor del taladro a la fuente de alimentación y monte el taladro en el manipulador XYZ, asegurando un ajuste seguro atornillándolo firmemente.
- Reemplace el componente del taladro con el soporte de microjeringa de vidrio para fines de inyección de celdas. Retire el taladro aflojando el tornillo del manipulador XYZ y reemplazándolo con el soporte de la jeringa. Asegúrese de que el tornillo esté apretado antes de alinear la microjeringa de vidrio con el orificio perforado anteriormente.
- Después de usar el dispositivo estereotáxico, desmonte todos los componentes y desinféctelos con etanol al 80% antes de guardarlos en una caja de almacenamiento limpia o en un armario libre de polvo. Deseche todos los objetos punzocortantes de manera segura y adecuada en un recipiente designado para objetos punzocortantes.
4. Inyección intracraneal
NOTA: Las inyecciones intracraneales se pueden realizar tanto en ratones machos como en hembras, aunque generalmente se prefieren los ratones hembra, ya que son menos propensos a complicaciones de heridas causadas por la agresión entre machos. El procedimiento generalmente se lleva a cabo en ratones de 7 a 10 semanas de edad, lo que permite tiempo suficiente para el desarrollo del tumor. Por lo general, los animales se asignan al azar en grupos de 4 a 6 por jaula. Las cepas inmunodeprimidas, como BALB/c Nude, NOD-SCID y NSG, se utilizan habitualmente para el desarrollo de xenoinjertos derivados del paciente (PDX), ya que su estado inmunodeficiente favorece el injerto y el crecimiento tumoral24. Si bien este protocolo especifica el uso de isoflurano para la inducción de la anestesia, también se pueden utilizar anestésicos alternativos como la ketamina y la xilacina25. Si no se utiliza isoflurano, los pasos que involucran la cámara anestésica y el equipo relacionado pueden omitirse del procedimiento.
- Pesar y controlar el bienestar general de los animales antes del procedimiento intracraneal. Administrar un analgésico a los animales en una jaula a la vez (p. ej., buprenorfina 0,05 mg/kg, por vía intraperitoneal) durante un máximo de 1 h antes de comenzar la inyección intracraneal.
- Configure el equipo anestésico de acuerdo con las pautas proporcionadas con el instrumento. Antes de comenzar el procedimiento, asegúrese de que el vaporizador esté al menos a la mitad de su capacidad. Asegúrese de que el suministro de oxígeno esté abierto.
- Si los animales tienen pelo, se puede quitar el día antes del procedimiento intracraneal o simultáneamente. Retire el pelo del sitio quirúrgico en el dorso o el cráneo del ratón con una maquinilla eléctrica o una navaja.
- Traslado del animal a la cámara de inducción anestésica. Asegúrese de que el medidor de flujo de la máquina de anestesia esté configurado en un caudal de 1 L / min y que el regulador de oxígeno esté entre 40 y 50 psi. Asegúrese de mantener la anestesia media comprobando que los músculos estén relajados y que no haya reflejos.
- Controle la respuesta del animal a los estímulos y observe el movimiento de la pared torácica para asegurar una respiración constante. Si las inyecciones intracraneales superan los 10 minutos, controle la temperatura con una sonda rectal y un sistema de control de la temperatura y realice un seguimiento del pulso con un oxímetro de pulso
- Monte al animal en el dispositivo estereotáxico, asegurándose de que los dientes frontales estén fijos en la barra de incisión y que el cono de la nariz haya asegurado al animal en su lugar.
- Desinfecta la cabeza del ratón con una punta de algodón empapada en yodo y luego con una toallita de isopropanol. Aplique ungüento córnea para los ojos en ambos ojos para evitar que se seque durante la cirugía.
- Comience la incisión en la base del cerebelo y extiéndala a través del cráneo hasta el punto medio, haciendo un pequeño corte de aproximadamente 1 cm de largo a lo largo de la cara superior del cráneo.
- Apriete la piel entre las orejas para exponer el cráneo y asegure la cabeza apretando las barras de las orejas. Limpia la superficie del cráneo y sécala con un bastoncillo de algodón.
- Asegure el taladro en el marco estereotáxico y localice el bregma (o estructura lambdoide) con el taladro.
NOTA: Las coordenadas estereotáxicas específicas se seleccionan en función de la región anatómica requerida para el estudio del injerto. Estas coordenadas precisas pueden obtenerse de la literatura publicada o determinarse utilizando recursos como el atlas Mouse Brain in Stereotaxic Coordinates26 , lo que garantiza una orientación precisa para una implantación exitosa. - Una vez que se establezcan las coordenadas, use un taladro para crear cuidadosamente un pequeño orificio de rebaba en el hueso en el sitio designado para el glioma difuso de la línea media (DMG): X = +0.5, Y = -5.5, Z = -3.1 de bregma; Tumor encefálico supratentorial (GBM o ependimoma): X = +1,5, Y = +1, Z = -3 de bregma; Tumor encefálico infratentorial (meduloblastoma, ependimoma): X = +2, Y = - 2, Z = -2 de estructura lambdoidea.
- Vuelva a suspender las células varias veces con una pipeta evitando las burbujas de aire. Extraiga 2 μL de la mezcla de células en una microjeringa de vidrio frío prelavado. Coloque la jeringa en el marco estereotáxico y ajuste la aguja a la punta del cráneo.
- Inyecte las células dentro de los 30 segundos en la región perforada, secando cualquier suspensión celular refluida durante la inyección.
NOTA: Dado que las células están suspendidas en hidrogel ECM, la inyección debe producirse lo suficientemente rápido para que la suspensión celular no se solidifique en la jeringa. Las densidades celulares variables se pueden usar para evaluar diferentes tasas de injerto, con densidades celulares más altas que generalmente conducen a un injerto tumoral más rápido. - Deje la jeringa en su lugar durante 1 minuto para evitar el reflujo y permitir que el hidrogel ECM se asiente. Retire la jeringa y limpie la herida con una toallita de isopropanol. Use pegamento para la piel o pinzas para heridas para sellar la incisión si es necesario.
- Coloque al animal en posición reclinada en una jaula de recuperación limpia con una lámpara de calor o sobre una almohadilla térmica para mantener el calor hasta la recuperación. Monitoree al animal continuamente hasta que comience a moverse por sí solo y con frecuencia a partir de entonces hasta que muestre un comportamiento normal.
- Si se descubre que un animal tiene una herida previamente sellada reabierta durante la recuperación, anestesia al animal nuevamente, limpie la herida con una toallita de isopropanol para eliminar cualquier pegamento restante y luego vuelva a asegurarla con grapas.
5. Seguimiento postquirúrgico del injerto
- Después de la inyección intracraneal, comience a monitorear a los ratones 5 días a la semana (o más si es necesario). Proporcione cuidados posteriores, como semillas o alimentos blandos, durante las primeras semanas después de la inyección intracraneal. Vigile cuidadosamente a los animales para detectar cualquier posible apertura de heridas.
NOTA: Si a las hembras se les cortan las heridas, permanecen en la caja de arena, ya que rara vez muestran agresión. Para los animales machos, proporcionamos dos iglús en la jaula junto con un enriquecimiento adicional para ayudar a reducir la agresión. En el raro caso de que se produzca una agresión y provoque la reapertura de las heridas, las heridas se vuelven a asegurar con grapas y el agresor se retira del grupo y se aloja por separado. - Registre los parámetros generales de bienestar, como la pérdida de peso, el nivel de actividad, la postura, los signos de deshidratación y el estado del pelaje en la hoja de seguimiento.
- Registre en la hoja de control los síntomas neurológicos intermitentes, leves o graves, como inclinación de la cabeza, ataxia y/o comportamiento en círculos.
- Identifique los síntomas neurológicos de la siguiente manera:
- Observe y clasifique los siguientes síntomas intermitentes: Inclinación de la cabeza: Observado 1-2 veces durante una inspección de 5 minutos, bienestar general satisfactorio. Ataxia: Observada 1-2 veces durante una inspección de 5 minutos; bienestar general satisfactorio. Dando vueltas: Se observa 1-2 veces durante una inspección de 5 minutos; bienestar general satisfactorio. Comportamiento: Los ratones muestran un comportamiento normal, capaces de alcanzar comida/agua y trepar.
- Observe y clasifique los siguientes síntomas como leves: Inclinación de la cabeza: Se muestra regularmente durante una inspección de 5 minutos, el bienestar general es satisfactorio. Ataxia: Se muestra regularmente durante una inspección de 5 minutos, el bienestar general es satisfactorio. Circulando: Se muestra regularmente durante una inspección de 5 minutos, el bienestar general es satisfactorio. Comportamiento: Los ratones pueden tener un pelaje ondulado o piel seca, pero aún pueden exhibir un comportamiento normal, alimentarse y trepar.
- Observe y clasifique los siguientes síntomas graves: Inclinación de la cabeza: Se muestra continuamente durante la inspección, inclinación de casi 90°, pelaje con volantes, menos activo. Ataxia: Manifestación continua durante la inspección, movimientos de embriaguez, pelaje con volantes, menos activo. Circular: Se muestra continuamente durante la inspección, pelaje con volantes, menos activo. Comportamiento: Los ratones pueden tener un pelaje muy erizado o una piel seca. Pueden exhibir una pérdida de peso de más del 15%. Proporcione a los animales semillas o alimentos blandos en esta etapa.
- Establecer el criterio de valoración humanitario para los ratones cuando presenten alguno de los siguientes signos clínicos que indiquen un crecimiento tumoral que afecte a su bienestar: pérdida de peso del 20% o más con respecto a su peso inicial, inclinación grave de la cabeza, ataxia grave, círculos intensos, letargo o respiración dificultosa. En esta etapa, eutanasia humanitaria a los ratones mediante asfixia con CO2 .
6. Recolección de cerebros
- Asegúrese de que el animal sea sacrificado humanitariamente, ya sea por asfixia por CO2 o dislocación cervical.
- Haz una incisión de 2 cm en la línea media del cuero cabelludo con unas tijeras o un bisturí. Separe y retire con cuidado la piel para exponer el cráneo.
- Con unas tijeras finas o un bisturí, haga una incisión cuidadosa de 2 cm a lo largo de la línea media del cráneo. Abre suavemente el cráneo con pinzas, trabajando desde la parte posterior de la cabeza hacia la nariz.
- Continúe cortando a lo largo de los lados del cráneo, asegurándose de que no se dañe el tejido cerebral que se encuentra debajo. Una vez que el cráneo esté completamente abierto, separe cuidadosamente el cerebro de los nervios craneales y los vasos sanguíneos con pinzas y tijeras.
- Levante el cerebro suavemente de la cavidad craneal, comenzando desde la espalda y moviéndose hacia adelante. Almacene el cerebro en condiciones apropiadas en función de los requisitos de los procedimientos experimentales posteriores, como la congelación instantánea o la fijación. El análisis inmunohistoquímico del cerebro puede variar de un laboratorio a otro. En la literatura publicada se describe un flujo de trabajo típico para el marcador de células proliferativas KI6720.
Resultados
Las inyecciones ortotópicas con un dispositivo estereotáxico se han vuelto esenciales para el desarrollo de modelos de tumores cerebrales. Esta técnica permite la colocación precisa y reproducible de las células tumorales, lo que es crucial para generar datos consistentes y fiables en la investigación neurooncológica. La implementación exitosa de las inyecciones ortotópicas depende en gran medida de la configuración precisa del equipo estereotáxico, que generalmente incluye un marco estereotáxico, un micromanipulador digital para movimientos precisos, una jeringa de inyección y un sistema de anestesia para inmovilizar al animal (Figura 1A, B). El uso de una microjeringa de vidrio permite la inyección intracraneal de pequeños volúmenes, normalmente entre 2 y 5 μL. El mantenimiento adecuado y el lavado frecuente son esenciales para evitar la acumulación de material biológico, que puede bloquear la inyección (Figura 1C).
El procedimiento para la inyección intracraneal de células tumorales cerebrales utilizando equipos estereotáxicos en ratones implica varios pasos clave. En primer lugar, se anestesia al ratón para que permanezca quieto y cómodo durante todo el procedimiento. Las señales típicas que indican que el animal está anestesiado incluyen la ausencia de movimiento y reflejos al pellizcar los dedos de los pies, así como la presencia de un patrón de respiración regular. A continuación, el ratón se coloca en un marco estereotáxico, asegurando su cabeza en una posición fija (Figura 2A). Utilizando puntos de referencia en el cráneo, como bregma y lambda, se determinan las coordenadas precisas para la inyección. Se hace una pequeña incisión en el cuero cabelludo y se perfora un orificio de rebaba a través del cráneo en las coordenadas elegidas (Figura 2B). Se inserta una aguja de microinyección conectada al brazo estereotáxico a través del orificio de fresa para llevar las células tumorales a la región cerebral deseada (corteza, cerebelo o tronco encefálico; Figura 2C). El control cuidadoso y el ajuste de la posición de la aguja garantizan una orientación precisa. Después de la inyección, la aguja se retira lentamente y se cierra la incisión (Figura 2D). Se espera que la herida sellada sane dentro de las dos semanas posteriores a la inyección intracraneal.
Después de la inyección intracraneal, los animales requieren un seguimiento cuidadoso para el bienestar general y el desarrollo de síntomas neurológicos, que a menudo indican progresión tumoral (Tabla suplementaria 1). Por lo general, los animales pueden experimentar una ligera pérdida de peso durante la primera semana después de la inyección (hasta el 10% de su peso máximo), que generalmente se estabiliza una vez que los sitios de inyección están completamente sellados al final de lasegunda semana. Por lo general, los animales exhiben un aumento constante de peso y mantienen una buena salud general hasta que se produce la progresión del tumor. La manifestación de los síntomas neurológicos varía en función de factores como el tipo de tumor cerebral, el lugar de la inyección y la cepa del animal. Por ejemplo, los gliomas corticales o los ependimomas pueden presentarse con una pérdida de peso progresiva y un posible agrandamiento del prosencéfalo, mientras que los gliomas del tronco encefálico y los meduloblastomas pueden presentar síntomas como ataxia e inclinación de la cabeza, especialmente en animales inmunocomprometidos (Figura 3A). Además, se puede observar un comportamiento circular en animales con tumores del tronco encefálico, especialmente en cepas NSG o NOD/SCID. La progresión de los síntomas neurológicos suele coincidir con la pérdida gradual de peso. Las medidas adecuadas de cuidado posterior, como proporcionar botellas de agua con boquillas largas u ofrecer alimentos blandos (gránulos de comida blanda) o semillas, son esenciales para apoyar el bienestar de los animales. Al alcanzar el criterio de valoración experimental y la posterior eutanasia humanitaria de los animales, pueden hacerse evidentes posibles alteraciones en el cerebro, incluyendo el agrandamiento en el lugar de la inyección y/o la presencia de áreas hemorrágicas (Figura 3B).
Los gráficos de Kaplan-Meier se emplean comúnmente para representar los resultados de supervivencia de modelos animales de tumores cerebrales. Ofrecen una representación visual de la probabilidad de supervivencia a lo largo del tiempo después de la inyección intracraneal o los tratamientos contra el cáncer. Estos gráficos sirven como herramientas cruciales para analizar y presentar los datos de supervivencia en entornos de investigación preclínica15,27. Realizamos inyecciones intracraneales de cultivo celular de meduloblastoma D425 a diferentes densidades celulares en el cerebelo. Todos los animales inyectados intracranealmente desarrollaron tumores. Nuestros resultados indicaron que densidades celulares más altas, específicamente 50.000 y 100.000 células por ratón, injertaron más rápidamente que 10.000 células por ratón (Figura 4). Además, inyectamos intracranealmente células de glioma de alto grado (HGG) derivadas del paciente en la corteza y el tronco encefálico para comparar la supervivencia general y el patrón de crecimiento tumoral, así como las características inmunohistoquímicas, en estas diferentes localizaciones. Independientemente de la localización, a todos los animales se les inyectaron tumores desarrollados intracranealmente. El cultivo de las células HGG se llevó a cabo siguiendo el protocolo detallado en los pasos 1.1 a 1.10. La preparación de las células para la inyección intracraneal se realizó como se describe en los pasos 2.1 a 2.6, mientras que el procedimiento de inyección intracraneal se adhirió al método descrito en los pasos 4.1 a 4.1627. Cuando se inyectaron en la corteza, las células HGG mostraron una mediana de supervivencia de aproximadamente 25 días después de la inyección intracraneal (Figura 5A). Los animales fueron monitoreados como se describe en los pasos 5.1 a 5.4. Estos animales no mostraron ningún síntoma neurológico, pero sí mostraron una pérdida de peso progresiva. Los animales fueron sacrificados humanitariamente al alcanzar el criterio de valoración humanitario descrito en el paso 5.5. Los cerebros se extrajeron siguiendo el protocolo detallado en los pasos 6.1 a 6.5 y se enviaron para su posterior análisis27. El análisis inmunohistoquímico reveló una masa tumoral grande, muy nucleada, con evidencia de aumento de la vascularización (Figura 5B) y muchas células Ki67 proliferativas (Figura 5C). Cuando se inyectaron en el tronco encefálico, las células HGG mostraron una mediana de supervivencia de aproximadamente 26 días después de la inyección intracraneal (Figura 5D). El análisis inmunohistoquímico indicó una gran masa tumoral en la región del 4º ventrículo/protuberancia superior, así como infiltración leptomeníngea en el ventrículo lateral (Figura 5E). El análisis inmunohistoquímico adicional indicó muchas células proliferativas en el tronco encefálico y otras áreas infiltradas (Figura 5F). Este experimento pone de manifiesto que inyectar las mismas células tumorales en diferentes localizaciones anatómicas no afecta a la tasa de crecimiento del tumor, aunque se observan algunas diferencias en el patrón de crecimiento.

Figura 1: Imágenes representativas de la configuración estereotáxica para la inyección intracraneal de células tumorales cerebrales. (A) El aparato anestésico generalmente se coloca junto a la campana BSC, lo que requiere la administración dual de anestesia tanto en la cámara de inducción como en el aparato estereotáxico. (B) Estación de lavado de microjeringas de vidrio y soporte estereotáxico; La jeringa requiere enjuague con solución salina, etanol y, posteriormente, agua después de cada inyección intracraneal. (C) Configuración estereotáxica dentro del capó BSC, que ilustra la cámara de anestesia, la máquina perforadora, el dispositivo estereotáxico, la consola de coordenadas estereotáxicas, las puntas de algodón, el bisturí, las pinzas, la pipeta y las puntas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes representativas de la inyección intracraneal realizada en un ratón inmunodeprimido. (A) Animal anestesiado colocado en un cono anestésico. (B) Incisión en la piel seguida de la fijación de la piel a cada lado con barras para las orejas. (C) Microjeringa de vidrio colocada encima del orificio perforado para inyección. (D) La piel forma un estilo Mohawk una vez pegada. Haga clic aquí para ver una versión más grande de esta figura.
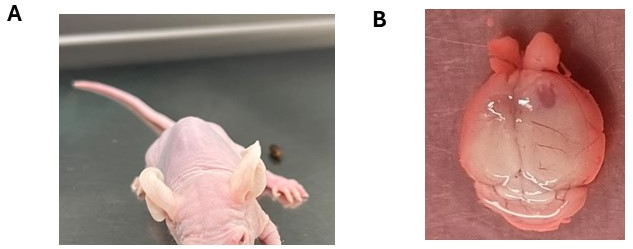
Figura 3: Posibles síntomas neurológicos observados después del injerto de células tumorales cerebrales. (A) Animal que presenta una inclinación de la cabeza después de la inyección intracraneal de células DMG en el tronco encefálico. (B) Agrandamiento del hemisferio cortical derecho con el lado de la inyección que revela la formación de tumores. Al animal se le inyectaron células de ependimoma. Haga clic aquí para ver una versión más grande de esta figura.
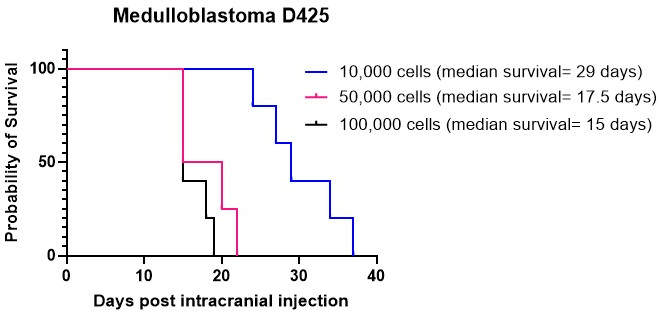
Figura 4: Injerto del cultivo de meduloblastoma D425 a diferentes densidades celulares. Las células de meduloblastoma se inyectaron intracranealmente utilizando equipo estereotáxico a densidades de 10 000 células en 2 μl de hidrogel de ECM, 50 000 células y 100 000 células. Los animales fueron monitoreados para la pérdida de peso progresiva y fueron sacrificados humanitariamente una vez que alcanzaron un 20% por debajo de su peso más alto registrado. La mediana de supervivencia de los animales inyectados con 10.000 células fue de 29 días, mientras que la mediana de supervivencia de los inyectados con densidades celulares más altas de 50.000 y 100.000 células fue de 17,5 días y 15 días, respectivamente. Todos los animales inyectados en este estudio desarrollaron tumores con éxito. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Curvas de supervivencia representativas y análisis histológico de animales NSG inyectados intracranealmente con células HGG en la corteza y el tronco encefálico. Se inyectaron aproximadamente 100.000 células HGG (pasaje 3) en 2 μL de hidrogel de MEC utilizando equipos estereotáxicos. Los animales fueron monitoreados para la pérdida progresiva de peso y sacrificados humanitariamente una vez que alcanzaron un 20% por debajo de su peso más alto registrado. No se observaron síntomas neurológicos para este subtipo de tumor cerebral. (A) La mediana de supervivencia de los animales con células HGG inyectadas en la corteza es de aproximadamente 25 días después de la inyección (N = 2). (B) La tinción de H&E de la corteza muestra una región altamente nucleada con una mayor vascularización, indicada por la presencia de glóbulos rojos. (C) El área injertada de tumor en la corteza muestra un alto nivel de células proliferativas, como lo muestra la tinción KI67. (D) La supervivencia media de los animales con células HGG inyectadas en el tronco encefálico es de aproximadamente 26 días después de la inyección (N = 2). Todos los animales inyectados en este estudio desarrollaron tumores con éxito. (E) La tinción de H&E del tronco encefálico muestra una región altamente nucleada con infiltración tumoral observada en las leptomeninges en el ventrículo lateral. (F) El área injertada de tumor en el tronco encefálico muestra un alto nivel de células proliferativas, como lo muestra la tinción KI67. La barra de escala negra en las imágenes principales indica 2 mm, mientras que las imágenes insertadas ampliadas indican 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1: Formulario de seguimiento utilizado para la inspección de las inyecciones post-intracraneales de los animales y el posible tratamiento con agentes anticancerígenos. Haga clic aquí para descargar esta tabla.
Discusión
Si bien la técnica de inyección intracraneal detallada en este estudio proporciona un método sólido para establecer modelos de xenoinjertos ortotópicos derivados del paciente (PDX) para tumores cerebrales pediátricos, varias áreas necesitan mejoras. Un enfoque para mejorar la técnica consiste en optimizar el proceso de preparación de las células tumorales. Esto incluye el refinamiento de los materiales utilizados para la implantación de las células tumorales. Si bien el hidrogel de MEC se considera el estándar de oro, el uso de hidrogeles compuestos por componentes que se asemejan más a los de la MEC cerebral o tumoral podría mejorar la supervivencia y el injerto de las células BT. Este abordaje beneficia particularmente a los tipos de tumores con períodos de injerto más largos, como los meduloblastomas y los ependimomas. Por ejemplo, se ha demostrado que el colágeno desempeña un papel fundamental en el crecimiento del meduloblastoma del grupo 3, mientras que la laminina apoya el meduloblastoma de tipo SHH28. Además, la rigidez de la MEC también puede influir en el crecimiento del tumor. Los glioblastomas de alto grado, por ejemplo, exhiben una mayor rigidez en su núcleo en comparación con el tejido cerebral normal, lo que puede apoyar el crecimiento tumoral y la supervivencia29. Al adaptar la composición y la rigidez de la MEC para que coincida con los requisitos específicos de los diferentes tipos de tumores, el injerto y el crecimiento de los modelos PDX pueden mejorar significativamente.
Algunos estudios recientes han proporcionado información valiosa sobre el manejo de muestras tumorales de pacientes y el desarrollo de modelos PDX. Tsoli et al. destacaron que la implantación directa de tejido DMG típicamente resulta en tasas de injerto más altas que los cultivos primarios15. Smith et al. establecieron 37 modelos de PDX mediante inyección intracraneal de biopsias de tumores cerebrales o muestras de autopsias, y notificaron una tasa de éxito general del 43 %, siendo los HGG los que mostraron la tasa de injerto más alta (100 %), seguidos de los meduloblastomas (45 %) y los ependimomas (25 %). La latencia tumoral varió ampliamente, de 1 a 11 meses, y los tumores más agresivos se injertaron más rápidamente11. En contraste, Brabetz et al. informaron una tasa de éxito general más baja del 30%, con HGG exhibiendo una tasa de injerto del 31% y tasas más bajas para meduloblastomas (37%) y ependimomas (17%)16. A pesar de estas diferencias, los dos últimos estudios realizados por Smith et al. y Brabetz et al. confirmaron que los modelos PDX generalmente recapitulaban los tumores de los pacientes a nivel inmunohistoquímico y molecular, aunque se observaron pequeñas discrepancias genómicas entre las muestras tumorales originales y los modelos establecidos. Estos hallazgos subrayan los desafíos en el desarrollo de modelos representativos de PDX y resaltan la variabilidad en el éxito del injerto entre los tipos de tumores11,16.
Una limitación importante del enfoque ortotópico es la incapacidad de medir con precisión el tamaño del tumor a menos que se utilice un sistema de imágenes, como Xenogen Imaging, si las células tumorales se marcan con luciferasa o imágenes por resonancia magnética (RM). El marcaje de las células tumorales con luciferasa podría proporcionar una solución al permitir la obtención de imágenes bioluminiscentes para confirmar el injerto y monitorizar la progresión del tumor de forma no invasiva. Este método mejoraría la capacidad de rastrear dinámicamente la respuesta al tratamiento, ofreciendo así una evaluación más precisa de la eficacia terapéutica17,30. Un método alternativo consiste en utilizar la tecnología de resonancia magnética; Sin embargo, la detectabilidad de los tumores depende de su tamaño. Los tumores de mayor tamaño se identifican más fácilmente, lo que a menudo se encuentra en el criterio de valoración experimental, y la detección también puede variar en función del subtipo de tumor, siendo el GBM más fácil de detectar que los gliomas difusos27,31. Particularmente en el caso de los gliomas difusos, la presencia de una barrera hematoencefálica (BBB) intacta conduce a una falta de realce del contraste. Sin embargo, en la MBG, la vasculatura permeable y la presencia de edema pueden amplificar el contraste entre el tejido tumoral y el tejido cerebral sano circundante, lo que podría ayudar en el proceso de detección. Generalmente, se necesitan agentes de contraste para mejorar la detección 30,31,32. A veces se utilizan técnicas de diagnóstico por imágenes alternativas, como las imágenes ponderadas por difusión (DWI) y la recuperación de inversión atenuada por líquido (FLAIR), para mejorar la detección de regiones tumorales que no realzan. Sin embargo, estos métodos también tienen sus limitaciones y no siempre pueden proporcionar una delimitación precisa de los límites tumorales33. Las imágenes ponderadas por transferencia de protones con amida (APTw) son una técnica de resonancia magnética no invasiva que detecta gliomas difusos mediante el seguimiento del intercambio proteína-agua-proteína, lo que ayuda en la clasificación del tumor. Si bien es prometedor, enfrenta desafíos como la susceptibilidad a los artefactos y aún no se ha adaptado para la obtención de imágenes de animales pequeños, lo que limita su aplicación más amplia34.
Otro aspecto crucial a tener en cuenta cuando se utilizan modelos ortotópicos BT PDX para estudios de eficacia de fármacos es la integridad de la BBB en los modelos PDX utilizados. La permeabilidad de la BHE afecta significativamente la administración de fármacos y la eficacia en el tratamiento de tumores cerebrales. Por ejemplo, el mantenimiento de la integridad de la BHE en los gliomas de tronco encefálico a menudo resulta en una mala penetración del fármaco, lo que limita la efectividad de las terapias sistémicas17. Por otro lado, en los meduloblastomas del grupo 3, se ha observado que la integridad de la BHE es heterogénea en las imágenes de resonancia magnética, y se encontró que es igualmente permeable en los modelos de xenoinjerto derivado del paciente (PDX)35. Por lo tanto, caracterizar el estado de la BHE, ya sea intacto o permeable, en cada modelo de PDX es esencial para diseñar estrategias terapéuticas adecuadas e interpretar con precisión los resultados de los estudios de eficacia de los fármacos.
En general, el procedimiento de inyección intracraneal descrito ofrece un enfoque sólido para establecer modelos BT PDX y realizar estudios de eficacia para agentes terapéuticos. Los refinamientos continuos, junto con una comprensión integral de estos modelos, aumentarán su utilidad y facilitarán el desarrollo de intervenciones terapéuticas para pacientes pediátricos con BT.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a los pacientes, médicos e investigadores de la Red de Hospitales Infantiles de Sydney, la Red de Bancos de Tumores Infantiles de Sydney y el Programa Cero Cáncer Infantil por proporcionar generosamente las muestras esenciales para establecer esta metodología. El Children's Cancer Institute Australia está afiliado a la Universidad de Nueva Gales del Sur en Sídney y a la Red de Hospitales Infantiles de Sídney. Este protocolo se deriva de los esfuerzos de investigación respaldados por subvenciones del Consejo Nacional de Investigación Médica y de Salud (Synergy Grant #2019056, Leadership Grant APP2017898 a DZ) y la subvención del Programa del Instituto del Cáncer de Nueva Gales del Sur (TPG2037 a DZ y MT), así como el apoyo de Levi's Project, The Kids Cancer Project, The Cure Starts Now, DIPG Collaborative, Fundación para la Cura del Cáncer Cerebral, Fundación Robert Connor Dawes y Fundación Benny Wills.
Materiales
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
Referencias
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados