Method Article
Istituzione di modelli ortotopici di xenotrapianto derivati da pazienti per tumori cerebrali utilizzando un dispositivo stereotassico
In questo articolo
Riepilogo
Lo sviluppo di modelli ortotopici di tumore cerebrale pediatrico richiede una precisione meticolosa, utilizzando un dispositivo stereotassico per impiantare con precisione le cellule tumorali. La metodologia qui presentata delinea le fasi coinvolte nella preparazione delle cellule tumorali cerebrali, nell'esecuzione di iniezioni intracraniche e nell'implementazione di un sistema di monitoraggio post-operatorio per valutare l'attecchimento del tumore cerebrale.
Abstract
Lo sviluppo di modelli clinicamente rilevanti e affidabili per i tumori del sistema nervoso centrale (SNC) è stato fondamentale per far progredire il campo della neuro-oncologia. Una delle tecniche più utilizzate è l'iniezione intracranica ortotopica, una metodica che consente di studiare la crescita, l'invasione e la disseminazione del tumore in un contesto controllato. Questa tecnica prevede il trapianto di cellule tumorali da una specifica regione del paziente nel sito anatomico corrispondente in un animale. In questo modo, questi modelli ortotopici di tumore cerebrale offrono un vantaggio unico, in quanto replicano in modo più accurato il comportamento biologico del cancro e le sue interazioni con l'ambiente cerebrale osservate nei pazienti umani. Ciò li rende particolarmente preziosi per i test terapeutici preclinici, dove una stretta somiglianza con lo scenario clinico è essenziale per valutare potenziali trattamenti. Questo protocollo condivide esperienze nello sviluppo di modelli di xenotrapianto derivati da pazienti (PDX) per tumori cerebrali pediatrici, tra cui glioma diffuso della linea mediana (DMG), glioblastoma (GBM), medulloblastoma ed ependimoma. Questo metodo delinea la procedura per condurre iniezioni stereotassiche intracraniche nei topi, garantendo il corretto targeting del sito di iniezione all'interno del cervello. Inoltre, descriviamo il sistema di monitoraggio post-procedurale impiegato per rilevare i segni di un attecchimento tumorale riuscito. Dopo l'iniezione del tumore, viene implementato un rigoroso sistema di monitoraggio per osservare gli animali alla ricerca di eventuali segni di compromissione neurologica, cambiamenti comportamentali e/o perdita di peso, che sono indicatori comuni della progressione del tumore. Questo sistema consente un intervento tempestivo e fornisce dati critici riguardanti le dinamiche di crescita del tumore. Perfezionando questi modelli e protocolli, miriamo a migliorare l'affidabilità e il potenziale traslazionale degli studi preclinici, contribuendo allo sviluppo di trattamenti più efficaci per i tumori pediatrici del SNC.
Introduzione
I tumori pediatrici del sistema nervoso centrale (SNC) sono i tumori solidi più comuni nei bambini, comprendendo circa il 20%-25% dei tumori pediatrici primari, con caratteristiche distinte dai tumori adulti in termini di incidenza e risposta al trattamento 1,2. I gliomi di alto grado (HGG), come il glioblastoma (GBM) e il glioma pontino intrinseco diffuso/glioma diffuso della linea mediana (DIPG/DMG), sono particolarmente aggressivi, con prognosi infausta e, nonostante i progressi nelle modalità di trattamento, i tassi di sopravvivenza rimangono bassi 3,4,5. I medulloblastomi, che rappresentano quasi il 20% dei tumori pediatrici del SNC, hanno raggiunto un alto tasso di sopravvivenza a 5 anni con la terapia standard, ma alcuni sottotipi pongono sfide, specialmente negli scenari di recidiva 6,7. Gli ependimomi, che costituiscono circa il 10% dei tumori pediatrici del SNC, mostrano prognosi variabili a seconda delle caratteristiche molecolari e della posizione del tumore, con la recidiva che pone sfide cliniche significative 8,9. La comprensione del panorama molecolare e lo sviluppo di modelli di tumore cerebrale ortotopico (BT) sono promettenti per lo sviluppo di terapie efficaci per migliorare i risultati per i pazienti pediatrici.
Lo sviluppo di modelli BT clinicamente rilevanti è fondamentale per far progredire la ricerca neuro-oncologica e la scoperta terapeutica. Le iniezioni ortotopiche con un dispositivo stereotassico sono fondamentali in questo approccio, in quanto consentono il posizionamento preciso delle cellule tumorali all'interno del cervello, imitando da vicino l'ambiente naturale dei tumori cerebrali10. Questo metodo migliora l'affidabilità e la riproducibilità dei modelli tumorali, facilitando studi più accurati della biologia tumorale e delle caratteristiche chiave come l'invasione e l'angiogenesi, nonché la valutazione degli interventi terapeutici11. La capacità del dispositivo stereotassico di controllare l'esatta posizione e profondità delle iniezioni cellulari garantisce che le cellule tumorali siano posizionate in modo coerente nelle regioni cerebrali previste, migliorando così la validità dei risultati sperimentali10. I modelli sottocutanei forniscono un'opzione più accessibile ed economica per lo screening iniziale degli agenti terapeutici. In questi modelli, le cellule tumorali vengono impiantate sotto la pelle, consentendo un monitoraggio diretto della crescita tumorale e delle risposte al trattamento12. Sebbene manchino della capacità di replicare il complesso microambiente del cervello, i modelli sottocutanei rimangono molto preziosi per lo screening di farmaci ad alto rendimento e le valutazioni preliminari di efficacia12,13.
Diversi studi hanno dimostrato il successo dello sviluppo di modelli ortotopici di xenotrapianto (PDX) derivati da pazienti da campioni di tumore cerebrale, tra cui l'impianto diretto di tessuto da campioni di autopsia o biopsia e colture di tumori cerebrali primari 11,14,15. Tuttavia, è fondamentale riconoscere che l'iniezione intracranica di tessuto dissociato dal tumore o di cellule tumorali non sempre garantisce l'attecchimento, con ragioni di fallimento non completamente comprese15. È interessante notare che i campioni di biopsia HGG tendono a mostrare un tasso di successo più elevato rispetto ad altri sottotipi di tumore cerebrale. Ad esempio, He et al. hanno dimostrato un tasso di successo del 56% per i modelli ortotopici HGG, mentre lo studio di Brabetz et al. ha riportato tassi di attecchimento più bassi, come il 43% e il 30%, rispettivamente, per altri campioni di tumore cerebrale pediatrico come l'ependimoma e il medulloblastoma 11,14,16. In particolare, i modelli PDX del tumore cerebrale mostrano un'ampia gamma di periodi di latenza, che variano da 1 mese a 11 mesi, con attecchimenti successivi che mostrano una ridotta utilità preclinica. Nonostante la loro capacità di ricapitolare la malattia a livello molecolare, sono state osservate alcune disparità genomiche tra le biopsie e i modelli consolidati14,16.
I modelli PDX fungono da strumenti indispensabili nella ricerca di nuove strategie terapeutiche contro i BT pediatrici. Sono considerati il gold standard per l'esecuzione di studi sull'efficacia dei farmaci in quanto i modelli ricapitolano fedelmente la malattia umana in termini di crescita tumorale, sintomi e farmacocinetica dei farmaci grazie alla presenza della barriera emato-encefalica (BEE). La ricerca ha dimostrato nel campo del glioma del tronco encefalico pediatrico che il mantenimento dell'integrità della BBB e la mancanza di penetrazione del farmaco sono una caratteristica che porta a una diminuzione dell'efficacia terapeutica per questi tumori 17,18,19. Tuttavia, l'efficacia può essere osservata in trattamenti selezionati che dimostrano un'adeguata penetrazione del farmaco, come gli inibitori epigenetici e metabolici17,20.
Questo studio presenta un metodo per l'esecuzione di iniezioni intracraniche di cellule tumorali cerebrali in animali immunocompromessi, volto a valutare l'attecchimento sia per lo sviluppo di PDX che per valutare l'efficacia terapeutica dei farmaci. Vengono inoltre forniti strumenti completi per il monitoraggio della progressione tumorale fino al raggiungimento dell'endpoint sperimentale etico.
Protocollo
Il protocollo descritto di seguito segue le linee guida etiche per la cura e l'uso degli animali come delineato dall'Università del New South Wales e tutte le procedure sono state approvate dal Comitato istituzionale per la cura e l'uso degli animali. Il benessere degli animali è stato dato priorità e sono stati fatti tutti gli sforzi per ridurre al minimo la sofferenza degli animali utilizzati durante la procedura di iniezione intracranica.
1. Coltura per l'espansione di colture di tumori cerebrali che formano neurosfere
NOTA: I requisiti specifici possono variare in base alle colture cerebrali utilizzate. I seguenti passaggi delineano un protocollo generale di coltura per le cellule tumorali cerebrali primarie come neurosfere. Le colture di tumori cerebrali possono essere ottenute da fornitori commerciali o stabilite come colture primarie da biopsie o autopsie di tumori cerebrali di pazienti. La procedura per stabilire le colture primarie da campioni di biopsia o autopsia del paziente è delineata nella letteratura pubblicata15,21.
- Mettere il flaconcino crioconservato a bagnomaria a 37 °C fino a quando il contenuto non si è scongelato. Pulire le superfici esterne del flaconcino con etanolo al 70% per garantire la sterilità.
- Preparare i terreni di neurosfera per le cellule tumorali cerebrali primarie come descritto in Mayoh et al.21. In una cabina di sicurezza biologica (BSC), utilizzare una pipetta sterile da 1 ml per trasferire le cellule scongelate in una provetta conica sterile da 15 ml contenente 5 ml di terreno neurosferico preriscaldato.
- Centrifugare la provetta conica a 300 x g per 3 minuti per pellettare le cellule. Scartare con cura la maggior parte possibile del surnatante con una pipetta da 10 ml.
- Risospendere il pellet cellulare in 10 mL o 25 mL di terreno della neurosfera. Placcare la sospensione cellulare in un pallone T25 o T75, a seconda del numero di cellule previsto dalla crioconservazione. Tipicamente, le celle iniziali con una densità di 5x 105 celle vengono poste in un pallone T25.
- Porre il matraccio in un'incubatrice a 37 °C con il 5% di CO2. Sostituire i file multimediali con nuovi supporti 1 o 2 volte alla settimana. In alternativa, rabboccare i fattori di crescita e la B27 secondo necessità, in base al tasso di crescita delle cellule.
- Una volta che le neurosfere si sono formate in un pallone T25, possono essere espanse in palloni T75. Trasferire il contenuto del matraccio T25 con una pipetta da 10 ml in una provetta conica da 15 ml. Osserva le neurosfere al microscopio ottico e, una volta che diventano sufficientemente grandi (circa 500 μm), possono anche essere visibili ad occhio nudo.
- Centrifugare la provetta a 300 x g per 3-5 minuti. Aspirare il terreno sopra il pellet cellulare, lasciando circa 1 mL nella provetta.
- Pipettare delicatamente le cellule su e giù 12x-15x con una pipetta da 1 mL per dissociare il pellet cellulare. Utilizzare un colino cellulare (40 μm) per dissociare le neurosfere in una miscela di singole cellule.
- Posizionare il filtro sulla parte superiore di una provetta conica da 50 ml e aggiungere gli sferoidi dissociati con una pipetta da 10 ml sul filtro. La maggior parte delle singole celle passerà la rete nel tubo e i materiali del grumo rimarranno sulla rete.
- Contare le cellule con una camera di conteggio delle cellule. Valutare la vitalità cellulare mescolando una quantità uguale di sospensione cellulare (ad es. 5 μL) con Trypan Blue (5 μL). Le cellule morte appariranno blu al microscopio ottico, mentre le cellule vive rimarranno non colorate.
- Calcola la densità delle celle come segue:
Concentrazione di cellule = Numero medio di cellule per griglia × Fattore di diluizione/Volume di una griglia (mL). Il volume della griglia di una camera di conteggio cellulare standard è di 0,0001 mL. - Per far passare le cellule, risospendere 1 x 106 cellule in 25 mL di terreno fresco e riscaldato in un matraccio T75. Una volta che le cellule sono state poste in un pallone T75, incubarle a 37 °C in un incubatore umidificato al 5% di CO2 fino a quando le neurosfere non crescono.
- Per crioconservare le cellule tumorali cerebrali, risospendere 1 x 106 cellule in 1 mL di soluzione di crioconservazione e metterle per una notte in un contenitore di congelamento a velocità controllata e conservare a -80 °C. Collocare le scorte crioconservate in un serbatoio di azoto liquido a -180 °C per la conservazione a lungo termine.
NOTA: Il terreno di crioconservazione comprende il 90% di siero fetale di vitello e il 10% di dimetilsolfossido (DMSO).
2. Preparazione di cellule tumorali cerebrali per l'iniezione intracranica
NOTA: Sebbene il seguente protocollo delinei la preparazione di cellule in coltura da colture consolidate o a breve termine per l'iniezione intracranica, può anche essere adattato per altri tipi di cellule, incluso il tessuto appena dissociato da tumori cerebrali umani22,23.
- In una cabina di biosicurezza, trasferire con cura le cellule e il terreno di coltura dal pallone di coltura tissutale con una pipetta sierologica in una provetta conica da 50 mL.
- Centrifugare la provetta conica a 300 x g per un massimo di 5 minuti a temperatura ambiente. Aspirare con una pipetta da 25 mL il terreno sopra il pellet, lasciando circa 0,5 mL nella provetta.
- Pipettare delicatamente le cellule su e giù 10 volte con una pipetta da 1 ml per dissociare il pellet cellulare. Contare le cellule utilizzando il blu di tripano e un emocitometro.
- Una volta aliquotata la conta cellulare desiderata in una provetta nuova, lavare 2 volte con PBS risospendendo le cellule e pellettandole a 300 x g per 5 minuti a 4 °C.
NOTA: il conteggio delle celle può essere determinato come descritto. Ad esempio, se è necessario iniettare 10 animali alla densità cellulare di 200.000 cellule, il numero minimo di cellule necessarie è 2 x 106. - Durante il lavaggio finale, rimuovere quanto più PBS possibile. Posizionare delicatamente il pellet cellulare e l'aliquota di idrogel di matrice extracellulare (ECM) da 50 μl su ghiaccio.
NOTA: L'idrogel ECM può essere pre-aliquotato in porzioni da 50 μl su ghiaccio utilizzando pipette raffreddate a 4 °C e conservato a -80 °C fino al momento del bisogno. L'idrogel ECM può essere temporaneamente tenuto sul ghiaccio per scongelarsi lentamente per un successivo uso sperimentale. - Miscelare il pellet cellulare con l'idrogel ECM per iniezione, con l'obiettivo di completare questo passaggio il più rapidamente possibile prima di iniziare le iniezioni intracraniche. Come procedura standard, utilizzare 2 μl della sospensione contenente 200.000 cellule sospese in idrogel ECM.
NOTA: Se le iniezioni intracraniche durano più di 2-3 ore, è necessario preparare un nuovo stock di cellule, poiché l'incubazione prolungata sul ghiaccio può ridurre la vitalità delle cellule. È possibile iniettare per via intracranica fino a 1.000.000 di cellule e in volumi fino a 10 μL; tuttavia, ciò richiederà che le cellule vengano risospese in PBS piuttosto che in idrogel ECM e aggiunte a una velocità di iniezione molto lenta.
3. Messa a punto di apparecchiature stereotassiche e anestesiologiche
NOTA: La procedura elencata di seguito potrebbe variare leggermente a seconda del produttore dell'apparecchiatura stereotassica e del tipo di anestesia preferito.
- Iniziare il BSC igienizzando prima la sua superficie con il detergente polisorbato 20 e lasciandolo agire per 10 minuti. Successivamente, pulire la superficie con etanolo all'80%. Prima di posizionarlo all'interno della cappa BSC, pulire ogni apparecchiatura con etanolo all'80% (evitare di bagnare gli ingressi elettrici).
- Posizionare la piastra di base all'interno del cofano BSC secondo la Figura 1, con l'ogiva posizionata sul lato destro (per utenti destrimani). Assicurarsi che i manipolatori XYZ siano già fissati alla piastra di base e fissati.
- Collegare la console del display digitale all'ingresso sul retro della piastra di base e collegare il cavo di alimentazione all'alimentatore fornito all'interno della calotta BSC (vedere la Figura 1). Questa console registra le coordinate dei movimenti del manipolatore XYZ.
- Fissare il contenitore del filtro a carbone (per l'uscita dell'anestetico) e l'ingresso dell'anestetico alle due valvole sul nasello rimovibile. Far scorrere l'ogiva sulla sezione di montaggio e serrare la vite sull'apparecchio stereotassico.
- Fissare le barre auricolari ai rispettivi supporti su ciascun lato della sezione di montaggio, fissandole in posizione serrando le viti fissate ai supporti. Le barre auricolari possono essere coperte con garze o nastro isolante.
- Introdurre il letto chirurgico nel dispositivo, regolandone l'altezza per allinearlo con le barre auricolari, che fissano l'animale in posizione. Avvolgere il letto chirurgico con un tampone di misurazione per mantenere l'animale al caldo.
- Collegare il termoforo all'alimentazione e posizionarlo sotto l'animale per mantenere il calore durante la procedura di anestesia.
- All'interno del cappuccio BSC, disporre i puntali in cotone sterile, i puntali per pipette da 20 μl, l'unguento per gli occhi, le salviette isopropanolo confezionate singolarmente, la colla chirurgica e una pipetta da 20 μl. Inumidisci una garza con etanolo all'80% e adagiaci sopra una pinza sterile e un bisturi.
- Pulire la microsiringa di vetro sciacquandola 5 volte in etanolo freddo all'80% e successivamente in una soluzione salina fredda allo 0,9%.
- Per la perforazione, collegare il motore del trapano all'alimentazione e montare il trapano sul manipolatore XYZ, assicurandosi che si adatti saldamente avvitandolo saldamente.
- Sostituire il componente del trapano con il supporto per microsiringa in vetro per l'iniezione cellulare. Rimuovere il trapano allentando la vite sul manipolatore XYZ e sostituendolo con il supporto della siringa. Assicurarsi che la vite sia serrata prima di allineare la microsiringa di vetro con il foro precedentemente praticato.
- Dopo aver utilizzato il dispositivo stereotassico, smontare tutti i componenti e sanificarli con etanolo all'80% prima di riporli in una scatola di stoccaggio pulita o in un armadio privo di polvere. Smaltire tutti gli oggetti taglienti in modo sicuro e appropriato in un contenitore per oggetti taglienti designato.
4. Iniezione intracranica
NOTA: Le iniezioni intracraniche possono essere eseguite sia nei topi maschi che nelle femmine, anche se i topi femmine sono generalmente preferiti, poiché sono meno inclini alle complicanze della ferita causate dall'aggressività tra i maschi. La procedura viene in genere eseguita in topi di età compresa tra 7 e 10 settimane, consentendo un tempo sufficiente per lo sviluppo del tumore. In genere, gli animali sono randomizzati in gruppi di 4-6 per gabbia. I ceppi immunocompromessi come BALB/c Nude, NOD-SCID e NSG sono comunemente usati per lo sviluppo di xenotrapianti derivati da pazienti (PDX), poiché il loro stato di immunodeficienza supporta l'attecchimento e la crescita del tumore24. Sebbene questo protocollo specifichi l'uso dell'isoflurano per l'induzione dell'anestesia, possono essere utilizzati anche anestetici alternativi come la ketamina e la xilazina25. Se l'isoflurano non viene utilizzato, le fasi che coinvolgono la camera anestetica e le relative apparecchiature possono essere omesse dalla procedura.
- Pesare e monitorare il benessere generale degli animali prima della procedura intracranica. Somministrare un analgesico agli animali una gabbia alla volta (ad es. buprenorfina 0,05 mg/kg, per via intraperitoneale) per un massimo di 1 ora prima di iniziare l'iniezione intracranica.
- Impostare l'apparecchiatura anestetica secondo le linee guida fornite con lo strumento. Prima di iniziare la procedura, assicurati che il vaporizzatore sia pieno almeno a metà. Assicurarsi che l'alimentazione dell'ossigeno sia aperta.
- Se gli animali hanno il pelo, può essere rimosso il giorno prima della procedura intracranica o contemporaneamente. Rimuovere il pelo dal sito chirurgico in corrispondenza del dorso o del cranio di topo con un tagliacapelli elettrico o un rasoio.
- Trasferire l'animale nella camera di induzione dell'anestetico. Assicurarsi che il flussometro della macchina per anestesia sia impostato su una portata di 1 L/min e che il regolatore di ossigeno sia compreso tra 40 e 50 psi. Assicurarsi che l'anestesia media sia mantenuta controllando che i muscoli siano rilassati e che i riflessi siano assenti.
- Monitora la risposta dell'animale agli stimoli e osserva il movimento della parete toracica per garantire una respirazione costante. Se le iniezioni intracraniche superano i 10 minuti, monitorare la temperatura con una sonda rettale e un sistema di monitoraggio della temperatura e monitorare il polso utilizzando un pulsossimetro
- Monta l'animale sul dispositivo stereotassico, assicurandoti che i denti anteriori siano fissati nella barra di incisione e che il cono del naso abbia fissato l'animale in posizione.
- Disinfettare la testa del topo con una punta di cotone imbevuta di iodio e poi una salvietta di isopropanolo. Applicare un unguento corneale su entrambi gli occhi per prevenire la secchezza durante l'intervento chirurgico.
- Inizia l'incisione alla base del cervelletto ed estendila attraverso il cranio fino al punto medio, praticando un piccolo taglio di circa 1 cm di lunghezza lungo la faccia superiore del cranio.
- Stringere la pelle tra le orecchie per esporre il teschio e fissare la testa stringendo le barre auricolari. Pulisci la superficie del cranio e asciugala con un batuffolo di cotone.
- Fissare il trapano sul telaio stereotassico e individuare la bregma (o struttura lambdoide) utilizzando il trapano.
NOTA: Le coordinate stereotassiche specifiche vengono selezionate in base alla regione anatomica richiesta per lo studio dell'attecchimento. Queste coordinate precise possono essere ricavate dalla letteratura pubblicata o determinate utilizzando risorse come l'atlante Mouse Brain in Stereotaxic Coordinates26 , garantendo un targeting accurato per un impianto di successo. - Una volta stabilite le coordinate, utilizzare un trapano per creare con cura un piccolo foro di bava nell'osso nel sito designato del glioma diffuso della linea mediana (DMG): X = +0,5, Y = -5,5, Z = -3,1 da bregma; Tumore cerebrale sopratentoriale (GBM o ependimoma): X = +1,5, Y = +1, Z = -3 da bregma; Tumore cerebrale infratentoriale (medulloblastoma, ependimoma): X = +2, Y = - 2, Z = -2 dalla struttura lambdoidea.
- Risospendere le cellule più volte con una pipetta evitando bolle d'aria. Aspirare 2 μl della miscela cellulare in una micro siringa di vetro fredda prelavata. Collegare la siringa al telaio stereotassico e regolare l'ago sulla punta del cranio.
- Iniettare le cellule entro 30 s nella regione perforata, asciugando eventuali sospensioni cellulari a riflusso durante l'iniezione.
NOTA: Poiché le cellule sono sospese nell'idrogel ECM, l'iniezione deve avvenire abbastanza velocemente in modo che la sospensione cellulare non si solidifichi nella siringa. Densità cellulari variabili possono essere utilizzate per valutare diversi tassi di attecchimento, con densità cellulari più elevate che generalmente portano a un attecchimento più rapido del tumore. - Lasciare la siringa in posizione per 1 minuto per evitare il riflusso e consentire all'idrogel ECM di depositarsi. Rimuovere la siringa e pulire la ferita con un panno a base di isopropanolo. Se necessario, utilizzare colla per la pelle o clip per ferite per sigillare l'incisione.
- Posizionare l'animale in posizione sdraiata in una gabbia di recupero pulita con una lampada termica o su un termoforo per mantenerlo al caldo fino al recupero. Monitorare continuamente l'animale fino a quando non inizia a muoversi da solo e frequentemente in seguito fino a quando non mostra un comportamento normale.
- Se si scopre che un animale ha una ferita precedentemente sigillata riaperta durante il recupero, anestetizzare nuovamente l'animale, pulire la ferita con una salvietta di isopropanolo per rimuovere la colla residua e quindi fissarla nuovamente con graffette.
5. Monitoraggio post-chirurgico per l'attecchimento
- Dopo l'iniezione intracranica, iniziare a monitorare i topi 5 giorni alla settimana (o più se necessario). Fornire cure post-vendita, come semi o cibo pastoso, durante le prime due settimane dopo l'iniezione intracranica. Monitorare attentamente gli animali per individuare eventuali aperture della ferita.
NOTA: Se le femmine hanno le ferite tagliate, rimangono nella lettiera, poiché raramente mostrano aggressività. Per gli animali maschi, forniamo due igloo nella gabbia insieme a un arricchimento extra per aiutare a ridurre l'aggressività. Nel raro caso in cui si verifichi un'aggressione che porti alla riapertura delle ferite, le ferite vengono nuovamente fissate con graffette e l'aggressore viene rimosso dal gruppo e alloggiato separatamente. - Registra i parametri generali di benessere come la perdita di peso, il livello di attività, la postura, i segni di disidratazione e le condizioni del pelo sul foglio di monitoraggio.
- Registrare sul foglio di monitoraggio sintomi neurologici intermittenti, lievi o gravi come inclinazione della testa, atassia e/o comportamento circolare.
- Identificare i sintomi neurologici come segue:
- Osservare e classificare i seguenti sintomi come intermittenti: Inclinazione della testa: osservata 1-2 volte durante un'ispezione di 5 minuti, benessere generale soddisfacente. Atassia: osservata 1-2 volte durante un'ispezione di 5 minuti; benessere generale soddisfacente. Circling: osservato 1-2 volte durante un'ispezione di 5 minuti; benessere generale soddisfacente. Comportamento: i topi mostrano un comportamento normale, in grado di raggiungere cibo/acqua e arrampicarsi.
- Osservare e classificare i seguenti sintomi lievi: Inclinazione della testa: Regolarmente visualizzato durante un'ispezione di 5 minuti, benessere generale soddisfacente. Atassia: Regolarmente visualizzata durante un'ispezione di 5 minuti, benessere generale soddisfacente. Cerchio: Regolarmente esposto durante un'ispezione di 5 minuti, benessere generale soddisfacente. Comportamento: i topi possono avere un pelo arruffato o la pelle secca, ma possono comunque mostrare un comportamento normale, nutrirsi e arrampicarsi.
- Osservare e classificare i seguenti sintomi come gravi: Inclinazione della testa: Continuamente visualizzato durante l'ispezione, inclinazione di quasi 90°, pelo arruffato, meno attivo. Atassia: continuamente visualizzata durante l'ispezione, movimenti da ubriaco, pelo arruffato, meno attivo. Cerchio: Continuamente visualizzato durante l'ispezione, cappotto arruffato, meno attivo. Comportamento: i topi potrebbero avere un pelo molto arruffato o la pelle secca. Possono mostrare una perdita di peso di oltre il 15%. Fornisci agli animali semi o cibo molliccio in questa fase.
- Stabilire l'endpoint umano per i topi quando mostrano uno dei seguenti segni clinici che indicano la crescita del tumore che influisce sul loro benessere: perdita di peso del 20% o più rispetto al loro peso iniziale, grave inclinazione della testa, grave atassia, grave circoncisione, letargia o respirazione affannosa. In questa fase, sopprimere umanamente i topi usando l'asfissia da CO2 .
6. Raccolta di cervelli
- Assicurarsi che l'animale sia sottoposto a eutanasia umana mediante asfissia da CO2 o lussazione cervicale.
- Praticare un'incisione di 2 cm sulla linea mediana lungo il cuoio capelluto utilizzando le forbici o un bisturi. Separare e staccare con cura la pelle per esporre il cranio.
- Usando forbici sottili o un bisturi, fai un'attenta incisione di 2 cm lungo la linea mediana del cranio. Aprire delicatamente il cranio con una pinza, lavorando dalla parte posteriore della testa verso il naso.
- Continua a tagliare lungo i lati del cranio, assicurandoti che non vengano danneggiati il tessuto cerebrale sottostante. Una volta che il cranio è completamente aperto, staccare con cura il cervello dai nervi cranici e dai vasi sanguigni usando pinze e forbici.
- Solleva delicatamente il cervello dalla cavità cranica, partendo dalla parte posteriore e andando avanti. Conservare il cervello in condizioni appropriate in base ai requisiti delle successive procedure sperimentali, come il congelamento rapido o la fissazione. L'analisi immunoistochimica del cervello può variare tra i diversi laboratori. Un flusso di lavoro tipico per il marcatore cellulare proliferativo KI67 è descritto nella letteratura pubblicata20.
Risultati
Le iniezioni ortotopiche con un dispositivo stereotassico sono diventate essenziali per lo sviluppo di modelli di tumore cerebrale. Questa tecnica consente il posizionamento preciso e riproducibile delle cellule tumorali, che è fondamentale per generare dati coerenti e affidabili nella ricerca neuro-oncologica. Il successo dell'implementazione delle iniezioni ortotopiche si basa in gran parte sull'accurata configurazione dell'apparecchiatura stereotassica, che in genere include un telaio stereotassico, un micromanipolatore digitale per movimenti precisi, una siringa per iniezione e un sistema di anestesia per immobilizzare l'animale (Figura 1A, B). L'uso di una microsiringa di vetro consente l'iniezione intracranica di piccoli volumi, tipicamente tra 2-5 μL. Una corretta manutenzione e lavaggi frequenti sono essenziali per prevenire l'accumulo di materiale biologico, che può bloccare l'iniezione (Figura 1C).
La procedura per l'iniezione intracranica di cellule tumorali cerebrali utilizzando apparecchiature stereotassiche nei topi prevede diversi passaggi chiave. In primo luogo, il topo viene anestetizzato per rimanere fermo e comodo durante tutta la procedura. I segnali tipici che indicano che l'animale è anestetizzato includono l'assenza di movimento e riflessi al momento del pizzicamento delle dita, nonché la presenza di un modello di respirazione regolare. Quindi, il mouse viene posizionato in una cornice stereotassica, fissando la testa in una posizione fissa (Figura 2A). Utilizzando punti di riferimento sul cranio, come bregma e lambda, vengono determinate le coordinate precise per l'iniezione. Viene praticata una piccola incisione nel cuoio capelluto e viene praticato un foro di bava attraverso il cranio alle coordinate scelte (Figura 2B). Un ago per microiniezione attaccato al braccio stereotassico viene inserito attraverso il foro della fresa per rilasciare le cellule tumorali nella regione cerebrale desiderata (corteccia, cervelletto o tronco encefalico; Figura 2C). Un attento monitoraggio e regolazione della posizione dell'ago garantiscono un puntamento accurato. Dopo l'iniezione, l'ago viene lentamente ritirato e l'incisione viene chiusa (Figura 2D). Si prevede che la ferita sigillata guarisca entro due settimane dall'iniezione intracranica.
Dopo l'iniezione intracranica, gli animali richiedono un attento monitoraggio per il benessere generale e lo sviluppo di sintomi neurologici, che spesso indicano la progressione del tumore (Tabella supplementare 1). In genere, gli animali possono sperimentare una leggera perdita di peso durante la prima settimana dopo l'iniezione (fino al 10% del loro peso massimo), che in genere si stabilizza una volta che i siti di iniezione sono completamente sigillati entro la fine dellaseconda settimana. Generalmente, gli animali mostrano un costante aumento di peso e mantengono una buona salute generale fino a quando non si verifica la progressione del tumore. La manifestazione dei sintomi neurologici varia a seconda di fattori quali il tipo di tumore cerebrale, il sito di iniezione e il ceppo animale. Ad esempio, i gliomi corticali o ependimomi possono presentare una progressiva perdita di peso e un potenziale ingrossamento del proencefalo, mentre i gliomi del tronco encefalico e i medulloblastomi possono mostrare sintomi come atassia e inclinazione della testa, in particolare negli animali immunocompromessi (Figura 3A). Inoltre, il comportamento circolare può essere osservato negli animali con tumori del tronco encefalico, specialmente nei ceppi NSG o NOD/SCID. La progressione dei sintomi neurologici spesso coincide con una graduale perdita di peso. Adeguate misure post-cura, come fornire bottiglie d'acqua con ugelli lunghi o offrire cibo morbido (pellet di cibo pastoso) o semi, sono essenziali per sostenere il benessere degli animali. Al raggiungimento dell'endpoint sperimentale e della successiva eutanasia umanitaria degli animali, possono diventare evidenti potenziali alterazioni nel cervello, tra cui l'ingrossamento del sito di iniezione e/o la presenza di aree emorragiche (Figura 3B).
I grafi di Kaplan-Meier sono comunemente impiegati per rappresentare i risultati di sopravvivenza dei modelli animali di tumore cerebrale. Offrono una rappresentazione visiva della probabilità di sopravvivenza nel tempo a seguito di iniezioni intracraniche o trattamenti antitumorali. Questi grafici fungono da strumenti cruciali per l'analisi e la presentazione dei dati di sopravvivenza in contesti di ricerca preclinica15,27. Sono state eseguite iniezioni intracraniche di coltura cellulare di medulloblastoma D425 a densità cellulari variabili nel cervelletto. Tutti gli animali iniettati per via intracranica hanno sviluppato tumori. I nostri risultati hanno indicato che densità cellulari più elevate, in particolare 50.000 e 100.000 cellule per topo, si sono innestate più rapidamente di 10.000 cellule per topo (Figura 4). Inoltre, abbiamo iniettato per via intracranica cellule di glioma di alto grado (HGG) derivate da pazienti nella corteccia e nel tronco encefalico per confrontare la sopravvivenza globale e il modello di crescita del tumore, nonché le caratteristiche immunoistochimiche, in queste diverse posizioni. Indipendentemente dalla posizione, a tutti gli animali sono stati iniettati tumori sviluppati per via intracranica. La coltura delle cellule HGG è stata effettuata seguendo il protocollo descritto nei passaggi da 1.1 a 1.10. La preparazione delle cellule per l'iniezione intracranica è stata eseguita come descritto nelle fasi da 2.1 a 2.6, mentre la procedura di iniezione intracranica ha seguito il metodo descritto nelle fasi da 4.1 a 4.1627. Quando iniettate nella corteccia, le cellule HGG hanno mostrato una sopravvivenza mediana di circa 25 giorni dopo l'iniezione intracranica (Figura 5A). Gli animali sono stati monitorati come indicato nei passaggi da 5.1 a 5.4. Questi animali non hanno mostrato alcun sintomo neurologico, ma hanno mostrato una progressiva perdita di peso. Gli animali sono stati sottoposti a eutanasia umanitaria al raggiungimento del punto finale umanitario descritto nel passaggio 5.5. I cervelli sono stati prelevati seguendo il protocollo descritto nei passaggi da 6.1 a 6.5 e inviati per ulteriori analisi27. L'analisi immunoistochimica ha rivelato una massa tumorale grande e altamente nucleata con evidenza di aumento della vascolarizzazione (Figura 5B) e molte cellule Ki67 proliferative (Figura 5C). Quando iniettate nel tronco encefalico, le cellule HGG hanno mostrato una sopravvivenza mediana di circa 26 giorni dopo l'iniezione intracranica (Figura 5D). L'analisi immunoistochimica ha indicato una grande massa tumorale nella regione del 4° ventricolo/ponte superiore, nonché un'infiltrazione leptomeningea nel ventricolo laterale (Figura 5E). Ulteriori analisi immunoistochimiche hanno indicato molte cellule proliferative nel tronco encefalico e in altre aree infiltrate (Figura 5F). Questo esperimento evidenzia che l'iniezione delle stesse cellule tumorali in diverse posizioni anatomiche non influisce sul tasso di crescita del tumore, sebbene si osservino alcune differenze nel modello di crescita.

Figura 1: Immagini rappresentative della configurazione stereotassica per l'iniezione intracranica di cellule tumorali cerebrali. (A) L'apparato anestetico è tipicamente posizionato accanto alla cappa BSC, richiedendo una doppia somministrazione di anestesia sia alla camera di induzione che all'apparato stereotassico. (B) Stazione di lavaggio per microsiringhe in vetro e supporto stereotassico; La siringa richiede il lavaggio con soluzione fisiologica, etanolo e successivamente acqua dopo ogni iniezione intracranica. (C) Configurazione stereotassica all'interno della cappa BSC, che illustra la camera anestetica, la perforatrice, il dispositivo stereotassico, la console delle coordinate stereotassiche, le punte di cotone, il bisturi, le pinzette, la pipetta e le punte. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini rappresentative dell'iniezione intracranica eseguita su un topo immunocompromesso. (A) Animale anestetizzato posizionato in un cono anestetico. (B) Incisione cutanea seguita dal fissaggio della pelle su ciascun lato con barre auricolari. (C) Microsiringa di vetro posizionata sopra il foro praticato per l'iniezione. (D) La pelle forma uno stile Mohawk una volta incollata. Clicca qui per visualizzare una versione più grande di questa figura.
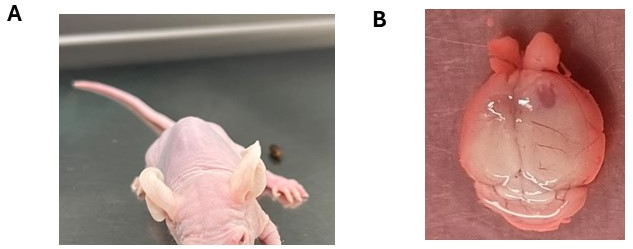
Figura 3: Potenziali sintomi neurologici osservati in seguito all'attecchimento di cellule tumorali cerebrali. (A) Animale che mostra un'inclinazione della testa in seguito all'iniezione intracranica di cellule DMG nel tronco encefalico. (B) Allargamento dell'emisfero corticale destro con il lato di iniezione che rivela la formazione del tumore. All'animale sono state iniettate cellule di ependimoma. Clicca qui per visualizzare una versione più grande di questa figura.
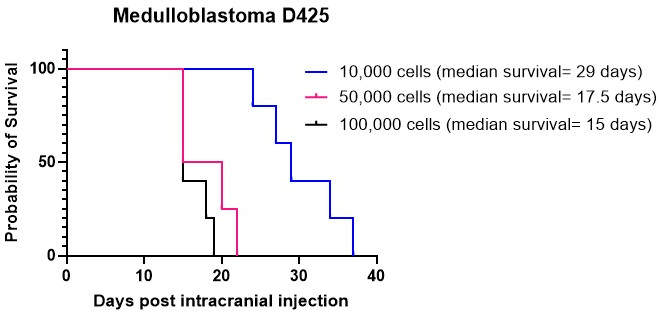
Figura 4: Attecchimento della coltura di medulloblastoma D425 a diverse densità cellulari. Le cellule di medulloblastoma sono state iniettate per via intracranica utilizzando apparecchiature stereotassiche a densità di 10.000 cellule in 2 μL di idrogel ECM, 50.000 cellule e 100.000 cellule. Gli animali sono stati monitorati per la progressiva perdita di peso e sono stati sottoposti a eutanasia umana una volta raggiunto il 20% al di sotto del loro peso più alto registrato. La sopravvivenza mediana per gli animali iniettati con 10.000 cellule è stata di 29 giorni, mentre la sopravvivenza mediana per quelli iniettati con densità cellulari più elevate, pari a 50.000 e 100.000 cellule, è stata rispettivamente di 17,5 giorni e 15 giorni. Tutti gli animali iniettati in questo studio hanno sviluppato con successo tumori. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Curve di sopravvivenza rappresentative e analisi istologica di animali NSG iniettati per via intracranica con cellule HGG nella corteccia e nel tronco encefalico. Circa 100.000 cellule HGG (passaggio 3) sono state iniettate in 2 μL di idrogel ECM utilizzando apparecchiature stereotassiche. Gli animali sono stati monitorati per la progressiva perdita di peso e sottoposti a eutanasia umana una volta raggiunto il 20% al di sotto del loro peso più alto registrato. Non sono stati osservati sintomi neurologici per questo sottotipo di tumore cerebrale. (A) La sopravvivenza mediana degli animali con cellule HGG iniettate nella corteccia è di circa 25 giorni dopo l'iniezione (N=2). (B) La colorazione H&E della corteccia mostra una regione altamente nucleata con aumento della vascolarizzazione, indicata dalla presenza di globuli rossi. (C) L'area innestata dal tumore nella corteccia mostra un alto livello di cellule proliferative, come dimostrato dalla colorazione KI67. (D) La sopravvivenza mediana degli animali con cellule HGG iniettate nel tronco encefalico è di circa 26 giorni dopo l'iniezione (N=2). Tutti gli animali iniettati in questo studio hanno sviluppato con successo tumori. (E) La colorazione H&E del tronco encefalico mostra una regione altamente nucleata con infiltrazione tumorale osservata nelle leptomeningi nel ventricolo laterale. (F) L'area trapiantata dal tumore nel tronco encefalico mostra un alto livello di cellule proliferative, come dimostrato dalla colorazione KI67. La barra della scala nera nelle immagini principali indica 2 mm, mentre le immagini ingrandite inserite indicano 20 μm. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella supplementare 1: Modulo di monitoraggio utilizzato per l'ispezione delle iniezioni post-intracraniche degli animali e dell'eventuale trattamento con agenti antitumorali. Clicca qui per scaricare questa tabella.
Discussione
Sebbene la tecnica di iniezione intracranica descritta in questo studio fornisca un metodo robusto per stabilire modelli di xenotrapianto ortotopico derivato da pazienti (PDX) per i tumori cerebrali pediatrici, diverse aree necessitano di miglioramenti. Un approccio per migliorare la tecnica prevede l'ottimizzazione del processo di preparazione delle cellule tumorali. Ciò include il perfezionamento dei materiali utilizzati per l'impianto delle cellule tumorali. Mentre l'idrogel ECM è considerato il gold standard, l'utilizzo di idrogel composti da componenti che assomigliano più da vicino a quelli del cervello o dell'ECM tumorale potrebbe migliorare la sopravvivenza e l'attecchimento delle cellule BT. Questo approccio avvantaggia in particolare i tipi di tumore con periodi di attecchimento più lunghi, come i medulloblastomi e gli ependimomi. Ad esempio, è stato dimostrato che il collagene svolge un ruolo fondamentale nella crescita del medulloblastoma del gruppo 3, mentre la laminina supporta il tipo SHH di medulloblastoma28. Inoltre, la rigidità della MEC può anche influenzare la crescita del tumore. I glioblastomi di alto grado, ad esempio, mostrano una maggiore rigidità nel loro nucleo rispetto al normale tessuto cerebrale, che può supportare la crescita e la sopravvivenza del tumore29. Adattando la composizione e la rigidità della ECM per soddisfare le esigenze specifiche dei diversi tipi di tumore, l'attecchimento e la crescita dei modelli PDX possono essere migliorati in modo significativo.
Alcuni studi recenti hanno fornito preziose informazioni sulla gestione dei campioni tumorali dei pazienti e sullo sviluppo di modelli PDX. Tsoli et al. hanno evidenziato che l'impianto diretto di tessuto DMG si traduce tipicamente in tassi di attecchimento più elevati rispetto alle colture primarie15. Smith et al. hanno stabilito 37 modelli PDX attraverso l'iniezione intracranica di biopsie di tumori cerebrali o campioni di autopsia, riportando un tasso di successo complessivo del 43%, con gli HGG che hanno dimostrato il più alto tasso di attecchimento (100%), seguiti da medulloblastomi (45%) ed ependimomi (25%). La latenza del tumore variava ampiamente, da 1 a 11 mesi, con tumori più aggressivi che si attecchivano più rapidamente11. Al contrario, Brabetz et al. hanno riportato un tasso di successo complessivo inferiore del 30%, con gli HGG che mostrano un tasso di attecchimento del 31% e tassi più bassi per i medulloblastomi (37%) e gli ependimomi (17%)16. Nonostante queste differenze, gli ultimi due studi condotti da Smith et al. e Brabetz et al. hanno confermato che i modelli PDX generalmente ricapitolavano i tumori dei pazienti a livello immunoistochimico e molecolare, sebbene siano state osservate discrepanze genomiche minori tra i campioni tumorali originali e i modelli stabiliti. Questi risultati sottolineano le sfide nello sviluppo di modelli PDX rappresentativi ed evidenziano la variabilità nel successo dell'attecchimento tra i tipi di tumore11,16.
Una limitazione significativa dell'approccio ortotopico è l'incapacità di misurare con precisione le dimensioni del tumore a meno che non venga utilizzato un sistema di imaging, come l'imaging xenogeno, se le cellule tumorali sono marcate con luciferasi o risonanza magnetica (MRI). L'etichettatura delle cellule tumorali con luciferasi potrebbe fornire una soluzione consentendo l'imaging bioluminescente per confermare l'attecchimento e monitorare la progressione del tumore in modo non invasivo. Questo metodo migliorerebbe la capacità di tracciare dinamicamente la risposta al trattamento, offrendo così una valutazione più precisa dell'efficacia terapeutica17,30. Un metodo alternativo prevede l'utilizzo della tecnologia MRI; Tuttavia, la rilevabilità dei tumori dipende dalle loro dimensioni. I tumori più grandi sono più facilmente identificabili, che è spesso all'endpoint sperimentale, e il rilevamento può anche variare a seconda del sottotipo del tumore, con il GBM che è più facilmente rilevabile rispetto ai gliomi diffusi27,31. In particolare per i gliomi diffusi, la presenza di una barriera emato-encefalica (BBB) intatta porta a una mancanza di miglioramento del contrasto. Nel GBM, tuttavia, la vascolarizzazione permeabile e la presenza di edema possono amplificare il contrasto tra il tessuto tumorale e il tessuto cerebrale sano circostante, aiutando potenzialmente nel processo di rilevamento. In generale, gli agenti di contrasto sono necessari per migliorare il rilevamento 30,31,32. Tecniche di imaging alternative come l'imaging pesato in diffusione (DWI) e il recupero dell'inversione attenuata dal fluido (FLAIR) sono talvolta utilizzate per migliorare il rilevamento delle regioni tumorali non potenzianti. Tuttavia, questi metodi hanno anche i loro limiti e potrebbero non fornire sempre una delineazione precisa dei confini tumorali33. L'imaging pesato in trasferimento protonico ammidico (APTw) è una tecnica di risonanza magnetica non invasiva che rileva i gliomi diffusi monitorando lo scambio protonico proteina-acqua, aiutando nella classificazione del tumore. Sebbene promettente, deve affrontare sfide come la suscettibilità agli artefatti e non è ancora stato adattato per l'imaging di piccoli animali, limitandone l'applicazione più ampia34.
Un altro aspetto cruciale da considerare quando si utilizzano modelli ortotopici BT PDX per studi di efficacia farmacologica è l'integrità della BBB nei modelli PDX utilizzati. La permeabilità della BBB influisce in modo significativo sulla somministrazione del farmaco e sull'efficacia nel trattamento del tumore cerebrale. Ad esempio, il mantenimento dell'integrità della BBB nei gliomi del tronco cerebrale spesso si traduce in una scarsa penetrazione del farmaco, limitando l'efficacia delle terapie sistemiche17. D'altra parte, nei medulloblastomi del gruppo 3, è stato osservato che l'integrità della BBB è eterogenea all'imaging MRI ed è stata similmente trovata che perdeva nei modelli di xenotrapianto derivati da pazienti (PDX)35. Pertanto, caratterizzare lo stato della BBB - indipendentemente dal fatto che sia intatta o permeabile - in ciascun modello PDX è essenziale per progettare strategie terapeutiche appropriate e interpretare accuratamente i risultati degli studi di efficacia dei farmaci.
Nel complesso, la procedura di iniezione intracranica delineata offre un approccio robusto per stabilire modelli BT PDX e condurre studi di efficacia per gli agenti terapeutici. I continui perfezionamenti, insieme a una comprensione completa di questi modelli, aumenteranno la loro utilità e faciliteranno lo sviluppo di interventi terapeutici per i pazienti pediatrici con BT.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano i pazienti, i medici e i ricercatori del Sydney Children's Hospital Network, del Sydney Children's Tumour Bank Network e dello Zero Childhood Cancer Program per aver generosamente fornito i campioni essenziali per stabilire questa metodologia. Il Children's Cancer Institute Australia è affiliato con l'Università del New South Wales di Sydney e con la Sydney Children's Hospital Network. Questo protocollo deriva dagli sforzi di ricerca sostenuti da sovvenzioni del National Health and Medical Research Council (Synergy Grant #2019056, Leadership Grant APP2017898 to DZ) e Cancer Institute New South Wales Program Grant (TPG2037 to DZ e MT), nonché dal supporto di Levi's Project, The Kids Cancer Project, The Cure Starts Now, DIPG Collaborative, Cure Brain Cancer Foundation, The Robert Connor Dawes Foundation e The Benny Wills Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
Riferimenti
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon