Method Article
Etablierung von orthotopen patientenabgeleiteten Xenotransplantatmodellen für Hirntumoren mit Hilfe eines stereotaktischen Geräts
In diesem Artikel
Zusammenfassung
Die Entwicklung von orthotopen pädiatrischen Hirntumormodellen erfordert akribische Präzision, bei der Krebszellen mit einem stereotaktischen Gerät präzise implantiert werden. Die hier vorgestellte Methodik beschreibt die Schritte bei der Vorbereitung von Hirntumorzellen, der Durchführung intrakranieller Injektionen und der Implementierung eines postoperativen Überwachungssystems zur Beurteilung der Hirntumortransplantation.
Zusammenfassung
Die Entwicklung klinisch relevanter und zuverlässiger Modelle für Tumoren des zentralen Nervensystems (ZNS) war entscheidend für die Weiterentwicklung des Gebiets der Neuroonkologie. Eine der am weitesten verbreiteten Techniken ist die orthotope intrakranielle Injektion, eine Methode, die es ermöglicht, das Wachstum, die Invasion und die Ausbreitung von Tumoren in einem kontrollierten Rahmen zu untersuchen. Bei dieser Technik werden Tumorzellen aus einer bestimmten Patientenregion in die entsprechende anatomische Stelle eines Tieres transplantiert. Auf diese Weise bieten diese orthotopen Hirntumormodelle einen einzigartigen Vorteil, da sie das biologische Verhalten von Krebs und seine Wechselwirkungen mit der Gehirnumgebung, die bei menschlichen Patienten beobachtet werden, genauer nachbilden. Dies macht sie besonders wertvoll für präklinische therapeutische Tests, bei denen eine große Ähnlichkeit mit dem klinischen Szenario für die Bewertung potenzieller Behandlungen unerlässlich ist. Dieses Protokoll teilt Erfahrungen bei der Entwicklung von patientenabgeleiteten Xenotransplantatmodellen (PDX) für pädiatrische Hirntumoren, einschließlich diffuser Mittelliniengliome (DMG), Glioblastome (GBM), Medulloblastome und Ependymome. Diese Methode beschreibt das Verfahren zur Durchführung intrakranieller stereotaktischer Injektionen bei Mäusen, um die korrekte Ausrichtung der Injektionsstelle im Gehirn zu gewährleisten. Darüber hinaus beschreiben wir das postprozedurale Monitoring-System, das zur Erkennung von Anzeichen einer erfolgreichen Tumortransplantation eingesetzt wird. Nach der Tumorinjektion wird ein strenges Überwachungssystem implementiert, um die Tiere auf Anzeichen von neurologischen Beeinträchtigungen, Verhaltensänderungen und/oder Gewichtsverlust zu überwachen, die häufige Indikatoren für das Fortschreiten des Tumors sind. Dieses System ermöglicht ein rechtzeitiges Eingreifen und liefert wichtige Daten über die Wachstumsdynamik des Tumors. Durch die Verfeinerung dieser Modelle und Protokolle wollen wir die Zuverlässigkeit und das translationale Potenzial präklinischer Studien verbessern und so zur Entwicklung wirksamerer Behandlungen für pädiatrische ZNS-Tumoren beitragen.
Einleitung
Tumoren des pädiatrischen Zentralnervensystems (ZNS) sind die häufigsten soliden Tumoren bei Kindern und machen etwa 20 % bis 25 % der primären pädiatrischen Tumoren aus, mit unterschiedlichen Merkmalen von adulten Tumoren in Bezug auf Inzidenz und Ansprechen auf die Behandlung 1,2. Hochgradige Gliome (HGGs) wie das Glioblastom (GBM) und das diffuse intrinsische Ponsgliom/diffuse Mittelliniengliom (DIPG/DMG) sind besonders aggressiv, mit düsteren Prognosen, und trotz Fortschritten in den Behandlungsmodalitäten bleiben die Überlebensraten niedrig 3,4,5. Medulloblastome, die fast 20 % der pädiatrischen ZNS-Tumoren ausmachen, haben mit der Standardtherapie eine hohe 5-Jahres-Überlebensrate erreicht, dennoch stellen bestimmte Subtypen Herausforderungen dar, insbesondere in Rezidivszenarien 6,7. Ependymome, die etwa 10% der pädiatrischen ZNS-Tumoren ausmachen, weisen je nach molekularen Merkmalen und Tumorlokalisation unterschiedliche Prognosen auf, wobei das Rezidiv eine erhebliche klinische Herausforderung darstellt 8,9. Das Verständnis der molekularen Landschaft und die Entwicklung orthotoper Hirntumormodelle (BT) sind vielversprechend für die Entwicklung wirksamer Therapien zur Verbesserung der Ergebnisse für pädiatrische Patienten.
Die Entwicklung klinisch relevanter BT-Modelle ist für die Weiterentwicklung der neuroonkologischen Forschung und therapeutischen Entdeckung von entscheidender Bedeutung. Orthotope Injektionen mit einem stereotaktischen Gerät sind für diesen Ansatz von entscheidender Bedeutung, da sie die präzise Platzierung von Tumorzellen im Gehirn ermöglichen und die natürliche Umgebung von Hirntumoren genau nachahmen10. Diese Methode verbessert die Zuverlässigkeit und Reproduzierbarkeit von Tumormodellen und ermöglicht genauere Untersuchungen der Tumorbiologie und wichtiger Merkmale wie Invasion und Angiogenese sowie die Bewertung therapeutischer Interventionen11. Die Fähigkeit des stereotaktischen Geräts, den genauen Ort und die Tiefe der Zellinjektionen zu kontrollieren, stellt sicher, dass die Tumorzellen konsistent in den vorgesehenen Gehirnregionen platziert werden, wodurch die Validität der experimentellen Ergebnisse verbessertwird 10. Subkutane Modelle bieten eine zugänglichere und kostengünstigere Option für das erste Screening von Therapeutika. In diesen Modellen werden Tumorzellen unter die Haut implantiert, was eine einfache Überwachung des Tumorwachstums und des Ansprechens auf die Behandlung ermöglicht12. Obwohl sie nicht in der Lage sind, die komplexe Mikroumgebung des Gehirns zu replizieren, sind subkutane Modelle nach wie vor sehr wertvoll für das Hochdurchsatz-Wirkstoffscreening und vorläufige Wirksamkeitsbewertungen12,13.
Mehrere Studien haben die erfolgreiche Entwicklung von orthotopen patientenabgeleiteten Xenotransplantatmodellen (PDXs) aus Hirntumorproben gezeigt, einschließlich der direkten Gewebeimplantation aus Autopsie- oder Biopsieproben und primären Hirntumorkulturen 11,14,15. Es ist jedoch wichtig zu erkennen, dass die intrakranielle Injektion von tumordissoziiertem Gewebe oder Tumorzellen nicht immer eine Transplantation garantiert, wobei die Gründe für das Scheitern nicht vollständig geklärt sind15. Interessanterweise weisen HGG-Biopsieproben im Vergleich zu anderen Hirntumor-Subtypen tendenziell eine höhere Erfolgsrate auf. Zum Beispiel zeigten He et al. eine Erfolgsrate von 56 % für orthotope HGG-Modelle, während die Studie von Brabetz et al. niedrigere Transplantationsraten von 43 % bzw. 30 % für andere pädiatrische Hirntumorproben wie Ependymom und Medulloblastom berichtete 11,14,16. Bemerkenswert ist, dass PDX-Modelle von Hirntumoren eine breite Palette von Latenzzeiten aufweisen, die von 1 Monat bis 11 Monaten reichen, wobei spätere Transplantationen einen verminderten präklinischen Nutzen zeigen. Trotz ihrer Fähigkeit, Krankheiten auf molekularer Ebene zu rekapitulieren, wurden einige genomische Unterschiede zwischen Biopsien und etablierten Modellen beobachtet 14,16.
PDX-Modelle dienen als unverzichtbare Werkzeuge bei der Suche nach neuen therapeutischen Strategien gegen pädiatrische BTs. Sie gelten als Goldstandard für die Durchführung von Studien zur Wirksamkeit von Arzneimitteln, da die Modelle die menschliche Krankheit in Bezug auf Tumorwachstum, Symptome und Arzneimittelpharmakokinetik aufgrund des Vorhandenseins der Blut-Hirn-Schranke (BHS) originalgetreu rekapitulieren. Die Forschung auf dem Gebiet des pädiatrischen Hirnstammglioms hat gezeigt, dass die Aufrechterhaltung der BHS-Integrität und die mangelnde Arzneimittelpenetration ein Merkmal ist, das zu einer verminderten therapeutischen Wirksamkeit bei diesen Tumoren führt 17,18,19. Eine Wirksamkeit kann jedoch bei ausgewählten Behandlungen beobachtet werden, die eine ausreichende Wirkstoffpenetration aufweisen, wie z. B. epigenetische und metabolische Inhibitoren17,20.
Diese Studie stellt eine Methode zur Durchführung intrakranieller Injektionen von Hirntumorzellen bei immungeschwächten Tieren vor, die darauf abzielt, die Transplantation entweder für die PDX-Entwicklung und/oder die Wirksamkeit des therapeutischen Medikaments zu bewerten. Darüber hinaus werden umfassende Instrumente zur Überwachung der Tumorprogression bis zum Erreichen des ethischen experimentellen Endpunkts zur Verfügung gestellt.
Protokoll
Das unten beschriebene Protokoll folgt den ethischen Richtlinien für die Pflege und Verwendung von Tieren, wie sie von der University of New South Wales dargelegt wurden, und alle Verfahren wurden vom Institutional Animal Care and Use Committee genehmigt. Der Tierschutz wurde priorisiert und es wurden alle Anstrengungen unternommen, um das Leiden der Tiere, die während der intrakraniellen Injektion verwendet wurden, so gering wie möglich zu halten.
1. Kultivierung zur Expansion von Neurosphären-bildenden Hirntumorkulturen
HINWEIS: Spezifische Anforderungen können je nach verwendeter Gehirnkultur variieren. Die folgenden Schritte skizzieren ein allgemeines Kultivierungsprotokoll für primäre Hirntumorzellen als Neurosphären. Hirntumorkulturen können von kommerziellen Anbietern bezogen oder als Primärkulturen aus Hirntumorbiopsien oder Autopsien von Patienten etabliert werden. Das Verfahren zur Etablierung von Primärkulturen aus Patientenbiopsie- oder Autopsieproben ist in der veröffentlichten Literatur beschrieben15,21.
- Stellen Sie das kryokonservierte Vorratsfläschchen in ein 37 °C heißes Wasserbad, bis der Inhalt aufgetaut ist. Wischen Sie die Außenflächen des Fläschchens mit 70 % Ethanol ab, um die Sterilität zu gewährleisten.
- Bereiten Sie Neurosphere-Medien für primäre Hirntumorzellen vor, wie in Mayoh et al.21 beschrieben. In einer biologischen Sicherheitswerkbank (BSC) verwenden Sie eine sterile 1-ml-Pipette, um die aufgetauten Zellen in ein steriles konisches 15-ml-Röhrchen mit 5 ml vorgewärmtem Neurosphärenmedium zu überführen.
- Zentrifugieren Sie das konische Röhrchen bei 300 x g für 3 min, um die Zellen zu pelletieren. Entsorgen Sie vorsichtig so viel Überstand wie möglich mit einer 10-ml-Pipette.
- Resuspendieren Sie das Zellpellet in 10 mL oder 25 mL Neurosphärenmedium. Plattieren Sie die Zellsuspension in einen T25- oder T75-Kolben, abhängig von der erwarteten Zellzahl aus der Kryokonservierung. Typischerweise werden Ausgangszellen mit einer Dichte von 5x 105 Zellen in einen T25-Kolben gegeben.
- Der Kolben wird in einen auf 37 °C und 5 % CO2 -Gehalt eingestellten Inkubator gestellt. Tauschen Sie die Medien 1x oder 2x pro Woche gegen frische Medien aus. Alternativ können Sie Wachstumsfaktoren und B27 nach Bedarf auffüllen, basierend auf der Wachstumsrate der Zellen.
- Sobald sich Neurosphären in einem T25-Kolben gebildet haben, können sie in T75-Kolben erweitert werden. Den Inhalt des T25-Kolbens mit einer 10-ml-Pipette auf ein konisches 15-ml-Röhrchen übertragen. Betrachten Sie Neurosphären unter einem Lichtmikroskop, und sobald sie groß genug sind (ca. 500 μm), können sie auch mit bloßem Auge sichtbar sein.
- Zentrifugieren Sie das Röhrchen bei 300 x g für 3-5 min. Saugen Sie das Medium über dem Zellpellet an und lassen Sie ca. 1 ml im Röhrchen.
- Pipettieren Sie die Zellen vorsichtig 12x-15x mit einer 1-ml-Pipette auf und ab, um das Zellpellet zu dissoziieren. Verwenden Sie ein Zellsieb (40 μm), um die Neurosphären in eine Einzelzellmischung zu dissoziieren.
- Legen Sie das Sieb auf ein konisches 50-ml-Röhrchen und geben Sie dissoziierte Sphäroide mit einer 10-ml-Pipette auf das Sieb. Die meisten Einzelzellen leiten das Netz in das Rohr und Klumpenmaterialien bleiben auf dem Netz.
- Zählen Sie Zellen mit einer Zellzählkammer. Beurteilen Sie die Lebensfähigkeit der Zellen, indem Sie eine gleiche Menge Zellsuspension (z. B. 5 μl) mit Trypanblau (5 μl) mischen. Tote Zellen erscheinen unter dem Lichtmikroskop blau, während lebende Zellen ungefärbt bleiben.
- Berechnen Sie die Zelldichte wie folgt:
Zellkonzentration = Durchschnittliche Anzahl von Zellen pro Gitter × Verdünnungsfaktor/ Volumen eines Gitters (ml). Das Gittervolumen einer Standard-Zellzählkammer beträgt 0,0001 ml. - Zur Passage der Zellen werden 1 x 106 Zellen in 25 ml frischem, erwärmtem Medium in einem T75-Kolben resuspendiert. Sobald die Zellen in einen T75-Kolben gegeben wurden, werden sie bei 37 °C in einem mit 5 % CO2 befeuchteten Inkubator inkubiert, bis die Neurosphären wachsen.
- Um Hirntumorzellen zu kryokonservieren, resuspendieren Sie 1 x 106 Zellen in 1 ml Kryokonservierungslösung und legen Sie sie über Nacht in einen Gefrierbehälter mit kontrollierter Geschwindigkeit und lagern Sie sie bei -80 °C. Legen Sie kryokonservierte Bestände zur Langzeitlagerung in einen -180 °C Tank mit flüssigem Stickstoff.
HINWEIS: Das Kryokonservierungsmedium besteht zu 90 % aus fötalem Kälberserum und zu 10 % aus Dimethylsulfoxid (DMSO).
2. Vorbereitung von Hirntumorzellen für die intrakranielle Injektion
HINWEIS: Während das folgende Protokoll die Vorbereitung von kultivierten Zellen aus etablierten oder kurzfristigen Kulturen für die intrakranielle Injektion beschreibt, kann es auch für andere Zelltypen angepasst werden, einschließlich frisch dissoziiertes Gewebe aus menschlichen Hirntumoren22,23.
- In einer Biosicherheitswerkbank werden die Zellen und das Kulturmedium vorsichtig mit einer serologischen Pipette aus dem Gewebekulturkolben in ein konisches 50-ml-Röhrchen überführt.
- Zentrifugieren Sie das konische Röhrchen bei 300 x g für bis zu 5 min bei Raumtemperatur. Aspirieren Sie mit einer 25-ml-Pipette das Medium über dem Pellet, wobei ca. 0,5 mL im Röhrchen verbleiben.
- Pipettieren Sie die Zellen vorsichtig 10x mit einer 1-ml-Pipette auf und ab, um das Zellpellet zu dissoziieren. Zählen Sie Zellen mit Trypanblau und einem Hämozytometer.
- Sobald die gewünschte Zellzahl in ein frisches Röhrchen aliquotiert ist, waschen Sie 2x mit PBS, indem Sie die Zellen resuspendieren und sie bei 300 x g für 5 min bei 4 °C pelletieren.
HINWEIS: Die Zellzahl kann wie beschrieben bestimmt werden. Wenn beispielsweise 10 Tiere mit einer Zelldichte von 200.000 Zellen injiziert werden müssen, beträgt die Mindestanzahl der benötigten Zellen 2 x 106. - Entfernen Sie bei der letzten Wäsche so viel PBS wie möglich. Legen Sie das Zellpellet und das 50 μL Hydrogel aliquot aus der extrazellulären Matrix (ECM) vorsichtig auf Eis.
HINWEIS: Das ECM-Hydrogel kann mit 4 °C gekühlten Pipetten auf Eis in 50-μl-Portionen voraliquotiert und bis zur Verwendung bei -80 °C gelagert werden. Das ECM-Hydrogel kann vorübergehend auf Eis aufbewahrt werden, um es für den späteren experimentellen Einsatz langsam aufzutauen. - Mischen Sie das Zellpellet mit dem ECM-Hydrogel für die Injektion, wobei Sie darauf abzielen, diesen Schritt so schnell wie möglich abzuschließen, bevor Sie mit der intrakraniellen Injektion beginnen. Als Standardverfahren verwenden Sie 2 μl der Suspension mit 200.000 Zellen, die in EZM-Hydrogel suspendiert sind.
HINWEIS: Wenn intrakranielle Injektionen länger als 2-3 Stunden dauern, sollte ein neuer Zellvorrat vorbereitet werden, da eine längere Inkubation auf Eis die Lebensfähigkeit der Zellen verringern kann. Es ist möglich, intrakraniell bis zu 1.000.000 Zellen und in Volumina von bis zu 10 μl zu injizieren; Dies erfordert jedoch, dass die Zellen in PBS und nicht in ECM-Hydrogel resuspendiert und mit einer sehr langsamen Injektionsrate hinzugefügt werden.
3. Einrichtung von stereotaktischen und anästhetischen Geräten
HINWEIS: Das unten aufgeführte Verfahren kann je nach Hersteller des stereotaktischen Geräts und der bevorzugten Art der Anästhesie leicht variieren.
- Starten Sie die BSC, indem Sie die Oberfläche zuerst mit dem Reinigungsmittel Polysorbat 20 desinfizieren und 10 Minuten einwirken lassen. Wischen Sie anschließend die Oberfläche mit 80% Ethanol ab. Wischen Sie jedes Gerät vor dem Einsetzen in die BSC-Haube mit 80 % Ethanol ab (vermeiden Sie eine Benetzung der elektrischen Eingänge).
- Positionieren Sie die Grundplatte innerhalb der BSC-Haube gemäß Abbildung 1, wobei der Nasenkonus auf der rechten Seite positioniert ist (für Rechtshänder). Stellen Sie sicher, dass die XYZ-Manipulatoren bereits auf der Grundplatte befestigt und gesichert sind.
- Schließen Sie die digitale Anzeigekonsole an den Eingang an der Rückseite der Grundplatte an und stecken Sie das Netzkabel in das mitgelieferte Netzteil in der BSC-Haube (siehe Abbildung 1). Diese Konsole registriert die Koordinaten der Bewegungen des XYZ-Manipulators.
- Befestigen Sie den Aktivkohlefilterbehälter (für die Anästhesieausgabe) und den Anästhesieeingang an den beiden Ventilen am abnehmbaren Objektivrevolver. Schieben Sie das Nasenkonusstück auf das Befestigungsteil und ziehen Sie die Schraube an der stereotaktischen Vorrichtung fest.
- Befestigen Sie die Ohrbügel an den entsprechenden Halterungen auf jeder Seite des Montageabschnitts und befestigen Sie sie, indem Sie die an den Halterungen befestigten Schrauben festziehen. Ohrbügel können mit Mullbinden oder Isolierband abgedeckt werden.
- Führen Sie die Operationsliege in das Gerät ein und stellen Sie ihre Höhe so ein, dass sie mit den Ohrstangen ausgerichtet ist, die das Tier in Position halten. Wickeln Sie das Operationsbett mit einem Messkissen ein, um das Tier warm zu halten.
- Schließen Sie das Heizkissen an die Stromversorgung an und positionieren Sie es unter dem Tier, um die Wärme während der Narkose zu erhalten.
- Ordnen Sie in der BSC-Haube sterile Wattespitzen, 20-μl-Pipettenspitzen, Augensalbe, einzeln verpackte Isopropanol-Tücher, chirurgischen Kleber und eine 20-μl-Pipette an. Befeuchten Sie ein Mullkissen mit 80% Ethanol und legen Sie eine sterile Pinzette und ein Skalpell darauf.
- Reinigen Sie die Glasmikrospritze, indem Sie sie 5x in kaltem 80%igem Ethanol und anschließend in kalter 0,9%iger Kochsalzlösung spülen.
- Schließen Sie zum Bohren den Bohrmotor an die Stromversorgung an und montieren Sie den Bohrer auf den XYZ-Manipulator, wobei Sie ihn fest verschrauben.
- Ersetzen Sie die Bohrerkomponente durch den Mikrospritzenhalter aus Glas für die Zellinjektion. Entfernen Sie den Bohrer, indem Sie die Schraube am XYZ-Manipulator lösen und durch den Spritzenhalter ersetzen. Stellen Sie sicher, dass die Schraube festgezogen ist, bevor Sie die Glasmikrospritze mit dem zuvor gebohrten Loch ausrichten.
- Zerlegen Sie nach der Verwendung des stereotaktischen Geräts alle Komponenten und desinfizieren Sie sie mit 80 % Ethanol, bevor Sie sie in einer sauberen Aufbewahrungsbox oder einem staubfreien Schrank aufbewahren. Entsorgen Sie alle scharfen Gegenstände sicher und ordnungsgemäß in einem dafür vorgesehenen Behälter für scharfe Gegenstände.
4. Intrakranielle Injektion
HINWEIS: Intrakranielle Injektionen können sowohl bei männlichen als auch bei weiblichen Mäusen durchgeführt werden, obwohl weibliche Mäuse im Allgemeinen bevorzugt werden, da sie weniger anfällig für Wundkomplikationen sind, die durch Aggressionen bei Männern verursacht werden. Das Verfahren wird in der Regel an Mäusen im Alter von 7-10 Wochen durchgeführt, so dass genügend Zeit für die Tumorentwicklung bleibt. In der Regel werden die Tiere in Gruppen von 4-6 pro Käfig randomisiert. Immungeschwächte Stämme wie BALB/c Nude, NOD-SCID und NSG werden häufig für die Entwicklung von patientenabgeleiteten Xenotransplantaten (PDX) verwendet, da ihr immundefizienter Status die Tumortransplantation und das Tumorwachstum unterstützt24. Während dieses Protokoll die Verwendung von Isofluran für die Anästhesieeinleitung spezifiziert, können auch alternative Anästhetika wie Ketamin und Xylazin verwendet werden25. Wenn Isofluran nicht verwendet wird, können Schritte, die die Anästhesiekammer und die zugehörige Ausrüstung betreffen, aus dem Verfahren ausgeschlossen werden.
- Wiegen und überwachen Sie das allgemeine Wohlbefinden der Tiere vor dem intrakraniellen Eingriff. Verabreichen Sie den Tieren jeweils ein Analgetikum in einem Käfig (z. B. Buprenorphin 0,05 mg/kg, intraperitoneal) für bis zu 1 Stunde vor Beginn der intrakraniellen Injektion.
- Richten Sie die Anästhesieausrüstung gemäß den mit dem Instrument bereitgestellten Richtlinien ein. Bevor Du mit dem Vorgang beginnst, Stelle sicher, dass der Vaporizer mindestens zur Hälfte gefüllt ist. Stellen Sie sicher, dass die Sauerstoffzufuhr offen ist.
- Wenn Tiere Fell haben, kann es am Tag vor dem intrakraniellen Eingriff oder gleichzeitig entfernt werden. Entfernen Sie das Fell von der Operationsstelle am Rücken oder Mausschädel mit einer elektrischen Haarschneidemaschine oder einem Rasierer.
- Bringen Sie das Tier in die Anästhesie-Induktionskammer. Stellen Sie sicher, dass der Durchflussmesser am Anästhesiegerät auf eine Durchflussrate von 1 l/min eingestellt ist und der Sauerstoffregler zwischen 40 und 50 psi liegt. Stellen Sie sicher, dass die mittlere Anästhesie aufrechterhalten wird, indem Sie überprüfen, ob die Muskeln entspannt sind und keine Reflexe vorhanden sind.
- Überwachen Sie die Reaktion des Tieres auf Reize und beobachten Sie die Bewegung der Brustwand, um eine gleichmäßige Atmung zu gewährleisten. Wenn die intrakraniellen Injektionen 10 Minuten überschreiten, überwachen Sie die Temperatur mit einer Rektalsonde und einem Temperaturüberwachungssystem und verfolgen Sie den Puls mit einem Pulsoximeter
- Montieren Sie das Tier auf das stereotaktische Gerät und stellen Sie sicher, dass die Frontzähne in der Inzisionsstange fixiert sind und der Nasenkonus das Tier an Ort und Stelle fixiert hat.
- Desinfizieren Sie den Kopf der Maus mit einem jodgetränkten Wattestäbchen und anschließend mit einem Isopropanol-Tuch. Tragen Sie Hornhaut-Augensalbe auf beide Augen auf, um ein Austrocknen während der Operation zu verhindern.
- Beginnen Sie den Schnitt an der Basis des Kleinhirns und verlängern Sie ihn über den Schädel bis zur Mitte, wobei Sie einen kleinen Schnitt von etwa 1 cm Länge entlang der oberen Seite des Schädels machen.
- Straffen Sie die Haut zwischen den Ohren, um den Schädel freizulegen, und sichern Sie den Kopf, indem Sie die Ohrstangen festziehen. Reinige die Schädeloberfläche und trockne sie mit einem Wattestäbchen ab.
- Befestigen Sie den Bohrer auf dem stereotaktischen Rahmen und lokalisieren Sie das Bregma (oder die Lambdoid-Struktur) mit dem Bohrer.
HINWEIS: Spezifische stereotaktische Koordinaten werden basierend auf der anatomischen Region ausgewählt, die für die Transplantationsstudie erforderlich ist. Diese präzisen Koordinaten können aus veröffentlichter Literatur stammen oder mit Ressourcen wie dem Atlas des Mausgehirns im Stereotaktischen Koordinaten26 bestimmt werden, um eine genaue Zielbestimmung für eine erfolgreiche Implantation zu gewährleisten. - Sobald die Koordinaten festgelegt sind, verwenden Sie einen Bohrer, um vorsichtig ein kleines Bohrloch in den Knochen an der vorgesehenen Stelle des diffusen Mittellinienglioms (DMG) zu bohren: X = +0,5, Y = -5,5, Z = -3,1 von Bregma; Supratentorieller Hirntumor (GBM oder Ependymom): X = +1,5, Y = +1, Z = -3 durch Bregma; Infratentorieller Hirntumor (Medulloblastom, Ependymom): X = +2, Y = - 2, Z = -2 aus der Lambdoide-Struktur.
- Resuspendieren Sie die Zellen mehrmals mit einer Pipette und vermeiden Sie dabei Luftblasen. Ziehen Sie 2 μl der Zellmischung in eine vorgewaschene Mikrospritze aus kaltem Glas. Befestigen Sie die Spritze am stereotaktischen Rahmen und passen Sie die Nadel an die Schädelspitze an.
- Injizieren Sie die Zellen innerhalb von 30 s in den gebohrten Bereich und trocknen Sie während der Injektion die zurückgefluxte Zellsuspension.
HINWEIS: Da die Zellen in EZM-Hydrogel suspendiert sind, muss die Injektion schnell genug erfolgen, damit sich die Zellsuspension in der Spritze nicht verfestigt. Unterschiedliche Zelldichten können verwendet werden, um unterschiedliche Transplantationsraten zu beurteilen, wobei höhere Zelldichten im Allgemeinen zu einer schnelleren Tumortransplantation führen. - Lassen Sie die Spritze 1 Minute lang an Ort und Stelle, um einen Rückfluss zu vermeiden und das ECM-Hydrogel absetzen zu lassen. Entfernen Sie die Spritze und wischen Sie die Wunde mit einem Isopropanol-Tuch ab. Verwenden Sie bei Bedarf Hautkleber oder Wundklammern, um den Schnitt zu versiegeln.
- Setzen Sie das Tier in eine liegende Position in einen sauberen Auffangkäfig mit einer Wärmelampe oder auf ein Heizkissen, um es bis zur Genesung warm zu halten. Überwachen Sie das Tier kontinuierlich, bis es sich von selbst zu bewegen beginnt, und danach häufig, bis es normales Verhalten zeigt.
- Wenn bei einem Tier festgestellt wird, dass eine zuvor versiegelte Wunde während der Genesung wieder geöffnet wurde, betäuben Sie das Tier erneut, reinigen Sie die Wunde mit einem Isopropanol-Tuch, um den restlichen Klebstoff zu entfernen, und befestigen Sie sie dann wieder mit Klammern.
5. Postoperative Überwachung auf Transplantation
- Beginnen Sie nach der intrakraniellen Injektion mit der Überwachung von Mäusen an 5 Tagen pro Woche (oder mehr, falls erforderlich). Sorgen Sie in den ersten Wochen nach der intrakraniellen Injektion für Nachsorge, wie z. B. Samen oder matschiges Essen. Überwachen Sie die Tiere sorgfältig auf mögliche Wundöffnungen.
HINWEIS: Wenn weiblichen Tieren die Wunden geschnitten werden, bleiben sie in der Katzentoilette, da sie selten Aggressionen zeigen. Für männliche Tiere stellen wir zwei Iglus im Käfig zur Verfügung, zusammen mit einer zusätzlichen Anreicherung, um Aggressionen zu reduzieren. In dem seltenen Fall, dass es zu Aggressionen kommt, die dazu führen, dass sich die Wunden wieder öffnen, werden die Wunden mit Klammern wieder gesichert, und der Angreifer wird aus der Gruppe entfernt und separat untergebracht. - Notieren Sie allgemeine Wohlbefindensparameter wie Gewichtsverlust, Aktivitätsniveau, Körperhaltung, Anzeichen von Dehydrierung und Fellzustand auf dem Überwachungsbogen.
- Notieren Sie auf dem Überwachungsbogen intermittierende, leichte oder schwere neurologische Symptome wie Kopfkippen, Ataxie und/oder Kreisverhalten.
- Identifizieren Sie neurologische Symptome wie folgt:
- Beobachten und kategorisieren Sie die folgenden Symptome als intermittierende Symptome: Kopfneigung: 1-2 Mal während einer 5-minütigen Inspektion beobachtet, allgemeines Wohlbefinden zufriedenstellend. Ataxie: 1-2 Mal während einer 5-minütigen Inspektion beobachtet; allgemeines Wohlbefinden zufriedenstellend. Kreisen: 1-2 Mal während einer 5-minütigen Inspektion beobachtet; allgemeines Wohlbefinden zufriedenstellend. Verhalten: Mäuse zeigen normales Verhalten, sind in der Lage, Nahrung/Wasser zu erreichen und zu klettern.
- Beobachten und kategorisieren Sie die folgenden Symptome als milde Symptome: Kopfneige: Regelmäßig während einer 5-minütigen Inspektion angezeigt, allgemeines Wohlbefinden zufriedenstellend. Ataxie: Wird regelmäßig während einer 5-minütigen Inspektion gezeigt, allgemeines Wohlbefinden zufriedenstellend. Kreisen: Regelmäßig während einer 5-minütigen Inspektion zur Schau gestellt, allgemeines Wohlbefinden zufriedenstellend. Verhalten: Mäuse können ein zerzaustes Fell oder trockene Haut haben, aber dennoch normales Verhalten zeigen, fressen und klettern.
- Beobachten und kategorisieren Sie Folgendes: Kopfneigung: Wird während der Inspektion kontinuierlich angezeigt, fast 90° Neigung, zerzaustes Fell, weniger aktiv. Ataxie: Zeigt sich kontinuierlich während der Inspektion, betrunkene Bewegungen, zerzaustes Fell, weniger aktiv. Kreisen: Während der Inspektion kontinuierlich angezeigt, gekräuseltes Fell, weniger aktiv. Verhalten: Mäuse können ein sehr zerzaustes Fell oder trockene Haut haben. Sie können einen Gewichtsverlust von über 15% aufweisen. Versorgen Sie die Tiere in dieser Phase mit Samen oder matschigem Futter.
- Legen Sie den humanen Endpunkt für die Mäuse fest, wenn sie eines der folgenden klinischen Symptome aufweisen, die auf ein Tumorwachstum hinweisen, das ihr Wohlbefinden beeinträchtigt: Gewichtsverlust von 20 % oder mehr gegenüber ihrem Ausgangsgewicht, starkes Kippen des Kopfes, schwere Ataxie, starkes Kreisen, Lethargie oder Atembeschwerden. In diesem Stadium euthanasieren Sie die Mäuse auf humane Weise durch CO2 -Erstickung.
6. Entnahme von Gehirnen
- Stellen Sie sicher, dass das Tier entweder durch CO 2-Erstickung oder Gebärmutterhalsluxation auf humane Weise eingeschläfert wird.
- Machen Sie mit einer Schere oder einem Skalpell einen 2 cm langen Schnitt entlang der Kopfhaut. Trennen Sie die Haut vorsichtig und schälen Sie sie, um den Schädel freizulegen.
- Machen Sie mit einer feinen Schere oder einem Skalpell einen vorsichtigen Schnitt von 2 cm entlang der Mittellinie des Schädels. Hebeln Sie den Schädel vorsichtig mit einer Pinzette auf, indem Sie sich vom Hinterkopf zur Nase vorarbeiten.
- Schneiden Sie weiter an den Seiten des Schädels entlang und stellen Sie sicher, dass das darunter liegende Hirngewebe nicht beschädigt wird. Sobald der Schädel vollständig geöffnet ist, lösen Sie das Gehirn vorsichtig mit einer Zange und einer Schere von den Hirnnerven und Blutgefäßen.
- Heben Sie das Gehirn sanft aus der Schädelhöhle an, beginnend von hinten nach vorne. Lagern Sie das Gehirn unter geeigneten Bedingungen, die auf den Anforderungen nachfolgender experimenteller Verfahren basieren, wie z. B. Schockfrosten oder Fixierung. Die immunhistochemische Analyse des Gehirns kann von Labor zu Labor variieren. Ein typischer Arbeitsablauf für den proliferativen Zellmarker KI67 ist in der veröffentlichten Literaturbeschrieben 20.
Ergebnisse
Orthotope Injektionen mit einem stereotaktischen Gerät sind für die Entwicklung von Hirntumormodellen unerlässlich geworden. Diese Technik ermöglicht die präzise und reproduzierbare Platzierung von Tumorzellen, was für die Generierung konsistenter und zuverlässiger Daten in der neuroonkologischen Forschung von entscheidender Bedeutung ist. Die erfolgreiche Durchführung orthotoper Injektionen hängt stark von der genauen Einrichtung der stereotaktischen Ausrüstung ab, die in der Regel einen stereotaktischen Rahmen, einen digitalen Mikromanipulator für präzise Bewegungen, eine Injektionsspritze und ein Anästhesiesystem zur Immobilisierung des Tieres umfasst (Abbildung 1A,B). Die Verwendung einer Glasmikrospritze ermöglicht die intrakranielle Injektion kleiner Volumina, typischerweise zwischen 2 und 5 μl. Die richtige Wartung und häufiges Waschen sind unerlässlich, um die Ansammlung von biologischem Material zu verhindern, das die Injektion blockieren kann (Abbildung 1C).
Das Verfahren zur intrakraniellen Injektion von Hirntumorzellen mit stereotaktischen Geräten bei Mäusen umfasst mehrere wichtige Schritte. Zunächst wird die Maus betäubt, um während des gesamten Eingriffs ruhig und komfortabel zu bleiben. Typische Hinweise, die darauf hindeuten, dass das Tier betäubt ist, sind das Fehlen von Bewegungen und Reflexen beim Einklemmen der Zehen sowie das Vorhandensein eines regelmäßigen Atemmusters. Dann wird die Maus in einen stereotaktischen Rahmen gesetzt, wobei ihr Kopf in einer festen Position fixiert wird (Abbildung 2A). Anhand von Landmarken auf dem Schädel, wie Bregma und Lambda, werden genaue Koordinaten für die Injektion bestimmt. Es wird ein kleiner Schnitt in die Kopfhaut gemacht und an den gewählten Koordinaten ein Bohrloch durch den Schädel gebohrt (Abbildung 2B). Eine Mikroinjektionsnadel, die am stereotaktischen Arm befestigt ist, wird durch das Bohrloch eingeführt, um die Tumorzellen in die gewünschte Hirnregion (Rinde, Kleinhirn oder Hirnstamm; Abbildung 2C). Eine sorgfältige Überwachung und Einstellung der Nadelposition sorgt für eine genaue Zielgenauigkeit. Nach der Injektion wird die Nadel langsam zurückgezogen und der Schnitt verschlossen (Abbildung 2D). Es wird erwartet, dass die versiegelte Wunde innerhalb von zwei Wochen nach der intrakraniellen Injektion heilt.
Nach der intrakraniellen Injektion müssen die Tiere sorgfältig auf das allgemeine Wohlbefinden und die Entwicklung neurologischer Symptome überwacht werden, die häufig auf eine Tumorprogression hinweisen (Ergänzende Tabelle 1). In der Regel kann es bei den Tieren in der 1. Woche nach der Injektion zu einem leichten Gewichtsverlust kommen (bis zu 10 % ihres höchsten Gewichts), der sich in der Regel stabilisiert, sobald die Injektionsstellen am Ende der 2. Woche vollständig verschlossen sind. Im Allgemeinen weisen die Tiere eine stetige Gewichtszunahme auf und behalten eine gute allgemeine Gesundheit bei, bis es zum Fortschreiten des Tumors kommt. Die Manifestation neurologischer Symptome variiert in Abhängigkeit von Faktoren wie der Art des Hirntumors, der Injektionsstelle und dem Tierstamm. Zum Beispiel können kortikale Gliome oder Ependymome mit fortschreitendem Gewichtsverlust und einer möglichen Vergrößerung des Vorderhirns einhergehen, während Hirnstammgliome und Medulloblastome Symptome wie Ataxie und Kopfneigung aufweisen können, insbesondere bei immungeschwächten Tieren (Abbildung 3A). Darüber hinaus kann kreisendes Verhalten bei Tieren mit Hirnstammtumoren beobachtet werden, insbesondere bei NSG- oder NOD/SCID-Stämmen. Das Fortschreiten der neurologischen Symptome geht oft mit einem allmählichen Gewichtsverlust einher. Die richtige Nachsorge, wie das Bereitstellen von Wasserflaschen mit langen Düsen oder das Anbieten von weichem Futter (matschige Futterpellets) oder Samen, sind essentiell, um das Wohlbefinden der Tiere zu unterstützen. Nach Erreichen des experimentellen Endpunkts und der anschließenden humanen Euthanasie der Tiere können mögliche Veränderungen im Gehirn sichtbar werden, einschließlich einer Vergrößerung an der Injektionsstelle und/oder des Vorhandenseins hämorrhagischer Bereiche (Abbildung 3B).
Kaplan-Meier-Diagramme werden häufig verwendet, um die Überlebensergebnisse von Hirntumor-Tiermodellen darzustellen. Sie bieten eine visuelle Darstellung der Überlebenswahrscheinlichkeit im Laufe der Zeit nach intrakranieller Injektion oder Krebsbehandlungen. Diese Diagramme dienen als wichtige Werkzeuge für die Analyse und Darstellung von Überlebensdaten in präklinischen Forschungsumgebungen15,27. Wir führten intrakranielle Injektionen von Medulloblastom-Zellkultur D425 bei unterschiedlichen Zelldichten im Kleinhirn durch. Alle Tiere, die intrakraniell injiziert wurden, entwickelten Tumore. Unsere Ergebnisse zeigten, dass höhere Zelldichten, insbesondere 50.000 und 100.000 Zellen pro Maus, schneller transplantierten als 10.000 Zellen pro Maus (Abbildung 4). Darüber hinaus injizierten wir intrakraniell patienteneigene hochgradige Gliomzellen (HGG) in die Hirnrinde und den Hirnstamm, um das Gesamtüberleben und das Muster des Tumorwachstums sowie immunhistochemische Merkmale an diesen verschiedenen Stellen zu vergleichen. Unabhängig von der Lokalisation wurden allen Tieren intrakraniell entwickelte Tumore injiziert. Die Kultivierung der HGG-Zellen erfolgte nach dem in den Schritten 1.1 bis 1.10 beschriebenen Protokoll. Die Vorbereitung der Zellen für die intrakranielle Injektion wurde wie in den Schritten 2.1 bis 2.6 beschrieben durchgeführt, während das intrakranielle Injektionsverfahren der in den Schritten 4.1 bis 4.16 beschriebenen Methode folgte27. Bei der Injektion in den Kortex zeigten HGG-Zellen ein medianes Überleben von etwa 25 Tagen nach der intrakraniellen Injektion (Abbildung 5A). Die Tiere wurden wie in den Schritten 5.1 bis 5.4 beschrieben überwacht. Diese Tiere zeigten keine neurologischen Symptome, zeigten aber einen fortschreitenden Gewichtsverlust. Die Tiere wurden auf humane Weise eingeschläfert, wenn sie den in Schritt 5.5 beschriebenen humanen Endpunkt erreicht hatten. Die Gehirne wurden gemäß dem in den Schritten 6.1 bis 6.5 beschriebenen Protokoll entnommen und zur weiteren Analyse geschickt27. Die immunhistochemische Analyse ergab eine große, stark kernhaltige Tumormasse mit Anzeichen einer erhöhten Vaskularisation (Abbildung 5B) und viele proliferative Ki67-Zellen (Abbildung 5C). Bei der Injektion in den Hirnstamm zeigten HGG-Zellen ein medianes Überleben von etwa 26 Tagen nach der intrakraniellen Injektion (Abbildung 5D). Die immunhistochemische Analyse zeigte eine große Tumormasse in der Region des 4. Ventrikels/oberen Pons sowie eine leptomeningeale Infiltration in den lateralen Ventrikel (Abbildung 5E). Weitere immunhistochemische Analysen zeigten viele proliferative Zellen im Hirnstamm und anderen infiltrierten Bereichen (Abbildung 5F). Dieses Experiment zeigt, dass die Injektion derselben Tumorzellen an verschiedenen anatomischen Stellen die Tumorwachstumsrate nicht beeinflusst, obwohl einige Unterschiede im Wachstumsmuster beobachtet werden.

Abbildung 1: Repräsentative Bilder des stereotaktischen Aufbaus für die intrakranielle Injektion von Hirntumorzellen. (A) Der Anästhesieapparat wird typischerweise neben der BSC-Haube positioniert, was eine doppelte Verabreichung der Anästhesie sowohl an die Induktionskammer als auch an den stereotaktischen Apparat erfordert. (B) Waschstation für Mikrospritzen aus Glas und stereotaktischer Halter; Die Spritze muss nach jeder intrakraniellen Injektion mit Kochsalzlösung, Ethanol und anschließend Wasser gespült werden. (C) Stereotaktischer Aufbau in der BSC-Haube, der die Anästhesiekammer, die Bohrmaschine, das stereotaktische Gerät, die stereotaktische Koordinatenkonsole, die Wattespitzen, das Skalpell, die Pinzette, die Pipette und die Spitzen darstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Bilder einer intrakraniellen Injektion, die an einer immungeschwächten Maus durchgeführt wird. (A) Anästhesiertes Tier, das in einem Anästhesiekegel positioniert ist. (B) Hautschnitt, gefolgt von der Fixierung der Haut auf jeder Seite mit Ohrstangen. (C) Glasmikrospritze, die zur Injektion auf dem Bohrloch positioniert ist. (D) Die Haut bildet nach dem Kleben einen Irokesenschnitt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
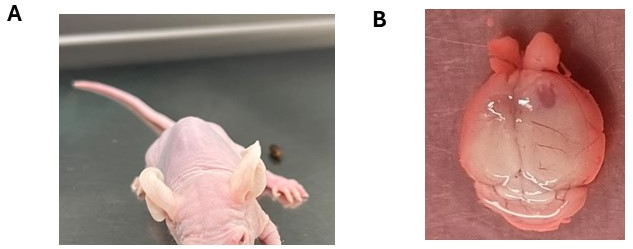
Abbildung 3: Mögliche neurologische Symptome, die nach der Transplantation von Hirntumorzellen beobachtet wurden. (A) Tier mit Kopfneigung nach intrakranieller Injektion von DMG-Zellen in den Hirnstamm. (B) Vergrößerung der rechten kortikalen Hemisphäre mit der Injektionsseite, die die Tumorbildung erkennen lässt. Dem Tier wurden Ependymomzellen injiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
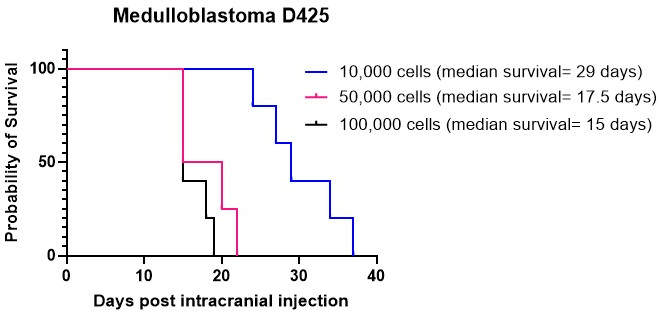
Abbildung 4: Transplantation der Medulloblastom-Kultur D425 bei unterschiedlichen Zelldichten. Medulloblastomzellen wurden intrakraniell mit stereotaktischen Geräten in Dichten von 10.000 Zellen in 2 μl EZM-Hydrogel, 50.000 Zellen und 100.000 Zellen injiziert. Die Tiere wurden auf fortschreitenden Gewichtsverlust überwacht und auf humane Weise eingeschläfert, sobald sie 20 % unter ihrem höchsten aufgezeichneten Gewicht lagen. Das mediane Überleben von Tieren, denen 10.000 Zellen injiziert wurden, betrug 29 Tage, während das mediane Überleben von Tieren, denen eine höhere Zelldichte von 50.000 bzw. 100.000 Zellen injiziert wurde, 17,5 Tage bzw. 15 Tage betrug. Alle Tiere, die in dieser Studie injiziert wurden, entwickelten erfolgreich Tumore. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative Überlebenskurven und histologische Analyse von NSG-Tieren, denen intrakraniell HGG-Zellen in die Hirnrinde und den Hirnstamm injiziert wurden. Etwa 100.000 HGG-Zellen (Passage 3) wurden mit stereotaktischen Geräten in 2 μl EZM-Hydrogel injiziert. Die Tiere wurden auf fortschreitenden Gewichtsverlust überwacht und auf humane Weise eingeschläfert, sobald sie 20 % unter ihrem höchsten aufgezeichneten Gewicht lagen. Bei diesem Hirntumor-Subtyp wurden keine neurologischen Symptome beobachtet. (A) Das mediane Überleben von Tieren, denen HGG-Zellen in die Hirnrinde injiziert wurden, beträgt etwa 25 Tage nach der Injektion (N=2). (B) Die H&E-Färbung der Hirnrinde zeigt eine stark kernhaltige Region mit erhöhter Vaskularisierung, was durch das Vorhandensein roter Blutkörperchen angezeigt wird. (C) Der tumortransplantierte Bereich in der Hirnrinde weist einen hohen Anteil an proliferativen Zellen auf, wie die KI67-Färbung zeigt. (D) Das mediane Überleben von Tieren, denen HGG-Zellen in den Hirnstamm injiziert wurden, beträgt etwa 26 Tage nach der Injektion (N=2). Alle Tiere, die in dieser Studie injiziert wurden, entwickelten erfolgreich Tumore. Die (E) H&E-Färbung des Hirnstamms zeigt eine stark kernhaltige Region mit Tumorinfiltration, die in den Leptomeningen im lateralen Ventrikel beobachtet wurde. (F) Der tumortransplantierte Bereich im Hirnstamm weist einen hohen Anteil an proliferativen Zellen auf, wie die KI67-Färbung zeigt. Der schwarze Maßstabsbalken in den Hauptbildern zeigt 2 mm an, während die vergrößert eingefügten Bilder 20 μm anzeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Tabelle 1: Überwachungsformular für die Inspektion der postintrakraniellen Injektionen von Tieren und die mögliche Behandlung mit Krebsmitteln. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Während die in dieser Studie beschriebene intrakranielle Injektionstechnik eine robuste Methode zur Etablierung von orthotopen patientenabgeleiteten Xenotransplantatmodellen (PDX) für pädiatrische Hirntumoren darstellt, müssen mehrere Bereiche verbessert werden. Ein Ansatz zur Verbesserung der Technik besteht darin, den Prozess der Präparation von Tumorzellen zu optimieren. Dazu gehört auch die Veredelung der Materialien, die für die Implantation der Tumorzellen verwendet werden. Während EZM-Hydrogel als Goldstandard gilt, könnte die Verwendung von Hydrogelen, die aus Komponenten bestehen, die denen des Gehirns oder des Tumors ähnlicher sind, das Überleben und die Transplantation von BT-Zellen verbessern. Von diesem Ansatz profitieren vor allem Tumorarten mit längeren Transplantationszeiten, wie z.B. Medulloblastome und Ependymome. Zum Beispiel hat sich gezeigt, dass Kollagen eine entscheidende Rolle beim Wachstum des Medulloblastoms der Gruppe 3 spielt, während Laminin den SHH-Typ des Medulloblastoms unterstützt28. Darüber hinaus kann auch die Steifigkeit der EZM das Tumorwachstum beeinflussen. Hochgradige Glioblastome weisen beispielsweise im Vergleich zu normalem Hirngewebe eine höhere Steifigkeit im Kern auf, was das Tumorwachstum und das Überleben unterstützen kann29. Durch die Anpassung der EZM-Zusammensetzung und -Steifigkeit an die spezifischen Anforderungen verschiedener Tumorarten können die Transplantation und das Wachstum von PDX-Modellen erheblich verbessert werden.
Einige aktuelle Studien haben wertvolle Einblicke in den Umgang mit Tumorproben von Patienten und die Entwicklung von PDX-Modellen geliefert. Tsoli et al. betonten, dass die direkte Implantation von DMG-Gewebe in der Regel zu höheren Transplantationsraten führt als Primärkulturen15. Smith et al. etablierten 37 PDX-Modelle durch intrakranielle Injektion von Hirntumorbiopsien oder Autopsieproben und berichteten über eine Gesamterfolgsrate von 43%, wobei HGGs die höchste Transplantationsrate (100%) aufwiesen, gefolgt von Medulloblastomen (45%) und Ependymomen (25%). Die Tumorlatenz variierte stark von 1 bis 11 Monaten, wobei sich aggressivere Tumoren schneller verfestigten11. Im Gegensatz dazu berichteten Brabetz et al. über eine niedrigere Gesamterfolgsrate von 30%, wobei HGGs eine Transplantationsrate von 31% und niedrigere Raten für Medulloblastome (37%) und Ependymome (17%) aufwiesen)16. Trotz dieser Unterschiede bestätigten die letzten beiden Studien von Smith et al. und Brabetz et al., dass die PDX-Modelle die Patiententumoren im Allgemeinen auf immunhistochemischer und molekularer Ebene rekapitulierten, obwohl geringfügige genomische Diskrepanzen zwischen den ursprünglichen Tumorproben und den etablierten Modellen beobachtet wurden. Diese Ergebnisse unterstreichen die Herausforderungen bei der Entwicklung repräsentativer PDX-Modelle und unterstreichen die Variabilität des Transplantationserfolgs bei verschiedenen Tumorarten11,16.
Eine wesentliche Einschränkung des orthotopen Ansatzes ist die Unfähigkeit, die Tumorgröße genau zu messen, es sei denn, es wird ein bildgebendes System wie Xenogen Imaging verwendet, wenn die Tumorzellen mit Luziferase oder Magnetresonanztomographie (MRT) markiert werden. Die Markierung von Tumorzellen mit Luciferase könnte eine Lösung bieten, indem sie eine biolumineszierende Bildgebung ermöglicht, um die Transplantation zu bestätigen und das Fortschreiten des Tumors nicht-invasiv zu überwachen. Diese Methode würde die Fähigkeit verbessern, das Ansprechen auf die Behandlung dynamisch zu verfolgen, und damit eine genauere Bewertung der therapeutischen Wirksamkeit ermöglichen17,30. Eine alternative Methode ist die Verwendung von MRT-Technologie. Die Erkennbarkeit von Tumoren hängt jedoch von ihrer Größe ab. Größere Tumoren werden leichter identifiziert, was oft am experimentellen Endpunkt liegt, und die Erkennung kann auch je nach Subtyp des Tumors variieren, wobei GBM leichter erkannt werden kann als diffuse Gliome27,31. Insbesondere bei diffusen Gliomen führt das Vorhandensein einer intakten Blut-Hirn-Schranke (BHS) zu einer fehlenden Kontrastverstärkung. Bei GBM können jedoch ein undichtes Gefäßsystem und das Vorhandensein von Ödemen den Kontrast zwischen dem Tumorgewebe und dem umgebenden gesunden Hirngewebe verstärken, was möglicherweise den Erkennungsprozess unterstützt. Im Allgemeinen werden Kontrastmittel benötigt, um die Detektion zu verbessern 30,31,32. Alternative bildgebende Verfahren wie die diffusionsgewichtete Bildgebung (DWI) und die flüssigkeitsabgeschwächte Inversionswiederherstellung (FLAIR) werden manchmal eingesetzt, um die Erkennung von nicht-verstärkenden Tumorregionen zu verbessern. Diese Methoden haben jedoch auch ihre Grenzen und liefern möglicherweise nicht immer eine genaue Abgrenzung der Tumorgrenzen33. Die Amid-Protonentransfer-gewichtete (APTw) Bildgebung ist eine nicht-invasive MRT-Technik, die diffuse Gliome durch Verfolgung des Protein-Wasser-Protonenaustauschs erkennt und so die Tumoreinstufung unterstützt. Es ist zwar vielversprechend, steht aber vor Herausforderungen wie der Anfälligkeit für Artefakte und wurde noch nicht für die Bildgebung von Kleintieren angepasst, was seine breitere Anwendung einschränkt34.
Ein weiterer entscheidender Aspekt, der bei der Verwendung orthotoper BT-PDX-Modelle für Arzneimittelwirksamkeitsstudien zu berücksichtigen ist, ist die BHS-Integrität in den verwendeten PDX-Modellen. Die Permeabilität der BHS beeinflusst maßgeblich die Verabreichung und Wirksamkeit von Medikamenten bei der Behandlung von Hirntumoren. Zum Beispiel führt die Aufrechterhaltung der BHS-Integrität bei Hirnstammgliomen oft zu einer schlechten Medikamentenpenetration, was die Wirksamkeit systemischer Therapien einschränkt17. Auf der anderen Seite wurde bei Medulloblastomen der Gruppe 3 beobachtet, dass die BHS-Integrität in der MRT-Bildgebung heterogen ist, und in ähnlicher Weise wurde festgestellt, dass sie in den patientenabgeleiteten Xenotransplantatmodellen (PDX) undicht ist35. Daher ist die Charakterisierung des BHS-Status - unabhängig davon, ob er intakt oder undicht ist - in jedem PDX-Modell unerlässlich, um geeignete therapeutische Strategien zu entwickeln und die Ergebnisse von Arzneimittelwirksamkeitsstudien genau zu interpretieren.
Insgesamt bietet das skizzierte intrakranielle Injektionsverfahren einen robusten Ansatz für die Etablierung von BT PDX-Modellen und die Durchführung von Wirksamkeitsstudien für Therapeutika. Kontinuierliche Verfeinerungen, gepaart mit einem umfassenden Verständnis dieser Modelle, werden ihren Nutzen erhöhen und die Entwicklung therapeutischer Interventionen für pädiatrische BT-Patienten erleichtern.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren danken den Patienten, Klinikern und Forschern des Sydney Children's Hospital Network, des Sydney Children's Tumour Bank Network und des Zero Childhood Cancer Program für die großzügige Bereitstellung der wesentlichen Proben für die Etablierung dieser Methodik. Das Children's Cancer Institute Australia ist mit der University of New South Wales Sydney und dem Sydney Children's Hospital Network verbunden. Dieses Protokoll stammt aus Forschungsanstrengungen, die durch Zuschüsse des National Health and Medical Research Council (Synergy Grant #2019056, Leadership Grant APP2017898 to DZ) und des Cancer Institute New South Wales Program Grant (TPG2037 to DZ und MT) sowie durch die Unterstützung des Levi's Project, des Kids Cancer Project, The Cure Starts Now, DIPG Collaborative Cure Brain Cancer Foundation, die Robert Connor Dawes Foundation und die Benny Wills Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
Referenzen
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten