Method Article
Stereotaxic Device를 이용한 뇌종양에 대한 Orthotopic Patient-derived Xenograft Models 구축
요약
정형소 소아 뇌종양 모델의 개발에는 암세포를 정밀하게 이식하기 위해 입체 장치를 사용하는 세심한 정밀도가 필요합니다. 여기에 제시된 방법론은 뇌종양 세포를 준비하고, 두개내 주사를 수행하고, 뇌종양 생착을 평가하기 위한 수술 후 모니터링 시스템을 구현하는 것과 관련된 단계를 간략하게 설명합니다.
초록
중추신경계(CNS) 종양에 대한 임상적으로 관련성이 있고 신뢰할 수 있는 모델의 개발은 신경 종양학 분야를 발전시키는 데 중추적인 역할을 했습니다. 가장 널리 사용되는 기술 중 하나는 정형소 두개내 주사로, 통제된 환경 내에서 종양의 성장, 침습 및 전파를 조사할 수 있는 방법입니다. 이 기술은 특정 환자 부위의 종양 세포를 동물의 해당 해부학적 부위에 이식하는 것을 포함합니다. 이를 통해 이러한 정소성 뇌종양 모델은 암의 생물학적 거동과 인간 환자에서 볼 수 있는 뇌 환경과의 상호 작용을 보다 정확하게 복제할 수 있기 때문에 고유한 이점을 제공합니다. 따라서 임상 시나리오와 매우 유사해야 잠재적인 치료법을 평가하는 데 필수적인 전임상 치료 테스트에 특히 유용합니다. 이 프로토콜은 미만성 정중선 신경교종(DMG), 교모세포종(GBM), 수모세포종 및 뇌실막종을 포함한 소아 뇌종양에 대한 환자 유래 이종이식(PDX) 모델 개발 경험을 공유합니다. 이 방법은 마우스에서 두개내 입위 주사를 수행하는 절차를 설명하여 뇌 내 주사 부위를 올바르게 표적으로 삼을 수 있도록 합니다. 또한 성공적인 종양 생착의 징후를 감지하기 위해 사용되는 시술 후 모니터링 시스템에 대해 설명합니다. 종양 주사 후, 종양 진행의 일반적인 지표인 신경학적 손상, 행동 변화 및/또는 체중 감소의 징후가 있는지 동물을 관찰하기 위해 엄격한 모니터링 시스템이 구현됩니다. 이 시스템은 적시에 개입할 수 있도록 하고 종양의 성장 역학에 관한 중요한 데이터를 제공합니다. 이러한 모델과 프로토콜을 개선함으로써 전임상 연구의 신뢰성과 중개 잠재력을 향상시켜 소아 CNS 종양에 대한 보다 효과적인 치료법 개발에 기여하는 것을 목표로 합니다.
서문
소아 중추신경계(CNS) 종양은 소아에서 가장 흔한 고형 종양으로, 원발성 소아 종양의 약 20%-25%를 차지하며, 발병률 및 치료에 대한 반응 측면에서 성인 종양과 뚜렷한 특징이 있습니다 1,2. 교모세포종(GBM) 및 미만성 내인성 폰틴 신경교종/미만성 정중선 신경교종(DIPG/DMG)과 같은 고등급 신경교종(HGG)은 특히 공격적이고 예후가 좋지 않으며, 치료 방식의 발전에도 불구하고 생존율은 여전히 낮다3,4,5. 소아 중추신경계 종양의 약 20%를 차지하는 수모세포종은 표준 요법으로 높은 5년 생존율을 달성했지만, 특정 하위 유형은 특히 재발 시나리오에서 어려움을 겪습니다 6,7. 소아 CNS 종양의 약 10%를 차지하는 뇌실막종은 분자적 특성과 종양 위치에 따라 다양한 예후를 보이며, 재발은 임상적으로 심각한 문제를 야기한다 8,9. 분자 환경을 이해하고 정형소 뇌종양(BT) 모델을 개발하면 소아 환자의 결과를 개선하기 위한 효과적인 치료법을 개발할 수 있습니다.
임상적으로 관련된 BT 모델을 개발하는 것은 신경 종양학 연구 및 치료 발견을 진전시키는 데 필수적입니다. 정위 장치를 사용한 정위 주사는 뇌종양의 자연 환경을 밀접하게 모방하여 뇌 내 종양 세포를 정확하게 배치할 수 있기 때문에 이 접근법에서 중추적인 역할을 합니다10. 이 방법은 종양 모델의 신뢰성과 재현성을 향상시켜 종양 생물학 및 침습 및 혈관 신생과 같은 주요 특성에 대한 보다 정확한 연구와 치료 중재의 평가를 용이하게 합니다11. 세포 주입의 정확한 위치와 깊이를 제어하는 입체택시 장치의 기능은 종양 세포가 의도된 뇌 영역에 일관되게 배치되도록 하여 실험 결과의 타당성을 향상시킵니다10. 피하 모델은 치료제의 초기 스크리닝을 위해 보다 접근하기 쉽고 비용 효율적인 옵션을 제공합니다. 이러한 모델에서는 종양 세포가 피부 아래에 이식되어 종양 성장 및 치료 반응을 직접 모니터링할 수 있습니다12. 뇌의 복잡한 미세환경을 복제할 수 있는 능력은 부족하지만, 피하 모델은 고처리량 약물 스크리닝 및 예비 효능 평가에 매우 가치가 있습니다12,13.
여러 연구에서 부검 또는 생검 샘플의 직접 조직 이식 및 원발성 뇌종양 배양을 포함하여 뇌종양 샘플에서 정소성 환자 유래 이종이식 모델(PDX)의 성공적인 개발을 입증했습니다 11,14,15. 그러나 종양해리된 조직이나 종양세포의 두개내 주사가 항상 생착을 보장하는 것은 아니며, 생착 실패 이유를 완전히 이해하지 못한다는 점을 인정하는 것이 중요하다15. 흥미롭게도 HGG 생검 샘플은 다른 뇌종양 아형에 비해 더 높은 성공률을 보이는 경향이 있습니다. 예를 들어, He 등은 HGG orthotopic 모델에 대해 56%의 성공률을 보인 반면, Brabetz 등의 연구에서는 뇌실막종 및 수모세포종과 같은 다른 소아 뇌종양 샘플에 대해 각각 43%와 30%와 같은 낮은 생착률을 보고했습니다 11,14,16. 특히, 뇌종양 PDX 모델은 1개월에서 11개월까지 다양한 잠복기를 보이며, 이후 생착 부위는 전임상 유용성이 감소하는 것으로 나타났습니다. 분자 수준에서 질병을 요약할 수 있는 능력에도 불구하고, 생검과 확립된 모델 간의 일부 게놈 격차가 관찰되었습니다14,16.
PDX 모델은 소아 BT에 대한 새로운 치료 전략을 찾는 데 없어서는 안 될 도구 역할을 합니다. 이 모델은 혈액뇌장벽(BBB)의 존재로 인한 종양 성장, 증상 및 약물 약동학 측면에서 인간 질병을 충실하게 요약하기 때문에 약물 효능 연구를 수행하기 위한 황금 표준으로 간주됩니다. 연구에 따르면 소아 뇌간 신경교종(brainstem glioma) 분야에서는 BBB의 무결성이 유지되고 약물 침투가 부족하면 이러한 종양의 치료 효능이 감소하는 것으로 나타났습니다 17,18,19. 그러나 후성유전학적 억제제(epigenetic inhibitor)와 같이 적절한 약물 침투를 입증하는 선별된 치료법에서 효능을 관찰할 수 있다17,20.
본 연구는 PDX 발달 및/또는 치료제 효능 평가를 목적으로 면역저하 동물에서 뇌종양 세포의 두개내 주사를 수행하는 방법을 제시합니다. 윤리적 실험 종점에 도달할 때까지 종양 진행을 모니터링하기 위한 포괄적인 도구도 제공됩니다.
프로토콜
아래에 설명된 프로토콜은 뉴사우스웨일즈 대학교(University of New South Wales)에서 설명한 동물 관리 및 사용에 대한 윤리 지침을 따르며, 모든 절차는 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)의 승인을 받았습니다. 동물복지를 최우선으로 하였으며, 두개내 주사 시술 시 사용되는 동물들의 고통을 최소화하기 위해 모든 노력을 기울였습니다.
1. 신경구를 형성하는 뇌종양 배양의 확장을 위한 배양
참고: 특정 요구 사항은 사용하는 뇌 배양에 따라 다를 수 있습니다. 다음 단계는 원발성 뇌종양 세포를 신경구(neurosphere)로 사용하는 일반적인 배양 프로토콜을 간략하게 설명합니다. 뇌종양 배양은 상업용 공급업체에서 얻거나 환자 뇌종양 생검 또는 부검을 통해 1차 배양으로 확립할 수 있습니다. 환자 생검 또는 부검 샘플로부터 1차 배양을 확립하는 절차는 발표된 문헌15,21에 요약되어 있습니다.
- 내용물이 해동될 때까지 냉동 보존된 스톡 바이알을 37°C 수조에 넣습니다. 멸균을 보장하기 위해 바이알의 외부 표면을 70% 에탄올로 닦습니다.
- Mayoh et al.21에 기술된 바와 같이 원발성 뇌종양 세포에 대한 신경구 배지를 준비합니다. 생물 안전 작업대(BSC)에서 멸균 1mL 피펫을 사용하여 해동된 세포를 5mL의 사전 예열된 신경구 배지가 들어 있는 멸균 15mL 원추형 튜브로 옮깁니다.
- 원뿔형 튜브를 300 x g 에서 3분 동안 원심분리하여 세포를 펠릿화합니다. 10mL 피펫으로 가능한 한 많은 상층액을 조심스럽게 폐기합니다.
- 세포 펠릿을 10mL 또는 25mL의 신경구 배지에 재현탁합니다. 세포 현탁액을 동결 보존에서 예상되는 세포 수에 따라 T25 또는 T75 플라스크에 플레이트화합니다. 일반적으로 밀도가 5x 105 세포인 시작 세포는 T25 플라스크에 배치됩니다.
- 플라스크를 37 ° C로 설정된 인큐베이터에 5 % CO2로 놓습니다. 미디어를 일주일에 1회 또는 2회 새 미디어로 교환합니다. 또는 세포의 성장 속도에 따라 필요에 따라 성장 인자와 B27을 보충합니다.
- T25 플라스크에서 신경구가 형성되면 T75 플라스크에서 확장할 수 있습니다. 10mL 피펫이 있는 T25 플라스크의 내용물을 15mL 코니컬 튜브로 옮깁니다. 광학 현미경으로 신경구를 관찰하고 충분히 커지면(약 500μm) 육안으로도 볼 수 있습니다.
- 튜브를 300 x g 에서 3-5분 동안 원심분리합니다. 세포 펠릿 위의 배지를 흡입하고 튜브에 약 1mL를 남겨둡니다.
- 1mL 피펫으로 세포를 12x-15x 위아래로 부드럽게 피펫팅하여 세포 펠렛을 해리합니다. 세포 스트레이너(40μm)를 사용하여 신경구를 단일 세포 혼합물로 해리합니다.
- 50mL 원뿔형 튜브 위에 스트레이너를 놓고 10mL 피펫으로 해리된 스페로이드를 스트레이너에 추가합니다. 대부분의 단일 세포는 메쉬를 튜브로 전달하고 덩어리 재료는 메쉬에 남아 있습니다.
- 세포 계수 챔버로 세포를 계수합니다. 동일한 양의 세포 현탁액(예: 5 μL)과 Trypan Blue(5 μL)를 혼합하여 세포 생존율을 평가합니다. 죽은 세포는 광학 현미경에서 파란색으로 보이는 반면, 살아 있는 세포는 염색되지 않은 상태로 남아 있습니다.
- 다음과 같이 셀 밀도를 계산합니다.
세포 농도 = 그리드당 평균 세포 수 × 희석 계수/한 그리드의 부피(mL). 표준 세포 계수 챔버의 그리드 부피는 0.0001mL입니다. - 세포를 계대파로 만들려면 T75 플라스크에 25mL의 신선하고 따뜻한 배지에 1 x 106 세포를 재현탁합니다. 세포를 T75 플라스크에 넣으면 신경구가 자랄 때까지 37°C의 5% CO2 가습 인큐베이터에서 배양합니다.
- 뇌종양 세포를 동결 보존하려면 1 x 106 세포를 1mL의 동결 보존 용액에 재현탁하고 제어된 속도 동결 용기에 밤새 넣고 -80°C에서 보관합니다. 장기 보관을 위해 냉동 보존된 재고를 -180°C 액체 질소 탱크에 보관하십시오.
참고: 동결 보존 배지는 90% 태아 송아지 혈청과 10% 디메틸 설폭사이드(DMSO)로 구성됩니다.
2. 두개내 주사를 위한 뇌종양 세포의 준비
참고: 다음 프로토콜은 두개내 주사를 위해 확립된 또는 단기 배양에서 배양된 세포의 준비를 간략하게 설명하지만, 인간 뇌종양에서 갓 해리된 조직을 포함한 다른 세포 유형에도 적용할 수 있습니다22,23.
- 생물 안전 캐비닛에서 혈청학적 피펫을 사용하여 조직 배양 플라스크의 세포와 배양 배지를 50mL 원뿔형 튜브로 조심스럽게 옮깁니다.
- 실온에서 최대 5분 동안 300 x g 의 원뿔형 튜브를 원심분리합니다. 25mL 피펫으로 펠릿 위의 배지를 흡입하고 튜브에 약 0.5mL를 남깁니다.
- 1mL 피펫으로 세포를 위아래로 10배 부드럽게 피펫팅하여 세포 펠릿을 해리합니다. 트리판 블루(trypan blue)와 혈구계(hemocytometer)를 사용하여 세포를 세어봅니다.
- 원하는 세포 수가 새 튜브에 분주되면 세포를 재현탁하고 4°C에서 5분 동안 300 x g 에서 펠렛화하여 PBS로 2x를 세척합니다.
참고: 셀 수는 설명된 대로 결정할 수 있습니다. 예를 들어, 200,000개 세포의 세포 밀도에서 10마리의 동물을 주입해야 하는 경우 필요한 최소 세포 수는 2 x 106입니다. - 마지막 세척 중에 가능한 한 많은 PBS를 제거하십시오. 세포 펠릿과 50μL 세포외 기질(ECM) 하이드로겔 분취액을 얼음 위에 부드럽게 놓습니다.
참고: ECM 하이드로겔은 4°C 냉각된 피펫을 사용하여 얼음에서 50μL 부분으로 사전 분주할 수 있으며 필요할 때까지 -80°C에서 보관할 수 있습니다. ECM 하이드로겔은 차후 실험용으로 천천히 해동하기 위해 일시적으로 얼음 위에 보관할 수 있습니다. - 세포 펠릿을 ECM 하이드로겔과 혼합하여 주사를 시작하고, 두개내 주사를 시작하기 전에 가능한 한 빨리 이 단계를 완료하는 것을 목표로 합니다. 표준 절차로, ECM 하이드로겔에 부유하는 200,000개의 세포가 포함된 현탁액 2μL를 사용합니다.
참고: 두개내 주사가 2-3시간 이상 걸리는 경우, 얼음에서 장기간 배양하면 세포의 생존력이 감소할 수 있으므로 새로운 세포를 준비해야 합니다. 최대 1,000,000개의 세포와 최대 10μL의 부피로 두개내를 주입할 수 있습니다. 그러나 이를 위해서는 ECM 하이드로겔이 아닌 PBS에 세포를 재현탁시키고 매우 느린 주입 속도로 첨가해야 합니다.
3. 입체택시 및 마취 장비 설정
참고: 아래 나열된 절차는 정위 장비 제조업체와 선호하는 마취 유형에 따라 약간 다를 수 있습니다.
- 먼저 폴리소르베이트 20 세제로 표면을 소독하고 10분 동안 그대로 두어 BSC를 시작합니다. 그런 다음 80% 에탄올로 표면을 닦습니다. BSC 후드 내에 배치하기 전에 각 장비를 80% 에탄올로 닦으십시오(전기 입력이 젖지 않도록 하십시오).
- 그림 1에 따라 BSC 후드 내에 베이스 플레이트를 배치하고 노즈 콘은 오른쪽에 위치합니다(오른손잡이 사용자용). XYZ 매니퓰레이터가 이미 베이스 플레이트에 부착되어 고정되어 있는지 확인합니다.
- 디지털 디스플레이 콘솔을 베이스 플레이트 후면의 입구에 연결하고 전원 케이블을 BSC 후드 내의 제공된 전원 공급 장치에 꽂습니다( 그림 1 참조). 이 콘솔은 XYZ 매니퓰레이터의 움직임 좌표를 등록합니다.
- 탄소 필터 캐니스터(마취 출력용)와 마취 입력을 분리 가능한 노즈피스에 있는 두 개의 밸브에 고정합니다. 노즈콘 조각을 장착 섹션에 밀어 넣고 입체 장치에 나사를 조입니다.
- 이어바를 장착 섹션의 각 측면에 있는 해당 홀더에 부착하고 홀더에 부착된 나사를 조여 제자리에 고정합니다. 이어바는 거즈 패드나 전기 테이프로 덮을 수 있습니다.
- 수술 침대를 장치에 삽입하고 동물을 제자리에 고정하는 이어 바에 맞게 높이를 조정합니다. 동물을 따뜻하게 유지하기 위해 게이지 패드로 수술 침대를 감쌉니다.
- 가열 패드를 전원 공급 장치에 연결하고 동물 아래에 배치하여 마취 절차 중에 보온을 유지하십시오.
- BSC 후드 내부에는 멸균 면 팁, 20μL 피펫 팁, 안연고, 개별 포장된 이소프로판올 물티슈, 수술용 접착제 및 20μL 피펫을 정렬합니다. 거즈 패드에 80% 에탄올을 적시고 그 위에 멸균 집게와 메스를 놓습니다.
- 유리 마이크로주사기를 차가운 80% 에탄올에 5번 세척한 다음 차가운 0.9% 식염수에 세척하여 세척합니다.
- 드릴링을 위해 드릴 모터를 전원 공급 장치에 연결하고 드릴을 XYZ 매니퓰레이터에 장착하여 단단히 나사로 고정하여 단단히 고정합니다.
- 드릴 구성 요소를 세포 주입 목적으로 유리 마이크로 주사기 홀더로 교체하십시오. XYZ 매니퓰레이터의 나사를 풀고 주사기 홀더로 교체하여 드릴을 제거합니다. 유리 마이크로 주사기를 이전에 뚫은 구멍에 맞추기 전에 나사가 조여졌는지 확인하십시오.
- 입체 장치를 사용한 후에는 모든 구성 요소를 분해하고 80% 에탄올로 소독한 후 깨끗한 보관 상자나 먼지가 없는 캐비닛에 보관하십시오. 모든 날카로운 물건은 지정된 날카로운 물건 용기에 안전하고 적절하게 폐기하십시오.
4. 두개내 주사
참고: 두개내 주사는 수컷 마우스와 암컷 마우스 모두에서 수행할 수 있지만, 수컷 마우스는 수컷의 공격성으로 인한 상처 합병증에 덜 취약하기 때문에 일반적으로 암컷 마우스가 선호됩니다. 이 절차는 일반적으로 7-10주 된 쥐에서 수행되어 종양 발달을 위한 충분한 시간을 허용합니다. 일반적으로 동물은 케이지당 4-6마리의 그룹으로 무작위 배정됩니다. BALB/c Nude, NOD-SCID 및 NSG와 같은 면역 저하 균주는 면역 결핍 상태가 종양 생착 및 성장을 지원하기 때문에 환자 유래 이종이식(PDX) 개발에 일반적으로 사용됩니다24. 이 프로토콜은 마취 유도를 위한 이소플루란의 사용을 명시하고 있지만, 케타민(ketamine) 및 자일라진(xylazine)과 같은 대체 마취제도 사용될 수 있다25. 이소플루란을 사용하지 않는 경우, 마취실 및 관련 장비와 관련된 단계를 절차에서 생략할 수 있습니다.
- 두개내 시술 전에 동물의 전반적인 복지를 평가하고 모니터링합니다. 두개내 주사를 시작하기 전에 최대 1시간 동안 한 번에 한 케이지(예: 부프레노르핀 0.05mg/kg, 복강내)에게 진통제를 투여합니다.
- 기기와 함께 제공된 지침에 따라 마취 장비를 설치하십시오. 절차를 시작하기 전에 기화기가 절반 이상 찼는지 확인하십시오. 산소 공급이 열려 있는지 확인하십시오.
- 동물에게 털이 있는 경우 두개내 시술 전날 또는 동시에 제거할 수 있습니다. 전기 이발기나 면도기로 등쪽 또는 쥐 두개골의 수술 부위에서 털을 제거합니다.
- 동물을 마취 유도 챔버로 옮깁니다. 마취 기계의 유량계가 1L/min 유속으로 설정되어 있고 산소 조절기가 40-50psi인지 확인하십시오. 근육이 이완되고 반사 신경이 없는지 확인하여 중간 마취가 유지되도록 합니다.
- 자극에 대한 동물의 반응을 모니터링하고 흉벽의 움직임을 관찰하여 안정적인 호흡을 보장합니다. 두개내 주사가 10분을 초과하는 경우, 직장 프로브와 체온 모니터링 시스템으로 체온을 모니터링하고 맥박 산소 농도계를 사용하여 맥박을 추적합니다.
- 동물을 정위 장치에 장착하고 앞니가 절개 막대에 고정되고 노즈 콘이 동물을 제자리에 고정했는지 확인합니다.
- 요오드를 적신 면봉으로 쥐의 머리를 소독한 다음 이소프로판올 물티슈로 소독합니다. 수술 중 건조를 방지하기 위해 양쪽 눈에 각막 안연고를 바르십시오.
- 소뇌 기저부에서 절개를 시작하여 두개골을 가로질러 중간 지점까지 확장하여 두개골의 상부를 따라 약 1cm 길이의 작은 절개를 만듭니다.
- 귀 사이의 피부를 조여 두개골을 드러내고 이어바를 조여 머리를 고정합니다. 두개골 표면을 청소하고 면봉으로 말리십시오.
- 드릴을 입체성 프레임에 고정하고 드릴을 사용하여 브레그마(또는 램도이드 구조)를 찾습니다.
참고: 특정 입체택시 좌표는 생착 연구에 필요한 해부학적 영역을 기반으로 선택됩니다. 이러한 정확한 좌표는 출판된 문헌에서 가져오거나 Mouse Brain in Stereotaxic Coordinates26 아틀라스와 같은 리소스를 사용하여 결정하여 성공적인 이식을 위한 정확한 표적을 보장할 수 있습니다. - 좌표가 설정되면 드릴을 사용하여 미만성 정중선 신경교종(DMG)의 지정된 부위에 있는 뼈에 작은 버 구멍을 조심스럽게 만듭니다: 브레그마에서 X = +0.5, Y = -5.5, Z = -3.1; 상악상 뇌종양(GBM 또는 뇌실막종): 브레그마에서 X = +1.5, Y = +1, Z = -3; 하부뇌종양(수모세포종, 뇌실막종): 양모세포종에서 X = +2, Y = - 2, Z = -2.
- 기포를 피하면서 피펫으로 세포를 여러 번 재현탁합니다. 세포 혼합물 2μL를 미리 세척된 차가운 유리 마이크로 주사기에 주입합니다. 주사기를 입위 안경테에 부착하고 바늘을 두개골 끝에 맞게 조정합니다.
- 30초 이내의 세포를 천공된 영역에 주입하고 주입하는 동안 역류된 세포 현탁액을 건조시킵니다.
참고: 세포는 ECM 하이드로겔에 현탁되어 있기 때문에 주입은 세포 현탁액이 주사기에서 응고되지 않도록 충분히 빠르게 이루어져야 합니다. 다양한 세포 밀도를 사용하여 다양한 생착 속도를 평가할 수 있으며, 세포 밀도가 높을수록 일반적으로 종양 생착이 더 빨라집니다. - 역류를 방지하고 ECM 하이드로겔이 가라앉을 수 있도록 주사기를 1분 동안 제자리에 두십시오. 주사기를 제거하고 이소프로판올 와이프로 상처를 닦습니다. 필요한 경우 피부 접착제 또는 상처 클립을 사용하여 절개 부위를 밀봉합니다.
- 동물을 누운 자세로 열 램프가 있는 깨끗한 회복 케이지에 넣거나 회복할 때까지 따뜻하게 유지하기 위해 가열 패드 위에 놓습니다. 동물이 스스로 움직이기 시작할 때까지 지속적으로 모니터링하고 그 이후에는 정상적인 행동을 보일 때까지 자주 모니터링하십시오.
- 회복 과정에서 이전에 봉해진 상처가 다시 열린 것으로 밝혀지면 동물을 다시 마취하고 이소프로판올 천으로 상처를 닦아 남아 있는 접착제를 제거한 다음 스테이플로 다시 고정합니다.
5. 생착을 위한 수술 후 모니터링
- 두개내 주사 후 일주일에 5일(또는 필요한 경우 그 이상) 마우스 모니터링을 시작합니다. 두개내 주사 후 처음 몇 주 동안 씨앗이나 흐물흐물한 음식과 같은 사후 관리를 제공하십시오. 잠재적인 상처 입구가 있는지 동물을 주의 깊게 관찰하십시오.
참고: 암컷 동물의 상처가 잘리면 공격성을 거의 보이지 않기 때문에 화장실에 남아 있습니다. 수컷 동물의 경우, 공격성을 줄이는 데 도움이 되는 추가 풍부화와 함께 케이지에 두 개의 이글루를 제공합니다. 드물게 공격성이 발생하여 상처가 다시 열리는 경우, 상처는 스테이플러로 다시 고정되고 공격자는 그룹에서 제거되어 별도로 수용됩니다. - 체중 감소, 활동 수준, 자세, 탈수 징후 및 털 상태와 같은 일반적인 웰빙 매개변수를 모니터링 시트에 기록합니다.
- 머리 기울이기, 운동 실조 및/또는 빙빙 도는 행동과 같은 간헐적이거나 경미하거나 심각한 신경학적 증상을 모니터링 시트에 기록합니다.
- 다음과 같이 신경학적 증상을 식별합니다.
- 다음을 관찰하고 간헐적 증상으로 분류합니다: 머리 기울이기: 5분 검사 동안 1-2회 관찰, 전반적인 웰빙 만족. 운동 실조: 5분 검사 동안 1-2회 관찰됩니다. 전반적인 웰빙이 만족스럽습니다. 선회: 5분 검사 동안 1-2회 관찰; 전반적인 웰빙이 만족스럽습니다. 행동: 생쥐는 음식/물에 도달하고 기어오를 수 있는 정상적인 행동을 보입니다.
- 다음을 관찰하고 경미한 증상으로 분류하십시오. 머리 기울이기: 5분 검사 중에 정기적으로 표시되며 전반적인 웰빙이 만족스럽습니다. 운동 실조증: 5분 검사 중에 정기적으로 표시되며 전반적인 웰빙이 만족스럽습니다. 선회: 5분 검사 중에 정기적으로 표시되며 전반적인 웰빙이 만족스럽습니다. 행동: 생쥐는 주름진 털이나 건조한 피부를 가지고 있을 수 있지만 여전히 정상적인 행동을 보이고 먹이를 먹고 기어오를 수 있습니다.
- 다음을 관찰하고 심각한 증상으로 분류하십시오 : 머리 기울이기: 검사 중 지속적으로 표시, 거의 90° 기울어짐, 주름진 털, 덜 활동적입니다. 운동 실조증: 검사 중 지속적으로 표시, 술에 취한 움직임, 주름진 코트, 덜 활동적입니다. 선회: 검사 도중 지속적으로 표시해, 주름진 외투, 보다 적게 활동적. 행동: 생쥐는 털이 매우 주름지거나 피부가 건조할 수 있습니다. 그들은 15% 이상의 체중 감소를 보일 수 있습니다. 이 단계에서 동물에게 씨앗이나 퍽퍽한 음식을 제공하십시오.
- 생쥐가 웰빙에 영향을 미치는 종양 성장을 나타내는 다음과 같은 임상 징후를 보일 때 인간적인 종점을 설정합니다: 초기 체중에서 20% 이상의 체중 감소, 심한 머리 기울이기, 심한 운동 실조, 심한 빙빙 돌기, 무기력 또는 호흡 곤란. 이 단계에서 CO2 질식을 사용하여 마우스를 인도적으로 안락사시킵니다.
6. 뇌 적출
- 동물이 CO2 질식 또는 자궁 경부 탈구에 의해 인도적으로 안락사되었는지 확인하십시오.
- 가위나 메스를 이용하여 두피를 따라 2cm의 정중선을 절개합니다. 조심스럽게 피부를 분리하고 벗겨내어 두개골을 드러냅니다.
- 가위나 메스를 사용하여 두개골 정중선을 따라 2cm를 조심스럽게 절개합니다. 집게를 사용하여 머리 뒤에서 코 쪽으로 두개골을 부드럽게 들어 올립니다.
- 두개골 측면을 따라 계속 절단하여 아래의 뇌 조직이 손상되지 않도록 합니다. 두개골이 완전히 열리면 집게와 가위를 사용하여 뇌 신경과 혈관에서 뇌를 조심스럽게 분리합니다.
- 두개강에서 뇌를 뒤쪽에서 시작하여 앞으로 부드럽게 들어 올립니다. 뇌를 스냅 냉동 또는 고정과 같은 후속 실험 절차의 요구 사항에 따라 적절한 조건으로 보관합니다. 뇌의 면역조직화학 분석은 실험실마다 다를 수 있습니다. 증식 세포 마커 KI67의 일반적인 워크플로우는 발표된 문헌20에 설명되어 있습니다.
결과
정위 장치를 사용한 정위 주사는 뇌종양 모델 개발에 필수가 되었습니다. 이 기술을 사용하면 종양 세포를 정확하고 재현 가능한 배치할 수 있으며, 이는 신경 종양학 연구에서 일관되고 신뢰할 수 있는 데이터를 생성하는 데 매우 중요합니다. 정위 주사의 성공적인 구현은 일반적으로 입체 주사 프레임, 정확한 움직임을 위한 디지털 미세 조작기, 주사 주사기 및 동물을 움직이지 못하게 하는 마취 시스템을 포함하는 정위 장비의 정확한 설정에 크게 의존합니다(그림 1A, B). 유리 마이크로주사기를 사용하면 일반적으로 2-5μL 사이의 소량을 두개내 주입할 수 있습니다. 주입을 막을 수 있는 생물학적 물질의 축적을 방지하기 위해 적절한 유지 관리와 잦은 세척이 필수적입니다(그림 1C).
생쥐에서 입체택시 장비를 사용하여 뇌종양 세포를 두개내 주입하는 절차에는 몇 가지 주요 단계가 포함됩니다. 첫째, 마우스는 시술 내내 가만히 있고 편안하게 유지되도록 마취됩니다. 동물이 마취되었음을 나타내는 일반적인 신호에는 발가락을 꼬집을 때 움직임과 반사 신경이 없는 것뿐만 아니라 규칙적인 호흡 패턴의 존재가 포함됩니다. 그런 다음 마우스를 입체성 프레임에 놓고 머리를 고정된 위치에 고정합니다(그림 2A). 브레그마(bregma)와 람다(lambda)와 같은 두개골의 랜드마크를 사용하여 주입을 위한 정확한 좌표를 결정합니다. 두피를 작게 절개하고 선택한 좌표로 두개골을 통해 버 구멍을 뚫습니다(그림 2B). 정위 팔에 부착된 미세 주입 바늘을 버 구멍을 통해 삽입하여 종양 세포를 원하는 뇌 영역(피질, 소뇌 또는 뇌간; 그림 2C). 바늘 위치를 주의 깊게 모니터링하고 조정하면 정확한 조준이 보장됩니다. 주입 후 바늘을 천천히 빼내고 절개 부위를 닫습니다(그림 2D). 봉합된 상처는 두개내 주사 후 2주 이내에 치유될 것으로 예상됩니다.
두개내 주사 후 동물은 전반적인 건강 상태와 종종 종양 진행을 나타내는 신경학적 증상의 발달에 대한 신중한 모니터링이 필요합니다(보충 표 1). 일반적으로 동물은 주사 후 1주 동안 약간의 체중 감소를 경험할 수 있으며(최대 체중의 최대 10%), 일반적으로2주가 끝날 때까지 주사 부위가 완전히 밀봉되면 안정화됩니다. 일반적으로 동물은 체중이 꾸준히 증가하고 종양이 진행될 때까지 전반적인 건강을 유지합니다. 신경학적 증상의 발현은 뇌종양의 유형, 주사 부위 및 동물 균주와 같은 요인에 따라 다릅니다. 예를 들어, 피질 신경교종(cortical gliomas) 또는 뇌실막종(ependymomas)은 점진적인 체중 감소와 잠재적인 전뇌 비대를 동반할 수 있는 반면, 뇌간 신경교종(brainstem gliomas)과 수모세포종(medulloblastomas)은 특히 면역력이 저하된 동물에서 운동 실조증 및 머리 기울어짐과 같은 증상을 나타낼 수 있습니다(그림 3A). 또한 뇌간 종양이 있는 동물, 특히 NSG 또는 NOD/SCID 균주에서 빙빙 도는 행동이 관찰될 수 있습니다. 신경학적 증상의 진행은 종종 점진적인 체중 감소와 일치합니다. 노즐이 긴 물병을 제공하거나 부드러운 음식(흐물흐물한 음식 알갱이) 또는 씨앗을 제공하는 것과 같은 적절한 사후 관리 조치는 동물의 복지를 지원하는 데 필수적입니다. 실험 종말점에 도달하고 동물에 대한 후속 인도적 안락사에 도달하면, 주사 부위의 확대 및/또는 출혈 부위의 존재를 포함하여 뇌의 잠재적인 변화가 명백해질 수 있습니다(그림 3B).
Kaplan-Meier 그래프는 일반적으로 뇌종양 동물 모델의 생존 결과를 묘사하는 데 사용됩니다. 그들은 두개내 주사 또는 항암 치료 후 시간이 지남에 따라 생존 확률을 시각적으로 묘사합니다. 이러한 그래프는 전임상 연구 환경에서 생존 데이터를 분석하고 제시하는 데 중요한 도구 역할을 합니다15,27. 우리는 소뇌의 다양한 세포 밀도에서 수모세포종 세포 배양 D425의 두개내 주사를 수행했습니다. 모든 동물은 두개내로 주입되어 종양이 발생했다. 그 결과, 세포 밀도가 높을수록 마우스당 50,000개 및 100,000개의 세포가 10,000개의 세포보다 더 빠르게 생착되는 것으로 나타났습니다(그림 4). 또한, 환자 유래 고급 신경교종(HGG) 세포를 두개골 내 피질과 뇌간에 주입하여 이러한 다양한 위치에서 전체 생존과 종양 성장 패턴, 면역조직화학적 특징을 비교했습니다. 위치에 관계없이 모든 동물에게 두개내에서 발생한 종양을 주입했습니다. HGG 세포의 배양은 1.1 단계 내지 1.10 단계에 자세히 설명 된 프로토콜에 따라 수행되었습니다. 두개내 주사를 위한 세포의 준비는 단계 2.1 내지 2.6에 기술된 바와 같이 수행되었으며, 두개내 주사 절차는 단계 4.1 내지 4.16에 설명된 방법을 따랐다27. 피질에 주입되었을 때, HGG 세포는 두개내 주사 후 약 25일의 평균 생존율을 보였습니다(그림 5A). 5.1 단계에서 5.4 단계에 설명된 대로 동물을 모니터링했습니다. 이 동물들은 신경학적 증상을 보이지 않았지만 점진적인 체중 감소를 보였습니다. 동물은 5.5단계에서 설명한 인도적 종점에 도달한 후 인도적으로 안락사되었습니다. 6.1 단계에서 6.5 단계에 상술된 프로토콜에 따라 뇌를 채취하여 추가 분석을 위해 보냈다27. 면역조직화학 분석을 통해 혈관화가 증가하고(그림 5B) 많은 증식성 Ki67 세포(그림 5C)가 있는 크고 핵이 많은 종양 덩어리가 밝혀졌습니다. 뇌간에 주입했을 때, HGG 세포는 두개내 주사 후 약 26일의 평균 생존 기간을 보였습니다(그림 5D). 면역조직화학 분석은 제4뇌실/상부 교구 영역에서 큰 종양 덩어리와 외측 심실로의 연수막 침투를 보여주었습니다(그림 5E). 추가 면역조직화학 분석에서는 뇌간 및 기타 침투 부위에 많은 증식 세포가 있는 것으로 나타났습니다(그림 5F). 이 실험은 동일한 종양 세포를 다른 해부학적 위치에 주입하는 것이 성장 패턴에서 약간의 차이가 관찰되기는 하지만 종양 성장 속도에 영향을 미치지 않는다는 것을 강조합니다.

그림 1: 뇌종양 세포의 두개내 주입을 위한 입체성 설정의 대표적인 이미지. (A) 마취 장치는 일반적으로 BSC 후드 옆에 위치하며, 이는 유도 챔버와 정위 장치 모두에 마취의 이중 투여를 필요로 합니다. (B) 유리 마이크로 주사기 세척 스테이션 및 입체 홀더; 주사기는 식염수, 에탄올로 씻어내야 하며, 두개내 주사를 맞을 때마다 물을 주입해야 합니다. (C) 마취실, 드릴링 머신, 입위 장치, 입위 좌표 콘솔, 면 팁, 메스, 핀셋, 피펫 및 팁을 보여주는 BSC 후드 내부의 입체 설정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 면역이 저하된 마우스에서 수행되는 두개내 주사의 대표적인 이미지. (A) 마취 원뿔에 배치된 마취된 동물. (B) 피부 절개 후 이어 바로 양쪽에 피부를 고정합니다. (C) 주입을 위해 뚫린 구멍 위에 배치된 유리 마이크로 주사기. (D) 피부는 접착되면 모호크 스타일을 형성합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
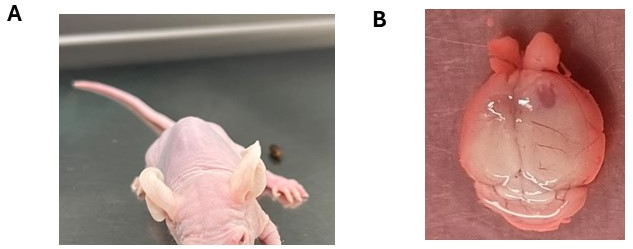
그림 3: 뇌종양 세포 생착 후 관찰된 잠재적인 신경학적 증상. (A) 뇌간에 DMG 세포의 두개내 주입 후 머리 기울기를 보이는 동물. (B) 주사 측이 종양 형성을 드러내는 우측 피질 반구의 비대. 동물에게 뇌실막종 세포를 주입했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
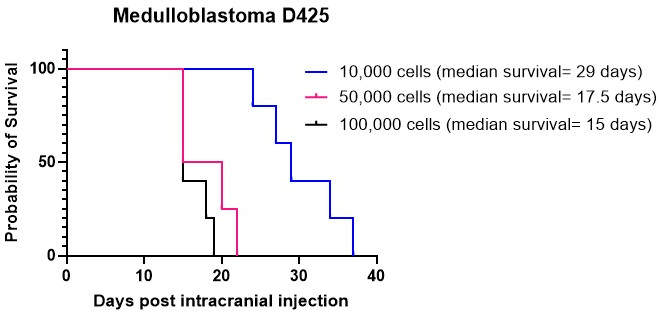
그림 4: 다양한 세포 밀도에서 수모세포종 배양 D425의 생착. 수모세포종 세포는 2μL의 ECM 하이드로겔, 50,000개 세포 및 100,000개 세포에 10,000개의 세포 밀도로 입체택시 장비를 사용하여 두개내 주입되었습니다. 동물들은 점진적인 체중 감소를 모니터링했으며 기록된 최고 체중보다 20% 낮아지면 인도적으로 안락사되었습니다. 10,000개의 세포를 주입받은 동물의 평균 생존 기간은 29일이었고, 50,000개와 100,000개의 더 높은 세포 밀도를 주입한 동물의 평균 생존 기간은 각각 17.5일과 15일이었다. 이 연구에서 주입된 모든 동물은 성공적으로 종양을 발생시켰습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 피질과 뇌간에서 HGG 세포를 두개골 내에 주입한 NSG 동물의 대표적인 생존 곡선 및 조직학적 분석. 약 100,000 HGG 세포(통로 3)를 입체택시 장비를 사용하여 2μL의 ECM 하이드로겔에 주입했습니다. 동물들은 점진적인 체중 감소를 모니터링했으며 기록된 최고 체중보다 20% 낮아지면 인도적으로 안락사되었습니다. 이 뇌종양 아형에 대한 신경학적 증상은 관찰되지 않았습니다. (A) HGG 세포가 피질에 주입된 동물의 평균 생존 기간은 주입 후 약 25일(N=2)입니다. (B) 피질의 H&E 염색은 적혈구의 존재로 나타나는 혈관화가 증가된 고도로 핵이 많은 영역을 보여줍니다. (C) 피질의 종양 생착 부위는 KI67 염색에서 알 수 있듯이 높은 수준의 증식 세포를 나타냅니다. (D) HGG 세포를 뇌간에 주입한 동물의 평균 생존 기간은 주사 후 약 26일(N=2)입니다. 이 연구에서 주입된 모든 동물은 성공적으로 종양을 발생시켰습니다. (E) 뇌간의 H&E 염색은 외측심실의 연봉(leptomeninges)에서 관찰된 종양 침투와 함께 고도로 핵이 있는 영역을 보여줍니다. (F) 뇌간의 종양 생착 부위는 KI67 염색에서 알 수 있듯이 높은 수준의 증식 세포를 나타냅니다. 메인 이미지의 검은색 눈금 막대는 2mm를 나타내는 반면 확대된 삽입 이미지는 20μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 동물의 두개후 주사 및 항암제에 대한 잠재적 치료를 검사하는 데 사용되는 모니터링 양식. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 연구에서 자세히 설명된 두개내 주사 기술은 소아 뇌종양에 대한 정형외과 환자 유래 이종이식(PDX) 모델을 확립하기 위한 강력한 방법을 제공하지만 몇 가지 영역은 개선이 필요합니다. 이 기술을 개선하기 위한 한 가지 접근 방식은 종양 세포 준비 프로세스를 최적화하는 것입니다. 여기에는 종양 세포의 이식에 사용되는 물질을 정제하는 것이 포함됩니다. ECM 하이드로겔이 황금 표준으로 간주되지만, 뇌 또는 종양 ECM의 성분과 더 유사한 성분으로 구성된 하이드로겔을 사용하면 BT 세포의 생존과 생착을 향상시킬 수 있습니다. 이 접근법은 특히 수모세포종 및 뇌실막종과 같이 생착 기간이 긴 종양 유형에 도움이 됩니다. 예를 들어, 콜라겐은 그룹 3 수모세포종의 성장에 중요한 역할을 하는 것으로 나타났으며, 라미닌은 SHH 유형의 수모세포종을 지원하는 것으로 나타났습니다28. 또한 ECM의 강성도 종양 성장에 영향을 미칠 수 있습니다. 예를 들어, 높은 등급의 교모세포종은 정상 뇌 조직에 비해 중심부의 강성이 더 높은데, 이는 종양의 성장과 생존에 도움이 될 수 있다29. 다양한 종양 유형의 특정 요구 사항에 맞게 ECM 구성과 강성을 조정함으로써 PDX 모델의 생착 및 성장을 크게 개선할 수 있습니다.
최근의 몇 가지 연구는 환자 종양 샘플 처리 및 PDX 모델 개발에 대한 귀중한 통찰력을 제공했습니다. Tsoli 등은 DMG 조직의 직접 이식이 일반적으로 1차 배양보다 더 높은 생착률을 초래한다는 점을 강조했습니다15. Smith 등은 뇌종양 생검 또는 부검 샘플의 두개내 주입을 통해 37개의 PDX 모델을 확립하여 전체 성공률이 43%를 보고했으며, HGG가 가장 높은 생착률(100%)을 보였고 수모세포종(45%)과 뇌실막종(25%)이 그 뒤를 이었습니다. 종양 잠복기는 1개월에서 11개월까지 매우 다양했으며, 공격적인 종양이 더 빨리 생착했다11. 이와는 대조적으로, Brabetz 등은 전체 성공률이 30%로 낮았으며, HGG는 31%의 생착률을 보였고 수모세포종(37%) 및 뇌실막종(17%)은 더 낮았습니다16. 이러한 차이에도 불구하고, Smith 등과 Brabetz 등이 수행한 마지막 두 연구에서는 PDX 모델이 원래 종양 샘플과 확립된 모델 간에 경미한 게놈 불일치가 관찰되었음에도 불구하고 일반적으로 면역조직화학 및 분자 수준에서 환자 종양을 요약한다는 것을 확인했습니다. 이러한 결과는 대표적인 PDX 모델 개발의 어려움을 강조하고 종양 유형에 따른 생착 성공의 다양성을 강조합니다11,16.
정소성 접근법의 중요한 한계 중 하나는 종양 세포에 루시퍼라아제 또는 자기공명영상(MRI)이 태그된 경우 Xenogen Imaging과 같은 이미징 시스템을 사용하지 않는 한 종양 크기를 정확하게 측정할 수 없다는 것입니다. 종양 세포에 루시퍼라아제를 태그하면 생물 발광 이미징을 통해 생착을 확인하고 종양 진행을 비침습적으로 모니터링할 수 있으므로 솔루션을 제공할 수 있습니다. 이 방법은 치료에 대한 반응을 동적으로 추적하는 능력을 향상시켜 치료 효능에 대한 보다 정확한 평가를 제공할 수 있다17,30. 대안적인 방법은 MRI 기술을 활용하는 것입니다. 그러나 종양의 검출 가능성은 종양의 크기에 따라 달라집니다. 더 큰 종양은 종종 실험 종말점에 있는 더 쉽게 식별되며, 검출은 종양의 아형에 따라 다를 수 있으며, 교모세포종은 미만성 신경교종보다 더 쉽게 검출됩니다27,31. 특히 미만성 신경교종의 경우, 손상되지 않은 혈액뇌장벽(BBB)이 있으면 대비 향상이 부족합니다. 그러나 교모세포종에서는 혈관 구조 누출과 부종의 존재로 인해 종양 조직과 주변의 건강한 뇌 조직 사이의 대비가 증폭되어 감지 과정에 도움이 될 수 있습니다. 일반적으로 검출을 개선하기 위해서는 조영제가 필요합니다 30,31,32. DWI(Diffusion-Weighted Imaging) 및 FLAIR(Fluid-Attenuated Inversion Recovery)과 같은 대체 이미징 기술은 때때로 비강화 종양 영역의 검출을 개선하는 데 사용됩니다. 그러나 이러한 방법에는 한계가 있으며 항상 종양 경계를 정확하게 묘사할 수 있는 것은 아니다33. APTw(Amide Proton Transfer-weighted) 이미징은 단백질-수분 양성자 교환을 추적하여 미만성 신경교종을 감지하여 종양 등급 지정을 돕는 비침습적 MRI 기술입니다. 유망하기는 하지만, 인공물에 대한 민감성과 같은 문제에 직면해 있으며, 아직 소동물 이미징에 적합하지 않아 더 광범위한 적용이 제한되고 있다34.
약물 효능 연구를 위해 정소성 BT PDX 모델을 사용할 때 고려해야 할 또 다른 중요한 측면은 사용된 PDX 모델의 BBB 무결성입니다. BBB의 투과성은 뇌종양 치료에서 약물 전달 및 효능에 큰 영향을 미칩니다. 예를 들어, 뇌간 신경교종에서 BBB 무결성이 유지되면 약물 침투율이 저하되어 전신 치료의 효과가 제한되는 경우가 많습니다17. 반면, 그룹 3 수모세포종에서 BBB 무결성은 MRI 영상에서 이질적인 것으로 관찰되었으며, 환자 유래 이종이식(PDX) 모델에서도 유사하게 누출이 발견되었습니다35. 따라서 각 PDX 모델에서 BBB 상태(온전한 상태 또는 누출 여부)를 특성화하는 것은 적절한 치료 전략을 설계하고 약물 효능 연구 결과를 정확하게 해석하는 데 필수적입니다.
전반적으로 설명된 두개내 주사 절차는 BT PDX 모델을 확립하고 치료제에 대한 효능 연구를 수행하기 위한 강력한 접근 방식을 제공합니다. 이러한 모델에 대한 포괄적인 이해와 함께 지속적인 개선을 통해 그 유용성을 증대하고 소아 BT 환자를 위한 치료 중재의 개발을 촉진할 것입니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
저자는 이 방법론을 확립하는 데 필요한 필수 샘플을 아낌없이 제공한 Sydney Children's Hospital Network, Sydney Children's Tumour Bank Network 및 Zero Childhood Cancer Program의 환자, 임상의, 연구자에게 감사를 표합니다. 호주 소아암 연구소(Children's Cancer Institute Australia)는 시드니 뉴사우스웨일즈 대학교(University of New South Wales) 및 시드니 아동병원 네트워크(Sydney Children's Hospital Network)와 제휴하고 있습니다. 이 프로토콜은 National Health and Medical Research Council(Synergy Grant #2019056, DZ에 Leadership Grant APP2017898) 및 Cancer Institute New South Wales Program Grant(DZ 및 MT에 TPG2037)의 보조금과 Levi's Project, The Kids Cancer Project, The Cure Starts Now, DIPG Collaborative의 지원으로 지원되는 연구 노력에서 비롯됩니다. 큐어 뇌암 재단(Cure Brain Cancer Foundation), 로버트 코너 도스 재단(Robert Connor Dawes Foundation), 베니 윌스 재단(Benny Wills Foundation).
자료
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
참고문헌
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유