Method Article
Estabelecimento de modelos ortotópicos de xenoenxerto derivados de pacientes para tumores cerebrais usando um dispositivo estereotáxico
Neste Artigo
Resumo
O desenvolvimento de modelos ortotópicos de tumores cerebrais pediátricos requer precisão meticulosa, usando um dispositivo estereotáxico para implantar células cancerígenas com precisão. A metodologia apresentada aqui descreve as etapas envolvidas na preparação de células tumorais cerebrais, na realização de injeções intracranianas e na implementação de um sistema de monitoramento pós-operatório para avaliar o enxerto de tumor cerebral.
Resumo
O desenvolvimento de modelos clinicamente relevantes e confiáveis para tumores do sistema nervoso central (SNC) tem sido fundamental no avanço do campo da neuro-oncologia. Uma das técnicas mais utilizadas é a injeção intracraniana ortotópica, um método que permite investigar o crescimento, invasão e disseminação do tumor em um ambiente controlado. Essa técnica envolve o transplante de células tumorais de uma região específica do paciente para o local anatômico correspondente em um animal. Ao fazer isso, esses modelos de tumor cerebral ortotópico oferecem uma vantagem única, pois replicam com mais precisão o comportamento biológico do câncer e suas interações com o ambiente cerebral visto em pacientes humanos. Isso os torna especialmente valiosos para testes terapêuticos pré-clínicos, onde uma grande semelhança com o cenário clínico é essencial para avaliar possíveis tratamentos. Este protocolo compartilha experiências no desenvolvimento de modelos de xenoenxerto derivado de pacientes (PDX) para tumores cerebrais pediátricos, incluindo glioma difuso da linha média (DMG), glioblastoma (GBM), meduloblastoma e ependimoma. Este método delineia o procedimento para a realização de injeções estereotáxicas intracranianas em camundongos, garantindo o direcionamento correto do local da injeção dentro do cérebro. Além disso, descrevemos o sistema de monitoramento pós-procedimento empregado para detectar sinais de enxerto tumoral bem-sucedido. Após a injeção do tumor, um rigoroso sistema de monitoramento é implementado para observar os animais em busca de sinais de comprometimento neurológico, alterações comportamentais e/ou perda de peso, que são indicadores comuns de progressão do tumor. Este sistema permite uma intervenção oportuna e fornece dados críticos sobre a dinâmica de crescimento do tumor. Ao refinar esses modelos e protocolos, pretendemos aumentar a confiabilidade e o potencial translacional dos estudos pré-clínicos, contribuindo para o desenvolvimento de tratamentos mais eficazes para tumores pediátricos do SNC.
Introdução
Os tumores pediátricos do sistema nervoso central (SNC) são os tumores sólidos mais comuns em crianças, compreendendo cerca de 20%-25% dos tumores pediátricos primários, com características distintas dos tumores adultos em termos de incidência e resposta ao tratamento 1,2. Gliomas de alto grau (HGGs), como glioblastoma (GBM) e glioma pontino intrínseco difuso/glioma de linha média difusa (DIPG/DMG), são particularmente agressivos, com prognósticos sombrios e, apesar dos avanços nas modalidades de tratamento, as taxas de sobrevida permanecem baixas 3,4,5. Os meduloblastomas, responsáveis por quase 20% dos tumores pediátricos do SNC, alcançaram uma alta taxa de sobrevida em 5 anos com a terapia padrão, mas certos subtipos apresentam desafios, especialmente em cenários de recidiva 6,7. Os ependimomas, constituindo cerca de 10% dos tumores pediátricos do SNC, exibem prognósticos variados dependendo das características moleculares e da localização do tumor, com a recorrência apresentando desafios clínicos significativos 8,9. Compreender o cenário molecular e desenvolver modelos de tumor cerebral ortotópico (BT) é promissor para o desenvolvimento de terapias eficazes para melhorar os resultados para pacientes pediátricos.
O desenvolvimento de modelos de BT clinicamente relevantes é vital para o avanço da pesquisa neuro-oncológica e da descoberta terapêutica. As injeções ortotópicas usando um dispositivo estereotáxico são fundamentais nessa abordagem, pois permitem a colocação precisa de células tumorais no cérebro, imitando de perto o ambiente natural dos tumores cerebrais10. Esse método aumenta a confiabilidade e a reprodutibilidade dos modelos tumorais, facilitando estudos mais precisos da biologia tumoral e de características-chave, como invasão e angiogênese, bem como a avaliação de intervenções terapêuticas11. A capacidade do dispositivo estereotáxico de controlar a localização exata e a profundidade das injeções celulares garante que as células tumorais sejam consistentemente colocadas nas regiões cerebrais pretendidas, melhorando assim a validade dos resultados experimentais10. Os modelos subcutâneos fornecem uma opção mais acessível e econômica para a triagem inicial de agentes terapêuticos. Nesses modelos, as células tumorais são implantadas sob a pele, permitindo o monitoramento direto do crescimento do tumor e das respostas ao tratamento12. Embora não tenham a capacidade de replicar o complexo microambiente do cérebro, os modelos subcutâneos permanecem altamente valiosos para triagem de medicamentos de alto rendimento e avaliações preliminares de eficácia12,13.
Vários estudos demonstraram o desenvolvimento bem-sucedido de modelos ortotópicos de xenoenxerto derivados de pacientes (PDXs) a partir de amostras de tumores cerebrais, incluindo implante direto de tecido a partir de amostras de autópsia ou biópsia e culturas de tumores cerebrais primários 11,14,15. No entanto, é crucial reconhecer que a injeção intracraniana de tecido dissociado do tumor ou células tumorais nem sempre garante o enxerto, com razões para o fracasso não totalmente compreendidas15. Curiosamente, as amostras de biópsia de HGG tendem a exibir uma taxa de sucesso mais alta em comparação com outros subtipos de tumores cerebrais. Por exemplo, He et al. demonstraram uma taxa de sucesso de 56% para modelos ortotópicos de HGG, enquanto o estudo de Brabetz et al. relatou taxas de enxerto mais baixas, como 43% e 30%, respectivamente, para outras amostras de tumores cerebrais pediátricos, como ependimoma e meduloblastoma 11,14,16. Notavelmente, os modelos PDX de tumor cerebral exibem uma ampla gama de períodos de latência, variando de 1 mês a 11 meses, com enxertos posteriores mostrando utilidade pré-clínica diminuída. Apesar de sua capacidade de recapitular a doença em nível molecular, algumas disparidades genômicas entre biópsias e modelos estabelecidos foram observadas14,16.
Os modelos PDX servem como ferramentas indispensáveis na busca de novas estratégias terapêuticas contra BTs pediátricos. Eles são considerados o padrão-ouro para a realização de estudos de eficácia de medicamentos, pois os modelos recapitulam fielmente a doença humana em termos de crescimento tumoral, sintomas e farmacocinética do medicamento devido à presença da barreira hematoencefálica (BHE). Pesquisas têm demonstrado no campo do glioma de tronco encefálico pediátrico que a manutenção da integridade da BHE e a falta de penetração da droga é uma característica que leva à diminuição da eficácia terapêutica para esses tumores 17,18,19. No entanto, a eficácia pode ser observada em tratamentos selecionados que demonstram penetração adequada da droga, como inibidores epigenéticos e metabólicos17,20.
Este estudo apresenta um método para a realização de injeções intracranianas de células tumorais cerebrais em animais imunocomprometidos, com o objetivo de avaliar o enxerto tanto para o desenvolvimento de PDX quanto para a avaliação da eficácia terapêutica do fármaco. Ferramentas abrangentes para monitorar a progressão do tumor até que o ponto final experimental ético seja alcançado também são fornecidas.
Protocolo
O protocolo descrito abaixo segue as diretrizes éticas para cuidados e uso de animais, conforme descrito pela Universidade de Nova Gales do Sul, e todos os procedimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais. O bem-estar animal foi priorizado e todos os esforços foram feitos para minimizar o sofrimento dos animais utilizados durante o procedimento de injeção intracraniana.
1. Cultura para expansão de culturas de tumores cerebrais formadores de neuroesferas
NOTA: Os requisitos específicos podem variar de acordo com as culturas cerebrais que estão sendo usadas. As etapas a seguir descrevem um protocolo geral de cultura para células tumorais cerebrais primárias como neuroesferas. As culturas de tumores cerebrais podem ser obtidas de fornecedores comerciais ou estabelecidas como culturas primárias de biópsias ou autópsias de tumores cerebrais de pacientes. O procedimento para estabelecer culturas primárias a partir de amostras de biópsia ou autópsia de pacientes é descrito na literaturapublicada 15,21.
- Coloque o frasco para injetáveis criopreservado em banho-maria a 37 °C até que o conteúdo esteja descongelado. Limpe as superfícies externas do frasco com etanol a 70% para garantir a esterilidade.
- Prepare meios de neuroesfera para células tumorais cerebrais primárias, conforme descrito em Mayoh et al.21. Em um gabinete de segurança biológica (BSC), use uma pipeta estéril de 1 mL para transferir as células descongeladas para um tubo cônico estéril de 15 mL contendo 5 mL de meio de neuroesfera pré-aquecido.
- Centrifugue o tubo cônico a 300 x g por 3 min para pellet as células. Descarte cuidadosamente o máximo possível do sobrenadante com uma pipeta de 10 mL.
- Ressuspenda o pellet celular em 10 mL ou 25 mL de meio de neuroesfera. Colocar a suspensão de células num balão T25 ou T75, em função do número de células previsto para a criopreservação. Normalmente, as células iniciais com uma densidade de 5x 105 células são colocadas em um frasco T25.
- Colocar o balão numa incubadora regulada para 37 °C com 5% de CO2. Troque a mídia por mídia nova 1x ou 2x por semana. Como alternativa, complete os fatores de crescimento e B27 conforme necessário, com base na taxa de crescimento das células.
- Uma vez que as neuroesferas se formaram em um frasco T25, elas podem ser expandidas em frascos T75. Transferir o conteúdo do balão T25 com uma pipeta de 10 ml para um tubo cónico de 15 ml. Observe as neuroesferas sob um microscópio óptico e, uma vez que cresçam o suficiente (aproximadamente 500 μm), também podem ser visíveis a olho nu.
- Centrifugue o tubo a 300 x g por 3-5 min. Aspire o meio acima do pellet celular, deixando aproximadamente 1 mL no tubo.
- Pipete suavemente as células para cima e para baixo 12x-15x com uma pipeta de 1 mL para dissociar o pellet celular. Use um filtro de células (40 μm) para dissociar as neuroesferas em uma mistura de uma única célula.
- Coloque o filtro no topo de um tubo cônico de 50 mL e adicione esferóides dissociados com uma pipeta de 10 mL no filtro. A maioria das células individuais passará a malha para o tubo e os materiais aglomerados permanecerão na malha.
- Conte as células com uma câmara de contagem de células. Avalie a viabilidade celular misturando uma quantidade igual de suspensão celular (por exemplo, 5 μL) com Trypan Blue (5 μL). As células mortas aparecerão azuis sob o microscópio óptico, enquanto as células vivas permanecerão sem coloração.
- Calcule a densidade celular da seguinte forma:
Concentração celular = Número médio de células por grade × Fator de diluição/ Volume de uma grade (mL). O volume da grade de uma câmara de contagem de células padrão é de 0,0001 mL. - Para passar as células, ressuspenda 1 x 106 células em 25 mL de meio fresco e aquecido em um balão T75. Uma vez que as células são colocadas em um frasco T75, incube-as a 37 ° C em uma incubadora umidificada com 5% de CO2 até que as neuroesferas cresçam.
- Para criopreservar células tumorais cerebrais, ressuspenda 1 x 106 células em 1 mL de solução de criopreservação e coloque durante a noite em um recipiente de congelamento de taxa controlada e armazene a -80 ° C. Coloque os estoques criopreservados em um tanque de nitrogênio líquido a -180 ° C para armazenamento de longo prazo.
NOTA: O meio de criopreservação compreende 90% de soro fetal de bezerro e 10% de dimetilsulfóxido (DMSO).
2. Preparação de células tumorais cerebrais para injeção intracraniana
NOTA: Embora o protocolo a seguir descreva a preparação de células cultivadas de culturas estabelecidas ou de curto prazo para injeção intracraniana, ele também pode ser adaptado para outros tipos de células, incluindo tecido recém-dissociado de tumores cerebrais humanos22,23.
- Em um gabinete de biossegurança, transferir cuidadosamente as células e o meio de cultura do frasco de cultura de tecidos com uma pipeta sorológica para um tubo cônico de 50 mL.
- Centrifugue o tubo cônico a 300 x g por até 5 min em temperatura ambiente. Aspire com uma pipeta de 25 mL o meio acima do pellet, deixando aproximadamente 0,5 mL no tubo.
- Pipete suavemente as células para cima e para baixo 10x com uma pipeta de 1 mL para dissociar o pellet celular. Conte as células usando azul de tripano e um hemocitômetro.
- Uma vez que a contagem de células desejada é aliquotada em um tubo novo, lave 2x com PBS ressuspendendo as células e peletizando-as a 300 x g por 5 min a 4 ° C.
NOTA: a contagem de células pode ser determinada conforme descrito. Por exemplo, se 10 animais precisam ser injetados com a densidade celular de 200.000 células, então o número mínimo de células necessárias é 2 x 106. - Durante a lavagem final, remova o máximo de PBS possível. Coloque suavemente o pellet celular e a alíquota de hidrogel de matriz extracelular (MEC) de 50 μL no gelo.
NOTA: O hidrogel ECM pode ser pré-aliquotado em porções de 50 μL no gelo usando pipetas resfriadas a 4 °C e armazenado a -80 °C até que seja necessário. O hidrogel ECM pode ser mantido temporariamente no gelo para descongelar lentamente para uso experimental subsequente. - Misture o pellet celular com o hidrogel ECM para injeção, com o objetivo de concluir esta etapa o mais rápido possível antes de iniciar as injeções intracranianas. Como procedimento padrão, use 2 μL da suspensão contendo 200.000 células suspensas em hidrogel ECM.
NOTA: Se as injeções intracranianas demorarem mais de 2-3 h, um novo estoque de células deve ser preparado, pois a incubação prolongada no gelo pode reduzir a viabilidade das células. É possível injetar intracranialmente até 1.000.000 de células e em volumes de até 10 μL; no entanto, isso exigirá que as células sejam ressuspensas em PBS em vez de hidrogel ECM e adicionadas a uma taxa de injeção muito lenta.
3. Configuração de equipamentos estereotáxicos e anestésicos
NOTA: O procedimento listado abaixo pode variar um pouco dependendo do fabricante do equipamento estereotáxico e do tipo de anestesia preferido.
- Comece o BSC higienizando sua superfície primeiro com detergente polissorbato 20 e deixando-o descansar por 10 min. Em seguida, limpe a superfície com etanol a 80%. Antes de colocá-lo dentro do capô BSC, limpe cada peça do equipamento com etanol a 80% (evite molhar as entradas elétricas).
- Posicione a placa de base dentro do capô BSC de acordo com a Figura 1, com o cone do nariz posicionado no lado direito (para usuários destros). Certifique-se de que os manipuladores XYZ já estejam afixados na placa de base e presos.
- Conecte o console do display digital à entrada na parte traseira da placa de base e conecte seu cabo de alimentação à fonte de alimentação fornecida dentro do capô BSC (consulte a Figura 1). Este console registra as coordenadas dos movimentos do manipulador XYZ.
- Prenda o recipiente do filtro de carbono (para saída de anestésico) e a entrada de anestésico nas duas válvulas do revólver removível. Deslize a peça do nariz na seção de montagem e aperte o parafuso no aparelho estereotáxico.
- Prenda as barras auriculares em seus respectivos suportes em cada lado da seção de montagem, prendendo-as no lugar apertando os parafusos fixados nos suportes. As barras auriculares podem ser cobertas com compressas de gaze ou fita isolante.
- Introduza a cama cirúrgica no dispositivo, ajustando sua altura para alinhar com as barras auriculares, que prendem o animal na posição. Enrole a cama cirúrgica com uma almofada de calibre para manter o animal aquecido.
- Conecte a almofada de aquecimento à fonte de alimentação e posicione-a embaixo do animal para manter o calor durante o procedimento anestésico.
- Dentro do capuz BSC, arrume pontas de algodão estéreis, pontas de pipeta de 20 μL, pomada para os olhos, lenços de isopropanol embalados individualmente, cola cirúrgica e uma pipeta de 20 μL. Umedeça uma gaze com 80% de etanol e coloque uma pinça estéril e um bisturi em cima dela.
- Limpe a microsseringa de vidro lavando-a 5x em etanol frio a 80% e, posteriormente, em solução salina fria a 0,9%.
- Para fins de perfuração, conecte o motor da furadeira à fonte de alimentação e monte a furadeira no manipulador XYZ, garantindo um ajuste seguro aparafusando-o firmemente.
- Substitua o componente da broca pelo suporte de microsseringa de vidro para fins de injeção de células. Remova a broca afrouxando o parafuso no manipulador XYZ e substituindo-o pelo suporte da seringa. Certifique-se de que o parafuso esteja apertado antes de alinhar a microsseringa de vidro com o orifício perfurado anteriormente.
- Depois de usar o dispositivo estereotáxico, desmonte todos os componentes e higienize-os com etanol a 80% antes de armazená-los em uma caixa de armazenamento limpa ou armário livre de poeira. Descarte todos os objetos cortantes com segurança e adequadamente em um recipiente designado para objetos cortantes.
4. Injeção intracraniana
NOTA: As injeções intracranianas podem ser realizadas em camundongos machos e fêmeas, embora os camundongos fêmeas sejam geralmente preferidos, pois são menos propensos a complicações de feridas causadas por agressão entre machos. O procedimento é normalmente realizado em camundongos com idade entre 7 e 10 semanas, permitindo tempo suficiente para o desenvolvimento do tumor. Normalmente, os animais são randomizados em grupos de 4-6 por gaiola. Cepas imunocomprometidas, como BALB/c Nude, NOD-SCID e NSG, são comumente usadas para o desenvolvimento de xenoenxerto derivado do paciente (PDX), pois seu status imunodeficiente suporta o enxerto e o crescimento do tumor24. Embora esse protocolo especifique o uso de isoflurano para indução anestésica, anestésicos alternativos como cetamina e xilazina também podem ser usados25. Se o isoflurano não for utilizado, as etapas envolvendo a câmara anestésica e o equipamento relacionado podem ser omitidas do procedimento.
- Pesar e monitorar o bem-estar geral dos animais antes do procedimento intracraniano. Administre um analgésico aos animais uma gaiola de cada vez (por exemplo, buprenorfina 0,05 mg / kg, por via intraperitoneal) por até 1 h antes de iniciar a injeção intracraniana.
- Configure o equipamento anestésico de acordo com as orientações fornecidas com o instrumento. Antes de iniciar o procedimento, certifique-se de que o vaporizador esteja pelo menos até a metade. Certifique-se de que o suprimento de oxigênio esteja aberto.
- Se os animais tiverem pelos, eles podem ser removidos no dia anterior ao procedimento intracraniano ou simultaneamente. Remova o pelo do local da cirurgia no dorso ou crânio do camundongo com tesouras elétricas ou navalha.
- Transferir o animal para a câmara de indução anestésica. Certifique-se de que o medidor de vazão na máquina anestésica esteja ajustado para uma taxa de fluxo de 1 L/min e que o regulador de oxigênio esteja entre 40-50 psi. Certifique-se de que a anestesia média seja mantida, verificando se os músculos estão relaxados e se os reflexos estão ausentes.
- Monitore a resposta do animal aos estímulos e observe o movimento da parede torácica para garantir uma respiração constante. Se as injeções intracranianas excederem 10 min, monitore a temperatura com uma sonda retal e um sistema de monitoramento de temperatura e rastreie o pulso usando um oxímetro de pulso
- Monte o animal no dispositivo estereotáxico, garantindo que os dentes da frente estejam fixados na barra de incisão e que o cone do nariz tenha prendido o animal no lugar.
- Desinfete a cabeça do rato com uma ponta de algodão embebida em iodo e, em seguida, um lenço umedecido em isopropanol. Aplique pomada para os olhos da córnea em ambos os olhos para evitar o ressecamento durante a cirurgia.
- Comece a incisão na base do cerebelo e estenda-a pelo crânio até o ponto médio, fazendo um pequeno corte de aproximadamente 1 cm de comprimento ao longo da face superior do crânio.
- Aperte a pele entre as orelhas para expor o crânio e prenda a cabeça apertando as barras auriculares. Limpe a superfície do crânio e seque-a com um cotonete.
- Prenda a broca na estrutura estereotáxica e localize o bregma (ou estrutura lambdoide) usando a broca.
NOTA: As coordenadas estereotáxicas específicas são selecionadas com base na região anatômica necessária para o estudo do enxerto. Essas coordenadas precisas podem ser obtidas da literatura publicada ou determinadas usando recursos como o atlas Mouse Brain in Stereotaxic Coordinates26 , garantindo um direcionamento preciso para uma implantação bem-sucedida. - Uma vez que as coordenadas são estabelecidas, use uma broca para criar cuidadosamente um pequeno orifício de rebarba no osso no local designado do glioma difuso da linha média (DMG): X = +0,5, Y = -5,5, Z = -3,1 de bregma; Tumor cerebral supratentorial (GBM ou ependimoma): X = +1.5, Y = +1, Z = -3 de bregma; Tumor cerebral infratentorial (Meduloblastoma, ependimoma): X = +2, Y = - 2, Z = -2 da estrutura lambdoide.
- Ressuspenda as células várias vezes com uma pipeta, evitando bolhas de ar. Retire 2 μL da mistura de células para uma microseringa de vidro frio pré-lavada. Encaixe a seringa na estrutura estereotáxica e ajuste a agulha na ponta do crânio.
- Injete as células dentro de 30 s na região perfurada, secando qualquer suspensão celular refluída durante a injeção.
NOTA: Como as células estão suspensas em hidrogel ECM, a injeção precisa ocorrer rápido o suficiente para que a suspensão celular não solidifique na seringa. Densidades celulares variadas podem ser usadas para avaliar diferentes taxas de enxerto, com densidades celulares mais altas geralmente levando a um enxerto tumoral mais rápido. - Deixe a seringa no lugar por 1 min para evitar o refluxo e permitir que o hidrogel ECM assente. Remova a seringa e limpe a ferida com um pano de isopropanol. Use cola de pele ou clipes de ferida para selar a incisão, se necessário.
- Coloque o animal em posição reclinada em uma gaiola de recuperação limpa com uma lâmpada de calor ou em uma almofada de aquecimento para mantê-lo aquecido até a recuperação. Monitore o animal continuamente até que ele comece a se mover por conta própria e frequentemente depois disso até que ele mostre um comportamento normal.
- Se um animal tiver uma ferida previamente selada reaberta durante a recuperação, anestesie o animal novamente, limpe a ferida com um pano de isopropanol para remover qualquer cola restante e, em seguida, prenda novamente com grampos.
5. Monitorização pós-cirúrgica para enxerto
- Após a injeção intracraniana, comece a monitorar os camundongos 5 dias por semana (ou mais, se necessário). Forneça cuidados posteriores, como sementes ou alimentos pastosos, durante as primeiras semanas após a injeção intracraniana. Monitore os animais cuidadosamente quanto a qualquer possível abertura de ferida.
NOTA: Se as fêmeas tiverem suas feridas cortadas, elas permanecem na caixa de areia, pois raramente exibem agressão. Para animais machos, fornecemos dois iglus na gaiola junto com enriquecimento extra para ajudar a reduzir a agressão. No caso raro de ocorrer agressão e levar à reabertura das feridas, as feridas são protegidas novamente com grampos e o agressor é removido do grupo e alojado separadamente. - Registre os parâmetros gerais de bem-estar, como perda de peso, nível de atividade, postura, sinais de desidratação e condição do pelo na folha de monitoramento.
- Registre na folha de monitoramento sintomas neurológicos intermitentes, leves ou graves, como inclinação da cabeça, ataxia e/ou comportamento circular.
- Identifique os sintomas neurológicos da seguinte forma:
- Observe e categorize o seguinte como sintomas intermitentes: Inclinação da cabeça: Observado 1-2 vezes durante uma inspeção de 5 minutos, bem-estar geral satisfatório. Ataxia: Observada 1-2 vezes durante uma inspeção de 5 minutos; bem-estar geral satisfatório. Circulando: Observado 1-2 vezes durante uma inspeção de 5 minutos; bem-estar geral satisfatório. Comportamento: Os ratos apresentam comportamento normal, capazes de alcançar comida/água e escalar.
- Observe e categorize o seguinte como sintomas leves: Inclinação da cabeça: Exibido regularmente durante uma inspeção de 5 minutos, bem-estar geral satisfatório. Ataxia: Exibido regularmente durante uma inspeção de 5 minutos, bem-estar geral satisfatório. Circulando: Exibido regularmente durante uma inspeção de 5 minutos, bem-estar geral satisfatório. Comportamento: Os ratos podem ter uma pelagem eriçada ou pele seca, mas ainda podem exibir comportamento normal, alimentação e escalada.
- Observe e categorize o seguinte como sintomas graves: Inclinação da cabeça: Exibido continuamente durante a inspeção, inclinação de quase 90°, pelagem franzida, menos ativo. Ataxia: Exibido continuamente durante a inspeção, movimentos de bêbados, pelagem com babados, menos ativo. Circulando: Exibido continuamente durante a inspeção, pelagem com babados, menos ativo. Comportamento: Os ratos podem ter uma pelagem muito eriçada ou pele seca. Eles podem apresentar perda de peso de mais de 15%. Forneça aos animais sementes ou alimentos pastosos nesta fase.
- Estabeleça o ponto final humano para os camundongos quando eles exibirem qualquer um dos seguintes sinais clínicos indicando crescimento de tumor que afeta seu bem-estar: perda de peso de 20% ou mais em relação ao peso inicial, inclinação grave da cabeça, ataxia grave, circulância grave, letargia ou respiração difícil. Nesta fase, eutanasiar humanamente os camundongos usando asfixia por CO2 .
6. Colheita de cérebros
- Certifique-se de que o animal seja sacrificado humanamente por asfixia por CO2 ou luxação cervical.
- Faça uma incisão na linha média de 2 cm ao longo do couro cabeludo usando uma tesoura ou bisturi. Separe e retire cuidadosamente a pele para expor o crânio.
- Usando uma tesoura fina ou um bisturi, faça uma incisão cuidadosa de 2 cm ao longo da linha média do crânio. Abra suavemente o crânio usando uma pinça, trabalhando da parte de trás da cabeça em direção ao nariz.
- Continue cortando ao longo das laterais do crânio, garantindo que não haja danos ao tecido cerebral por baixo. Quando o crânio estiver totalmente aberto, retire cuidadosamente o cérebro dos nervos cranianos e vasos sanguíneos usando uma pinça e uma tesoura.
- Levante o cérebro suavemente da cavidade craniana, começando pelas costas e avançando. Armazene o cérebro em condições apropriadas com base nos requisitos de procedimentos experimentais subsequentes, como congelamento instantâneo ou fixação. A análise imuno-histoquímica de cérebros pode variar entre diferentes laboratórios. Um fluxo de trabalho típico para o marcador de células proliferativas KI67 é descrito na literatura publicada20.
Resultados
As injeções ortotópicas usando um dispositivo estereotáxico tornaram-se essenciais para o desenvolvimento de modelos de tumores cerebrais. Essa técnica permite a colocação precisa e reprodutível de células tumorais, o que é crucial para gerar dados consistentes e confiáveis na pesquisa em neuro-oncologia. A implementação bem-sucedida de injeções ortotópicas depende muito da configuração precisa do equipamento estereotáxico, que normalmente inclui uma estrutura estereotáxica, um micromanipulador digital para movimentos precisos, uma seringa de injeção e um sistema de anestesia para imobilizar o animal (Figura 1A, B). O uso de uma microsseringa de vidro permite a injeção intracraniana de pequenos volumes, tipicamente entre 2-5 μL. A manutenção adequada e a lavagem frequente são essenciais para evitar o acúmulo de material biológico, que pode bloquear a injeção (Figura 1C).
O procedimento para injeção intracraniana de células tumorais cerebrais usando equipamento estereotáxico em camundongos envolve várias etapas importantes. Em primeiro lugar, o mouse é anestesiado para permanecer imóvel e confortável durante todo o procedimento. Os sinais típicos que indicam que o animal está anestesiado incluem a ausência de movimento e reflexos ao beliscar o dedo do pé, bem como a presença de um padrão respiratório regular. Em seguida, o mouse é colocado em um quadro estereotáxico, prendendo sua cabeça em uma posição fixa (Figura 2A). Usando pontos de referência no crânio, como bregma e lambda, as coordenadas precisas para injeção são determinadas. Uma pequena incisão é feita no couro cabeludo e um orifício de rebarba é perfurado no crânio nas coordenadas escolhidas (Figura 2B). Uma agulha de microinjeção presa ao braço estereotáxico é inserida através do orifício da broca para entregar as células tumorais na região cerebral desejada (córtex, cerebelo ou tronco cerebral; Figura 2C). O monitoramento cuidadoso e o ajuste da posição da agulha garantem um direcionamento preciso. Após a injeção, a agulha é retirada lentamente e a incisão é fechada (Figura 2D). Espera-se que a ferida selada cicatrize dentro de duas semanas após a injeção intracraniana.
Após a injeção intracraniana, os animais requerem monitoramento cuidadoso para o bem-estar geral e o desenvolvimento de sintomas neurológicos, que geralmente indicam progressão do tumor (Tabela Suplementar 1). Normalmente, os animais podem experimentar uma ligeira perda de peso durante a 1ª semana após a injeção (até 10% do seu peso mais alto), que normalmente se estabiliza quando os locais de injeção estão totalmente selados no final da2ª semana. Geralmente, os animais exibem um aumento constante de peso e mantêm uma boa saúde geral até que ocorra a progressão do tumor. A manifestação dos sintomas neurológicos varia dependendo de fatores como o tipo de tumor cerebral, local da injeção e cepa animal. Por exemplo, gliomas corticais ou ependimomas podem apresentar perda de peso progressiva e potencial aumento do prosencéfalo, enquanto gliomas do tronco encefálico e meduloblastomas podem apresentar sintomas como ataxia e inclinação da cabeça, particularmente em animais imunocomprometidos (Figura 3A). Além disso, o comportamento circular pode ser observado em animais com tumores do tronco encefálico, especialmente em cepas NSG ou NOD/SCID. A progressão dos sintomas neurológicos geralmente coincide com a perda gradual de peso. Medidas adequadas pós-cuidados, como fornecer garrafas de água com bicos longos ou oferecer alimentos macios (pellets de comida mole) ou sementes, são essenciais para apoiar o bem-estar dos animais. Ao atingir o ponto final experimental e a subsequente eutanásia humana dos animais, podem tornar-se aparentes alterações potenciais no cérebro, incluindo aumento no local da injeção e/ou presença de áreas hemorrágicas (Figura 3B).
Os gráficos de Kaplan-Meier são comumente empregados para representar os resultados de sobrevivência de modelos animais com tumor cerebral. Eles oferecem uma representação visual da probabilidade de sobrevivência ao longo do tempo após injeção intracraniana ou tratamentos anticancerígenos. Esses gráficos servem como ferramentas cruciais para analisar e apresentar dados de sobrevida em ambientes de pesquisa pré-clínica15,27. Realizamos injeções intracranianas de cultura de células de meduloblastoma D425 em diferentes densidades celulares no cerebelo. Todos os animais injetados por via intracraniana desenvolveram tumores. Nossos resultados indicaram que densidades celulares mais altas, especificamente 50.000 e 100.000 células por camundongo, enxertadas mais rapidamente do que 10.000 células por camundongo (Figura 4). Além disso, injetamos intracranialmente células de glioma de alto grau (HGG) derivadas do paciente no córtex e no tronco encefálico para comparar a sobrevida global e o padrão de crescimento do tumor, bem como as características imuno-histoquímicas, nesses diferentes locais. Independentemente da localização, todos os animais foram injetados com tumores desenvolvidos intracranianamente. A cultura de células HGG foi realizada seguindo o protocolo detalhado nas etapas 1.1 a 1.10. A preparação das células para injeção intracraniana foi realizada conforme descrito nas etapas 2.1 a 2.6, enquanto o procedimento de injeção intracraniana seguiu o método descrito nas etapas 4.1 a 4.1627. Quando injetadas no córtex, as células HGG exibiram uma sobrevida média de aproximadamente 25 dias após a injeção intracraniana (Figura 5A). Os animais foram monitorados conforme descrito nas etapas 5.1 a 5.4. Esses animais não apresentaram sintomas neurológicos, mas apresentaram perda de peso progressiva. Os animais foram sacrificados humanamente ao atingir o ponto final humanitário descrito na etapa 5.5. Os cérebros foram colhidos seguindo o protocolo detalhado nas etapas 6.1 a 6.5 e enviados para análise posterior27. A análise imuno-histoquímica revelou uma grande massa tumoral altamente nucleada com evidência de aumento da vascularização (Figura 5B) e muitas células proliferativas Ki67 (Figura 5C). Quando injetadas no tronco encefálico, as células HGG exibiram uma sobrevida média de aproximadamente 26 dias após a injeção intracraniana (Figura 5D). A análise imuno-histoquímica indicou grande massa tumoral na região do 4º ventrículo/ponte superior, bem como infiltração leptomeníngea no ventrículo lateral (Figura 5E). Outras análises imuno-histoquímicas indicaram muitas células proliferativas no tronco encefálico e outras áreas infiltradas (Figura 5F). Este experimento destaca que injetar as mesmas células tumorais em diferentes locais anatômicos não afeta a taxa de crescimento do tumor, embora algumas diferenças no padrão de crescimento sejam observadas.

Figura 1: Imagens representativas da configuração estereotáxica para injeção intracraniana de células tumorais cerebrais. (A) O aparelho anestésico é tipicamente posicionado próximo ao capuz do BSC, necessitando de administração dupla de anestesia tanto na câmara de indução quanto no aparelho estereotáxico. (B) Estação de lavagem de microsseringas de vidro e suporte estereotáxico; A seringa requer lavagem com solução salina, etanol e, posteriormente, água após cada injeção intracraniana. (C) Configuração estereotáxica dentro do capuz BSC, ilustrando a câmara anestésica, máquina de perfuração, dispositivo estereotáxico, console de coordenadas estereotáxica, pontas de algodão, bisturi, pinça, pipeta e pontas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens representativas da injeção intracraniana sendo realizada em um camundongo imunocomprometido. (A) Animal anestesiado posicionado em um cone anestésico. (B) Incisão na pele seguida de fixação da pele de cada lado com barras auriculares. (C) Microsseringa de vidro posicionada no topo do orifício perfurado para injeção. (D) A pele forma um estilo moicano uma vez colada. Clique aqui para ver uma versão maior desta figura.
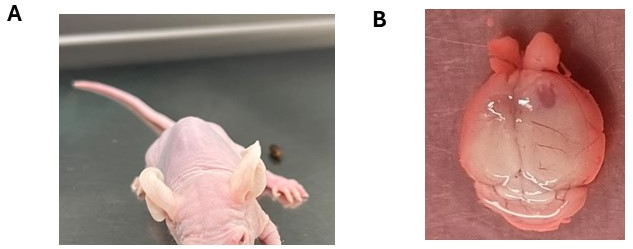
Figura 3: Potenciais sintomas neurológicos observados após o enxerto de células tumorais cerebrais. (A) Animal exibindo uma inclinação da cabeça após injeção intracraniana de células DMG no tronco encefálico. (B) Alargamento do hemisfério cortical direito com o lado da injeção revelando a formação de tumor. O animal foi injetado com células de ependimoma. Clique aqui para ver uma versão maior desta figura.
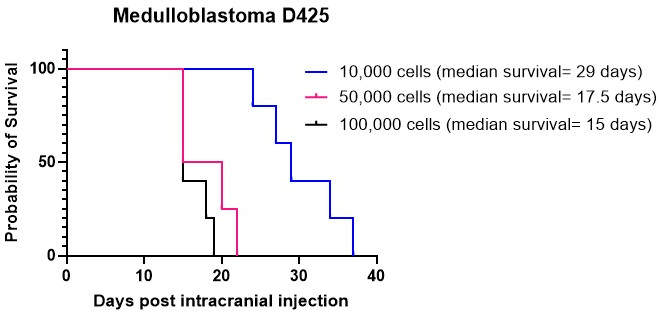
Figura 4: Enxerto da cultura de meduloblastoma D425 em diferentes densidades celulares. As células de meduloblastoma foram injetadas intracranialmente usando equipamento estereotáxico em densidades de 10.000 células em 2 μL de hidrogel ECM, 50.000 células e 100.000 células. Os animais foram monitorados quanto à perda progressiva de peso e foram sacrificados humanamente quando atingiram 20% abaixo do peso mais alto registrado. A sobrevida média para animais injetados com 10.000 células foi de 29 dias, enquanto a sobrevida média para aqueles injetados com densidades celulares mais altas de 50.000 e 100.000 células foi de 17,5 dias e 15 dias, respectivamente. Todos os animais injetados neste estudo desenvolveram tumores com sucesso. Clique aqui para ver uma versão maior desta figura.

Figura 5: Curvas representativas de sobrevida e análise histológica de animais NSG injetados intracranialmente com células HGG no córtex e tronco encefálico. Aproximadamente 100.000 células HGG (passagem 3) foram injetadas em 2 μL de hidrogel ECM usando equipamento estereotáxico. Os animais foram monitorados quanto à perda progressiva de peso e sacrificados humanamente quando atingiram 20% abaixo do peso mais alto registrado. Não foram observados sintomas neurológicos para este subtipo de tumor cerebral. (A) A sobrevida média de animais com células HGG injetadas no córtex é de aproximadamente 25 dias após a injeção (N = 2). (B) A coloração H & E do córtex mostra uma região altamente nucleada com aumento da vascularização, indicada pela presença de glóbulos vermelhos. (C) A área enxertada por tumor no córtex exibe um alto nível de células proliferativas, conforme mostrado pela coloração KI67. (D) A sobrevida média de animais com células HGG injetadas no tronco cerebral é de aproximadamente 26 dias após a injeção (N = 2). Todos os animais injetados neste estudo desenvolveram tumores com sucesso. (E) A coloração H & E do tronco encefálico mostra uma região altamente nucleada com infiltração tumoral observada nas leptomeninges no ventrículo lateral. (F) A área enxertada por tumor no tronco encefálico exibe um alto nível de células proliferativas, conforme mostrado pela coloração KI67. A barra de escala preta nas imagens principais indica 2 mm, enquanto as imagens ampliadas inseridas indicam 20 μm. Clique aqui para ver uma versão maior desta figura.
Tabela Suplementar 1: Formulário de monitoramento utilizado para a inspeção de injeções pós-intracranianas dos animais e potencial tratamento com agentes anticancerígenos. Clique aqui para baixar esta tabela.
Discussão
Embora a técnica de injeção intracraniana detalhada neste estudo forneça um método robusto para estabelecer modelos ortotópicos de xenoenxerto derivado de pacientes (PDX) para tumores cerebrais pediátricos, várias áreas precisam ser melhoradas. Uma abordagem para melhorar a técnica envolve otimizar o processo de preparação de células tumorais. Isso inclui refinar os materiais usados para a implantação das células tumorais. Embora o hidrogel ECM seja considerado o padrão-ouro, a utilização de hidrogéis compostos de componentes que se assemelham mais aos do cérebro ou do tumor ECM pode aumentar a sobrevivência e o enxerto das células BT. Essa abordagem beneficia particularmente os tipos de tumores com períodos de enxerto mais longos, como meduloblastomas e ependimomas. Por exemplo, o colágeno demonstrou desempenhar um papel crítico no crescimento do meduloblastoma do Grupo 3, enquanto a laminina suporta o tipo de meduloblastoma SHH28. Além disso, a rigidez da ECM também pode influenciar o crescimento do tumor. Glioblastomas de alto grau, por exemplo, exibem maior rigidez em seu núcleo em comparação com o tecido cerebral normal, o que pode apoiar o crescimento e a sobrevivência do tumor29. Ao adaptar a composição e a rigidez da ECM para atender aos requisitos específicos de diferentes tipos de tumores, o enxerto e o crescimento dos modelos PDX podem ser significativamente melhorados.
Alguns estudos recentes forneceram informações valiosas sobre o manuseio de amostras de tumores de pacientes e o desenvolvimento de modelos PDX. Tsoli et al. destacaram que o implante direto de tecido DMG normalmente resulta em taxas de enxerto mais altas do que as culturas primárias15. Smith et al. estabeleceram 37 modelos PDX por meio de injeção intracraniana de biópsias de tumores cerebrais ou amostras de autópsia, relatando uma taxa de sucesso geral de 43%, com HGGs demonstrando a maior taxa de enxerto (100%), seguidos por meduloblastomas (45%) e ependimomas (25%). A latência tumoral variou amplamente, de 1 a 11 meses, com tumores mais agressivos enxertando mais rapidamente11. Em contraste, Brabetz et al. relataram uma taxa de sucesso geral mais baixa de 30%, com HGGs exibindo uma taxa de enxerto de 31% e taxas mais baixas para meduloblastomas (37%) e ependimomas (17%)16. Apesar dessas diferenças, os dois últimos estudos conduzidos por Smith et al. e Brabetz et al. confirmaram que os modelos PDX geralmente recapitularam os tumores dos pacientes em níveis imuno-histoquímicos e moleculares, embora pequenas discrepâncias genômicas tenham sido observadas entre as amostras originais do tumor e os modelos estabelecidos. Esses achados ressaltam os desafios no desenvolvimento de modelos PDX representativos e destacam a variabilidade no sucesso do enxerto entre os tipos de tumor11,16.
Uma limitação significativa da abordagem ortotópica é a incapacidade de medir com precisão o tamanho do tumor, a menos que um sistema de imagem seja usado, como a imagem de xenogênio, se as células tumorais forem marcadas com luciferase ou ressonância magnética (MRI). A marcação de células tumorais com luciferase pode fornecer uma solução, permitindo imagens bioluminescentes para confirmar o enxerto e monitorar a progressão do tumor de forma não invasiva. Esse método aumentaria a capacidade de rastrear a resposta ao tratamento dinamicamente, oferecendo uma avaliação mais precisa da eficácia terapêutica17,30. Um método alternativo envolve a utilização da tecnologia de ressonância magnética; no entanto, a detectabilidade dos tumores depende de seu tamanho. Tumores maiores são mais facilmente identificados, o que geralmente ocorre no desfecho experimental, e a detecção também pode variar dependendo do subtipo do tumor, sendo o GBM mais facilmente detectado do que os gliomas difusos27,31. Particularmente para gliomas difusos, a presença de uma barreira hematoencefálica intacta (BHE) leva à falta de realce do contraste. No GBM, no entanto, a vasculatura permeável e a presença de edema podem amplificar o contraste entre o tecido tumoral e o tecido cerebral saudável circundante, potencialmente auxiliando no processo de detecção. Geralmente, agentes contrastantes são necessários para melhorar a detecção 30,31,32. Técnicas alternativas de imagem, como imagem ponderada por difusão (DWI) e recuperação de inversão atenuada por fluido (FLAIR), às vezes são usadas para melhorar a detecção de regiões tumorais sem realce. No entanto, esses métodos também têm suas limitações e nem sempre fornecem um delineamento preciso dos limites do tumor33. A imagem ponderada por transferência de prótons de amida (APTw) é uma técnica de ressonância magnética não invasiva que detecta gliomas difusos rastreando a troca de prótons proteína-água, auxiliando na classificação do tumor. Embora promissora, enfrenta desafios como suscetibilidade a artefatos e ainda não foi adaptada para imagens de pequenos animais, limitando sua aplicação mais ampla34.
Outro aspecto crucial a ser considerado ao utilizar modelos ortotópicos BT PDX para estudos de eficácia de medicamentos é a integridade da BHE nos modelos PDX usados. A permeabilidade do BBB afeta significativamente a administração e a eficácia do medicamento no tratamento de tumores cerebrais. Por exemplo, a manutenção da integridade da BHE em gliomas do tronco encefálico geralmente resulta em baixa penetração do medicamento, limitando a eficácia das terapias sistêmicas17. Por outro lado, nos meduloblastomas do Grupo 3, observou-se que a integridade da BHE é heterogênea na RM, e também foi encontrada com vazamento nos modelos de xenoenxerto derivado do paciente (PDX)35. Portanto, caracterizar o status da BHE - se está intacto ou com vazamento - em cada modelo PDX é essencial para projetar estratégias terapêuticas apropriadas e interpretar com precisão os resultados dos estudos de eficácia de medicamentos.
No geral, o procedimento de injeção intracraniana descrito oferece uma abordagem robusta para estabelecer modelos BT PDX e conduzir estudos de eficácia para agentes terapêuticos. Refinamentos contínuos, juntamente com uma compreensão abrangente desses modelos, aumentarão sua utilidade e facilitarão o desenvolvimento de intervenções terapêuticas para pacientes pediátricos com TB.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem aos pacientes, médicos e pesquisadores da Rede de Hospitais Infantis de Sydney, da Rede de Bancos de Tumores Infantis de Sydney e do Programa Zero Childhood Cancer por fornecerem generosamente as amostras essenciais para o estabelecimento dessa metodologia. O Children's Cancer Institute Australia é afiliado à University of New South Wales Sydney e à Sydney Children's Hospital Network. Este protocolo decorre de esforços de pesquisa apoiados por doações do Conselho Nacional de Saúde e Pesquisa Médica (Synergy Grant # 2019056, Leadership Grant APP2017898 para DZ) e Cancer Institute New South Wales Program Grant (TPG2037 para DZ e MT), bem como o apoio do Levi's Project, The Kids Cancer Project, The Cure Starts Now, DIPG Collaborative, Fundação de Cura do Câncer Cerebral, Fundação Robert Connor Dawes e Fundação Benny Wills.
Materiais
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
Referências
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados