Method Article
Etablissement de modèles de xénogreffes orthotopiques dérivées de patients pour des tumeurs cérébrales à l’aide d’un dispositif stéréotaxique
Dans cet article
Résumé
Le développement de modèles orthotopiques de tumeurs cérébrales pédiatriques nécessite une précision méticuleuse, en utilisant un dispositif stéréotaxique pour implanter les cellules cancéreuses avec précision. La méthodologie présentée ici décrit les étapes de la préparation des cellules tumorales cérébrales, de la réalisation d’injections intracrâniennes et de la mise en œuvre d’un système de surveillance postopératoire pour évaluer la greffe de tumeur cérébrale.
Résumé
Le développement de modèles cliniquement pertinents et fiables pour les tumeurs du système nerveux central (SNC) a été essentiel pour faire progresser le domaine de la neuro-oncologie. L’une des techniques les plus largement utilisées est l’injection intracrânienne orthotopique, une méthode qui permet d’étudier la croissance, l’invasion et la dissémination des tumeurs dans un cadre contrôlé. Cette technique consiste à transplanter des cellules tumorales d’une région spécifique du patient dans le site anatomique correspondant chez un animal. Ce faisant, ces modèles de tumeurs cérébrales orthotopiques offrent un avantage unique, car ils reproduisent plus précisément le comportement biologique du cancer et ses interactions avec l’environnement cérébral observées chez les patients humains. Cela les rend particulièrement précieux pour les tests thérapeutiques précliniques, où une ressemblance étroite avec le scénario clinique est essentielle pour évaluer les traitements potentiels. Ce protocole partage les expériences dans le développement de modèles de xénogreffes dérivées de patients (PDX) pour les tumeurs cérébrales pédiatriques, y compris le gliome diffus de la ligne médiane (DMG), le glioblastome (GBM), le médulloblastome et l’épendymome. Cette méthode définit la procédure d’exécution d’injections stéréotaxiques intracrâniennes chez la souris, assurant le ciblage correct du site d’injection dans le cerveau. De plus, nous décrivons le système de surveillance post-opératoire utilisé pour détecter les signes de réussite de la greffe tumorale. Après l’injection de la tumeur, un système de surveillance rigoureux est mis en œuvre pour observer les animaux à la recherche de tout signe de déficience neurologique, de changements de comportement et/ou de perte de poids, qui sont des indicateurs courants de la progression tumorale. Ce système permet une intervention rapide et fournit des données critiques concernant la dynamique de croissance de la tumeur. En affinant ces modèles et protocoles, nous visons à améliorer la fiabilité et le potentiel translationnel des études précliniques, contribuant ainsi au développement de traitements plus efficaces pour les tumeurs pédiatriques du SNC.
Introduction
Les tumeurs du système nerveux central (SNC) pédiatriques sont les tumeurs solides les plus courantes chez les enfants, représentant environ 20 % à 25 % des tumeurs pédiatriques primaires, avec des caractéristiques distinctes des tumeurs adultes en termes d’incidence et de réponse au traitement 1,2. Les gliomes de haut grade (HGG), tels que le glioblastome (GBM) et le gliome pontique intrinsèque diffus/gliome diffus de la ligne médiane (DIPG/DMG), sont particulièrement agressifs, avec des pronostics sombres, et malgré les progrès dans les modalités de traitement, les taux de survie restent faibles 3,4,5. Les médulloblastomes, qui représentent près de 20 % des tumeurs pédiatriques du SNC, ont atteint un taux de survie élevé à 5 ans avec un traitement standard, mais certains sous-types posent des défis, en particulier dans les scénarios de rechute 6,7. Les épendymomes, qui représentent environ 10 % des tumeurs pédiatriques du SNC, présentent des pronostics variés en fonction des caractéristiques moléculaires et de la localisation de la tumeur, la récidive posant des défis cliniques importants 8,9. La compréhension du paysage moléculaire et le développement de modèles de tumeurs cérébrales orthotopiques (BT) sont prometteurs pour le développement de thérapies efficaces visant à améliorer les résultats pour les patients pédiatriques.
Le développement de modèles de BT cliniquement pertinents est essentiel pour faire progresser la recherche en neuro-oncologie et la découverte thérapeutique. Les injections orthotopiques à l’aide d’un dispositif stéréotaxique sont essentielles dans cette approche, car elles permettent de placer avec précision les cellules tumorales dans le cerveau, imitant étroitement l’environnement naturel des tumeurs cérébrales10. Cette méthode améliore la fiabilité et la reproductibilité des modèles tumoraux, facilitant des études plus précises de la biologie tumorale et des caractéristiques clés telles que l’invasion et l’angiogenèse, ainsi que l’évaluation des interventions thérapeutiques11. La capacité du dispositif stéréotaxique à contrôler l’emplacement exact et la profondeur des injections de cellules garantit que les cellules tumorales sont constamment placées dans les régions cérébrales prévues, améliorant ainsi la validité des résultats expérimentaux10. Les modèles sous-cutanés offrent une option plus accessible et plus rentable pour le dépistage initial d’agents thérapeutiques. Dans ces modèles, les cellules tumorales sont implantées sous la peau, ce qui permet de surveiller facilement la croissance tumorale et les réponses au traitement12. Bien qu’ils n’aient pas la capacité de reproduire le microenvironnement complexe du cerveau, les modèles sous-cutanés restent très précieux pour le criblage de médicaments à haut débit et les évaluations préliminaires de l’efficacité12,13.
De nombreuses études ont démontré le développement réussi de modèles de xénogreffes orthotopiques dérivées de patients (PDX) à partir d’échantillons de tumeurs cérébrales, y compris l’implantation directe de tissus à partir d’échantillons d’autopsie ou de biopsie et de cultures de tumeurs cérébrales primaires 11,14,15. Cependant, il est crucial de reconnaître que l’injection intracrânienne de tissus ou de cellules tumorales dissociés de la tumeur ne garantit pas toujours la greffe, les raisons de l’échec n’étant pas entièrement comprises. Il est intéressant de noter que les échantillons de biopsie HGG ont tendance à présenter un taux de réussite plus élevé par rapport aux autres sous-types de tumeurs cérébrales. Par exemple, He et al. ont démontré un taux de réussite de 56 % pour les modèles orthotopiques HGG, tandis que l’étude de Brabetz et al. a rapporté des taux de greffe plus faibles, tels que 43 % et 30 %, respectivement, pour d’autres échantillons de tumeurs cérébrales pédiatriques comme l’épendymome et le médulloblastome 11,14,16. Notamment, les modèles PDX de tumeurs cérébrales présentent une large gamme de périodes de latence, variant de 1 mois à 11 mois, les greffes ultérieures montrant une utilité préclinique diminuée. Malgré leur capacité à récapituler la maladie au niveau moléculaire, certaines disparités génomiques entre les biopsies et les modèles établis ont été observées14,16.
Les modèles PDX sont des outils indispensables dans la recherche de nouvelles stratégies thérapeutiques contre les BT pédiatriques. Ils sont considérés comme l’étalon-or pour la réalisation d’études d’efficacité des médicaments, car les modèles récapitulent fidèlement la maladie humaine en termes de croissance tumorale, de symptômes et de pharmacocinétique des médicaments en raison de la présence de la barrière hémato-encéphalique (BHE). La recherche a démontré dans le domaine du gliome pédiatrique du tronc cérébral que le maintien de l’intégrité de la BHE et l’absence de pénétration du médicament sont une caractéristique qui entraîne une diminution de l’efficacité thérapeutique de ces tumeurs 17,18,19. Cependant, l’efficacité peut être observée dans certains traitements qui démontrent une pénétration adéquate des médicaments, tels que les inhibiteurs épigénétiques et métaboliques17,20.
Cette étude présente une méthode pour effectuer des injections intracrâniennes de cellules tumorales cérébrales chez des animaux immunodéprimés, visant à évaluer la greffe soit pour le développement de PDX et/ou l’évaluation de l’efficacité thérapeutique d’un médicament. Des outils complets pour surveiller la progression tumorale jusqu’à ce que le point expérimental éthique soit atteint sont également fournis.
Protocole
Le protocole décrit ci-dessous suit les directives éthiques pour les soins et l’utilisation des animaux telles que décrites par l’Université de Nouvelle-Galles du Sud, et toutes les procédures ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux. Le bien-être des animaux a été priorisé, et tous les efforts ont été déployés pour minimiser la souffrance des animaux utilisés lors de la procédure d’injection intracrânienne.
1. Culture pour l’expansion des cultures de tumeurs cérébrales formant la neurosphère
REMARQUE : Les exigences spécifiques peuvent varier en fonction des cultures cérébrales utilisées. Les étapes suivantes décrivent un protocole général de culture des cellules tumorales cérébrales primaires en tant que neurosphères. Les cultures de tumeurs cérébrales peuvent être obtenues auprès de fournisseurs commerciaux ou établies comme cultures primaires à partir de biopsies ou d’autopsies de tumeurs cérébrales de patients. La procédure d’établissement de cultures primaires à partir d’échantillons de biopsie ou d’autopsie de patients est décrite dans la littérature publiée15,21.
- Placer le flacon cryoconservé dans un bain-marie à 37 °C jusqu’à ce que le contenu soit décongelé. Essuyez les surfaces externes du flacon avec de l’éthanol à 70% pour assurer la stérilité.
- Préparer le milieu Neurosphere pour les cellules tumorales cérébrales primaires tel que décrit dans Mayoh et coll.21. Dans une enceinte de sécurité biologique (ESB), utiliser une pipette stérile de 1 mL pour transférer les cellules décongelées dans un tube conique stérile de 15 mL contenant 5 mL de milieu neurosphère préchauffé.
- Centrifuger le tube conique à 300 x g pendant 3 minutes pour granuler les cellules. Jeter soigneusement le plus possible de surnageant à l’aide d’une pipette de 10 ml.
- Remettre en suspension la pastille de cellules dans 10 mL ou 25 mL de milieu neurosphere. Plaquer la suspension cellulaire dans une fiole T25 ou T75, selon le nombre de cellules prévu de la cryoconservation. Habituellement, les cellules de départ d’une densité de 5 x 105 cellules sont placées dans une fiole T25.
- Placer la fiole dans un incubateur réglé à 37 °C avec 5% de CO2. Remplacez les médias par de nouveaux médias 1 ou 2 fois par semaine. Vous pouvez également compléter les facteurs de croissance et la vitamine B27 au besoin, en fonction du taux de croissance des cellules.
- Une fois que les neurosphères se sont formées dans un flacon T25, elles peuvent être dilatées dans des flacons T75. Transférer le contenu du flacon T25 à l’aide d’une pipette de 10 mL dans un tube conique de 15 mL. Observez les neurosphères au microscope optique et, une fois qu’elles deviennent suffisamment grandes (environ 500 μm), elles peuvent également être visibles à l’œil nu.
- Centrifuger le tube à 300 x g pendant 3 à 5 min. Aspirer le milieu au-dessus de la pastille cellulaire, en laissant environ 1 mL dans le tube.
- Pipeter doucement les cellules de haut en bas 12 à 15 fois avec une pipette de 1 mL pour dissocier la pastille cellulaire. Utiliser une passoire à cellules (40 μm) pour dissocier les neurosphères en un mélange unicellulaire.
- Placer la passoire sur le dessus d’un tube conique de 50 mL et ajouter les sphéroïdes dissociés avec une pipette de 10 mL sur la passoire. La plupart des cellules individuelles feront passer le treillis dans le tube et les matériaux agglutinés resteront sur le maillage.
- Comptez les cellules à l’aide d’une chambre de comptage cellulaire. Évaluer la viabilité cellulaire en mélangeant une quantité égale de suspension cellulaire (p. ex., 5 μL) avec du bleu de trypan (5 μL). Les cellules mortes apparaîtront bleues au microscope optique, tandis que les cellules vivantes ne seront pas colorées.
- Calculer la densité cellulaire comme suit :
Concentration cellulaire = Nombre moyen de cellules par grille × Facteur de dilution/Volume d’une grille (mL). Le volume de la grille d’une chambre de comptage cellulaire standard est de 0,0001 mL. - Pour faire passer les cellules, remettre en suspension 1 x 106 cellules dans 25 mL de milieu frais et chauffé dans une fiole T75. Une fois les cellules placées dans un flacon T75, les incuber à 37 °C dans un incubateur humidifié à 5% de CO2 jusqu’à ce que les neurosphères se développent.
- Pour cryoconserver les cellules tumorales cérébrales, resuspendre 1 x 106 cellules dans 1 mL de solution de cryoconservation et les placer pendant la nuit dans un contenant de congélation à vitesse contrôlée et conserver à -80 °C. Placer les stocks cryoconservés dans un réservoir d’azote liquide à -180 °C pour un entreposage à long terme.
REMARQUE : Le milieu de cryoconservation comprend 90% de sérum de veau fœtal et 10% de diméthylsulfoxyde (DMSO).
2. Préparation des cellules tumorales cérébrales pour l’injection intracrânienne
REMARQUE : Bien que le protocole suivant décrit la préparation de cellules cultivées à partir de cultures établies ou à court terme pour l’injection intracrânienne, il peut également être adapté à d’autres types de cellules, y compris les tissus fraîchement dissociés des tumeurs cérébrales humaines22,23.
- Dans une enceinte de biosécurité, transférez soigneusement les cellules et le milieu de culture du flacon de culture tissulaire à l’aide d’une pipette sérologique dans un tube conique de 50 ml.
- Centrifuger le tube conique à 300 x g jusqu’à 5 min à température ambiante. Aspirez à l’aide d’une pipette de 25 ml le milieu au-dessus de la pastille, en laissant environ 0,5 ml dans le tube.
- Pipetez doucement les cellules de haut en bas 10 fois avec une pipette de 1 mL pour dissocier la pastille de cellule. Comptez les cellules à l’aide du bleu trypan et d’un hémocytomètre.
- Une fois que le nombre de cellules souhaité est aliquote dans un tube frais, laver 2 fois avec du PBS en remettant les cellules en suspension et en les granulant à 300 x g pendant 5 min à 4 °C.
REMARQUE : le nombre de cellules peut être déterminé comme décrit. Par exemple, si 10 animaux doivent être injectés à la densité cellulaire de 200 000 cellules, alors le nombre minimum de cellules nécessaires est de 2 x 106. - Lors du lavage final, retirez autant de PBS que possible. Placez délicatement la pastille cellulaire et l’aliquote d’hydrogel à matrice extracellulaire (MEC) de 50 μL sur de la glace.
REMARQUE : L’hydrogel ECM peut être pré-aliquote en portions de 50 μL sur de la glace à l’aide de pipettes refroidies à 4 °C et stocké à -80 °C jusqu’à ce que nécessaire. L’hydrogel ECM peut être temporairement conservé sur de la glace pour décongeler lentement en vue d’une utilisation expérimentale ultérieure. - Mélangez la pastille cellulaire avec l’hydrogel ECM pour injection, dans le but de terminer cette étape le plus rapidement possible avant de commencer les injections intracrâniennes. En standard, utilisez 2 μL de la suspension contenant 200 000 cellules en suspension dans de l’hydrogel ECM.
REMARQUE : Si les injections intracrâniennes durent plus de 2-3 heures, un nouveau stock de cellules doit être préparé, car une incubation prolongée sur de la glace peut réduire la viabilité des cellules. Il est possible d’injecter par voie intracrânienne jusqu’à 1 000 000 de cellules et dans des volumes allant jusqu’à 10 μL ; cependant, cela nécessitera que les cellules soient remises en suspension dans de l’hydrogel PBS plutôt que dans de l’ECM et ajoutées à un taux d’injection très lent.
3. Mise en place d’équipements stéréotaxiques et anesthésiques
REMARQUE : La procédure énumérée ci-dessous peut varier légèrement en fonction du fabricant de l’équipement stéréotaxique et du type d’anesthésie préféré.
- Commencez le BSC en désinfectant d’abord sa surface avec un détergent polysorbate 20 et en le laissant reposer pendant 10 min. Ensuite, essuyez la surface avec de l’éthanol à 80 %. Avant de le placer dans la hotte BSC, essuyez chaque pièce d’équipement avec de l’éthanol à 80 % (évitez de mouiller les entrées électriques).
- Positionnez la plaque de base à l’intérieur du capot BSC conformément à la figure 1, avec le cône de nez positionné sur le côté droit (pour les utilisateurs droitiers). Assurez-vous que les manipulateurs XYZ sont déjà fixés à la plaque de base et sécurisés.
- Connectez la console d’affichage numérique à l’entrée à l’arrière de la plaque de base et branchez son câble d’alimentation sur le bloc d’alimentation fourni à l’intérieur du capot BSC (voir Figure 1). Cette console enregistre les coordonnées des mouvements du manipulateur XYZ.
- Fixez la cartouche du filtre à charbon (pour la sortie de l’anesthésique) et l’entrée anesthésique aux deux vannes sur le nez amovible. Faites glisser la pièce du cône avant sur la section de montage et serrez la vis sur l’appareil stéréotaxique.
- Fixez les barres d’oreille à leurs supports respectifs de chaque côté de la section de montage, en les fixant en place en serrant les vis fixées aux supports. Les barres d’oreille peuvent être recouvertes de compresses de gaze ou de ruban isolant.
- Introduisez le lit chirurgical dans l’appareil, en ajustant sa hauteur pour l’aligner avec les barres d’oreille, qui maintiennent l’animal en position. Enveloppez le lit chirurgical avec un tampon de jauge pour garder l’animal au chaud.
- Connectez le coussin chauffant à l’alimentation électrique et placez-le sous l’animal pour maintenir la chaleur pendant la procédure d’anesthésie.
- À l’intérieur de la cagoule BSC, disposez des embouts en coton stériles, des pointes de pipette de 20 μL, une pommade pour les yeux, des lingettes isopropanol emballées individuellement, de la colle chirurgicale et une pipette de 20 μL. Humidifiez un tampon de gaze avec de l’éthanol à 80 % et posez une pince stérile et un scalpel dessus.
- Nettoyez la microseringue en verre en la rinçant 5 fois dans de l’éthanol froid à 80 %, puis dans une solution saline froide à 0,9 %.
- Pour le perçage, connectez le moteur de la perceuse à l’alimentation électrique et montez la perceuse sur le manipulateur XYZ, en assurant un ajustement sûr en la vissant fermement.
- Remplacez le composant de la perceuse par le porte-microseringue en verre à des fins d’injection de cellules. Retirez la perceuse en desserrant la vis du manipulateur XYZ et en la remplaçant par le porte-seringue. Assurez-vous que la vis est serrée avant d’aligner la microseringue en verre avec le trou précédemment percé.
- Après avoir utilisé l’appareil stéréotaxique, démontez tous les composants et désinfectez-les avec de l’éthanol à 80 % avant de les ranger dans une boîte de rangement propre ou une armoire sans poussière. Jetez tous les objets tranchants de manière sécuritaire et appropriée dans un contenant désigné pour objets tranchants.
4. Injection intracrânienne
REMARQUE : Les injections intracrâniennes peuvent être effectuées chez les souris mâles et femelles, bien que les souris femelles soient généralement préférées, car elles sont moins sujettes aux complications de plaie causées par l’agression entre mâles. La procédure est généralement effectuée chez des souris âgées de 7 à 10 semaines, ce qui laisse suffisamment de temps pour le développement de la tumeur. En règle générale, les animaux sont répartis aléatoirement en groupes de 4 à 6 par cage. Les souches immunodéprimées telles que BALB/c Nude, NOD-SCID et NSG sont couramment utilisées pour le développement de xénogreffes dérivées de patients (PDX), car leur statut immunodéficient favorise la greffe et la croissancetumorales 24. Bien que ce protocole spécifie l’utilisation de l’isoflurane pour l’induction de l’anesthésie, des anesthésiques alternatifs tels que la kétamine et la xylazine peuvent également être utilisés25. Si l’isoflurane n’est pas utilisé, les étapes impliquant la chambre d’anesthésie et l’équipement connexe peuvent être omises de la procédure.
- Peser et surveiller le bien-être général des animaux avant la procédure intracrânienne. Administrer un analgésique aux animaux une cage à la fois (p. ex., buprénorphine 0,05 mg/kg, par voie intrapéritonéale) pendant une période allant jusqu’à 1 heure avant de commencer l’injection intracrânienne.
- Installez l’équipement d’anesthésie selon les directives fournies avec l’instrument. Avant de commencer la procédure, assurez-vous que le vaporisateur est au moins à moitié plein. Assurez-vous que l’alimentation en oxygène est ouverte.
- Si les animaux ont de la fourrure, elle peut être retirée la veille de la procédure intracrânienne ou simultanément. Retirez la fourrure du site chirurgical au niveau du dos ou du crâne de la souris avec une tondeuse électrique ou un rasoir.
- Transférez l’animal dans la chambre d’induction de l’anesthésie. Assurez-vous que le débitmètre de l’appareil d’anesthésie est réglé sur un débit de 1 L/min et que le régulateur d’oxygène est compris entre 40 et 50 psi. Assurez-vous que l’anesthésie moyenne est maintenue en vérifiant que les muscles sont détendus et que les réflexes sont absents.
- Surveillez la réponse de l’animal aux stimuli et observez le mouvement de la paroi thoracique pour assurer une respiration régulière. Si les injections intracrâniennes dépassent 10 minutes, surveiller la température à l’aide d’une sonde rectale et d’un système de surveillance de la température et suivre le pouls à l’aide d’un oxymètre de pouls
- Montez l’animal sur le dispositif stéréotaxique, en vous assurant que les dents de devant sont fixées dans la barre d’incision et que le cône nasal a maintenu l’animal en place.
- Désinfectez la tête de la souris à l’aide d’un coton-tige imbibé d’iode puis d’une lingette isopropanol. Appliquez une pommade pour les yeux cornéens sur les deux yeux pour éviter le dessèchement pendant la chirurgie.
- Commencez l’incision à la base du cervelet et étendez-la à travers le crâne jusqu’au point médian, en faisant une petite incision d’environ 1 cm de long le long de la face supérieure du crâne.
- Serrez la peau entre les oreilles pour exposer le crâne et fixez la tête en resserrant les barres d’oreille. Nettoyez la surface du crâne et séchez-la avec un coton-tige.
- Fixez la perceuse sur le cadre stéréotaxique et localisez le bregma (ou structure lambdoïde) à l’aide de la perceuse.
REMARQUE : Des coordonnées stéréotaxiques spécifiques sont sélectionnées en fonction de la région anatomique requise pour l’étude de la greffe. Ces coordonnées précises peuvent provenir de la littérature publiée ou être déterminées à l’aide de ressources telles que l’atlas Mouse Brain in Stereotaxic Coordinates26 , garantissant un ciblage précis pour une implantation réussie. - Une fois les coordonnées établies, utilisez une perceuse pour créer soigneusement un petit trou de bavure dans l’os à l’endroit désigné du gliome diffus de la ligne médiane (DMG) : X = +0,5, Y = -5,5, Z = -3,1 à partir du bregma ; Tumeur cérébrale supratentorielle (GBM ou épendymome) : X = +1,5, Y = +1, Z = -3 du bregma ; Tumeur cérébrale infratentorielle (médulloblastome, épendymome) : X = +2, Y = - 2, Z = -2 à partir de la structure lambdoïde.
- Remettez les cellules en suspension plusieurs fois à l’aide d’une pipette tout en évitant les bulles d’air. Prélevez 2 μL du mélange cellulaire dans une micro-seringue en verre froid prélavé. Fixez la seringue au cadre stéréotaxique et ajustez l’aiguille à l’extrémité du crâne.
- Injecter les cellules dans les 30 s dans la région percée, en séchant toute suspension de cellules refluxées pendant l’injection.
REMARQUE : Étant donné que les cellules sont en suspension dans l’hydrogel ECM, l’injection doit se produire suffisamment rapidement pour que la suspension cellulaire ne se solidifie pas dans la seringue. Des densités cellulaires variables peuvent être utilisées pour évaluer différents taux de greffe, des densités cellulaires plus élevées conduisant généralement à une greffe tumorale plus rapide. - Laissez la seringue en place pendant 1 min pour éviter le reflux et laissez l’hydrogel ECM se déposer. Retirez la seringue et essuyez la plaie avec une lingette isopropanol. Utilisez de la colle pour la peau ou des pinces pour sceller l’incision si nécessaire.
- Placez l’animal en position couchée dans une cage de récupération propre avec une lampe chauffante ou sur un coussin chauffant pour le garder au chaud jusqu’à ce qu’il se rétablisse. Surveillez l’animal en permanence jusqu’à ce qu’il commence à bouger tout seul et fréquemment par la suite jusqu’à ce qu’il montre un comportement normal.
- S’il s’avère qu’un animal a une plaie précédemment scellée rouverte pendant la convalescence, anesthésie à nouveau l’animal, nettoie la plaie avec une lingette à l’isopropanol pour enlever toute colle restante, puis refixe avec des agrafes.
5. Suivi post-chirurgical de la greffe
- Après l’injection intracrânienne, commencez à surveiller les souris 5 jours par semaine (ou plus si nécessaire). Fournir des soins postopératoires, tels que des graines ou de la nourriture pâteuse, pendant les deux premières semaines après l’injection intracrânienne. Surveillez attentivement les animaux pour détecter toute ouverture potentielle de la plaie.
REMARQUE : Si les animaux femelles ont leurs blessures coupées, ils restent dans le bac à litière, car ils montrent rarement de l’agressivité. Pour les animaux mâles, nous fournissons deux igloos dans la cage ainsi qu’un enrichissement supplémentaire pour aider à réduire l’agressivité. Dans les rares cas où une agression se produit et conduit à la réouverture des plaies, les plaies sont resécurisées avec des agrafes et l’agresseur est retiré du groupe et logé séparément. - Enregistrez les paramètres généraux de bien-être tels que la perte de poids, le niveau d’activité, la posture, les signes de déshydratation et l’état de la fourrure sur la feuille de surveillance.
- Noter sur la feuille de surveillance les symptômes neurologiques intermittents, légers ou sévères tels que l’inclinaison de la tête, l’ataxie et/ou le comportement circulaire.
- Identifiez les symptômes neurologiques comme suit :
- Inclinaison de la tête : Observé 1 à 2 fois au cours d’une inspection de 5 minutes, bien-être général satisfaisant. Ataxie : observée 1 à 2 fois au cours d’une inspection de 5 minutes ; bien-être général satisfaisant. Cercles : Observé 1 à 2 fois au cours d’une inspection de 5 minutes ; bien-être général satisfaisant. Comportement : Les souris ont un comportement normal, capables d’atteindre la nourriture / l’eau et de grimper.
- Observez et catégorisez les symptômes suivants comme des symptômes bénins : Inclinaison de la tête : Régulièrement affiché lors d’une inspection de 5 minutes, bien-être général satisfaisant. Ataxie : Régulièrement affichée lors d’un contrôle de 5 min, bien-être général satisfaisant. Cercles : Régulièrement affiché lors d’une inspection de 5 min, bien-être général satisfaisant. Comportement : Les souris peuvent avoir un pelage ébouriffé ou une peau sèche, mais peuvent toujours présenter un comportement normal, se nourrir et grimper.
- Observez et catégorisez les symptômes suivants comme des symptômes graves : Inclinaison de la tête : Affichage continu pendant l’inspection, inclinaison de près de 90°, pelage ébouriffé, moins actif. Ataxie : Affichage continu lors de l’inspection, mouvements d’ivresse, pelage ébouriffé, moins actif. Cercle : Affiché en permanence pendant l’inspection, pelage à volants, moins actif. Comportement : Les souris peuvent avoir un pelage très ébouriffé ou une peau sèche. Ils peuvent présenter une perte de poids de plus de 15 %. Fournissez aux animaux des graines ou de la nourriture pâteuse à ce stade.
- Établissez le critère d’évaluation humain pour les souris lorsqu’elles présentent l’un des signes cliniques suivants indiquant une croissance tumorale qui affecte leur bien-être : perte de poids de 20 % ou plus par rapport à leur poids initial, inclinaison sévère de la tête, ataxie sévère, cercles sévères, léthargie ou respiration laborieuse. À ce stade, euthanasiez les souris sans cruauté en utilisant l’asphyxie au CO2 .
6. Prélèvement de cerveaux
- S’assurer que l’animal est euthanasié sans cruauté par asphyxie au CO2 ou par luxation cervicale.
- Faites une incision médiane de 2 cm le long du cuir chevelu à l’aide de ciseaux ou d’un scalpel. Séparez et retirez soigneusement la peau pour exposer le crâne.
- À l’aide de ciseaux fins ou d’un scalpel, faites une incision soigneuse de 2 cm le long de la ligne médiane du crâne. Ouvrez doucement le crâne à l’aide d’une pince, en partant de l’arrière de la tête vers le nez.
- Continuez à couper le long des côtés du crâne, en veillant à ce qu’aucun dommage ne soit causé au tissu cérébral en dessous. Une fois le crâne complètement ouvert, détachez soigneusement le cerveau des nerfs crâniens et des vaisseaux sanguins à l’aide de pinces et de ciseaux.
- Soulevez doucement le cerveau de la cavité crânienne, en commençant par l’arrière et en avançant. Stocker le cerveau dans des conditions appropriées en fonction des exigences des procédures expérimentales ultérieures, telles que la congélation instantanée ou la fixation. L’analyse immunohistochimique du cerveau peut varier d’un laboratoire à l’autre. Un flux de travail typique pour le marqueur cellulaire prolifératif KI67 est décrit dans la littérature publiée20.
Résultats
Les injections orthotopiques à l’aide d’un dispositif stéréotaxique sont devenues essentielles pour développer des modèles de tumeurs cérébrales. Cette technique permet de placer avec précision et reproductibilité les cellules tumorales, ce qui est crucial pour générer des données cohérentes et fiables dans la recherche en neuro-oncologie. La mise en œuvre réussie des injections orthotopiques repose en grande partie sur la configuration précise de l’équipement stéréotaxique, qui comprend généralement un cadre stéréotaxique, un micromanipulateur numérique pour des mouvements précis, une seringue d’injection et un système d’anesthésie pour immobiliser l’animal (Figure 1A,B). L’utilisation d’une microseringue en verre permet l’injection intracrânienne de petits volumes, généralement entre 2 et 5 μL. Un bon entretien et un lavage fréquent sont essentiels pour prévenir l’accumulation de matière biologique, qui peut bloquer l’injection (Figure 1C).
La procédure d’injection intracrânienne de cellules tumorales cérébrales à l’aide d’un équipement stéréotaxique chez la souris comporte plusieurs étapes clés. Tout d’abord, la souris est anesthésiée pour rester immobile et confortable tout au long de la procédure. Les indices typiques indiquant que l’animal est anesthésié comprennent l’absence de mouvement et de réflexes lors du pincement des orteils, ainsi que la présence d’un schéma respiratoire régulier. Ensuite, la souris est placée dans un cadre stéréotaxique, fixant sa tête dans une position fixe (Figure 2A). À l’aide de points de repère sur le crâne, tels que bregma et lambda, les coordonnées précises de l’injection sont déterminées. Une petite incision est pratiquée dans le cuir chevelu et un trou de bavure est percé à travers le crâne aux coordonnées choisies (figure 2B). Une aiguille de micro-injection attachée au bras stéréotaxique est insérée à travers le trou de la fraise pour délivrer les cellules tumorales dans la région cérébrale souhaitée (cortex, cervelet ou tronc cérébral ; Figure 2C). Une surveillance minutieuse et un réglage de la position de l’aiguille garantissent un ciblage précis. Après l’injection, l’aiguille est retirée lentement et l’incision est fermée (Figure 2D). La plaie scellée devrait guérir dans les deux semaines suivant l’injection intracrânienne.
Après une injection intracrânienne, les animaux nécessitent une surveillance attentive pour leur bien-être général et le développement de symptômes neurologiques, qui indiquent souvent une progression tumorale (tableau supplémentaire 1). En règle générale, les animaux peuvent subir une légère perte de poids au cours de la 1ère semaine après l’injection (jusqu’à 10 % de leur poids le plus élevé), qui se stabilise généralement une fois que les sites d’injection sont complètement scellés à la fin de la 2esemaine. Généralement, les animaux présentent une augmentation constante du poids et maintiennent une bonne santé générale jusqu’à ce que la progression de la tumeur se produise. La manifestation des symptômes neurologiques varie en fonction de facteurs tels que le type de tumeur cérébrale, le site d’injection et la souche animale. Par exemple, les gliomes corticaux ou les épendymomes peuvent présenter une perte de poids progressive et une hypertrophie potentielle du cerveau antérieur, tandis que les gliomes et les médulloblastomes du tronc cérébral peuvent présenter des symptômes tels que l’ataxie et l’inclinaison de la tête, en particulier chez les animaux immunodéprimés (Figure 3A). De plus, un comportement de cercle peut être observé chez les animaux atteints de tumeurs du tronc cérébral, en particulier dans les souches NSG ou NOD/SCID. La progression des symptômes neurologiques coïncide souvent avec une perte de poids progressive. Des mesures post-soins appropriées, telles que fournir des bouteilles d’eau avec de longues buses ou offrir de la nourriture molle (granulés de nourriture pâteuse) ou des graines, sont essentielles pour favoriser le bien-être des animaux. Lorsque le point final expérimental est atteint et que les animaux sont euthanasiés sans cruauté, des altérations potentielles du cerveau peuvent apparaître, notamment une hypertrophie au point d’injection et/ou la présence de zones hémorragiques (figure 3B).
Les graphiques de Kaplan-Meier sont couramment utilisés pour décrire les résultats de survie des modèles animaux de tumeurs cérébrales. Ils offrent une représentation visuelle de la probabilité de survie dans le temps après une injection intracrânienne ou des traitements anticancéreux. Ces graphiques constituent des outils cruciaux pour l’analyse et la présentation des données de survie dans les contextes de recherche préclinique15,27. Nous avons effectué des injections intracrâniennes de culture cellulaire de médulloblastome D425 à différentes densités cellulaires dans le cervelet. Tous les animaux injectés par voie intracrânienne ont développé des tumeurs. Nos résultats ont indiqué que des densités cellulaires plus élevées, en particulier 50 000 et 100 000 cellules par souris, se greffaient plus rapidement que 10 000 cellules par souris (Figure 4). De plus, nous avons injecté par voie intracrânienne des cellules de gliome de haut grade (HGG) dérivées de patients dans le cortex et le tronc cérébral pour comparer la survie globale et le modèle de croissance tumorale, ainsi que les caractéristiques immunohistochimiques, dans ces différents endroits. Quel que soit l’endroit, tous les animaux ont reçu des injections avec des tumeurs développées par voie intracrânienne. La culture des cellules HGG a été réalisée selon le protocole détaillé aux étapes 1.1 à 1.10. La préparation des cellules pour l’injection intracrânienne a été effectuée comme décrit aux étapes 2.1 à 2.6, tandis que la procédure d’injection intracrânienne a respecté la méthode décrite aux étapes 4.1 à 4.1627. Lorsqu’elles sont injectées dans le cortex, les cellules HGG présentent une survie médiane d’environ 25 jours après l’injection intracrânienne (Figure 5A). Les animaux ont été surveillés conformément aux étapes 5.1 à 5.4. Ces animaux ne présentaient aucun symptôme neurologique, mais une perte de poids progressive. Les animaux ont été euthanasiés sans cruauté lorsqu’ils ont atteint le critère d’évaluation sans cruauté décrit à l’étape 5.5. Les cerveaux ont été prélevés selon le protocole décrit aux étapes 6.1 à 6.5 et envoyés pour une analyse plus approfondie27. L’analyse immunohistochimique a révélé une masse tumorale importante et fortement nucléée avec des signes de vascularisation accrue (Figure 5B) et de nombreuses cellules Ki67 prolifératives (Figure 5C). Lorsqu’elles sont injectées dans le tronc cérébral, les cellules HGG ont affiché une survie médiane d’environ 26 jours après l’injection intracrânienne (Figure 5D). L’analyse immunohistochimique a indiqué une masse tumorale importante dans la région du 4e ventricule/pont supérieur, ainsi qu’une infiltration leptoméningée dans le ventricule latéral (Figure 5E). Une analyse immunohistochimique plus poussée a révélé la présence de nombreuses cellules prolifératives dans le tronc cérébral et d’autres zones infiltrées (figure 5F). Cette expérience met en évidence que l’injection des mêmes cellules tumorales dans différents emplacements anatomiques n’affecte pas le taux de croissance tumorale, bien que certaines différences dans le modèle de croissance soient observées.

Figure 1 : Images représentatives de la configuration stéréotaxique pour l’injection intracrânienne de cellules tumorales cérébrales. (A) L’appareil anesthésique est généralement positionné à côté de la hotte BSC, nécessitant une double administration d’anesthésie à la fois à la chambre d’induction et à l’appareil stéréotaxique. (B) Station de lavage de microseringues en verre et support stéréotaxique ; La seringue doit être rincée avec du sérum physiologique, de l’éthanol et ensuite de l’eau après chaque injection intracrânienne. (C) Configuration stéréotaxique à l’intérieur de la hotte BSC, illustrant la chambre d’anesthésie, la machine de forage, le dispositif stéréotaxique, la console de coordonnées stéréotaxiques, les pointes en coton, le scalpel, la pince à épiler, la pipette et les pointes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images représentatives d’une injection intracrânienne réalisée sur une souris immunodéprimée. (A) Animal anesthésié positionné dans un cône anesthésique. (B) Incision cutanée suivie d’une fixation de la peau de chaque côté à l’aide de barres auriculaires. (C) Microseringue en verre positionnée au-dessus du trou percé pour l’injection. (D) La peau forme un style mohawk une fois collée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
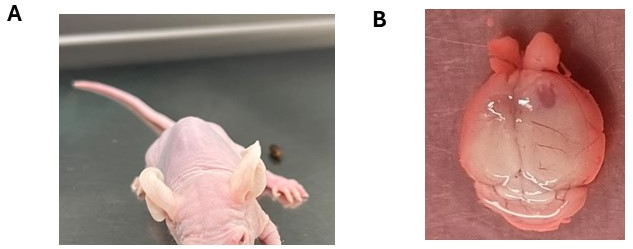
Figure 3 : Symptômes neurologiques potentiels observés suite à la greffe de cellules tumorales cérébrales. (A) Animal présentant une inclinaison de la tête suite à l’injection intracrânienne de cellules DMG dans le tronc cérébral. (B) Élargissement de l’hémisphère cortical droit avec le côté de l’injection révélant la formation de tumeurs. L’animal a reçu une injection de cellules d’épendymome. Veuillez cliquer ici pour voir une version agrandie de cette figure.
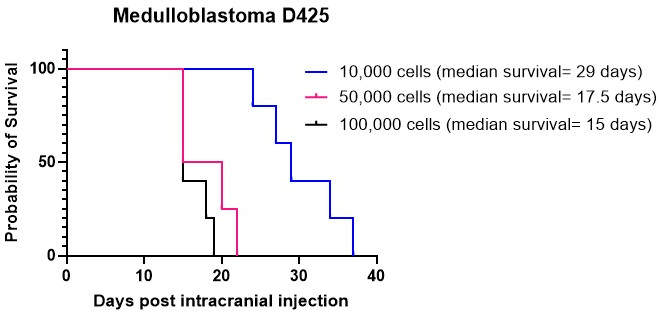
Figure 4 : Greffe de la culture de médulloblastome D425 à différentes densités cellulaires. Des cellules de médulloblastome ont été injectées par voie intracrânienne à l’aide d’un équipement stéréotaxique à des densités de 10 000 cellules dans 2 μL d’hydrogel ECM, 50 000 cellules et 100 000 cellules. Les animaux ont été surveillés pour une perte de poids progressive et ont été euthanasiés sans cruauté une fois qu’ils ont atteint 20 % en dessous de leur poids le plus élevé enregistré. La survie médiane des animaux injectés avec 10 000 cellules était de 29 jours, tandis que la survie médiane pour ceux injectés avec des densités cellulaires plus élevées de 50 000 et 100 000 cellules était de 17,5 jours et 15 jours, respectivement. Tous les animaux injectés dans cette étude ont développé avec succès des tumeurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Courbes de survie représentatives et analyse histologique d’animaux NSG injectés par voie intracrânienne avec des cellules HGG dans le cortex et le tronc cérébral. Environ 100 000 cellules HGG (passage 3) ont été injectées dans 2 μL d’hydrogel ECM à l’aide d’un équipement stéréotaxique. Les animaux ont été surveillés pour une perte de poids progressive et euthanasiés sans cruauté une fois qu’ils ont atteint 20 % en dessous de leur poids le plus élevé enregistré. Aucun symptôme neurologique n’a été observé pour ce sous-type de tumeur cérébrale. (A) La survie médiane des animaux avec des cellules HGG injectées dans le cortex est d’environ 25 jours après l’injection (N = 2). (B) La coloration H&E du cortex montre une région fortement nucléée avec une vascularisation accrue, indiquée par la présence de globules rouges. (C) La zone greffée par la tumeur dans le cortex présente un niveau élevé de cellules prolifératives, comme le montre la coloration KI67. (D) La survie médiane des animaux avec des cellules HGG injectées dans le tronc cérébral est d’environ 26 jours après l’injection (N = 2). Tous les animaux injectés dans cette étude ont développé avec succès des tumeurs. (E) La coloration H&E du tronc cérébral montre une région fortement nucléée avec une infiltration tumorale observée chez les leptoméninges du ventricule latéral. (F) La zone greffée tumorale dans le tronc cérébral présente un niveau élevé de cellules prolifératives, comme le montre la coloration KI67. La barre d’échelle noire dans les images principales indique 2 mm, tandis que les images agrandies insérées indiquent 20 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Tableau supplémentaire 1 : Formulaire de surveillance utilisé pour l’inspection des injections post-intracrâniennes des animaux et le traitement potentiel avec des agents anticancéreux. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Bien que la technique d’injection intracrânienne détaillée dans cette étude fournisse une méthode robuste pour établir des modèles de xénogreffes orthotopiques dérivées de patients (PDX) pour les tumeurs cérébrales pédiatriques, plusieurs domaines doivent être améliorés. Une approche pour améliorer la technique consiste à optimiser le processus de préparation des cellules tumorales. Cela comprend l’affinement des matériaux utilisés pour l’implantation des cellules tumorales. Bien que l’hydrogel ECM soit considéré comme l’étalon-or, l’utilisation d’hydrogels composés de composants qui ressemblent davantage à ceux du cerveau ou de la tumeur ECM pourrait améliorer la survie et la greffe des cellules BT. Cette approche profite particulièrement aux types de tumeurs avec des périodes de greffe plus longues, telles que les médulloblastomes et les épendymomes. Par exemple, il a été démontré que le collagène joue un rôle essentiel dans la croissance du médulloblastome du groupe 3, tandis que la laminine soutient le type SHH du médulloblastome28. De plus, la rigidité de l’ECM peut également influencer la croissance tumorale. Les glioblastomes de haut grade, par exemple, présentent une rigidité plus élevée dans leur noyau par rapport au tissu cérébral normal, ce qui peut favoriser la croissance tumorale et la survie29. En adaptant la composition et la rigidité de l’ECM aux exigences spécifiques des différents types de tumeurs, la prise de greffe et la croissance des modèles PDX peuvent être considérablement améliorées.
Quelques études récentes ont fourni des informations précieuses sur la manipulation d’échantillons de tumeurs chez les patients et le développement de modèles PDX. Tsoli et al. ont souligné que l’implantation directe de tissu DMG entraîne généralement des taux de greffe plus élevés que les cultures primaires15. Smith et al. ont établi 37 modèles PDX par injection intracrânienne de biopsies de tumeurs cérébrales ou d’échantillons d’autopsie, rapportant un taux de réussite global de 43 %, les HGG présentant le taux de greffe le plus élevé (100 %), suivis des médulloblastomes (45 %) et des épendymomes (25 %). La latence tumorale variait considérablement, de 1 à 11 mois, les tumeurs les plus agressives se greffant plus rapidement11. En revanche, Brabetz et al. ont signalé un taux de réussite global plus faible de 30 %, les HGG présentant un taux de greffe de 31 % et des taux plus faibles pour les médulloblastomes (37 %) et les épendymomes (17 %)16. Malgré ces différences, les deux dernières études menées par Smith et al. et Brabetz et al. ont confirmé que les modèles PDX récapitulaient généralement les tumeurs des patients aux niveaux immunohistochimique et moléculaire, bien que des divergences génomiques mineures aient été observées entre les échantillons tumoraux originaux et les modèles établis. Ces résultats soulignent les défis liés au développement de modèles PDX représentatifs et mettent en évidence la variabilité du succès de la greffe entre les types de tumeurs11,16.
L’une des limites importantes de l’approche orthotopique est l’incapacité de mesurer avec précision la taille de la tumeur à moins qu’un système d’imagerie ne soit utilisé, tel que Xenogen Imaging, si les cellules tumorales sont marquées avec de la luciférase ou de l’imagerie par résonance magnétique (IRM). Le marquage des cellules tumorales avec de la luciférase pourrait apporter une solution en permettant l’imagerie bioluminescente pour confirmer la greffe et surveiller la progression tumorale de manière non invasive. Cette méthode améliorerait la capacité de suivre dynamiquement la réponse au traitement, offrant ainsi une évaluation plus précise de l’efficacité thérapeutique 17,30. Une autre méthode consiste à utiliser la technologie IRM ; Cependant, la détectabilité des tumeurs dépend de leur taille. Les tumeurs plus grandes sont plus facilement identifiées, ce qui se situe souvent au point final expérimental, et la détection peut également varier en fonction du sous-type de tumeur, le GBM étant plus facilement détecté que les gliomes diffus27,31. En particulier pour les gliomes diffus, la présence d’une barrière hémato-encéphalique (BHE) intacte entraîne un manque d’amélioration du contraste. Dans le GBM, cependant, une vascularisation perméable et la présence d’un œdème peuvent amplifier le contraste entre le tissu tumoral et le tissu cérébral sain environnant, ce qui peut aider au processus de détection. En général, des agents de contraste sont nécessaires pour améliorer la détection 30,31,32. Des techniques d’imagerie alternatives telles que l’imagerie pondérée en diffusion (DWI) et la récupération par inversion atténuée par fluide (FLAIR) sont parfois utilisées pour améliorer la détection des régions tumorales non améliorées. Cependant, ces méthodes ont également leurs limites et ne fournissent pas toujours une délimitation précise des limites tumorales33. L’imagerie pondérée par transfert de protons amides (APTw) est une technique d’IRM non invasive qui détecte les gliomes diffus en suivant l’échange de protons protéine-eau, ce qui contribue à la classification tumorale. Bien que prometteur, il fait face à des défis tels que la sensibilité aux artefacts et n’a pas encore été adapté à l’imagerie des petits animaux, ce qui limite son application plus large34.
Un autre aspect crucial à prendre en compte lors de l’utilisation de modèles orthotopiques BT PDX pour les études d’efficacité des médicaments est l’intégrité de la BHE dans les modèles PDX utilisés. La perméabilité de la BHE affecte considérablement l’administration et l’efficacité des médicaments dans le traitement des tumeurs cérébrales. Par exemple, le maintien de l’intégrité de la BHE dans les gliomes du tronc cérébral entraîne souvent une mauvaise pénétration des médicaments, ce qui limite l’efficacité des thérapies systémiques17. D’autre part, dans les médulloblastomes du groupe 3, l’intégrité de la BHE a été observée hétérogène à l’imagerie IRM, et elle s’est également avérée perméable dans les modèles de xénogreffe dérivée du patient (PDX)35. Par conséquent, la caractérisation de l’état de la BHE - qu’elle soit intacte ou perméable - dans chaque modèle PDX est essentielle pour concevoir des stratégies thérapeutiques appropriées et interpréter avec précision les résultats des études d’efficacité des médicaments.
Dans l’ensemble, la procédure d’injection intracrânienne décrite offre une approche robuste pour établir des modèles BT PDX et mener des études d’efficacité pour les agents thérapeutiques. Les améliorations continues, associées à une compréhension complète de ces modèles, augmenteront leur utilité et faciliteront le développement d’interventions thérapeutiques pour les patients pédiatriques atteints de BT.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient les patients, les cliniciens et les chercheurs du Sydney Children’s Hospital Network, du Sydney Children’s Tumour Bank Network et du Zero Childhood Cancer Program d’avoir généreusement fourni les échantillons essentiels à l’établissement de cette méthodologie. Le Children’s Cancer Institute Australia est affilié à l’Université de Nouvelle-Galles du Sud à Sydney et au Sydney Children’s Hospital Network. Ce protocole découle des efforts de recherche soutenus par des subventions du Conseil national de la santé et de la recherche médicale (Synergy Grant #2019056, Leadership Grant APP2017898 à DZ) et de la subvention du programme de l’Institut du cancer de Nouvelle-Galles du Sud (TPG2037 à DZ et MT), ainsi qu’au soutien du Levi’s Project, The Kids Cancer Project, The Cure Starts Now, DIPG Collaborative, la Fondation Cure Brain Cancer, la Fondation Robert Connor Dawes et la Fondation Benny Wills.
matériels
| Name | Company | Catalog Number | Comments |
| Anaesthetic agent (e.g. Isoflurane) | Merck | 792632 | |
| 100% Ethanol | Merck | 459844 | |
| 70% ethanol | NA | NA | Make 70% ethanol from 100% ethanol diluting it with sterile water |
| 80% ethanol | NA | NA | Make 80% ethanol from 100% ethanol diluting it with sterile water |
| Adhesive microscope slides | Merck | Z681156 | |
| Analgesic (Buprenorphine 0.3mg/mL) | Jurox | NA | |
| Carbon filter canister | Vet Equip | 931401 | |
| Conical tubes 15 mL (Falcon) | Fisher Scientific | 14-959-53A | |
| Conical tubes 50 mL (Falcon) | Fisher Scientific | 14-432-22 | |
| DMSO | Merck | 472301 | |
| Ear bars | Kopf | 1921 | |
| ECM hydrogel (Matrigel, Corning) | Merck | E1270 | |
| Eye Ointment (Poly Visc) | ChemistDirect | 719986 | |
| Fetal Calf Serum | Merck | F0926 | |
| glass microsyringe | Hamilton | 7002 | |
| Isopropanol wipes | Medisa | SUL_LWMS-1 | |
| KI67 antibody | Abcam | ab209897 | |
| Microcentrifuge tubes | Eppendorf | 211-2130 | |
| Microdrill bit 0.028” | Kopf | 8170 | |
| Microinjection unit | Kopf | 5004 | |
| PBS | Merck | P4474 | |
| Pipette 10mL | Corning | CLS4488 | |
| Pipette 1mL | Eppendorf | 3123000063 | |
| Pipette 200uL | Eppendorf | 3123000055 | |
| Pipette 20uL | Eppendorf | 3123000098 | |
| Pipette 25mL | Corning | CLS4489 | |
| Pipette tip 1mL | Corning | CLS4868 | |
| Pipette tip 200uL | Corning | CLS4860 | |
| Polysorbate 20 detergent (F10SC) | Health and Hygiene | G3070 | |
| Pulse oximeter (MouseSTAT) | Kent Scientific | SPO2-MSE | |
| Riodine (Povidone-Iodine) | Merck | Y0000466 | |
| Scalpel (disposable) | Medisa | SUL_SCALPEL | |
| Skin Glue Vetbond | Medisa | 3M_1469SB | |
| Small Animal stereotactic instrument with digital display console | Kopf | 940 | |
| Stereotactic Drill | Kopf | 1474 | |
| Temperature monitoring system | Harvard Apparatus | 55-7020 | |
| Trypan Blue | Merck | 93595 |
Références
- Mueller, S., Chang, S. Pediatric brain tumors: current treatment strategies and future therapeutic approaches. Neurotherapeutics. 6 (3), 570-586 (2009).
- Packer, R. J. Brain tumors in children. Arch Neurol. 56 (4), 421-425 (1999).
- Paugh, B. S., et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol. 28 (18), 3061-3068 (2010).
- MacDonald, T. J., Aguilera, D., Kramm, C. M. Treatment of high-grade glioma in children and adolescents. Neuro Oncol. 13 (10), 1049-1058 (2011).
- Rutka, J. T. Malignant brain tumours in children : Present and future perspectives. J Korean Neurosurg Soc. 61 (3), 402-406 (2018).
- Cho, Y. J., et al. Integrative genomic analysis of medulloblastoma identifies a molecular subgroup that drives poor clinical outcome. J Clin Oncol. 29 (11), 1424-1430 (2011).
- Thomas, A., Noel, G. Medulloblastoma: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 12, 335-347 (2019).
- Pajtler, K. W., et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell. 27 (5), 728-743 (2015).
- Thorp, N., Gandola, L. Management of ependymoma in children, adolescents and young adults. Clin Oncol. 31 (3), 162-170 (2019).
- Upton, D. H., Ziegler, D. S., Tsoli, M. Development of orthotopic patient-derived xenograft models of pediatric intracranial tumors. Methods Mol Biol. 2806, 75-90 (2024).
- Smith, K. S., et al. Patient-derived orthotopic xenografts of pediatric brain tumors: a St. Jude resource. Acta Neuropathol. 140 (2), 209-225 (2020).
- Akter, F., et al. Pre-clinical tumor models of primary brain tumors: Challenges and opportunities. Biochim Biophys Acta Rev Cancer. 1875 (1), 188458 (2021).
- Stribbling, S. M., Ryan, A. J. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 17 (9), 2108-2128 (2022).
- He, C., et al. Patient-derived models recapitulate heterogeneity of molecular signatures and drug response in pediatric high-grade glioma. Nat Commun. 12 (1), 4089 (2021).
- Tsoli, M., et al. International experience in the development of patient-derived xenograft models of diffuse intrinsic pontine glioma. J Neurooncol. 141 (2), 253-263 (2019).
- Brabetz, S., et al. A biobank of patient-derived pediatric brain tumor models. Nat Med. 24 (11), 1752-1761 (2018).
- Khan, A., et al. Dual targeting of polyamine synthesis and uptake in diffuse intrinsic pontine gliomas. Nat Commun. 12 (1), 971 (2021).
- Chen, Y., et al. Preclinical evaluation of protein synthesis inhibitor omacetaxine in pediatric brainstem gliomas. Neurooncol Adv. 6 (1), vdae029 (2024).
- Ung, C., et al. Doxorubicin-loaded gold nanoarchitectures as a therapeutic strategy against diffuse intrinsic pontine glioma. Cancers (Basel). 13 (6), 1278 (2021).
- Ehteda, A., et al. Dual targeting of the epigenome via FACT complex and histone deacetylase is a potent treatment strategy for DIPG. Cell Rep. 35 (2), 108994 (2021).
- Mayoh, C., et al. High-throughput drug screening of primary tumor cells identifies therapeutic strategies for treating children with high-risk cancer. Cancer Res. 83 (16), 2716-2732 (2023).
- Lin, G. L., Monje, M. A Protocol for rapid post-mortem cell culture of diffuse intrinsic pontine glioma (DIPG). J Vis Exp. (121), e55360 (2017).
- Whitehouse, J. P., et al. In vivo loss of tumorigenicity in a patient-derived orthotopic xenograft mouse model of ependymoma. Front Oncol. 13, 1123492 (2023).
- Hermans, E., Hulleman, E. Patient-derived orthotopic xenograft models of pediatric brain tumors: In a mature phase or still in its infancy. Front Oncol. 9, 1418 (2019).
- Kim, M. P., et al. Generation of orthotopic and heterotopic human pancreatic cancer xenografts in immunodeficient mice. Nat Protoc. 4 (11), 1670-1680 (2009).
- Paxinos, G., Franklin, K. . Paxinos and Franklin's the Mouse Brain in Stereotaxic Coordinates. , (2019).
- Tsoli, M., et al. Integration of genomics, high throughput drug screening, and personalized xenograft models as a novel precision medicine paradigm for high risk pediatric cancer. Cancer Biol Ther. 19 (12), 1078-1087 (2018).
- Yang, H., et al. Roles and interactions of tumor microenvironment components in medulloblastoma with implications for novel therapeutics. Genes Chromosomes Cancer. 63 (4), e23233 (2024).
- Kondapaneni, R. V., et al. Glioblastoma mechanobiology at multiple length scales. Biomater Adv. 160, 213860 (2024).
- Mahmoudian, E., Jahani-Asl, A. Establishing brain tumor stem cell culture from patient brain tumors and imaging analysis of patient-derived xenografts. Methods Mol Biol. 2736, 177-192 (2024).
- Oudin, A., Moreno-Sanchez, P. M., Baus, V., Niclou, S. P., Golebiewska, A. Magnetic resonance imaging-guided intracranial resection of glioblastoma tumors in patient-derived orthotopic xenografts leads to clinically relevant tumor recurrence. BMC Cancer. 24 (1), 3 (2024).
- Bauer, S., Wiest, R., Nolte, L. P., Reyes, M. A survey of MRI-based medical image analysis for brain tumor studies. Phys Med Biol. 58 (13), R97-R129 (2013).
- Lasocki, A., Gaillard, F. Non-contrast-enhancing tumor: A new frontier in glioblastoma research. AJNR Am J Neuroradiol. 40 (5), 758-765 (2019).
- Nichelli, L., Zaiss, M., Casagranda, S. APT weighted imaging in diffuse gliomas. BJR Open. 5 (1), 20230025 (2023).
- Genovesi, L. A., et al. Patient-derived orthotopic xenograft models of medulloblastoma lack a functional blood-brain barrier. Neuro Oncol. 23 (5), 732-742 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon