Method Article
经结膜入路注射大鼠视神经
摘要
该协议描述了一种使用经结膜入路进入大鼠视神经进行注射的独特技术。
摘要
大鼠是研究视神经疾病的重要模型,包括遗传性、创伤性、肿瘤性和自身免疫性疾病。由于眼眶的体积小且周围眼眶组织的血管分布较小,因此进入大鼠视神经进行实验作和注射具有挑战性。以前的技术涉及皮肤切口,感染风险更高,需要闭合伤口。本研究旨在描述一种独特的、侵入性较小且可能更有效的进入大鼠视神经的方法。经结膜切口以及大鼠脊髓钩用于隔离视神经以进行实验注射。在这些实验中,将腺病毒载体注射到视神经中,目的是在未来使用该技术进行直接基因治疗递送。需要进入大鼠视神经的研究人员也可以将这项技术应用于其他实验研究,包括药物输送和视神经损伤研究。
引言
大鼠是研究视神经疾病的关键实验模型,包括青光眼、外伤性视神经病变、遗传性视神经病变、脱髓鞘疾病和视神经肿瘤2,3,4,5,6,7。然而,鉴于眼眶和血管眼眶组织的体积较小,进入视神经进行实验注射和作可能很困难。
已经描述的两种先前技术用于进入大鼠视神经进行实验作,利用眼眶上或外侧经皮入路进入眼眶 8,9。Raykova 等人描述了使用眼眶上部皮肤切口将染色珠子注射到视神经中8。虽然他们的技术很有效,但它需要止血并且需要牵引缝合线进行暴露,这种方法可能更具挑战性8。另一组同样描述了一种使用侧向皮肤切口进入眼眶的方法。他们能够使用这种方法成功地注射视神经,但需要止血和伤口闭合9。虽然这些技术是进入视神经进行实验研究的有效方法,但它们都涉及皮肤切口、止血需求和伤口闭合。这些步骤具有感染的相关风险,并且由于需要闭合伤口而可能增加麻醉时间 8,9,10。
鉴于前面描述的技术的局限性,本研究的目标是描述一种更有效、创伤更小的进入神经进行实验研究的方法。脊髓钩用于隔离视神经,类似于人类使用肌肉钩隔离肌肉和眼附件结构的手术技术。需要进入大鼠视神经进行许多适应症(从药物输送到基因治疗)的研究者可以使用这项技术。
本文介绍了经结膜方法在脊髓钩的帮助下进入大鼠眼眶和视神经进行实验研究的新用途。
研究方案
所有动物程序均已获得爱荷华大学机构动物护理和使用委员会办公室的批准。这项研究由吉尔伯特家庭基金会(资助号 913012)资助。这些实验使用了 4-12 周龄、体重 100-400 g 的雄性和雌性 Sprague Dawley 大鼠的组合。所用试剂和设备的详细信息列在 材料表中。
1. 麻醉
- 通过吸入异氟醚气体麻醉大鼠。将动物放入诱导室中,将蒸发器调至 4%-5% 以诱导麻醉,将 2%-3% 调至维持麻醉。
- 在继续之前,通过评估踏板撤退反射的缺失来验证麻醉深度。
- 将人工泪液凝胶涂抹在眼表。
2. 定位
- 麻醉后,将动物放在加热垫上,呈侧卧位。使用鼻锥维持麻醉。
- 将轨道放置在手术显微镜下方。
3. 手术暴露
- 在颞下象限用齿镊子抓住结膜(图1)。
- 使用 Westcott 剪刀创建一个桡状结膜切口,然后在下鼻象限打开 Tenon 筋膜(图 1)。使用钝性解剖去除覆盖的眼眶组织。
4. 分离视神经
- 使用齿形镊子向鼻腔旋转眼睛,并让助手将脊髓钩插入颞下象限以隔离视神经(图1)。注意避开腹侧眼静脉和眼外肌。
- 用棉签涂抹器或镊子钝性解剖去除覆盖的眼眶组织和 Tenon 筋膜,以暴露视神经和鞘。
5. 注射
- 使用连接到 10 uL 或 1 mL 注射器的 33 G 针头刺穿视神经鞘(图 1)。
- 在直接观察下将不同浓度的腺相关病毒-eGFP 或 India Ink 染料注射到视神经中,以确保材料直接注射到神经中。
- 为了评估 AAV-eGFP,注射 10 μL 含有 AAV 病毒颗粒的悬浮液(2 x 1013 载体基因组 (vg)/mL,总剂量为 2 x 1011 vg)。
注意:研究人员可能会根据实验需要注射其他染料或染色剂。
6. 术后步骤
- 将结膜重新接近角膜缘以覆盖切口部位,并在结膜上涂抹抗生素软膏(图1)。
- 让动物从麻醉中恢复并监测它们是否有任何感染迹象。
7. 染色
- 注射后 7 天,按照伦理准则 通过 CO2 窒息处死动物,然后进行颈椎脱位11 。解剖视神经。
- 用 4% 多聚甲醛固定视神经,并用增加浓度的蔗糖冲洗。将冷冻模具包埋在 OCT 化合物与 20% 蔗糖的 2:1 溶液中。在液氮中快速冷冻样品,储存在 -80 °C 下,切片厚度为 7 μm。
- 在室温下在免疫细胞化学 (IHC) 缓冲液和 3% 牛血清白蛋白中阻断视神经的冷冻切片 30 分钟。将切片与在 IHC 缓冲液中稀释的大鼠抗 GFP 一抗在室温下孵育 2 小时。
- 在室温下将切片与山羊抗大鼠在 IHC 缓冲液中再孵育 1 小时。在二抗孵育过程中,用 4',6-二脒基-2-苯基吲哚二盐酸盐 (DAPI) 标记切片以观察细胞核。用 PBS 彻底冲洗切片并使用封固剂封片。
8. 成像
- 使用正置共聚焦显微镜系统对标记的切片进行成像。
- 具体来说,使用 405 nm 紫色激光可视化 DAPI 标记,使用 488 nm 青色激光可视化 GFP。
注意:每个用户应针对不同的共聚焦显微镜系统优化每个激光器的设置(即激光功率、强度/增益、背景/噪声过滤器)。使用 20 倍物镜采集图像。
结果
使用这种技术进行大鼠视神经注射的代表性实验结果如图 2 所示。在这个例子中,使用上述经结膜技术将腺相关病毒-eGFP (AAV-eGFP) 注射到大鼠视神经中,并将 33 G 针头连接到 10 μL 注射器。这些结果是使用该技术研究视神经注射的实验的一部分,作为使用 AAV 对神经纤维瘤病 1 (NF1) 大鼠模型中的视神经进行 CRISPR 校正的最终目标的一部分。使用染料和 AAV 载体的组合来开发注射技术。注射到视神经中 7 天后处死动物。然后解剖神经并用抗 GFP 抗体标记,以便用共聚焦显微镜对视神经进行成像,以确认材料已成功穿透视神经鞘并进入视神经。抗体染色证实了材料成功引入视神经,它在共聚焦显微镜下呈绿色,如图 2A 所示。在穿过视神经鞘不完全或针道有物质外流的情况下,沿着视神经鞘的边缘而不是神经组织内看到染色,如图 2C 所示。
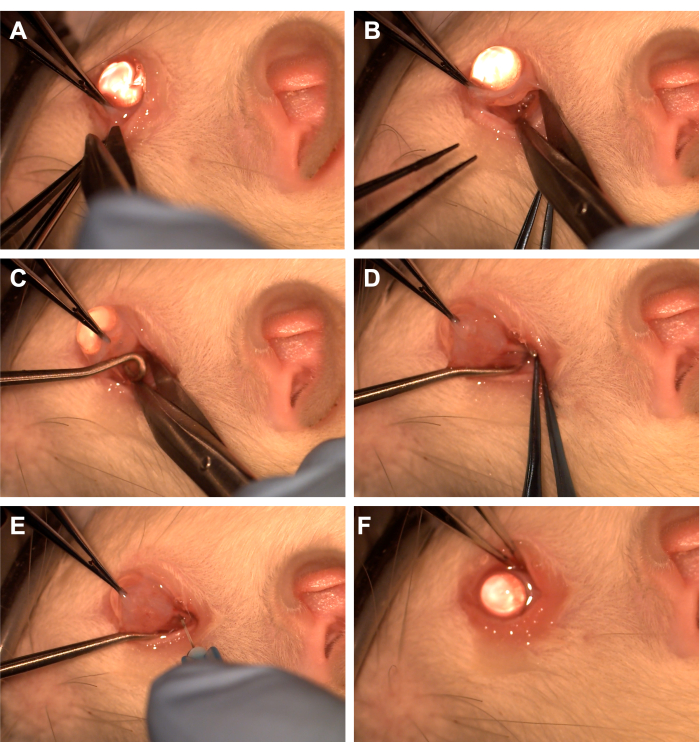
图 1:手术步骤的顺序。 (A) 用带齿的镊子抓住结膜,并使用 Westcott 剪刀创建角膜缘腹膜切开术。(B) 榫卯筋膜打开并钝解剖后,在 Westcott 剪刀的帮助下暴露眼眶。(C) 插入脊髓钩并用于隔离视神经。(D) 钝性解剖上覆的眼眶组织后,使用脊髓钩暴露视神经。(E) 用 33 G 针刺穿视神经鞘,将腺病毒或染料注射到视神经中。(F) 将眼球重新定位到眼眶中,结膜重新定位在腹膜切开部位上。 请单击此处查看此图的较大版本。
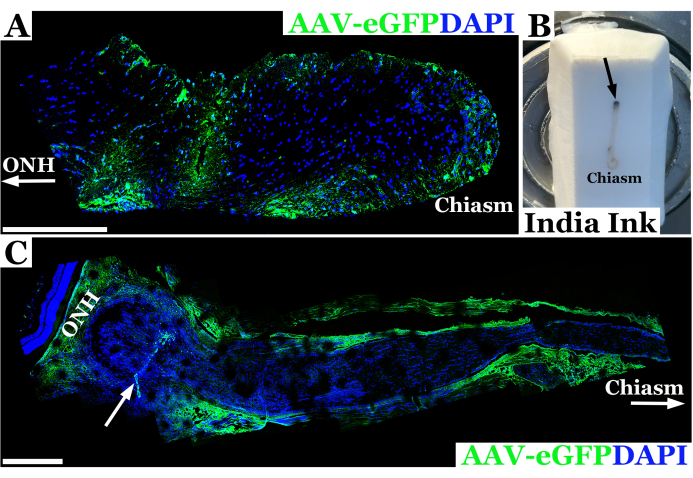
图 2: 成功注射 AAV-eGFP(绿色)后 7 天大鼠视神经的代表性荧光共聚焦全景图像,其中载体转导了视交叉附近的神经元。(A) 视神经核用 DAPI(蓝色)标记。带箭头的 ONH 表示视神经头或神经的眼眶端,而视交叉端被标记为“视交叉”。(B) 嵌入冷冻冷冻切片块中的大鼠视神经从眼眶到视交叉的照片。在眼眶后方(注射部位用黑色箭头表示)向神经注射 India Ink,以定向视神经。(C) 大鼠视神经注射 AAV-eGFP 失败后 7 天的全景荧光图像(绿色),其中大部分载体悬液可能从神经束流出,转导视鞘。视神经核用 DAPI(蓝色)标记。ONH 表示紧邻神经视网膜后方的视神经头和注射部位,由白色箭头表示。视交叉和白色箭头朝向视交叉划界。比例尺 = (A) 中 400 μm 和 (C) 中 200 μm。 请单击此处查看此图的较大版本。
| 变量 | 方法 | ||
| 经结膜 | 优越 | 侧面的 | |
| 皮肤切口 | 不 | 是的 | 是的 |
| 结膜切口 | 是的 | 不 | 不 |
| 显微镜 | 是的 | 是的 | 是的 |
| 眼眶上肌横断 | 不 | 是的 | 不 |
| 牵引缝合 | 不 | 是的 | 是的 |
| 脊髓钩 | 是的 | 不 | 不 |
| 皮肤缝合 | 不 | 是的 | 是的 |
表 1:与以前发表的用于实验研究的分离大鼠视神经的技术的比较。 使用经结膜、上部和外侧入路比较变量,包括皮肤切口、结膜切口、手术显微镜、眼眶上肌横断、牵引缝合、脊髓钩和皮肤缝合。
讨论
本文介绍了一种无需皮肤切口即可进入大鼠视神经进行实验研究的新方法。鉴于与其他技术相比,这种方法不需要皮肤切口且步骤更少,因此具有效率低、感染和出血风险低的潜在优势8,9。该技术还使用了用大鼠脊髓钩隔离视神经的新方法,以避免对神经和周围组织造成创伤。
该技术的关键步骤包括做一个足够的角膜缘切口以进入结膜下间隙,使用脊髓钩隔离视神经,以及使用小口径针刺穿视神经鞘并将材料输送到视神经。必须小心旋转脊髓钩以隔离神经。当神经没有被明确隔离时,可能需要多次引入钩子以确保神经被隔离,并且可以使用棉签涂抹器从神经鞘中取出结缔组织,以获得更好的可视化。对于眼眶脂肪体积较大的大型动物来说,接触这种技术可能更具挑战性。在这些情况下,使用助手缩回周围组织以进行充分暴露可能很有用。在注射过程中必须注意直接看到视神经。在注射过程中确保针头穿过神经鞘的垂直方向可以提高注射成功率。
该技术建立在 Raykova 等人以及 Hallas 和Wells 8,9 的先前工作之上。Raykova 等人描述了使用上入路进入大鼠视神经,在眶嵴和眶上肌横断面上创建皮肤切口8。虽然这种方法允许暴露神经,但它需要横切出血风险较高的眼外肌,并且需要缝合皮肤切口。同样,Hallas 和 Wells 描述了一种外向入路进入大鼠眼眶以到达视神经9。他们描述了一个侧面皮肤切口,然后是一个侧面结膜切口和一个用于旋转眼睛并暴露视神经的牵引缝合线 9。与高级方法类似,该技术涉及皮肤切口,因此需要闭合伤口,感染和出血的风险更高 8,9。这里介绍的经结膜技术消除了对皮肤和肌肉切口的需要,因此降低了出血/感染的风险,并通过避免关闭皮肤切口的需要来提高效率。该手术造成的痛苦最小,耐受性良好,不需要长期使用镇痛药或抗炎药。经结膜技术与 表 1 中先前发表的技术进行了比较和对比。
本研究中介绍的技术的局限性包括使用脊髓钩隔离视神经的学习曲线,但一旦掌握,该技术就可以有效和无创伤地隔离神经。熟悉手术显微镜的使用对于这种技术是必要的。虽然这项技术有一个学习曲线,但相对于其他已发表的方法,更少的步骤和不需要缝合伤口将使这项技术更容易掌握 8,9。必须仔细钝解剖以暴露神经和鞘,因为附近的血管和肌肉组织可能会出血。在较大的大鼠中,由于眼眶脂肪/组织增加,暴露大部分视神经可能更加困难,但小心时,通常可以通过钝性解剖去除这些组织,以改善神经的可视化。进一步的工作可以解决该技术在其他模型系统(例如小鼠)中的使用,并且可以直接将手术效率与其他视神经通路技术进行比较。
该技术可由需要进入大鼠视神经进行实验研究的其他组使用。这里介绍的实验是一个更大项目的一部分,该项目旨在开发在 1 型神经纤维瘤病 (NF1) 大鼠模型中将 CRISPR 基因校正传递到视神经的方法。该项目的最终目标是找到将基因疗法直接输送到 NF1 患者的视神经的方法,以防止视神经胶质瘤的发展,这种神经胶质瘤会威胁视力12。在这项研究中,将 India Ink 染料或 AAV-eGFP 载体注射到视神经中,以确保物质被输送到视神经中,并证明载体可以穿透视神经。
其他研究人员可以更广泛地使用这项技术,因为可能需要进入神经或注射新的疗法来治疗各种威胁视力的疾病,包括视神经肿瘤、退行性过程(如 Leber 遗传性视神经病变)、创伤性视神经病变、青光眼和自身免疫性疾病(如视神经炎)13,14.例如,Singh 等人将 C6 神经胶质瘤细胞注射到大鼠视神经中描述为使用皮肤切口进入神经的 1 型神经纤维瘤病模型 3,Kwon 等人从外侧皮肤入路进入视神经,用于涉及干细胞视神经压迫和再生的研究6,Negishi 等人访问大鼠视神经进行雪旺细胞移植物放置作为视神经模型再生15.这里介绍的技术可以为诸如此类需要进入大鼠视神经以回答各种实验问题的研究提供一种更有效、更安全的方法。
总之,这项工作证明了使用小规格针入路进入视神经的有效性,并且能够穿透神经鞘而无需皮肤切口。代表性图像显示腺病毒载体成功穿透视神经。该技术可应用于再生医学、肿瘤学和遗传性视网膜疾病中的各种视神经实验。
披露声明
没有相关披露。
致谢
作者感谢 Gilbert Family Foundation 资助该项目。
材料
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
参考文献
- Korn, P. et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383 (2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695 (2020).
- Ellouze, S. et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. 99, e52249 (2015).
- Hallas, B.H., Wells, M.R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F. et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. 128, e56272 (2017).
- Han I. H. et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T. et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683 (2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。