Method Article
Approccio transcongiuntivale per l'iniezione nel nervo ottico del ratto
In questo articolo
Riepilogo
Questo protocollo descrive una tecnica unica che utilizza un approccio transcongiuntivale per accedere al nervo ottico del ratto per le iniezioni.
Abstract
Il ratto funge da modello importante per lo studio dei disturbi del nervo ottico, comprese le condizioni ereditarie, traumatiche, neoplastiche e autoimmuni. L'accesso al nervo ottico di ratto per manipolazioni sperimentali e iniezioni è impegnativo a causa delle piccole dimensioni dell'orbita e della vascolarizzazione dei tessuti orbitali circostanti. Le tecniche precedenti prevedevano un'incisione cutanea, che comporta un rischio maggiore di infezione e richiede la chiusura della ferita. Questo studio mira a descrivere un approccio unico, meno invasivo e potenzialmente più efficiente per accedere al nervo ottico del ratto. Un'incisione transcongiuntivale, insieme a un gancio del midollo spinale di ratto, viene utilizzata per isolare il nervo ottico per iniezioni sperimentali. In questi esperimenti, un vettore adenovirale viene iniettato nel nervo ottico con l'obiettivo di utilizzare questa tecnica per la somministrazione diretta di terapia genica in futuro. Questa tecnica può essere applicata anche dai ricercatori che richiedono l'accesso al nervo ottico di ratto per altri studi sperimentali, tra cui la somministrazione di farmaci e la ricerca sulle lesioni del nervo ottico.
Introduzione
Il ratto è un modello sperimentale chiave per lo studio dei disturbi del nervo ottico, tra cui glaucoma, neuropatia ottica traumatica, neuropatia ottica ereditaria, malattia demielinizzante e tumori del nervo ottico,2,3,4,5,6,7. Tuttavia, ottenere l'accesso al nervo ottico per l'iniezione sperimentale e le manipolazioni può essere difficile, date le piccole dimensioni dell'orbita e dei tessuti orbitari vascolari.
Le due tecniche precedenti che sono state descritte per accedere al nervo ottico di ratto per manipolazioni sperimentali utilizzano un approccio transcutaneo orbitale o laterale superiore per accedere all'orbita 8,9. Raykova et al. descrivono l'iniezione di perline colorate nel nervo ottico utilizzando un'incisione cutanea orbitale superiore8. Sebbene la loro tecnica sia stata efficace, richiede l'emostasi e la necessità di una sutura da trazione per l'esposizione, che può essere più impegnativa con questo approccio8. Un altro gruppo ha descritto in modo simile un approccio che utilizza un'incisione cutanea laterale per accedere all'orbita. Sono stati in grado di iniettare con successo il nervo ottico utilizzando questo approccio, ma hanno richiesto l'emostasi e la chiusura della ferita9. Sebbene queste tecniche siano approcci efficaci per accedere al nervo ottico per lo studio sperimentale, entrambe comportano un'incisione cutanea, la necessità di emostasi e la chiusura della ferita. Questi passaggi hanno rischi associati di infezione e potenzialmente un aumento del tempo in anestesia a causa della necessità di chiusura della ferita 8,9,10.
Dati i limiti delle tecniche precedentemente descritte, l'obiettivo di questo studio è quello di descrivere un approccio più efficiente e meno traumatico all'accesso al nervo per lo studio sperimentale. Un gancio del midollo spinale viene utilizzato per isolare il nervo ottico, analogamente alla tecnica chirurgica utilizzata nell'uomo per isolare le strutture annessiali muscolari e oculari utilizzando un gancio muscolare. Questa tecnica può essere utilizzata dai ricercatori che hanno bisogno di accedere al nervo ottico del ratto per molte indicazioni, dalla somministrazione di farmaci alla terapia genica.
Questo articolo descrive l'uso innovativo di un approccio transcongiuntivale per accedere all'orbita del ratto e al nervo ottico per lo studio sperimentale con l'aiuto di un uncino del midollo spinale.
Protocollo
Tutte le procedure per gli animali sono state approvate dall'Ufficio del Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università dell'Iowa. Questo studio è stato finanziato dalla Gilbert Family Foundation (numero di sovvenzione 913012). Per questi esperimenti è stata utilizzata una combinazione di ratti Sprague Dawley maschi e femmine, di età compresa tra 4 e 12 settimane e del peso di 100-400 g. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Anestetizzazione
- Anestetizzare i ratti utilizzando l'inalazione di gas isoflurano. Metti l'animale nella camera di induzione e gira il vaporizzatore al 4%-5% per l'induzione dell'anestesia e al 2%-3% per mantenere l'anestesia.
- Verificare la profondità dell'anestesia valutando l'assenza del riflesso di ritiro del pedale prima di procedere.
- Applicare il gel lacrimale artificiale sulla superficie oculare.
2. Posizionamento
- Una volta indotta l'anestesia, posizionare l'animale su un termoforo in posizione sdraiata laterale. Usa un cono per mantenere l'anestesia.
- Posizionare l'orbita sotto il microscopio operatorio.
3. Esposizione chirurgica
- Afferrare la congiuntiva con una pinza dentata nel quadrante inferotemporale (Figura 1).
- Utilizzare le forbici Westcott per creare un'incisione congiuntivale radiale e quindi aprire la fascia del tenone nel quadrante inferonasale (Figura 1). Utilizzare la dissezione smussata per rimuovere il tessuto orbitale sovrastante.
4. Isolamento del nervo ottico
- Ruotare l'occhio nasale utilizzando una pinza dentata e chiedere all'assistente di passare un uncino del midollo spinale nel quadrante inferotemporale per isolare il nervo ottico (Figura 1). Fare attenzione ad evitare la vena oftalmica ventrale e i muscoli extraoculari.
- Rimuovere il tessuto orbitale sovrastante e la fascia di Tenone utilizzando la dissezione smussata con un applicatore a punta di cotone o una pinza per esporre il nervo ottico e la guaina.
5. Iniezione
- Utilizzare un ago da 33 G collegato a una siringa da 10 uL o da 1 mL per perforare la guaina del nervo ottico (Figura 1).
- Iniettare diverse concentrazioni di virus adeno-associato-eGFP o colorante di inchiostro di china nel nervo ottico sotto visualizzazione diretta per garantire che il materiale venga iniettato direttamente nel nervo.
- Per valutare l'AAV-eGFP, iniettare 10 μL di sospensione contenente particelle virali AAV (2 x 1013 genomi vettori (vg)/mL per una dose totale di 2 x 1011 vg).
NOTA: Gli investigatori possono iniettare altri coloranti o coloranti a seconda delle esigenze sperimentali.
6. Fasi post-procedurali
- Riavvicinare la congiuntiva al limbus per coprire il sito di incisione e applicare un unguento antibiotico sulla congiuntiva (Figura 1).
- Consenti agli animali di riprendersi dall'anestesia e monitorali per eventuali segni di infezione.
7. Colorazione
- Sette giorni dopo l'iniezione, sacrificare gli animali tramite asfissia da CO2 seguita da lussazione cervicale11 seguendo le linee guida etiche. Sezionare il nervo ottico.
- Fissare i nervi ottici con paraformaldeide al 4% e risciacquare con concentrazioni aumentate di saccarosio. Incorporare i criostampi in una soluzione 2:1 di composto OCT al 20% di saccarosio. Congelare i campioni in azoto liquido, conservarli a -80 °C e sezionarli con uno spessore di 7 μm.
- Bloccare le criosezioni del nervo ottico per 30 minuti a temperatura ambiente in tampone immunocitochimico (IHC) e albumina sierica bovina al 3%. Incubare le sezioni con l'anticorpo primario anti-GFP di ratto diluito in tampone IHC per 2 ore a temperatura ambiente.
- Incubare le sezioni con capra anti-ratto in tampone IHC per un'ulteriore 1 ora a temperatura ambiente. Durante l'incubazione secondaria degli anticorpi, marcare le sezioni con 4',6-Diamidino-2-fenilindolo dicloridrato (DAPI) per visualizzare i nuclei cellulari. Sciacquare accuratamente le sezioni con PBS e montarle utilizzando un mezzo di montaggio.
8. Imaging
- Visualizzare le sezioni etichettate utilizzando un sistema di microscopio confocale verticale.
- In particolare, è possibile utilizzare un laser viola da 405 nm per visualizzare l'etichettatura DAPI e un laser ciano da 488 nm per visualizzare la GFP.
NOTA: Le impostazioni per ciascun laser (ad esempio, potenza laser, intensità/guadagno, filtri di fondo/rumore) devono essere ottimizzate da ciascun utente per diversi sistemi di microscopio confocale. Acquisisci immagini utilizzando un obiettivo 20x.
Risultati
I risultati sperimentali rappresentativi che utilizzano questa tecnica per l'iniezione del nervo ottico di ratto sono mostrati nella Figura 2. In questo esempio, il virus adeno-associato-eGFP (AAV-eGFP) è stato iniettato nel nervo ottico di ratto utilizzando la tecnica transcongiuntivale descritta sopra con un ago da 33 G collegato a una siringa da 10 μL. Questi risultati facevano parte di un esperimento che utilizzava questa tecnica per studiare l'iniezione del nervo ottico come parte di un obiettivo finale per utilizzare l'AAV per fornire la correzione CRISPR ai nervi ottici in un modello di ratto di neurofibromatosi 1 (NF1). Per sviluppare la tecnica di iniezione è stata utilizzata una combinazione di colorante e vettore AAV. Gli animali venivano sacrificati sette giorni dopo l'iniezione nel nervo ottico. I nervi sono stati quindi sezionati e marcati con anticorpi anti-GFP per consentire l'imaging del nervo ottico con microscopia confocale per confermare che il materiale era penetrato con successo nella guaina del nervo ottico ed era entrato nel nervo ottico. Il successo dell'introduzione del materiale nel nervo ottico è stato confermato dalla colorazione degli anticorpi ed è apparso verde alla microscopia confocale, come mostrato nella Figura 2A. Nei casi in cui la penetrazione attraverso la guaina del nervo ottico non era completa, o c'era efflusso di materiale dalla traccia dell'ago, la colorazione è stata osservata lungo il bordo della guaina del nervo ottico piuttosto che all'interno del tessuto nervoso, come mostrato nella Figura 2C.
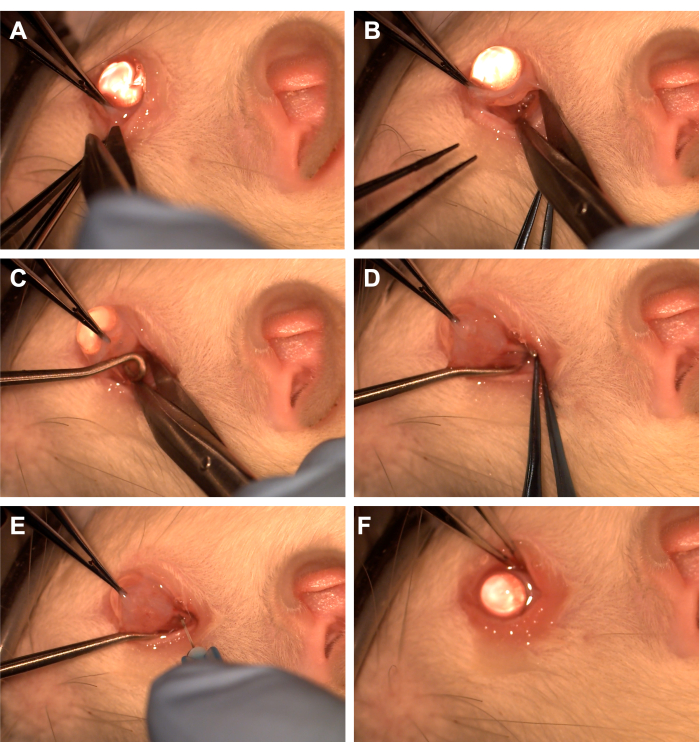
Figura 1: Sequenza delle fasi chirurgiche. (A) La congiuntiva viene afferrata con una pinza dentata e le forbici Westcott vengono utilizzate per creare una peritomia limbare. (B) Dopo che la fascia del tenone è stata aperta e sezionata senza mezzi termini, l'orbita viene esposta con l'assistenza delle forbici di Westcott. (C) Un gancio del midollo spinale viene inserito e utilizzato per isolare il nervo ottico. (D) Dopo la dissezione smussata del tessuto orbitale sovrastante, il nervo ottico viene esposto utilizzando il gancio del midollo spinale. (E) Un ago da 33 G viene utilizzato per perforare la guaina del nervo ottico e iniettare adenovirus o colorante nel nervo ottico. (F) Il globo viene riposizionato nell'orbita e la congiuntiva viene riposizionata sopra il sito della peritomia. Clicca qui per visualizzare una versione più grande di questa figura.
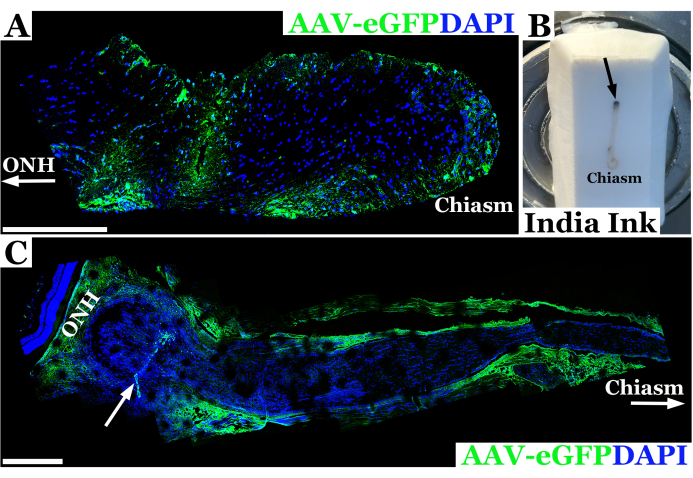
Figura 2: Immagine panoramica confocale fluorescente rappresentativa del nervo ottico di ratto 7 giorni dopo l'iniezione riuscita di AAV-eGFP (verde) in cui il vettore ha trasdotto i neuroni vicino al chiasma ottico. (A) I nuclei del nervo ottico sono marcati con DAPI (blu). ONH con freccia denota la testa del nervo ottico o l'estremità orbitale del nervo, mentre l'estremità del chiasma ottico è etichettata come "chiasma". (B) Fotografia di un nervo ottico di ratto dall'orbita al chiasma incorporato in un blocco di criosezione congelato. Il nervo viene iniettato con inchiostro di china immediatamente posteriormente all'orbita (sito di iniezione indicato da una freccia nera) per orientare il nervo ottico. (C) Immagine fluorescente panoramica del nervo ottico di ratto 7 giorni dopo l'iniezione non riuscita di AAV-eGFP (verde) in cui la maggior parte della sospensione vettoriale probabilmente è fluita fuori dal tratto nervoso, trasducendo la guaina ottica. I nuclei del nervo ottico sono marcati con DAPI (blu). ONH denota la testa del nervo ottico immediatamente posteriore alla retina neurale e il sito di iniezione indicato da una freccia bianca. Il chiasma e la freccia bianca demarcano verso il chiasma ottico. Barre di scala = 400 μm in (A) e 200 μm in (C). Clicca qui per visualizzare una versione più grande di questa figura.
| Variabile | Avvicinarsi | ||
| transcongiuntivale | Superiore | Laterale | |
| Incisione cutanea | No | Sì | Sì |
| Incisione congiuntivale | Sì | No | No |
| Microscopio | Sì | Sì | Sì |
| Troncazione del muscolo orbitario superiore | No | Sì | No |
| Sutura di trazione | No | Sì | Sì |
| Gancio del midollo spinale | Sì | No | No |
| Sutura cutanea | No | Sì | Sì |
Tabella 1: Confronto con tecniche precedentemente pubblicate per isolare il nervo ottico di ratto per lo studio sperimentale. Le variabili, tra cui la necessità di incisione cutanea, incisione congiuntivale, microscopio operatorio, sezione del muscolo orbitale superiore, sutura di trazione, gancio del midollo spinale e sutura cutanea, vengono confrontate utilizzando gli approcci transcongiuntivale, superiore e laterale.
Discussione
Questo articolo descrive un nuovo metodo per accedere al nervo ottico di ratto per lo studio sperimentale senza la necessità di un'incisione cutanea. Questo approccio offre i potenziali vantaggi in termini di efficienza e riduzione del rischio di infezione e sanguinamento, data la mancanza di una necessità di incisione cutanea e un minor numero di passaggi rispetto ad altre tecniche 8,9. Questa tecnica utilizza anche il nuovo approccio di isolare il nervo ottico con un gancio del midollo spinale di ratto per evitare traumi al nervo e ai tessuti circostanti.
I passaggi critici della tecnica includono l'esecuzione di un'adeguata incisione limbare per l'accesso allo spazio sottocongiuntivale, l'uso del gancio del midollo spinale per isolare il nervo ottico e l'uso di un ago di piccolo diametro per perforare la guaina del nervo ottico e fornire materiale al nervo ottico. Bisogna fare attenzione a ruotare il gancio del midollo spinale per isolare il nervo. Quando il nervo non è chiaramente isolato, potrebbe essere necessario introdurre il gancio più volte per garantire che il nervo sia isolato e un applicatore con punta di cotone può essere utilizzato per rimuovere il tessuto connettivo dalla guaina nervosa per una migliore visualizzazione. L'esposizione a questa tecnica può essere più impegnativa negli animali di taglia più grande con un volume maggiore di grasso orbitale. L'uso di un assistente per ritrarre i tessuti circostanti per un'adeguata esposizione può essere utile in queste situazioni. Bisogna prestare attenzione a visualizzare il nervo ottico direttamente durante l'iniezione. Garantire un orientamento perpendicolare dell'ago attraverso la guaina nervosa durante l'iniezione migliora il successo dell'iniezione.
Questa tecnica si basa su precedenti lavori di Raykova et al. e Hallas e Wells 8,9. Raykova et al. hanno descritto l'accesso al nervo ottico di ratto utilizzando un approccio superiore con un'incisione cutanea creata sopra la cresta orbitale e la transezione del muscolo orbitale superiore8. Sebbene questo approccio consenta l'esposizione del nervo, richiede la resezione di un muscolo extraoculare con un rischio maggiore di sanguinamento e la necessità di sutura dell'incisione cutanea. Allo stesso modo, Hallas e Wells descrivono un approccio laterale all'orbita del ratto per raggiungere il nervo ottico9. Descrivono un'incisione cutanea laterale seguita da un'incisione congiuntivale laterale e una sutura da trazione utilizzata per ruotare l'occhio ed esporre il nervo ottico9. Simile all'approccio superiore, questa tecnica comporta un'incisione cutanea con conseguente necessità di chiusura della ferita e un rischio più elevato di infezione e sanguinamento 8,9. La tecnica transcongiuntivale qui presentata ovvia alla necessità di un'incisione cutanea e muscolare, riducendo così il rischio di sanguinamento/infezione e migliorando l'efficienza evitando la necessità di chiudere un'incisione cutanea. La procedura provoca un disagio minimo, è ben tollerata e non richiede l'uso a lungo termine di farmaci analgesici o antinfiammatori. La tecnica transcongiuntivale viene confrontata e contrastata con le tecniche precedentemente pubblicate nella Tabella 1.
I limiti della tecnica presentata in questo studio includono una curva di apprendimento per isolare il nervo ottico utilizzando il gancio del midollo spinale, ma una volta padroneggiata, questa tecnica consente un isolamento efficiente e atraumatico del nervo. Per questa tecnica è necessaria la familiarità con l'uso di un microscopio operatorio. Sebbene esista una curva di apprendimento per questa tecnica, il minor numero di passaggi e l'assenza della necessità di sutura della ferita renderanno questa tecnica più facile da padroneggiare rispetto agli altri approcci pubblicati 8,9. Un'attenta dissezione smussata per esporre il nervo e la guaina è imperativa, poiché può esserci un'emorragia dai vasi vicini e dal tessuto muscolare. Nei ratti più grandi, può essere più difficile esporre ampie sezioni del nervo ottico a causa dell'aumento del grasso/tessuto orbitale, ma con cura, questo tessuto può generalmente essere rimosso con una dissezione smussata per migliorare la visualizzazione del nervo. Ulteriori lavori potrebbero riguardare l'uso di questa tecnica in altri sistemi modello, come il topo, e potrebbero confrontare direttamente l'efficienza chirurgica con altre tecniche per l'accesso al nervo ottico.
Questa tecnica può essere utilizzata da altri gruppi che hanno bisogno di accedere al nervo ottico del ratto per lo studio sperimentale. Gli esperimenti qui presentati facevano parte di un progetto più ampio che mirava a sviluppare modi per fornire la correzione del gene CRISPR al nervo ottico in modelli di ratto di neurofibromatosi di tipo 1 (NF1). L'obiettivo finale di questo progetto è quello di trovare il modo di somministrare la terapia genica direttamente al nervo ottico nei pazienti con NF1 per prevenire lo sviluppo di gliomi del nervo ottico, che sono pericolosi per la vista12. In questo studio, il colorante a inchiostro di china o vettore AAV-eGFP è stato iniettato nel nervo ottico per garantire che il materiale venisse erogato nel nervo ottico e per dimostrare che il vettore potesse penetrare nel nervo ottico.
Questa tecnica potrebbe essere più ampiamente utilizzata da altri ricercatori in quanto potrebbe essere necessario accedere al nervo o iniettare nuove terapie nel tentativo di trattare una varietà di condizioni che minacciano la vista, tra cui neoplasie del nervo ottico, processi degenerativi come la neuropatia ottica ereditaria di Leber, la neuropatia ottica traumatica, il glaucoma e malattie autoimmuni come la neurite ottica13, 14. Ad esempio, Singh et al. descrivono l'iniezione di cellule di glioma C6 nel nervo ottico di ratto come un modello di neurofibromatosi di tipo 1 che accede al nervo utilizzando un'incisione cutanea3, Kwon et al. ha avuto accesso al nervo ottico da un approccio cutaneo laterale per studi che coinvolgono la compressione e la rigenerazione del nervo ottico con cellule staminali6 e Negishi et al. ha avuto accesso al nervo ottico di ratto per il posizionamento dell'innesto di cellule di Schwann come modello di nervo ottico Rigenerazione15. La tecnica qui presentata potrebbe fornire un approccio più efficiente e sicuro per studi come questi che richiedono l'accesso al nervo ottico del ratto per rispondere a una varietà di domande sperimentali.
In sintesi, questo lavoro dimostra l'efficacia nell'entrare nel nervo ottico con un ago di piccolo calibro e la capacità di penetrare la guaina nervosa senza la necessità di un'incisione cutanea. Le immagini rappresentative mostrano che il vettore adenovirale è penetrato con successo nel nervo ottico. Questa tecnica ha applicazioni a una varietà di esperimenti sul nervo ottico in medicina rigenerativa, oncologia e malattie retiniche ereditarie.
Divulgazioni
Nessuna divulgazione pertinente.
Riconoscimenti
Gli autori ringraziano la Gilbert Family Foundation per il finanziamento di questo progetto.
Materiali
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Riferimenti
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon