Method Article
쥐의 시신경에 주입하기 위한 경결막 접근법
요약
이 프로토콜은 주사를 위해 쥐의 시신경에 접근하기 위해 경결막 접근법을 사용하는 독특한 기술을 설명합니다.
초록
쥐는 유전성, 외상성, 종양성 및 자가면역 질환을 포함한 시신경 장애를 연구하는 데 중요한 모델 역할을 합니다. 실험적 조작 및 주입을 위해 쥐의 시신경에 접근하는 것은 안와의 크기가 작고 주변 안와 조직의 혈관성으로 인해 어렵습니다. 이전 기술은 감염 위험이 더 높고 상처를 봉합해야 하는 피부 절개를 포함했습니다. 이 연구는 쥐의 시신경에 접근하기 위한 독특하고 덜 침습적이며 잠재적으로 더 효율적인 접근 방식을 설명하는 것을 목표로 합니다. 쥐의 척수 고리와 함께 경결막 절개는 실험적 주사를 위해 시신경을 분리하는 데 사용됩니다. 이 실험에서는 아데노바이러스 벡터를 시신경에 주입하여 향후 직접 유전자 치료를 제공하는 것을 목표로 합니다. 이 기술은 약물 전달 및 시신경 손상 연구를 포함한 다른 실험 연구를 위해 쥐 시신경에 접근해야 하는 연구자도 적용할 수 있습니다.
서문
쥐는 녹내장, 외상성 시신경병증, 유전성 시신경병증, 탈수초성 질환 및 시신경 종양을 포함한 시신경 장애 연구를 위한 핵심 실험 모델입니다.2,3,4,5,6,7. 그러나 실험적 주입 및 조작을 위해 시신경에 접근하는 것은 안와 및 혈관 안와 조직의 크기가 작기 때문에 어려울 수 있습니다.
실험적 조작을 위해 쥐의 시신경에 접근하기 위해 설명된 두 가지 이전 기술은 궤도에 접근하기 위해 우수한 안와 또는 측면 경피 접근법을 사용합니다 8,9. Raykova 등은 상안와피부 절개를 사용하여 염색된 구슬을 시신경에 주입하는 방법을 설명합니다8. 그들의 기술은 효과적이었지만 지혈과 노출을 위한 견인 봉합사의 필요성이 필요한데, 이는 이 접근법에서 더 어려울 수 있습니다8. 또 다른 그룹은 안와에 접근하기 위해 측면 피부 절개를 사용하는 접근 방식을 유사하게 설명했습니다. 그들은 이 접근법을 사용하여 시신경을 성공적으로 주입할 수 있었지만 지혈과 상처 봉합이 필요했다9. 이러한 기술은 실험 연구를 위해 시신경에 접근하는 효과적인 접근 방식이지만 둘 다 피부 절개, 지혈 필요 및 상처 봉합을 포함합니다. 이러한 조치는 감염 위험과 관련이 있으며, 상처 봉합이 필요하기 때문에 마취 시간이 증가할 수 있다 8,9,10.
앞서 설명한 기술의 한계를 감안할 때 이 연구의 목표는 실험 연구를 위해 신경에 접근하는 보다 효율적이고 덜 외상적인 접근 방식을 설명하는 것입니다. 척수 갈고리는 시신경을 분리하는 데 사용되며, 이는 근육 갈고리를 사용하여 근육과 안구 부속기 구조를 분리하기 위해 인간이 사용하는 수술 기술과 유사합니다. 이 기술은 약물 전달에서 유전자 치료에 이르기까지 많은 적응증을 위해 쥐의 시신경에 접근해야 하는 연구자가 사용할 수 있습니다.
이 기사는 척수 고리의 도움으로 실험 연구를 위해 쥐 궤도와 시신경에 접근하기 위한 경결막 접근법의 새로운 사용에 대해 설명합니다.
프로토콜
모든 동물 절차는 아이오와 대학의 기관 동물 관리 및 사용 위원회 사무국의 승인을 받았습니다. 이 연구는 Gilbert Family Foundation(보조금 번호 913012)의 지원을 받았습니다. 4-12주령, 체중 100-400g의 수컷과 암컷 Sprague Dawley 쥐의 조합이 이러한 실험에 사용되었습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 마취
- 이소플루란 가스를 흡입하여 쥐를 마취합니다. 동물을 유도 챔버에 넣고 마취 유도를 위해 기화기를 4%-5%로 돌리고 마취를 유지하려면 2%-3%로 돌립니다.
- 진행하기 전에 페달 철수 반사의 부재를 평가하여 마취 깊이를 확인하십시오.
- 인공 눈물 젤을 안구 표면에 바르십시오.
2. 포지셔닝
- 마취가 시작되면 동물을 옆으로 누운 자세로 발열 패드에 놓습니다. 마취를 유지하기 위해 노즈콘을 사용하십시오.
- 작동 중인 현미경 아래에 궤도를 배치합니다.
3. 외과적 노출
- 하측두엽 사분면(inferotemporal quadrant)에서 톱니가 있는 집게로 결막을 잡습니다(그림 1).
- Westcott 가위를 사용하여 요골 결막 절개를 만든 다음 하사분면에 있는 장부 근막을 엽니다(그림 1). 둔기 박리를 사용하여 위에 있는 안와 조직을 제거합니다.
4. 시신경의 격리
- 톱니가 있는 집게를 사용하여 눈을 코로 회전시키고 보조자가 척수 고리를 측두하 사분면에 통과시켜 시신경을 분리하도록 합니다(그림 1). 복부 안과 정맥과 안구 외 근육을 피하도록 주의하십시오.
- 솜 끝이 있는 어플리케이터 또는 집게로 둔기 절개를 사용하여 위에 있는 안와 조직과 장부 근막을 제거하여 시신경과 덮개를 노출시킵니다.
5. 주입
- 10uL 또는 1mL 주사기에 연결된 33G 바늘을 사용하여 시신경초를 뚫습니다(그림 1).
- 다양한 농도의 아데노 관련 바이러스-eGFP 또는 India Ink 염료를 직접 시각화하여 시신경에 주입하여 재료가 신경에 직접 주입되도록 합니다.
- AAV-eGFP를 평가하기 위해 AAV 바이러스 입자(2 x 1013 벡터 게놈(vg)/mL, 총 용량 2 x 1011 vg)를 포함하는 10μL의 현탁액을 주입합니다.
참고: 조사관은 실험 요구 사항에 따라 다른 염료 또는 염색을 주입할 수 있습니다.
6. 시술 후 단계
- 절개 부위를 덮기 위해 결막을 가장자리로 재근사화하고 결막 위에 항생제 연고를 바릅니다(그림 1).
- 동물이 마취에서 회복될 때까지 하고 감염 징후가 있는지 모니터링합니다.
7. 염색
- 주사 후 7일 후, CO2 질식 후 자궁 경부 탈구11을 통해 동물을 희생시킵니다. 시신경을 해부합니다.
- 시신경을 파라포름알데히드 4%로 고정하고 증가된 농도의 자당으로 헹굽니다. 2:1 비율의 OCT 화합물 용액에 cryomolds를 20% 자당으로 첨가합니다. 액체 질소의 샘플을 급속 동결하고 -80 ° C에서 보관하고 7 μm 두께로 절편합니다.
- 실온에서 30분 동안 면역세포화학(IHC) 완충액과 3% 소 혈청 알부민으로 시신경의 동결절편을 차단합니다. IHC 완충액에 희석된 rat anti-GFP 1차 항체로 절편을 실온에서 2시간 동안 배양합니다.
- IHC 완충액에서 염소 항쥐로 절편을 실온에서 추가로 1시간 동안 배양합니다. 2차 항체 배양 중에 4',6-Diamidino-2-phenylindole dihydrochloride(DAPI)로 섹션을 표시하여 세포핵을 시각화합니다. PBS로 섹션을 철저히 헹구고 장착 매체를 사용하여 장착합니다.
8. 이미징
- 정립 컨포칼 현미경 시스템을 사용하여 라벨링된 부분을 이미지화합니다.
- 구체적으로 405nm 바이올렛 레이저를 사용하여 DAPI 라벨링을 시각화하고 488nm 청록색 레이저를 사용하여 GFP를 시각화합니다.
참고: 각 레이저에 대한 설정(즉, 레이저 출력, 강도/게인, 배경/노이즈 필터)은 서로 다른 컨포칼 현미경 시스템에 대해 각 사용자가 최적화해야 합니다. 20x 대물렌즈를 사용하여 이미지를 획득합니다.
결과
쥐의 시신경 주입을 위해 이 기술을 사용한 대표적인 실험 결과는 그림 2에 나와 있습니다. 이 예에서는 10μL 주사기에 연결된 33G 바늘로 위에서 설명한 경결막 기술을 사용하여 아데노 관련 바이러스-eGFP(AAV-eGFP)를 쥐 시신경에 주입했습니다. 이러한 결과는 신경섬유종증 1(NF1)의 쥐 모델에서 AAV를 사용하여 시신경에 CRISPR 교정을 전달하려는 궁극적인 목표의 일환으로 시신경 주입을 연구하기 위해 이 기술을 사용하는 실험의 일부였습니다. 주입 기술을 개발하기 위해 염료와 AAV 벡터의 조합을 사용했습니다. 동물은 시신경에 주입된 지 7일 후에 희생되었습니다. 그런 다음 신경을 해부하고 항 GFP 항체로 라벨링하여 컨포칼 현미경으로 시신경을 이미징하여 물질이 시신경초를 성공적으로 관통하여 시신경에 들어갔는지 확인했습니다. 시신경으로의 물질의 성공적인 도입은 항체 염색에 의해 확인되었으며, 그림 2A에서 볼 수 있듯이 컨포칼 현미경 검사에서 녹색으로 나타났습니다. 시신경초를 통한 침투가 완전하지 않거나 바늘 궤도에서 물질이 유출된 경우, 그림 2C에서 볼 수 있듯이 신경 조직 내부가 아닌 시신경초의 가장자리를 따라 염색이 관찰되었습니다.
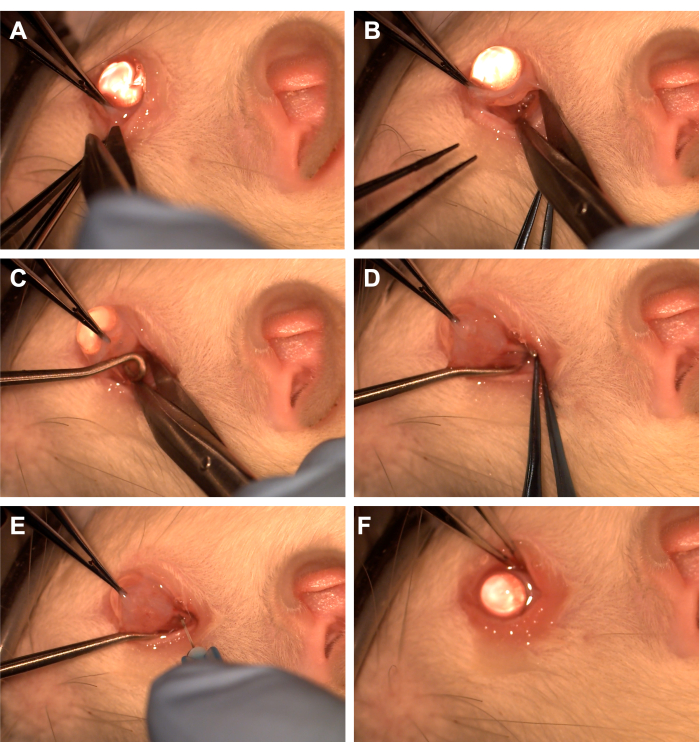
그림 1: 수술 단계의 순서. (A) 결막은 톱니가 있는 집게로 잡고 Westcott 가위를 사용하여 윤부 절개술을 만듭니다. (B) 장부의 근막을 열고 뭉툭하게 절개한 후, 웨스트콧 가위의 도움으로 안와를 노출시킵니다. (C) 척수 고리를 삽입하여 시신경을 분리하는 데 사용합니다. (D) 위에 있는 안와 조직을 둔기로 절제한 후 척수 고리를 사용하여 시신경을 노출시킵니다. (E) 33G 바늘을 사용하여 시신경초를 뚫고 아데노바이러스나 염료를 시신경에 주입합니다. (F) 지구는 궤도로 다시 배치되고 결막은 주위 부위 위에 재배치됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
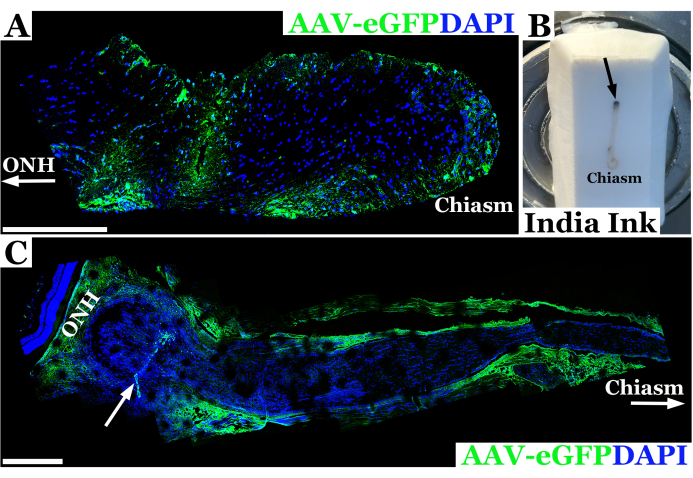
그림 2: AAV-eGFP(녹색)를 성공적으로 주입한 후 7일 후 쥐의 시신경을 보여주는 대표적인 형광 컨포칼 파노라마 이미지. (A) 시신경핵은 DAPI(파란색)로 표시되어 있습니다. 화살표가 있는 ONH는 시신경의 머리 또는 안와 끝을 나타내는 반면 시신경 끝은 "chiasm"으로 표시됩니다. (B) 안와에서 동결 냉동 절편 블록에 내장된 키즘까지 쥐의 시신경 사진. 신경은 시신경의 방향을 잡기 위해 안와(검은색 화살표로 표시된 주입 부위) 바로 뒤에 India Ink를 주입합니다. (C) AAV-eGFP(녹색) 주입 실패 후 7일 후 쥐의 시신경의 파노라마 형광 이미지로, 대부분의 벡터 현탁액이 신경관 밖으로 유출되어 시초를 전달했을 가능성이 있습니다. 시신경핵은 DAPI(파란색)로 표시되어 있습니다. ONH는 흰색 화살표로 표시된 신경 망막과 주입 부위 바로 뒤에 있는 시신경두를 나타냅니다. Chiasm과 흰색 화살표는 optic chiasm을 구분합니다. 스케일 바 = 400μm(A) 및 200μm(C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 변수 | 접근 | ||
| 경결막 | 우수한 | 옆의 | |
| 피부 절개 | 아니요 | 예 | 예 |
| 결막 절개 | 예 | 아니요 | 아니요 |
| 현미경 | 예 | 예 | 예 |
| 상안와근(superior orbital muscle)의 절개 | 아니요 | 예 | 아니요 |
| 견인 봉합사 | 아니요 | 예 | 예 |
| 척수 후크 | 예 | 아니요 | 아니요 |
| 피부 봉합사 | 아니요 | 예 | 예 |
표 1: 실험 연구를 위해 쥐의 시신경을 분리하기 위해 이전에 발표된 기술과의 비교. 피부 절개, 결막 절개, 수술 현미경, 상안와근 절제, 견인 봉합사, 척수 후크 및 피부 봉합사의 필요성을 포함한 변수를 경결막, 상결막 및 측면 접근법을 사용하여 비교합니다.
토론
이 기사는 피부 절개 없이 실험 연구를 위해 쥐의 시신경에 접근하는 새로운 방법을 설명합니다. 이 접근법은 다른 기법에 비해 피부 절개가 필요하지 않고 단계 수가 적다는 점을 감안할 때 효율성이 높고 감염 및 출혈 위험이 감소하는 잠재적인 이점을 제공한다 8,9. 이 기술은 또한 쥐의 척수 고리로 시신경을 분리하여 신경 및 주변 조직에 대한 외상을 방지하는 새로운 접근 방식을 사용합니다.
이 기술의 중요한 단계에는 결막하 공간에 접근하기 위한 적절한 윤부 절개, 시신경을 분리하기 위한 척수 후크 사용, 시신경초를 뚫고 시신경에 물질을 전달하기 위한 소구경 바늘 사용 등이 포함됩니다. 신경을 분리하기 위해 척수 고리를 회전할 때 주의해야 합니다. 신경이 명확하게 분리되어 있지 않은 경우 신경이 분리되었는지 확인하기 위해 후크를 여러 번 삽입해야 할 수 있으며, 더 나은 시각화를 위해 신경초에서 결합 조직을 제거하기 위해 솜 팁 애플리케이터를 사용할 수 있습니다. 이 기술에 대한 노출은 안와 지방이 많은 더 큰 동물에서 더 어려울 수 있습니다. 적절한 노출을 위해 주변 조직을 수축시키는 보조 도구를 사용하는 것은 이러한 상황에서 유용할 수 있습니다. 주사 중 시신경을 직접 시각화할 수 있도록 주의해야 합니다. 주사 중 신경초를 통해 바늘이 수직 방향을 유지하도록 하면 주사 성공률이 향상됩니다.
이 기술은 Raykova et al. 및 Hallas and Wells 8,9의 이전 연구를 기반으로 합니다. Raykova 등은 안와 융기 위에 생성된 피부 절개와 상안와 근육의 절개를 통한 우수한 접근 방식을 사용하여 쥐의 시신경에 접근하는 방법을 설명했습니다8. 이 접근법은 신경을 노출시킬 수 있지만, 출혈 위험이 더 높고 피부 절개 부위를 봉합해야 하는 안구 외 근육의 절개가 필요합니다. 이와 유사하게, Hallas와 Wells는 시신경9에 도달하기 위해 쥐 궤도에 대한 측면 접근을 설명한다. 그들은 측면 피부 절개 후 측면 결막 절개와 눈을 회전시키고 시신경을 노출시키는 데 사용되는 견인 봉합사에 대해 설명합니다9. 우수한 접근법과 유사하게, 이 기법은 상처 봉합이 필요하고 감염 및 출혈의 위험이 더 높은 피부 절개를 포함한다 8,9. 여기에 제시된 경결막 기술은 피부와 근육을 절개할 필요성을 없애주므로 출혈/감염의 위험을 줄이고 피부 절개 부위를 닫을 필요가 없어 효율성을 향상시킵니다. 이 절차는 최소한의 고통을 유발하고 내약성이 좋으며 진통제 또는 항염증제를 장기간 사용할 필요가 없습니다. 경결막 기법을 표 1에 이전에 발표된 기법과 비교 및 대조합니다.
이 연구에서 제시된 기술의 한계에는 척수 갈고리를 사용하여 시신경을 분리하는 학습 곡선이 포함되지만, 일단 숙달되면 이 기술을 사용하면 신경을 효율적이고 외상적으로 분리할 수 있습니다. 이 기술에는 작동 현미경 사용에 대한 지식이 필요합니다. 이 기법에 대한 학습 곡선이 있기는 하지만, 단계 수가 적고 상처 부위를 봉합할 필요가 없기 때문에 이 기법은 발표된 다른 접근법에 비해 더 쉽게 숙달할 수 있다 8,9. 신경과 초를 노출시키기 위해 조심스럽게 둔기를 해부하는 것이 필수적이며, 주변 혈관과 근육 조직에서 출혈이 있을 수 있습니다. 몸집이 큰 쥐의 경우 안와 지방/조직이 증가하기 때문에 시신경의 많은 부분을 노출시키는 것이 더 어려울 수 있지만, 주의를 기울이면 일반적으로 신경의 시각화를 개선하기 위해 둔기 절개로 이 조직을 제거할 수 있습니다. 추가 연구를 통해 마우스와 같은 다른 모델 시스템에서 이 기술을 사용하는 문제를 해결할 수 있으며 시신경 접근을 위한 다른 기술과 수술 효율성을 직접 비교할 수 있습니다.
이 기술은 실험 연구를 위해 쥐의 시신경에 접근해야 하는 다른 그룹에서 사용할 수 있습니다. 여기에 제시된 실험은 신경섬유종증 1형(NF1)의 쥐 모델에서 시신경에 CRISPR 유전자 교정을 전달하는 방법을 개발하는 것을 목표로 하는 대규모 프로젝트의 일부였습니다. 이 프로젝트의 궁극적인 목표는 NF1 환자의 시신경에 직접 유전자 요법을 전달하여 시력을 위협하는 시신경 신경교종의 발병을 예방하는 방법을 찾는 것입니다12. 이 연구에서는 India Ink dye 또는 AAV-eGFP 벡터를 시신경에 주입하여 물질이 시신경으로 전달되고 있는지 확인하고 벡터가 시신경을 관통할 수 있음을 입증했습니다.
이 기술은 시신경의 신생물, Leber 유전성 시신경병증, 외상성 시신경병증, 녹내장과 같은 퇴행성 과정, 시신경염과 같은 자가면역 질환을 포함한 다양한 시력 위협 상태를 치료하기 위해 신경에 접근하거나 새로운 치료법을 주입해야 할 수 있기 때문에 다른 연구자들에 의해 더 광범위하게 사용될 수 있습니다13 14. 예를 들어, Singh 등은 C6 신경교종 세포를 쥐의 시신경에 주입하는 것을 피부 절개를 사용하여 신경에 접근하는 신경섬유종증 1형의 모델로 설명하고, 3, Kwon 등은 줄기세포를 이용한 시신경 압박 및 재생과 관련된 연구를 위해 측면 피부 접근법에서 시신경에 접근했으며, 6 Negishi 등은 시신경 모델로서 Schwann 세포 이식 배치를 위해 쥐의 시신경에 접근했습니다 재생15. 여기에 제시된 기술은 다양한 실험 질문에 답하기 위해 쥐의 시신경에 접근해야 하는 이와 같은 연구에 보다 효율적이고 안전한 접근 방식을 제공할 수 있습니다.
요약하면, 이 연구는 스몰 게이지 바늘 접근법으로 시신경에 침투하는 효능과 피부 절개 없이 신경초를 관통할 수 있는 능력을 보여줍니다. 대표적인 이미지는 아데노바이러스 벡터가 시신경을 성공적으로 관통했음을 보여줍니다. 이 기술은 재생 의학, 종양학 및 유전성 망막 질환의 다양한 시신경 실험에 응용됩니다.
공개
관련 공개 없음.
감사의 말
저자는 이 프로젝트에 자금을 지원한 Gilbert Family Foundation에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
참고문헌
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유