Method Article
Abordaje transconjuntival para inyección en el nervio óptico de la rata
En este artículo
Resumen
Este protocolo describe una técnica única que utiliza un abordaje transconjuntival para acceder al nervio óptico de rata para inyecciones.
Resumen
La rata sirve como un modelo importante para el estudio de los trastornos del nervio óptico, incluidas las afecciones hereditarias, traumáticas, neoplásicas y autoinmunes. El acceso al nervio óptico de la rata para manipulaciones e inyecciones experimentales es un desafío debido al pequeño tamaño de la órbita y la vascularización de los tejidos orbitales circundantes. Las técnicas anteriores han implicado una incisión cutánea, que conlleva un mayor riesgo de infección y requiere el cierre de la herida. Este estudio tiene como objetivo describir un enfoque único, menos invasivo y potencialmente más eficiente para acceder al nervio óptico de rata. Se utiliza una incisión transconjuntival, junto con un gancho de médula espinal de rata, para aislar el nervio óptico y aplicarlo a las inyecciones experimentales. En estos experimentos, se inyecta un vector adenoviral en el nervio óptico con el objetivo de utilizar esta técnica para la administración directa de terapia génica en el futuro. Esta técnica también puede ser aplicada por investigadores que requieran acceso al nervio óptico de rata para otros estudios experimentales, incluida la administración de fármacos y la investigación de lesiones del nervio óptico.
Introducción
La rata es un modelo experimental clave para el estudio de los trastornos del nervio óptico, como el glaucoma, la neuropatía óptica traumática, la neuropatía óptica hereditaria, la enfermedad desmielinizante y los tumores del nervio óptico2,3,4,5,6,7. Sin embargo, obtener acceso al nervio óptico para la inyección experimental y las manipulaciones puede ser difícil, dado el pequeño tamaño de la órbita y los tejidos vasculares orbitarios.
Las dos técnicas previas que se han descrito para acceder al nervio óptico de rata para manipulaciones experimentales utilizan un abordaje orbital superior o transcutáneo lateral para acceder a la órbita 8,9. Raykova et al. describen la inyección de cuentas teñidas en el nervio óptico mediante una incisión cutánea orbitaria superior8. Si bien su técnica fue efectiva, requiere hemostasia y la necesidad de una sutura de tracción para la exposición, lo que puede ser más desafiante con este enfoque8. Otro grupo describió de manera similar un enfoque que utiliza una incisión lateral en la piel para acceder a la órbita. Lograron inyectar con éxito el nervio óptico mediante este abordaje, pero requirieron hemostasia y cierre de la herida9. Si bien estas técnicas son enfoques efectivos para acceder al nervio óptico para el estudio experimental, ambas implican una incisión cutánea, la necesidad de hemostasia y el cierre de la herida. Estas medidas tienen asociados riesgos de infección y potencialmente aumento del tiempo bajo anestesia debido a la necesidad de cierre de la herida 8,9,10.
Dadas las limitaciones de las técnicas anteriormente descritas, el objetivo de este estudio es describir un enfoque más eficiente y menos traumático para acceder al nervio para su estudio experimental. Se utiliza un gancho de la médula espinal para aislar el nervio óptico, de forma análoga a la técnica quirúrgica utilizada en los seres humanos para aislar las estructuras musculares y anexiales oculares mediante un gancho muscular. Esta técnica puede ser utilizada por investigadores que necesitan acceder al nervio óptico de la rata para muchas indicaciones, desde la administración de fármacos hasta la terapia génica.
Este artículo describe el uso novedoso de un abordaje transconjuntival para acceder a la órbita y el nervio óptico de rata para su estudio experimental con la ayuda de un gancho de médula espinal.
Protocolo
Todos los procedimientos con animales fueron aprobados por la Oficina del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Iowa. Este estudio fue financiado por la Fundación de la Familia Gilbert (subvención número 913012). Para estos experimentos se utilizó una combinación de ratas Sprague Dawley macho y hembra, de 4 a 12 semanas de edad y con un peso de 100 a 400 g. Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Anestesia
- Anestesiar ratas mediante la inhalación de gas isoflurano. Coloque al animal en la cámara de inducción y gire el vaporizador a 4%-5% para la inducción de la anestesia y 2%-3% para mantener la anestesia.
- Verifique la profundidad de la anestesia evaluando la ausencia del reflejo de retirada del pedal antes de continuar.
- Aplicar gel lagrimal artificial sobre la superficie ocular.
2. Posicionamiento
- Una vez inducida la anestesia, coloque al animal sobre una almohadilla térmica en posición recostada lateral. Use una nariz para mantener la anestesia.
- Coloque la órbita debajo del microscopio operativo.
3. Exposición quirúrgica
- Agarre la conjuntiva con pinzas dentadas en el cuadrante inferotemporal (Figura 1).
- Use tijeras Westcott para crear una incisión conjuntival radial y luego abra la fascia de Tenon en el cuadrante inferonasal (Figura 1). Use la disección roma para extirpar el tejido orbital suprayacente.
4. Aislamiento del nervio óptico
- Gire el ojo nasalmente con pinzas dentadas y haga que el asistente pase un gancho de médula espinal en el cuadrante inferotemporal para aislar el nervio óptico (Figura 1). Tenga cuidado de evitar la vena oftálmica ventral y los músculos extraoculares.
- Extirpe el tejido orbital suprayacente y la fascia de Tenon mediante una disección roma con un aplicador con punta de algodón o pinzas para exponer el nervio óptico y la vaina.
5. Inyección
- Utilice una aguja de 33 G conectada a una jeringa de 10 uL o 1 mL para perforar la vaina del nervio óptico (Figura 1).
- Inyecte diferentes concentraciones de virus adenoasociados-eGFP o tinte de tinta india en el nervio óptico bajo visualización directa para asegurarse de que el material se inyecte directamente en el nervio.
- Para evaluar la AAV-eGFP, inyecte 10 μL de suspensión que contenga partículas virales de AAV (2 x 1013 genomas vectoriales (vg)/mL para una dosis total de 2 x 1011 vg).
NOTA: Los investigadores pueden inyectar otros tintes o tinciones dependiendo de las necesidades experimentales.
6. Etapas posteriores al procedimiento
- Vuelva a aproximar la conjuntiva al limbo para cubrir el sitio de la incisión y aplique ungüento antibiótico sobre la conjuntiva (Figura 1).
- Permita que los animales se recuperen de la anestesia y vigílelos para detectar cualquier signo de infección.
7. Manchas
- Siete días después de la inyección, sacrificar a los animales mediante asfixia por CO2 seguida de luxación cervical11 siguiendo las pautas éticas. Disecciona el nervio óptico.
- Fije los nervios ópticos en paraformaldehído al 4% y enjuague con concentraciones aumentadas de sacarosa. Incruste los criomoldes en una solución 2:1 de compuesto OCT al 20% de sacarosa. Congele rápidamente las muestras en nitrógeno líquido, almacene a -80 °C y córtelas en secciones con un espesor de 7 μm.
- Bloquear las criosecciones del nervio óptico durante 30 min a temperatura ambiente en tampón inmunocitoquímico (IHQ) y albúmina sérica bovina al 3%. Incubar secciones con anticuerpo primario anti-GFP de rata diluido en tampón IHQ durante 2 h a temperatura ambiente.
- Incubar secciones con anti-ratas de cabra en tampón IHC durante 1 h adicional a temperatura ambiente. Durante la incubación secundaria de anticuerpos, marque las secciones con diclorhidrato de 4',6-Diamidino-2-fenilindol (DAPI) para visualizar los núcleos celulares. Enjuague bien las secciones con PBS y móntelas con un medio de montaje.
8. Imágenes
- Tome imágenes de las secciones etiquetadas utilizando un sistema de microscopio confocal vertical.
- En concreto, utilice un láser violeta de 405 nm para visualizar el etiquetado DAPI y un láser cian de 488 nm para visualizar GFP.
NOTA: Los ajustes de cada láser (es decir, potencia del láser, intensidad/ganancia, filtros de fondo/ruido) deben ser optimizados por cada usuario para diferentes sistemas de microscopio confocal. Adquiera imágenes con una lente de objetivo de 20x.
Resultados
En la Figura 2 se muestran los resultados experimentales representativos utilizando esta técnica para la inyección del nervio óptico en ratas. En este ejemplo, se inyectó el virus adenoasociado eGFP (AAV-eGFP) en el nervio óptico de rata utilizando la técnica transconjuntival descrita anteriormente con una aguja de 33 G conectada a una jeringa de 10 μL. Estos resultados formaron parte de un experimento en el que se utilizó esta técnica para estudiar la inyección del nervio óptico como parte de un objetivo final de utilizar el AAV para proporcionar corrección CRISPR a los nervios ópticos en un modelo de rata de neurofibromatosis 1 (NF1). Se utilizó una combinación de colorante y vector AAV para desarrollar la técnica de inyección. Los animales fueron sacrificados siete días después de la inyección en el nervio óptico. A continuación, se diseccionaron los nervios y se marcaron con anticuerpos anti-GFP para permitir la obtención de imágenes del nervio óptico con microscopía confocal para confirmar que el material había penetrado con éxito en la vaina del nervio óptico y había entrado en el nervio óptico. La introducción exitosa de material en el nervio óptico se confirmó mediante tinción de anticuerpos, y apareció verde en la microscopía confocal, como se ve en la Figura 2A. En los casos en que la penetración a través de la vaina del nervio óptico no fue completa, o hubo eflujo de material desde la pista de la aguja, se observaron tinciones a lo largo del borde de la vaina del nervio óptico en lugar de dentro del tejido nervioso, como se ve en la Figura 2C.
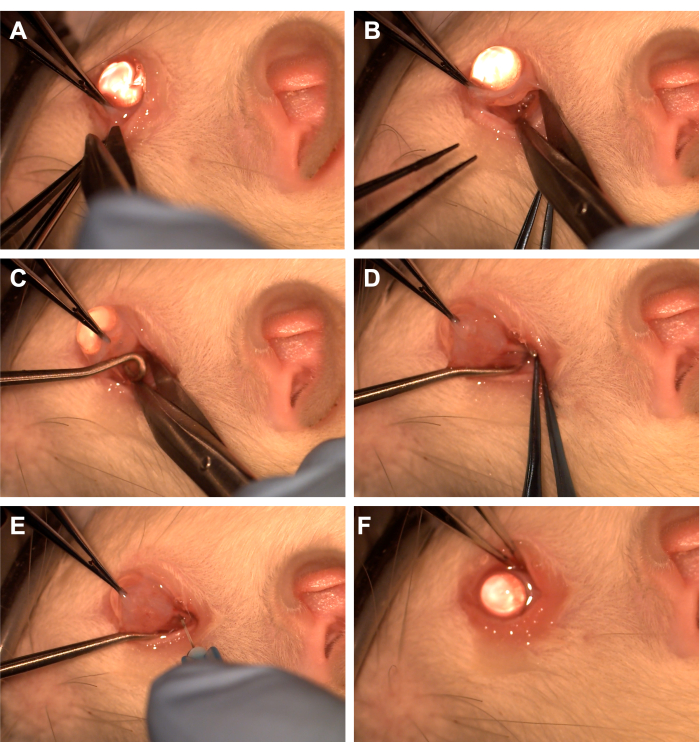
Figura 1: Secuencia de los pasos quirúrgicos. (A) La conjuntiva se agarra con pinzas dentadas y se utilizan tijeras Westcott para crear una peritomía limbal. (B) Después de que la fascia de la espiga se abre y se disecciona sin rodeos, la órbita se expone con la ayuda de tijeras Westcott. (C) Se inserta un gancho de médula espinal y se utiliza para aislar el nervio óptico. (D) Después de la disección roma del tejido orbitario suprayacente, el nervio óptico se expone utilizando el gancho de la médula espinal. (E) Se utiliza una aguja de 33 G para perforar la vaina del nervio óptico e inyectar adenovirus o tinte en el nervio óptico. (F) El globo se deposita en la órbita y la conjuntiva se reposiciona sobre el sitio de la peritomía. Haga clic aquí para ver una versión más grande de esta figura.
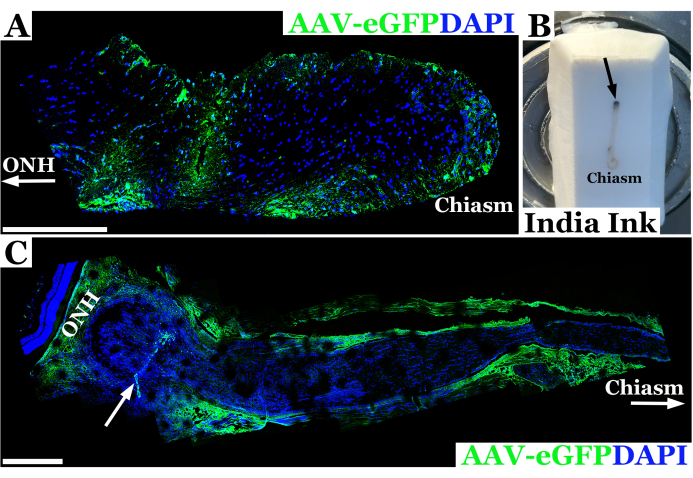
Figura 2: Imagen panorámica confocal fluorescente representativa del nervio óptico de rata 7 días después de la inyección exitosa con AAV-eGFP (verde) en la que las neuronas transducidas vectoriales cerca del quiasma óptico. (A) Los núcleos del nervio óptico están marcados con DAPI (azul). La ONH con flecha denota la cabeza del nervio óptico o el extremo orbital del nervio, mientras que el extremo del quiasma óptico se etiqueta como "quiasma". (B) Fotografía de un nervio óptico de rata desde la órbita hasta el quiasma incrustado en un bloque de criosección congelado. El nervio se inyecta con tinta china inmediatamente después de la órbita (el sitio de inyección se indica con una flecha negra) para orientar el nervio óptico. (C) Imagen fluorescente panorámica del nervio óptico de rata 7 días después de una inyección fallida con AAV-eGFP (verde) en la que la mayor parte de la suspensión vectorial probablemente se efusivó fuera del tracto nervioso, transduciendo la vaina óptica. Los núcleos del nervio óptico están marcados con DAPI (azul). ONH denota la cabeza del nervio óptico inmediatamente posterior a la retina neural y el sitio de inyección indicado por una flecha blanca. El quiasma y la flecha blanca se demarcan hacia el quiasma óptico. Barras de escala = 400 μm en (A) y 200 μm en (C). Haga clic aquí para ver una versión más grande de esta figura.
| Variable | Acercarse | ||
| Transconjuntival | Superior | Lateral | |
| Incisión en la piel | No | Sí | Sí |
| Incisión conjuntival | Sí | No | No |
| Microscopio | Sí | Sí | Sí |
| Transección del músculo orbitario superior | No | Sí | No |
| Sutura de tracción | No | Sí | Sí |
| Gancho de la médula espinal | Sí | No | No |
| Sutura cutánea | No | Sí | Sí |
Tabla 1: Comparación con técnicas previamente publicadas para aislar el nervio óptico de rata para estudio experimental. Las variables, como la necesidad de incisión en la piel, la incisión conjuntival, el microscopio quirúrgico, la transección del músculo orbitario superior, la sutura de tracción, el gancho de la médula espinal y la sutura de la piel, se comparan mediante los abordajes transconjuntival, superior y lateral.
Discusión
Este artículo describe un método novedoso para acceder al nervio óptico de rata para su estudio experimental sin la necesidad de una incisión en la piel. Este abordaje proporciona las ventajas potenciales de la eficiencia y la disminución del riesgo de infección y sangrado, dada la ausencia de necesidad de incisión en la piel y la menor cantidad de pasos en comparación con otras técnicas 8,9. Esta técnica también utiliza el enfoque novedoso de aislar el nervio óptico con un gancho de médula espinal de rata para evitar traumatismos en el nervio y los tejidos circundantes.
Los pasos críticos en la técnica incluyen la realización de una incisión limbal adecuada para acceder al espacio subconjuntival, el uso del gancho de la médula espinal para aislar el nervio óptico y el uso de una aguja de pequeño calibre para perforar la vaina del nervio óptico y administrar material al nervio óptico. Se debe tener cuidado de rotar el gancho de la médula espinal para aislar el nervio. Cuando el nervio no está claramente aislado, es posible que sea necesario introducir el gancho varias veces para garantizar que el nervio esté aislado, y se puede usar un aplicador con punta de algodón para eliminar el tejido conectivo de la vaina nerviosa para una mejor visualización. La exposición a esta técnica puede ser más desafiante en animales de mayor tamaño con un mayor volumen de grasa orbital. El uso de un asistente para retraer los tejidos circundantes para una exposición adecuada puede ser útil en estas situaciones. Se debe tener cuidado de visualizar el nervio óptico directamente durante la inyección. Asegurar una orientación perpendicular de la aguja a través de la vaina nerviosa durante la inyección mejora el éxito de la inyección.
Esta técnica se basa en trabajos previos de Raykova et al. y Hallas y Wells 8,9. Raykova et al. describieron el acceso al nervio óptico de rata utilizando un abordaje superior con una incisión en la piel creada sobre la cresta orbitaria y la transección del músculo orbitario superior8. Si bien este enfoque permite la exposición del nervio, requiere la transección de un músculo extraocular con un mayor riesgo de sangrado y la necesidad de sutura de la incisión en la piel. De manera similar, Hallas y Wells describen un acercamiento lateral a la órbita de la rata para alcanzar el nervio óptico9. Describen una incisión lateral en la piel seguida de una incisión conjuntival lateral y una sutura de tracción utilizada para rotar el ojo y exponer el nervio óptico9. Al igual que el abordaje superior, esta técnica implica una incisión en la piel con la consiguiente necesidad de cierre de la herida y un mayor riesgo de infección y sangrado 8,9. La técnica transconjuntival presentada aquí evita la necesidad de una incisión en la piel y el músculo, lo que reduce el riesgo de sangrado/infección y mejora la eficiencia al evitar la necesidad de cerrar una incisión en la piel. El procedimiento causa un sufrimiento mínimo, es bien tolerado y no requiere el uso prolongado de medicamentos analgésicos o antiinflamatorios. La técnica transconjuntival se compara y contrasta con las técnicas previamente publicadas en la Tabla 1.
Las limitaciones de la técnica presentada en este estudio incluyen una curva de aprendizaje para aislar el nervio óptico utilizando el gancho de la médula espinal, pero una vez dominada, esta técnica permite un aislamiento eficiente y atraumático del nervio. Para esta técnica es necesario estar familiarizado con el uso de un microscopio quirúrgico. Si bien existe una curva de aprendizaje para esta técnica, el menor número de pasos y la ausencia de la necesidad de suturar la herida harán que esta técnica sea más fácil de dominar en relación con los otros enfoques publicados 8,9. Es imprescindible una disección roma cuidadosa para exponer el nervio y la vaina, ya que puede haber hemorragia de los vasos cercanos y el tejido muscular. En ratas más grandes, puede ser más difícil exponer grandes secciones del nervio óptico debido al aumento de la grasa/tejido orbital, pero con cuidado, este tejido generalmente se puede extirpar con una disección roma para mejorar la visualización del nervio. Trabajos posteriores podrían abordar el uso de esta técnica en otros sistemas modelo, como el ratón, y podrían comparar directamente la eficiencia quirúrgica con otras técnicas para el acceso al nervio óptico.
Esta técnica puede ser utilizada por otros grupos que necesiten acceder al nervio óptico de rata para su estudio experimental. Los experimentos presentados aquí fueron parte de un proyecto más amplio que tiene como objetivo desarrollar formas de administrar la corrección génica CRISPR al nervio óptico en modelos de ratas de neurofibromatosis tipo 1 (NF1). El objetivo final de este proyecto es encontrar formas de administrar terapia génica directamente al nervio óptico en pacientes con NF1 para prevenir el desarrollo de gliomas del nervio óptico, que amenazan la visión12. En este estudio, se inyectó un tinte de tinta china o un vector AAV-eGFP en el nervio óptico para garantizar que el material se entregara al nervio óptico y para demostrar que el vector podía penetrar en el nervio óptico.
Esta técnica podría ser utilizada más ampliamente por otros investigadores, ya que es posible que sea necesario acceder al nervio o inyectar nuevas terapias en un esfuerzo por tratar una variedad de afecciones que amenazan la visión, incluidas las neoplasias del nervio óptico, los procesos degenerativos como la neuropatía óptica hereditaria de Leber, la neuropatía óptica traumática, el glaucoma y las enfermedades autoinmunes como laneuritis óptica. 14. Por ejemplo, Singh et al. describen la inyección de células de glioma C6 en el nervio óptico de rata como un modelo de neurofibromatosis tipo 1 accediendo al nervio mediante una incisión cutánea3, Kwon et al. accedieron al nervio óptico desde un abordaje cutáneo lateral para estudios que involucran compresión y regeneración del nervio óptico con células madre6, y Negishi et al. accedieron al nervio óptico de rata para la colocación de injertos de células de Schwann como modelo de nervio óptico Regeneración15. La técnica presentada aquí podría proporcionar un enfoque más eficiente y seguro para estudios como estos que requieren acceso al nervio óptico de rata para responder a una variedad de preguntas experimentales.
En resumen, este trabajo demuestra la eficacia en la introducción del nervio óptico con un abordaje de aguja de pequeño calibre y la capacidad de penetrar en la vaina nerviosa sin necesidad de una incisión cutánea. Las imágenes representativas muestran que el vector adenoviral penetró con éxito en el nervio óptico. Esta técnica tiene aplicaciones en una variedad de experimentos con el nervio óptico en medicina regenerativa, oncología y enfermedades hereditarias de la retina.
Divulgaciones
No hay divulgaciones relevantes.
Agradecimientos
Los autores desean agradecer a la Fundación de la Familia Gilbert por financiar este proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Referencias
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados