Method Article
نهج عبر الملتحمة للحقن في العصب البصري للفئران
In This Article
Summary
يصف هذا البروتوكول تقنية فريدة باستخدام نهج عبر الملتحمة للوصول إلى العصب البصري للفئران للحقن.
Abstract
يعمل الجرذ كنموذج مهم لدراسة اضطرابات العصب البصري ، بما في ذلك الأمراض الوراثية والرضية والأورام والمناعة الذاتية. يعد الوصول إلى العصب البصري للفئران للتلاعب والحقن التجريبي أمرا صعبا نظرا لصغر حجم المدار والأوعية الدموية للأنسجة المدارية المحيطة. تضمنت التقنيات السابقة شقا جلديا ، والذي ينطوي على خطر أكبر للإصابة بالعدوى ويتطلب إغلاق الجرح. تهدف هذه الدراسة إلى وصف نهج فريد وأقل توغلا وربما أكثر كفاءة للوصول إلى العصب البصري للفئران. يتم استخدام شق عبر الملتحمة ، جنبا إلى جنب مع خطاف الحبل الشوكي للفئران ، لعزل العصب البصري للحقن التجريبي. في هذه التجارب ، يتم حقن ناقل الفيروس الغدي في العصب البصري بهدف استخدام هذه التقنية لتوصيل العلاج الجيني المباشر في المستقبل. يمكن أيضا تطبيق هذه التقنية من قبل الباحثين الذين يحتاجون إلى الوصول إلى العصب البصري للفئران لإجراء دراسات تجريبية أخرى ، بما في ذلك توصيل الأدوية وأبحاث إصابة العصب البصري.
Introduction
الجرذ هو نموذج تجريبي رئيسي لدراسة اضطرابات العصب البصري ، بما في ذلك الجلوكوما ، والاعتلال العصبي البصري الرضحي ، والاعتلال العصبي البصري الوراثي ، ومرض إزالة الميالين ، وأورام العصب البصري ، 2،3،4،5،6،7. ومع ذلك ، قد يكون الوصول إلى العصب البصري للحقن التجريبي والتلاعب أمرا صعبا ، نظرا لصغر حجم المدار والأنسجة المدارية الوعائية.
تستخدم التقنيتان السابقتان اللتان تم وصفهما للوصول إلى العصب البصري للفئران للتلاعب التجريبي إما نهجا مداريا أو جانبيا عبر الجلد للوصول إلى المدار8،9. يصف Raykova et al. حقن الخرز المصبوغ في العصب البصري باستخدام شق جلدي مداري علوي8. في حين أن أسلوبهم كان فعالا ، إلا أنه يتطلب الإرقاء والحاجة إلى خياطة جر للتعرض ، والتي يمكن أن تكون أكثر صعوبة مع هذاالنهج 8. وبالمثل وصفت مجموعة أخرى نهجا يستخدم شق جانبي في الجلد للوصول إلى المدار. لقد تمكنوا بنجاح من حقن العصب البصري باستخدام هذا النهج ، لكنهم تطلبوا الإرقاء وإغلاق الجرح9. في حين أن هذه التقنيات هي طرق فعالة للوصول إلى العصب البصري للدراسة التجريبية ، إلا أن كلاهما يتضمن شقا جلديا ، والحاجة إلى الإرقاء ، وإغلاق الجرح. ترتبط هذه الخطوات بمخاطر الإصابة بالعدوى وربما زيادة الوقت تحت التخدير بسبب الحاجة إلى إغلاق الجرح8،9،10.
نظرا لقيود التقنيات الموصوفة سابقا ، فإن الهدف من هذه الدراسة هو وصف نهج أكثر كفاءة وأقل صدمة للوصول إلى العصب للدراسة التجريبية. يستخدم خطاف الحبل الشوكي لعزل العصب البصري ، على غرار التقنية الجراحية المستخدمة في البشر لعزل الهياكل العضلية والعينية باستخدام خطاف العضلات. يمكن استخدام هذه التقنية من قبل الباحثين الذين يحتاجون إلى الوصول إلى العصب البصري للفئران للعديد من المؤشرات ، من توصيل الدواء إلى العلاج الجيني.
تصف هذه المقالة الاستخدام الجديد لنهج عبر الملتحمة للوصول إلى مدار الفئران والعصب البصري للدراسة التجريبية بمساعدة خطاف الحبل الشوكي.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل مكتب اللجنة المؤسسية لرعاية واستخدامه في جامعة أيوا. تم تمويل هذه الدراسة من قبل مؤسسة عائلة جيلبرت (رقم المنحة 913012). تم استخدام مزيج من ذكور وإناث فئران Sprague Dawley ، الذين تتراوح أعمارهم بين 4 و 12 أسبوعا ووزنهم 100-400 جرام ، في هذه التجارب. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. التخدير
- تخدير الفئران باستخدام استنشاق غاز الأيزوفلوران. ضع في غرفة الحث وقم بتحويل المرذاذ إلى 4٪ -5٪ لتحريض التخدير و 2٪ -3٪ للحفاظ على التخدير.
- تحقق من عمق التخدير من خلال تقييم عدم وجود منعكس سحب الدواسة قبل المتابعة.
- ضع جل المسيل للدموع الاصطناعي على سطح العين.
2. تحديد المواقع
- بمجرد تحفيز التخدير ، ضع على وسادة تسخين في وضع الاستلقاء الجانبي. استخدم مخروط الأنف للحفاظ على التخدير.
- ضع المدار أسفل مجهر التشغيل.
3. التعرض الجراحي
- أمسك الملتحمة بالملقط المسنن في الربع السفلي الصدغي (الشكل 1).
- استخدم مقص Westcott لإنشاء شق ملتحمة شعاعي ثم افتح لفافة Tekon في الربع الجحيمي (الشكل 1). استخدم تشريحا حادا لإزالة الأنسجة المدارية العلوية.
4. عزل العصب البصري
- قم بتدوير العين عن طريق الأنف باستخدام ملقط مسنن واطلب من المساعد تمرير خطاف الحبل الشوكي إلى الربع السفلي الصدغي لعزل العصب البصري (الشكل 1). احرص على تجنب الوريد البطني للعين والعضلات خارج العين.
- قم بإزالة الأنسجة المدارية المغطاة ولفافة تينون باستخدام تشريح حاد باستخدام قضيب قطني أو ملقط لكشف العصب البصري والغمد.
5. الحقن
- استخدم إبرة 33 جم متصلة بحقنة 10 ميكرولتر أو 1 مل لاختراق غمد العصب البصري (الشكل 1).
- حقن تركيزات مختلفة من صبغة الحبر الهندي المرتبطة بالفيروس الغدي أو صبغة الحبر الهندي في العصب البصري تحت التصور المباشر لضمان حقن المادة مباشرة في العصب.
- لتقييم AAV-eGFP ، قم بحقن 10 ميكرولتر من المعلق الذي يحتوي على جزيئات فيروسية AAV (2 × 1013 جينوم ناقل (vg) / مل للحصول على جرعة إجمالية تبلغ 2 × 1011 vg).
ملاحظة: قد يقوم الباحثون بحقن أصباغ أو بقع أخرى حسب الاحتياجات التجريبية.
6. خطوات ما بعد الإجراءات
- أعد تقريب الملتحمة إلى الأطراف لتغطية موقع الشق وتطبيق مرهم مضاد حيوي على الملتحمة (الشكل 1).
- اسمح للحيوانات بالتعافي من التخدير وراقبها بحثا عن أي علامات للعدوى.
7. تلطيخ
- بعد سبعة أيام من الحقن ، قم بالتضحية بالحيوانات عن طريق اختناق ثاني أكسيد الكربون2 متبوعا بخلع عنقالرحم 11 باتباع الإرشادات الأخلاقية. تشريح العصب البصري.
- ثبت الأعصاب البصرية في 4٪ بارافورمالدهيد واشطفها بتركيزات متزايدة من السكروز. قم بتضمين قوالب التبريد في محلول 2: 1 من مركب OCT إلى 20٪ سكروز. عينات التجميد السريع في النيتروجين السائل ، وتخزينها في -80 درجة مئوية وقسمها بسمك 7 ميكرومتر.
- منع القطع بالتبريد للعصب البصري لمدة 30 دقيقة في درجة حرارة الغرفة في المخزن المؤقت للخلايا المناعية (IHC) وزلاليم مصل الأبقار بنسبة 3٪. احتضان الأقسام بالجسم المضاد الأولي للفئران المضادة ل GFP المخفف في عازلة IHC لمدة ساعتين في درجة حرارة الغرفة.
- احتضان الأقسام مع الماعز المضاد للفئران في المخزن المؤقت IHC لمدة 1 ساعة إضافية في درجة حرارة الغرفة. أثناء حضانة الأجسام المضادة الثانوية ، قم بتسمية الأقسام التي تحتوي على 4 '، 6-Diamidino-2-phenylindole dihydrochloride (DAPI) لتصور نوى الخلية. اشطف الأقسام جيدا باستخدام PBS وقم بتثبيتها باستخدام وسيط تثبيت.
8. التصوير
- قم بتصوير الأقسام المسماة باستخدام نظام مجهر متحد البؤر المستقيم.
- على وجه التحديد ، استخدم ليزر بنفسجي 405 نانومتر لتصور ملصقات DAPI وليزر سماوي 488 نانومتر لتصور GFP.
ملاحظة: يجب تحسين إعدادات كل ليزر (أي طاقة الليزر ، والكثافة / الكسب ، ومرشحات الخلفية / الضوضاء) من قبل كل مستخدم لأنظمة المجهر متحد البؤر المختلفة. احصل على الصور باستخدام عدسة موضوعية 20x.
النتائج
تظهر النتائج التجريبية التمثيلية باستخدام هذه التقنية لحقن العصب البصري للفئران في الشكل 2. في هذا المثال ، تم حقن الفيروس eGFP المرتبط بالغدة (AAV-eGFP) في العصب البصري للفئران باستخدام تقنية عبر الملتحمة الموضحة أعلاه بإبرة 33 G متصلة بحقنة 10 ميكرولتر. كانت هذه النتائج جزءا من تجربة باستخدام هذه التقنية لدراسة حقن العصب البصري كجزء من الهدف النهائي لاستخدام AAV لتقديم تصحيح CRISPR للأعصاب البصرية في نموذج الفئران من الورم العصبي الليفي 1 (NF1). تم استخدام مزيج من الصبغة وناقلات AAV لتطوير تقنية الحقن. تم التضحية بالحيوانات بعد سبعة أيام من الحقن في العصب البصري. ثم تم تشريح الأعصاب وتصنيفها بالأجسام المضادة ل GFP للسماح بتصوير العصب البصري باستخدام الفحص المجهري متحد البؤر للتأكد من أن المادة قد اخترقت بنجاح غمد العصب البصري ودخلت العصب البصري. تم تأكيد الإدخال الناجح للمادة في العصب البصري عن طريق تلطيخ الأجسام المضادة ، وظهرت باللون الأخضر في الفحص المجهري متحد البؤر ، كما هو موضح في الشكل 2 أ. في الحالات التي لم يكتمل فيها الاختراق عبر غمد العصب البصري ، أو كان هناك تدفق للمواد من مسار الإبرة ، شوهد تلطيخ على طول حافة غمد العصب البصري بدلا من داخل الأنسجة العصبية ، كما هو موضح في الشكل 2C.
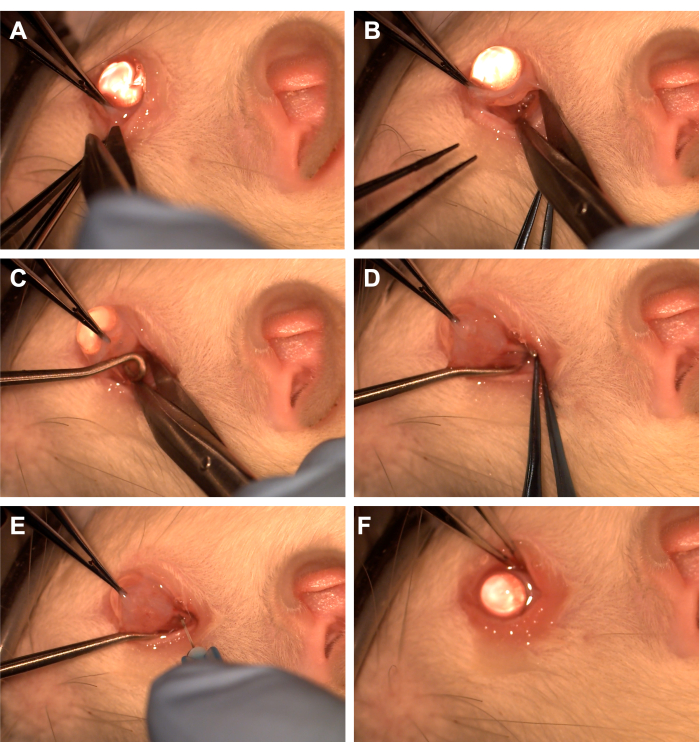
الشكل 1: تسلسل الخطوات الجراحية. (أ) يتم إمساك الملتحمة بالملقط المسنن ، ويستخدم مقص Westcott لإنشاء استئصال الصفاق الدافي. (ب) بعد فتح لفافة اللسان وتشريحها بصراحة ، يتم الكشف عن المدار بمساعدة مقص Westcott. (ج) يتم إدخال خطاف الحبل الشوكي واستخدامه لعزل العصب البصري. (د) بعد التشريح الحاد للأنسجة الحجاجية المغطى ، يتم الكشف عن العصب البصري باستخدام خطاف الحبل الشوكي. (ه) تستخدم إبرة 33 جم لثقب غمد العصب البصري وحقن الفيروس الغدي أو الصبغة في العصب البصري. (و) يتم وضع الكرة الأرضية في المدار، ويعاد وضع الملتحمة فوق موقع استئصال الصفاق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
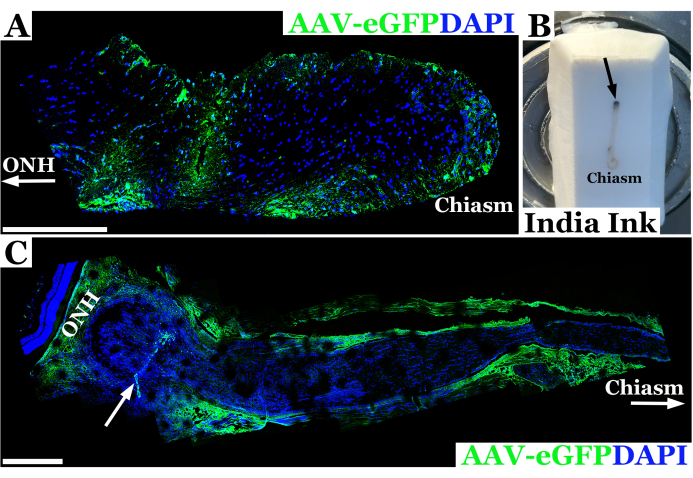
الشكل 2: صورة بانورامية ممثلة فلورسنت متحدة البؤر للعصب البصري للفئران بعد 7 أيام من الحقن الناجح باستخدام AAV-eGFP (أخضر) حيث تم نقل الخلايا العصبية المتجهة بالقرب من التصاب البصري. (أ) يتم تمييز نوى العصب البصري ب DAPI (أزرق). يشير ONH مع السهم إلى رأس العصب البصري أو الطرف المداري للعصب ، في حين أن نهاية chiasm البصرية تسمى "chiasm". (ب) صورة فوتوغرافية لعصب بصري للفأر من المدار إلى التصلب مدمج في إدرار القطع بالتبريد المجمد. يتم حقن العصب بالحبر الهندي خلف المدار مباشرة (موقع الحقن المشار إليه بالسهم الأسود) من أجل توجيه العصب البصري. (ج) صورة فلورية بانورامية للعصب البصري للفئران بعد 7 أيام من الحقن غير الناجح باستخدام AAV-eGFP (أخضر) حيث من المحتمل أن يتدفق معظم معلق الناقل من المسالك العصبية ، مما يؤدي إلى تحويل الغمد البصري. يتم تصنيف نوى العصب البصري ب DAPI (أزرق). يشير ONH إلى رأس العصب البصري الخلفي مباشرة للشبكية العصبية وموقع الحقن المشار إليه بسهم أبيض. يحدد Chiasm والسهم الأبيض نحو chiasm البصري. أشرطة المقياس = 400 ميكرومتر في (A) و 200 ميكرومتر في (C). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| متغير | أقبل | ||
| عبر الملتحمة | متفوق | جانبي | |
| شق الجلد | لا | نعم | نعم |
| شق الملتحمة | نعم | لا | لا |
| مجهر | نعم | نعم | نعم |
| قطع العضلة المدارية العليا | لا | نعم | لا |
| خياطة الجر | لا | نعم | نعم |
| خطاف الحبل الشوكي | نعم | لا | لا |
| خياطة الجلد | لا | نعم | نعم |
الجدول 1: مقارنة بالتقنيات المنشورة سابقا لعزل العصب البصري للفئران للدراسة التجريبية. تتم مقارنة المتغيرات ، بما في ذلك الحاجة إلى شق الجلد ، وشق الملتحمة ، ومجهر التشغيل ، وقطع العضلة المدارية العلوية ، وخياطة الجر ، وخطاف الحبل الشوكي ، وخياطة الجلد ، باستخدام الأساليب عبر الملتحمة ، والعليا ، والجانبي.
Discussion
توضح هذه المقالة طريقة جديدة للوصول إلى العصب البصري للفئران للدراسة التجريبية دون الحاجة إلى شق جلدي. يوفر هذا النهج المزايا المحتملة للكفاءة وتقليل مخاطر العدوى والنزيف ، نظرا لعدم الحاجة إلى شق الجلد وخطوات أقل مقارنة بالتقنيات الأخرى8،9. تستخدم هذه التقنية أيضا النهج الجديد لعزل العصب البصري بخطاف الحبل الشوكي للفئران لتجنب صدمة العصب والأنسجة المحيطة.
تشمل الخطوات الحاسمة في هذه التقنية إجراء شق داكنوي مناسب للوصول إلى الفضاء تحت الملتحمة ، واستخدام خطاف الحبل الشوكي لعزل العصب البصري ، واستخدام إبرة صغيرة التجويف لثقب غمد العصب البصري وتوصيل المواد إلى العصب البصري. يجب توخي الحذر لتدوير خطاف الحبل الشوكي لعزل العصب. عندما لا يكون العصب معزولا بوضوح ، قد يحتاج الخطاف إلى الإدخال عدة مرات لضمان عزل العصب ، ويمكن استخدام قضيب قطني لإزالة النسيج الضام من غمد العصب لتحسين التخيل. يمكن أن يكون التعرض لهذه التقنية أكثر صعوبة في الأكبر حجما التي تحتوي على كمية أكبر من الدهون المدارية. يمكن أن يكون استخدام مساعد لسحب الأنسجة المحيطة للتعرض الكافي مفيدا في هذه المواقف. يجب توخي الحذر لتصور العصب البصري مباشرة أثناء الحقن. ضمان الاتجاه العمودي للإبرة من خلال غمد العصب أثناء الحقن يحسن نجاح الحقن.
تعتمد هذه التقنية على العمل السابق الذي قام به Raykova et al. و Hallas and Wells8،9. Raykova et al. وصف الوصول إلى العصب البصري للفئران باستخدام نهج متفوق مع شق جلدي تم إنشاؤه فوق التلال المدارية وقطع العضلة المداريةالعلوية 8. في حين أن هذا النهج يسمح بتعرض العصب ، إلا أنه يتطلب قطع عضلة خارج العين مع زيادة خطر النزيف والحاجة إلى خياطة شق الجلد. وبالمثل ، يصف Hallas و Wells نهجا جانبيا لمدار الفئران للوصول إلى العصب البصري9. يصفون شق جانبي في الجلد متبوعا بشق جانبي في الملتحمة وخياطة جر تستخدم لتدوير العين وفضح العصب البصري9. على غرار النهج المتفوق ، تتضمن هذه التقنية شقا في الجلد مع الحاجة إلى إغلاق الجرح وزيادة خطر الإصابة بالعدوى والنزيف8،9. تعمل تقنية الملتحمة المعروضة هنا على تجنب الحاجة إلى شق الجلد والعضلات ، وبالتالي تقليل خطر النزيف / العدوى وتحسين الكفاءة عن طريق تجنب الحاجة إلى إغلاق شق الجلد. يسبب الإجراء الحد الأدنى من الضيق ، ويتم تحمله جيدا ، ولا يتطلب استخداما طويل الأمد للأدوية المسكنة أو المضادة للالتهابات. تتم مقارنة تقنية الملتحمة ومقارنتها بالتقنيات المنشورة سابقا في الجدول 1.
تشمل قيود التقنية المقدمة في هذه الدراسة منحنى تعليمي لعزل العصب البصري باستخدام خطاف الحبل الشوكي ، ولكن بمجرد إتقانها ، تسمح هذه التقنية بعزل فعال وغير رضحي للعصب. الإلمام باستخدام مجهر التشغيل ضروري لهذه التقنية. في حين أن هناك منحنى تعليمي لهذه التقنية ، فإن قلة عدد الخطوات وعدم الحاجة إلى خياطة الجرح ستجعل هذه التقنية أسهل في إتقان مقارنة بالأساليب الأخرى المنشورة8،9. من الضروري إجراء تشريح حاد دقيق لفضح العصب والغمد ، حيث يمكن أن يكون هناك نزيف من الأوعية والأنسجة العضلية القريبة. في الفئران الكبيرة ، قد يكون من الصعب تعريض أجزاء كبيرة من العصب البصري بسبب زيادة الدهون / الأنسجة المدارية ، ولكن بعناية ، يمكن إزالة هذا النسيج بشكل عام عن طريق التشريح الحاد لتحسين تصور العصب. يمكن أن يعالج العمل الإضافي استخدام هذه التقنية في أنظمة نموذجية أخرى ، مثل الفأر ، ويمكن أن يقارن الكفاءة الجراحية مباشرة بالتقنيات الأخرى للوصول إلى العصب البصري.
يمكن استخدام هذه التقنية من قبل مجموعات أخرى تحتاج إلى الوصول إلى العصب البصري للفئران للدراسة التجريبية. كانت التجارب المقدمة هنا جزءا من مشروع أكبر يهدف إلى تطوير طرق لتقديم تصحيح جيني كريسبر للعصب البصري في نماذج الفئران من الورم العصبي الليفي من النوع 1 (NF1). الهدف النهائي من هذا المشروع هو إيجاد طرق لتقديم العلاج الجيني مباشرة إلى العصب البصري لدى المرضى الذين يعانون من NF1 لمنع تطور الأورام الدبقية في العصب البصري ، والتي تهدد الرؤية12. في هذه الدراسة ، تم حقن صبغة الحبر الهندي أو ناقل AAV-eGFP في العصب البصري لضمان توصيل المادة إلى العصب البصري ، ولإثبات أن الناقل يمكن أن يخترق العصب البصري.
يمكن استخدام هذه التقنية على نطاق أوسع من قبل باحثين آخرين حيث قد يحتاج العصب إلى الوصول إلى العصب أو حقن علاجات جديدة في محاولة لعلاج مجموعة متنوعة من الحالات المهددة للرؤية ، بما في ذلك أورام العصب البصري ، والعمليات التنكسية مثل اعتلال الأعصاب البصري الوراثي ليبر ، والاعتلال العصبي البصري الرضحي ، والزرق ، وأمراض المناعة الذاتية مثل التهاب العصب البصري13 ، 14. على سبيل المثال ، سينغ وآخرون يصف حقن خلايا الورم الدبقي C6 في العصب البصري للفئران كنموذج للورم العصبي الليفي من النوع 1 للوصول إلى العصب باستخدام شق جلدي3 ، Kwon et al. الوصول إلى العصب البصري من نهج جلدي جانبي للدراسات التي تنطوي على ضغط العصب البصري وتجديده بالخلايا الجذعية6 ، و Negishi et al. الوصول إلى العصب البصري للفئران لوضع طعم خلية شوان كنموذج للعصب البصري التجديد15. يمكن أن توفر التقنية المعروضة هنا نهجا أكثر كفاءة وأمانا لدراسات مثل هذه التي تتطلب الوصول إلى العصب البصري للفئران للإجابة على مجموعة متنوعة من الأسئلة التجريبية.
باختصار ، يوضح هذا العمل الفعالية في دخول العصب البصري بنهج إبرة صغير الحجم والقدرة على اختراق غمد العصب دون الحاجة إلى شق جلدي. تظهر الصور التمثيلية أن ناقل الفيروس الغدي اخترق العصب البصري بنجاح. هذه التقنية لها تطبيقات في مجموعة متنوعة من تجارب العصب البصري في الطب التجديدي والأورام وأمراض الشبكية الوراثية.
Disclosures
لا توجد إفصاحات ذات صلة.
Acknowledgements
يود المؤلفون أن يشكروا مؤسسة عائلة جيلبرت لتمويل هذا المشروع.
Materials
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
References
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved