Method Article
גישה טרנס-לחמית להזרקה לעצב הראייה של החולדה
In This Article
Summary
פרוטוקול זה מתאר טכניקה ייחודית המשתמשת בגישה טרנס-לחמית לגישה לעצב הראייה של החולדה לצורך זריקות.
Abstract
החולדה משמשת מודל חשוב לחקר הפרעות בעצב הראייה, כולל מצבים תורשתיים, טראומטיים, ניאופלסטיים ואוטואימוניים. הגישה לעצב הראייה של החולדה למניפולציות והזרקות ניסיוניות היא מאתגרת בשל גודלו הקטן של המסלול וכלי הדם של רקמות המסלול שמסביב. טכניקות קודמות כללו חתך עורי, הנושא סיכון גבוה יותר לזיהום ודורש סגירת פצע. מחקר זה נועד לתאר גישה ייחודית, פחות פולשנית ואולי יעילה יותר לגישה לעצב הראייה של חולדה. חתך דרך הלחמית, יחד עם וו חוט השדרה של חולדה, משמש לבידוד עצב הראייה לזריקות ניסיוניות. בניסויים אלה מוזרק וקטור אדנו-ויראלי לעצב הראייה במטרה להשתמש בטכניקה זו להעברת טיפול גנטי ישיר בעתיד. טכניקה זו יכולה להיות מיושמת גם על ידי חוקרים הזקוקים לגישה לעצב הראייה של החולדה למחקרים ניסיוניים אחרים, כולל מתן תרופות ומחקר פגיעה בעצב הראייה.
Introduction
החולדה היא מודל ניסיוני מרכזי לחקר הפרעות בעצב הראייה, כולל גלאוקומה, נוירופתיה אופטית טראומטית, נוירופתיה אופטית תורשתית, מחלה דמיאלינטית וגידולים של עצב הראייה,2,3,4,5,6,7. עם זאת, השגת גישה לעצב הראייה לצורך הזרקה ניסיונית ומניפולציות יכולה להיות קשה, בהתחשב בגודל הקטן של המסלול ורקמות המסלול של כלי הדם.
שתי הטכניקות הקודמות שתוארו לגישה לעצב הראייה של החולדה למניפולציות ניסיוניות משתמשות בגישה אורביטלית מעולה או טרנס-עורית לרוחב כדי לגשת למסלול 8,9. Raykova et al. מתארים הזרקת חרוזים צבועים לעצב הראייה באמצעות חתך עור אורביטלי עליון8. בעוד שהטכניקה שלהם הייתה יעילה, היא דורשת המוסטזיס וצורך בתפר מתיחה לחשיפה, מה שיכול להיות מאתגר יותר בגישה זו8. קבוצה אחרת תיארה באופן דומה גישה המשתמשת בחתך עור לרוחב כדי לגשת למסלול. הם הצליחו להזריק לעצב הראייה בגישה זו, אך נזקקו להמוסטזיס וסגירת פצע9. בעוד שטכניקות אלו הן גישות יעילות לגישה לעצב הראייה למחקר ניסיוני, שתיהן כרוכות בחתך עורי, צורך בהמוסטזיס וסגירת פצע. לשלבים אלה יש סיכונים נלווים לזיהום ופוטנציאל לזמן מוגבר בהרדמה עקב הצורך בסגירת פצע 8,9,10.
בהתחשב במגבלות הטכניקות שתוארו קודם לכן, מטרת מחקר זה היא לתאר גישה יעילה יותר ופחות טראומטית לגישה לעצב למחקר ניסיוני. וו חוט השדרה משמש לבידוד עצב הראייה, בדומה לטכניקה הכירורגית המשמשת בבני אדם לבידוד מבנים אדנקסליים של שרירים ועיניים באמצעות וו שריר. טכניקה זו יכולה לשמש חוקרים הזקוקים לגישה לעצב הראייה של החולדה עבור אינדיקציות רבות, החל ממתן תרופות ועד לטיפול גנטי.
מאמר זה מתאר את השימוש החדשני בגישה טרנס-לחמית לגישה למסלול החולדה ולעצב הראייה למחקר ניסיוני בעזרת וו חוט השדרה.
Protocol
כל ההליכים בבעלי חיים אושרו על ידי משרד הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת איווה. מחקר זה מומן על ידי קרן משפחת גילברט (מענק מספר 913012). לניסויים אלה נעשה שימוש בשילוב של חולדות Sprague Dawley זכר ונקבה, בגילאי 4-12 שבועות ובמשקל 100-400 גרם. פרטי הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. הרדמה
- להרדים חולדות באמצעות שאיפת גז איזופלורן. הכניסו את בעל החיים לתא האינדוקציה וסובבו את הוופורייזר ל-4%-5% לזירוז הרדמה ו-2%-3% לשמירה על הרדמה.
- ודא את עומק ההרדמה על ידי הערכת היעדר רפלקס נסיגת הדוושה לפני שתמשיך.
- מרחו ג'ל דמעות מלאכותי על פני העין.
2. מיקום
- לאחר השראת ההרדמה, הנח את החיה על כרית חימום בתנוחת שכיבה לרוחב. השתמש באף כדי לשמור על הרדמה.
- מקם את המסלול מתחת למיקרוסקופ ההפעלה.
3. חשיפה כירורגית
- תפסו את הלחמית עם מלקחיים עם שיניים ברביע התחתון (איור 1).
- השתמש במספריים של Westcott כדי ליצור חתך לחמית רדיאלי ולאחר מכן פתח את הפאשיה של טנון ברביע האינפרונזלי (איור 1). השתמש בדיסקציה קהה כדי להסיר רקמת מסלול מעל.
4. בידוד עצב הראייה
- סובב את העין דרך האף באמצעות מלקחיים עם שיניים ובקש מהעוזר להעביר וו חוט שדרה לרביע התחתון כדי לבודד את עצב הראייה (איור 1). הקפד להימנע מווריד העיניים הגחוני ומהשרירים החוץ-עיניים.
- הסר את רקמת המסלול המכסה ואת הפאשיה של טנון באמצעות דיסקציה קהה עם אפליקטור או מלקחיים עם קצה כותנה כדי לחשוף את עצב הראייה והמעטפת.
5. הזרקה
- השתמש במחט של 33 גרם המחוברת למזרק של 10 uL או 1 מ"ל כדי לנקב את מעטפת עצב הראייה (איור 1).
- הזרקו ריכוזים שונים של וירוס-eGFP הקשור לאדנו-או צבע דיו הודי לעצב הראייה בהדמיה ישירה כדי להבטיח שהחומר מוזרק ישירות לעצב.
- כדי להעריך AAV-eGFP, יש להזריק תרחיף של 10 מיקרוליטר המכיל חלקיקים נגיפיים AAV (2 x 1013 גנומים וקטוריים (vg)/mL למינון כולל של 2 x 1011 vg).
הערה: חוקרים עשויים להזריק צבעים או כתמים אחרים בהתאם לצרכי הניסוי.
6. שלבים פוסט-פרוצדורליים
- קירבו מחדש את הלחמית ללימבוס כדי לכסות את מקום החתך ולמרוח משחה אנטיביוטית על הלחמית (איור 1).
- אפשר לבעלי החיים להתאושש מההרדמה ולעקוב אחריהם לאיתור סימני זיהום.
7. מכתים
- שבעה ימים לאחר ההזרקה, יש להקריב את בעלי החיים באמצעות חנקCO2 ואחריו פריקת צוואר הרחם11 בהתאם להנחיות האתיות. נתח את עצב הראייה.
- יש לתקן את עצבי הראייה ב-4% פרפורמלדהיד ולשטוף בריכוזים מוגברים של סוכרוז. הטמיעו תבניות קריופולניות בתמיסה של 2:1 של תרכובת OCT ל-20% סוכרוז. הקפאת בזק דגימות בחנקן נוזלי, אחסון ב-80 מעלות צלזיוס וחתך בעובי של 7 מיקרומטר.
- חסום קריוסקטים של עצב הראייה למשך 30 דקות בטמפרטורת החדר במאגר אימונוציטוכימי (IHC) ו-3% אלבומין בסרום בקר. דגירה של קטעים עם נוגדן ראשוני נגד GFP של חולדות מדולל במאגר IHC למשך שעתיים בטמפרטורת החדר.
- דגרו קטעים עם אנטי חולדות עזים במאגר IHC למשך שעה נוספת בטמפרטורת החדר. במהלך דגירה משנית של נוגדנים, סמן קטעים עם 4',6-Diamidino-2-phenylindole dihydrochloride (DAPI) כדי להמחיש גרעיני תאים. יש לשטוף חלקים ביסודיות עם PBS ולהרכיב באמצעות מדיום הרכבה.
8. הדמיה
- דמיין את החלקים המסומנים באמצעות מערכת מיקרוסקופ קונפוקלית זקופה.
- באופן ספציפי, השתמש בלייזר סגול 405 ננומטר כדי לדמיין תיוג DAPI ובלייזר ציאן 488 ננומטר כדי לדמיין GFP.
הערה: ההגדרות עבור כל לייזר (כלומר, עוצמת לייזר, עוצמה/רווח, מסנני רקע/רעש) צריכות להיות מותאמות על ידי כל משתמש עבור מערכות מיקרוסקופ קונפוקליות שונות. רכוש תמונות באמצעות עדשה אובייקטיבית פי 20.
תוצאות
תוצאות ניסוי מייצגות המשתמשות בטכניקה זו להזרקת עצב ראייה לחולדה מוצגות באיור 2. בדוגמה זו, וירוס-eGFP הקשור לאדנו (AAV-eGFP) הוזרק לעצב הראייה של החולדה באמצעות הטכניקה הטרנס-לחמית שתוארה לעיל עם מחט 33 G המחוברת למזרק של 10 מיקרוליטר. תוצאות אלה היו חלק מניסוי המשתמש בטכניקה זו כדי לחקור הזרקת עצב ראייה כחלק מהמטרה הסופית להשתמש ב-AAV כדי לספק תיקון CRISPR לעצבי הראייה במודל חולדה של נוירופיברומטוזיס 1 (NF1). שילוב של צבע וקטור AAV שימש לפיתוח טכניקת ההזרקה. בעלי חיים הוקרבו שבעה ימים לאחר ההזרקה לעצב הראייה. לאחר מכן נותחו העצבים ותויגו בנוגדנים נגד GFP כדי לאפשר הדמיה של עצב הראייה במיקרוסקופיה קונפוקלית כדי לאשר שהחומר חדר בהצלחה למעטפת עצב הראייה ונכנס לעצב הראייה. ההחדרה המוצלחת של חומר לעצב הראייה אושרה על ידי צביעת נוגדנים, והוא נראה ירוק במיקרוסקופיה קונפוקלית, כפי שניתן לראות באיור 2A. במקרים שבהם החדירה דרך מעטפת עצב הראייה לא הייתה מלאה, או שהייתה שטף של חומר ממסלול המחט, נצפה כתמים לאורך קצה מעטפת עצב הראייה ולא בתוך רקמת העצב, כפי שניתן לראות באיור 2C.
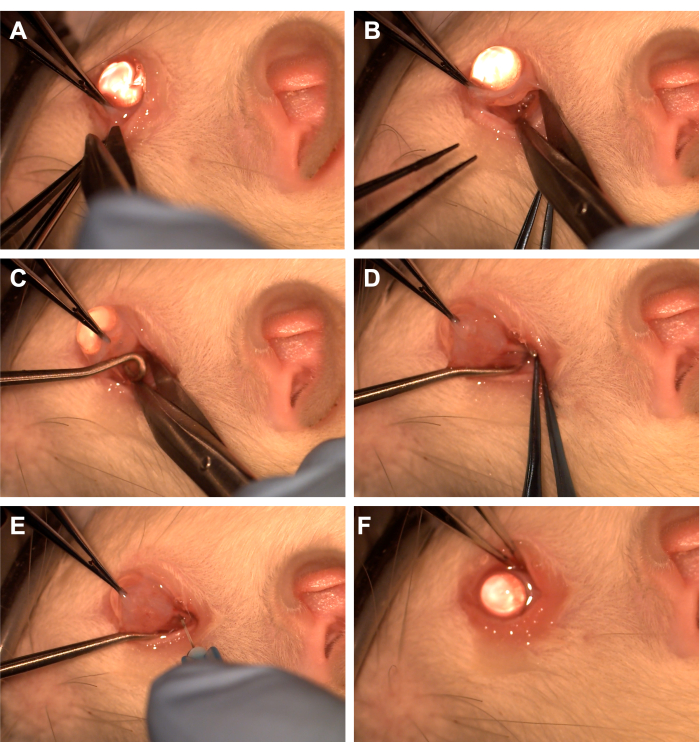
איור 1: רצף השלבים הכירורגיים. (A) הלחמית נתפסת עם מלקחיים עם שיניים, ומספריים של Westcott משמשים ליצירת היקף לימבלי. (B) אחרי שהפאשיה של הטנון נפתחת ומנותחת בצורה בוטה, המסלול נחשף בעזרת מספריים של ווסטקוט. (C) וו חוט השדרה מוחדר ומשמש לבידוד עצב הראייה. (D) אחרי דיסקציה קהה של רקמת המסלול שמעליו, עצב הראייה נחשף באמצעות וו חוט השדרה. (E) מחט 33G משמשת לניקוב מעטפת עצב הראייה ולהזרקת אדנו-וירוס או צבע לעצב הראייה. (F) הגלובוס ממוקם במסלול, והלחמית ממוקמת מחדש מעל אתר הפריטומיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
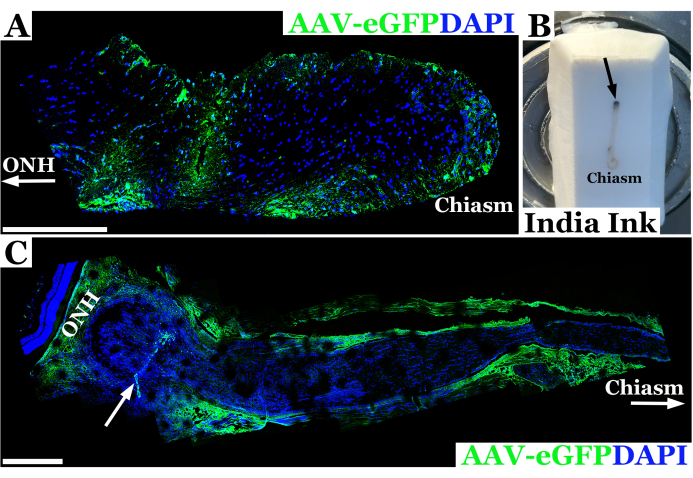
איור 2: תמונה פנורמית קונפוקלית פלואורסצנטית מייצגת של עצב הראייה של חולדה 7 ימים לאחר הזרקה מוצלחת עם AAV-eGFP (ירוק) שבה וקטור התמיר נוירונים ליד הכיאזמה האופטית. (A) גרעיני עצב הראייה מסומנים ב-DAPI (כחול). ONH עם חץ מציין את ראש עצב הראייה או קצה המסלול של העצב, בעוד שקצה הכיאזמה האופטית מסומן כ"כיאזמה". (B) תצלום של עצב ראייה של חולדה ממסלול לכיאזמה משובץ בבלוק קריוסקציה קפוא. העצב מוזרק עם דיו הודי מיד מאחורי המסלול (אתר ההזרקה המסומן בחץ שחור) על מנת לכוון את עצב הראייה. (C) תמונה פלואורסצנטית פנורמית של עצב הראייה של חולדה 7 ימים לאחר הזרקה לא מוצלחת עם AAV-eGFP (ירוק) שבה רוב התרחיף הווקטורי ככל הנראה נפלט ממערכת העצבים, והופך את המעטפת האופטית. גרעיני עצב הראייה מסומנים ב-DAPI (כחול). ONH מציין את ראש עצב הראייה מיד מאחורי הרשתית העצבית ואתר ההזרקה המסומן על ידי חץ לבן. כיאזמה וחץ לבן תוחמים לכיוון הכיאזמה האופטית. פסי קנה מידה = 400 מיקרומטר ב-(A) ו-200 מיקרומטר ב-(C). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| משתנה | גישה | ||
| טרנס-לחמית | מעולה | לרוחב | |
| חתך בעור | לא | כן | כן |
| חתך הלחמית | כן | לא | לא |
| מיקרוסקופ | כן | כן | כן |
| חתך של שריר המסלול העליון | לא | כן | לא |
| תפר מתיחה | לא | כן | כן |
| וו חוט השדרה | כן | לא | לא |
| תפר עור | לא | כן | כן |
טבלה 1: השוואה לטכניקות שפורסמו בעבר לבידוד עצב הראייה של חולדה למחקר ניסיוני. משתנים, כולל הצורך בחתך בעור, חתך הלחמית, מיקרוסקופ ניתוח, חתך של שריר המסלול העליון, תפר המתיחה, וו חוט השדרה ותפר העור, מושווים באמצעות הגישות הטרנס-לחמית, העליונה והרוחבית.
Discussion
מאמר זה מתאר שיטה חדשה לגישה לעצב הראייה של חולדה למחקר ניסיוני ללא צורך בחתך בעור. גישה זו מספקת את היתרונות הפוטנציאליים של יעילות והפחתת הסיכון לזיהום ודימום, בהתחשב בהיעדר צורך בחתך בעור ופחות צעדים בהשוואה לטכניקות אחרות 8,9. טכניקה זו משתמשת גם בגישה החדשנית של בידוד עצב הראייה עם וו חוט השדרה של חולדה כדי למנוע טראומה לעצב ולרקמות שמסביב.
שלבים קריטיים בטכניקה כוללים ביצוע חתך לימלי הולם לגישה לחלל התת-לחמית, שימוש בוו חוט השדרה כדי לבודד את עצב הראייה, ושימוש במחט בעלת קדח קטן כדי לנקב את מעטפת עצב הראייה ולהעביר חומר לעצב הראייה. יש להקפיד לסובב את וו חוט השדרה כדי לבודד את העצב. כאשר העצב אינו מבודד בבירור, ייתכן שיהיה צורך להכניס את הקרס מספר פעמים על מנת להבטיח שהעצב מבודד, וניתן להשתמש באפליקטור עם קצה כותנה להסרת רקמת חיבור ממעטפת העצב להדמיה טובה יותר. חשיפה לטכניקה זו יכולה להיות מאתגרת יותר בבעלי חיים גדולים יותר עם נפח גדול יותר של שומן מסלולי. השימוש בעוזר כדי להחזיר את הרקמות שמסביב לחשיפה נאותה יכול להיות שימושי במצבים אלה. יש להקפיד לדמיין את עצב הראייה ישירות במהלך ההזרקה. הקפדה על כיוון מאונך של המחט דרך מעטפת העצב במהלך ההזרקה משפרת את הצלחת ההזרקה.
טכניקה זו מתבססת על עבודות קודמות של Raykova et al. ו-Hallas and Wells 8,9. Raykova et al. תיארו גישה לעצב הראייה של החולדה באמצעות גישה מעולה עם חתך עור שנוצר מעל רכס המסלול וחתך של שריר האורביטלהעליון 8. בעוד שגישה זו מאפשרת חשיפת העצב, היא דורשת חתך של שריר חוץ עיני עם סיכון גבוה יותר לדימום וצורך בתפירת חתך העור. באופן דומה, הלאס ו-וולס מתארים גישה רוחבית למסלול החולדה כדי להגיע לעצב הראייה9. הם מתארים חתך עור לרוחב ואחריו חתך לחמית לרוחב ותפר מתיחה המשמש לסיבוב העין וחשיפת עצב הראייה9. בדומה לגישה המעולה, טכניקה זו כוללת חתך בעור עם צורך בסגירת פצע וסיכון גבוה יותר לזיהום ודימום 8,9. הטכניקה הטרנס-לחמית המוצגת כאן מייתרת את הצורך בחתך בעור ובשרירים, ולכן מפחיתה את הסיכון לדימום/זיהום ומשפרת את היעילות על ידי הימנעות מהצורך בסגירת חתך בעור. ההליך גורם למצוקה מינימלית, נסבל היטב ואינו מצריך שימוש ארוך טווח בתרופות משככות כאבים או אנטי דלקתיות. הטכניקה הטרנס-לחמית מושווה ומנוגדת לטכניקות שפורסמו בעבר בטבלה 1.
מגבלות הטכניקה המוצגת במחקר זה כוללות עקומת למידה לבידוד עצב הראייה באמצעות וו חוט השדרה, אך לאחר שליטה, טכניקה זו מאפשרת בידוד יעיל ואטראומטי של העצב. היכרות עם השימוש במיקרוסקופ הפעלה נחוצה לטכניקה זו. אמנם יש עקומת למידה לטכניקה זו, אך מספר הצעדים הקטן יותר והיעדר הצורך בתפירת הפצע יהפכו את הטכניקה הזו לקלה יותר לשליטה ביחס לגישות האחרות שפורסמו 8,9. דיסקציה קהה זהירה כדי לחשוף את העצב והמעטפת היא הכרחית, מכיוון שיכול להיות דימום מכלי הדם ורקמת השריר הסמוכים. בחולדות גדולות יותר, זה יכול להיות קשה יותר לחשוף חלקים גדולים של עצב הראייה בגלל השומן/רקמה המוגברת, אך בזהירות, ניתן בדרך כלל להסיר רקמה זו עם דיסקציה קהה כדי לשפר את ההדמיה של העצב. עבודה נוספת יכולה להתייחס לשימוש בטכניקה זו במערכות מודל אחרות, כגון העכבר, ויכולה להשוות ישירות את היעילות הכירורגית לטכניקות אחרות לגישה לעצב הראייה.
טכניקה זו יכולה לשמש קבוצות אחרות שצריכות לגשת לעצב הראייה של החולדה למחקר ניסיוני. הניסויים המוצגים כאן היו חלק מפרויקט גדול יותר שמטרתו לפתח דרכים לספק תיקון גנים של CRISPR לעצב הראייה במודלים של חולדות של נוירופיברומטוזיס מסוג 1 (NF1). המטרה הסופית של פרויקט זה היא למצוא דרכים לספק טיפול גנטי ישירות לעצב הראייה בחולים עם NF1 כדי למנוע התפתחות של גליומות בעצב הראייה, המאיימות על הראייה12. במחקר זה, צבע דיו הודו או וקטור AAV-eGFP הוזרק לעצב הראייה כדי להבטיח שהחומר מועבר לעצב הראייה, וכדי להדגים שהווקטור יכול לחדור לעצב הראייה.
טכניקה זו יכולה להיות בשימוש נרחב יותר על ידי חוקרים אחרים מכיוון שייתכן שיהיה צורך לגשת לעצב או להזריק טיפולים חדשים במאמץ לטפל במגוון מצבים המאיימים על הראייה, כולל ניאופלזמות של עצב הראייה, תהליכים ניווניים כגון נוירופתיה אופטית תורשתית של לבר, נוירופתיה אופטית טראומטית, גלאוקומה ומחלות אוטואימוניות כגון דלקת עצב הראייה13. 14. לדוגמה, סינג ועמיתיו מתארים הזרקת תאי גליומה C6 לעצב הראייה של החולדה כמודל של נוירופיברומטוזיס מסוג 1 הנכנס לעצב באמצעות חתך עורי3, קוון ואחרים ניגשו לעצב הראייה מגישה עורית רוחבית למחקרים הכוללים דחיסה והתחדשות של עצב הראייה עם תאי גזע6, ו-Negishi et al. ניגשו לעצב הראייה של החולדה למיקום השתלת תאי שוואן כמודל של עצב הראייה התחדשות15. הטכניקה המוצגת כאן יכולה לספק גישה יעילה ובטוחה יותר למחקרים כגון אלה הדורשים גישה לעצב הראייה של החולדה כדי לענות על מגוון שאלות ניסוי.
לסיכום, עבודה זו מדגימה יעילות בכניסה לעצב הראייה בגישת מחט קטנה ויכולת לחדור למעטפת העצב ללא צורך בחתך עורי. התמונות המייצגות מראות כי הווקטור האדנוויראלי חדר בהצלחה לעצב הראייה. לטכניקה זו יש יישומים למגוון ניסויים בעצב הראייה ברפואה רגנרטיבית, אונקולוגיה ומחלות רשתית תורשתיות.
Disclosures
אין גילויים רלוונטיים.
Acknowledgements
המחברים מבקשים להודות לקרן משפחת גילברט על מימון פרויקט זה.
Materials
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
References
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved