Method Article
Трансконъюнктивальный доступ для инъекции в зрительный нерв крысы
В этой статье
Резюме
Этот протокол описывает уникальную технику с использованием трансконъюнктивального доступа к зрительному нерву крысы для инъекций.
Аннотация
Крыса служит важной моделью для изучения нарушений зрительного нерва, включая наследственные, травматические, опухолевые и аутоиммунные состояния. Доступ к зрительному нерву крысы для экспериментальных манипуляций и инъекций затруднен из-за небольшого размера глазницы и васкулярности окружающих тканей орбиты. Предыдущие методы включали в себя кожный разрез, который несет более высокий риск инфекции и требует закрытия раны. Это исследование направлено на описание уникального, менее инвазивного и потенциально более эффективного подхода к доступу к зрительному нерву крысы. Трансконъюнктивальный разрез вместе с крючком спинного мозга крысы используется для изоляции зрительного нерва для экспериментальных инъекций. В этих экспериментах аденовирусный вектор вводится в зрительный нерв с целью использования этой методики для прямой доставки генной терапии в будущем. Этот метод также может быть применен исследователями, которым требуется доступ к зрительному нерву крысы для других экспериментальных исследований, включая доставку лекарств и исследования повреждений зрительного нерва.
Введение
Крыса является ключевой экспериментальной моделью для изучения заболеваний зрительного нерва, включая глаукому, травматическую нейропатию зрительного нерва, наследственную нейропатию зрительного нерва, демиелинизирующее заболевание и опухоли зрительного нерва,2,3,4,5,6,7. Однако получение доступа к зрительному нерву для экспериментальных инъекций и манипуляций может быть затруднено, учитывая небольшие размеры глазницы и тканей сосудистой орбиты.
Два предыдущих метода, которые были описаны для доступа к зрительному нерву крысы для экспериментальных манипуляций, используют либо верхнюю орбитальную, либо латеральную чрескожную доступность для доступа к орбите 8,9. Raykova et al. описывают введение окрашенных бусин в зрительный нерв с использованием разреза верхней орбитальной кожи8. Несмотря на то, что их метод был эффективным, он требует гемостаза и необходимости наложения тракционного шва для воздействия, что может быть более сложным притаком подходе. Другая группа аналогичным образом описала подход с использованием бокового разреза кожи для доступа к орбите. Они смогли успешно ввести зрительный нерв с помощью этого подхода, но потребовали гемостаза и закрытия раны9. Хотя эти методы являются эффективными подходами к доступу к зрительному нерву для экспериментального исследования, они оба включают в себя кожный разрез, необходимость гемостаза и закрытие раны. Эти шаги связаны с риском инфицирования и потенциально увеличенным временем под анестезией из-за необходимости закрытия раны 8,9,10.
Учитывая ограничения ранее описанных методов, целью данного исследования является описание более эффективного и менее травматичного подхода к доступу к нерву для экспериментального изучения. Крючок спинного мозга используется для изоляции зрительного нерва, аналогично хирургической технике, используемой у людей для изоляции мышечных и глазных придатковых структур с помощью мышечного крючка. Этот метод может быть использован исследователями, которым необходим доступ к зрительному нерву крысы по многим показаниям, от доставки лекарств до генной терапии.
В данной статье описывается новое использование трансконъюнктивального подхода для доступа к орбите крысы и зрительному нерву для экспериментального исследования с помощью крючка спинного мозга.
протокол
Все процедуры для животных были одобрены Управлением Комитета по уходу за животными и их использованию в Университете Айовы. Это исследование было профинансировано Фондом семьи Гилберта (грант No 913012). Для этих экспериментов использовали комбинацию самцов и самок крыс Sprague Dawley в возрасте 4-12 недель и весом 100-400 г. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Обезболивание
- Обезболивайте крыс с помощью ингаляции газа изофлурана. Поместите животное в индукционную камеру и поверните испаритель на 4%-5% для индукции анестезии и на 2%-3% для поддержания анестезии.
- Перед тем, как продолжить, проверьте глубину анестезии, оценив отсутствие рефлекса отмены педали.
- Нанесите искусственный слезоберуточный гель на поверхность глаза.
2. Позиционирование
- Как только будет введена анестезия, положите животное на грелку в боковом лежачем положении. Используйте носовой конус для поддержания анестезии.
- Расположите орбиту под операционным микроскопом.
3. Хирургическое воздействие
- Захватите конъюнктиву зубчатыми щипцами в нижневисочной области (рис. 1).
- С помощью ножниц Уэсткотта сделайте радиальный разрез конъюнктивы, а затем откройте фасцию Тенона в нижненосовом квадранте (Рисунок 1). Используйте тупое рассечение для удаления вышележащей орбитальной ткани.
4. Изоляция зрительного нерва
- Поверните глаз носово с помощью зубчатых щипцов и попросите ассистента ввести крючок спинного мозга в нижневисочный квадрант, чтобы изолировать зрительный нерв (Рисунок 1). Следите за тем, чтобы не затрагивать вентральную глазную вену и экстраокулярные мышцы.
- Удалите вышележащую орбитальную ткань и фасцию Тенона с помощью тупого рассечения с помощью аппликатора с ватным наконечником или щипцов, чтобы обнажить зрительный нерв и влагалище.
5. Инъекция
- С помощью иглы 33 G, подключенной к шприцу емкостью 10 мкл или 1 мл, проколите оболочку зрительного нерва (рисунок 1).
- Вводите различные концентрации аденоассоциированного вируса-eGFP или красителя индийских чернил в зрительный нерв под прямой визуализацией, чтобы гарантировать, что материал вводится непосредственно в нерв.
- Для оценки AAV-eGFP вводят 10 мкл суспензии, содержащей вирусные частицы AAV (2 x10 13 векторных геномов (vg)/мл в сумме 2 x 1011 vg).
ПРИМЕЧАНИЕ: Исследователи могут вводить другие красители или красители в зависимости от экспериментальных потребностей.
6. Постпроцедурные шаги
- Приблизьте конъюнктиву к лимбусу, чтобы закрыть место разреза, и нанесите мазь с антибиотиком на конъюнктиву (Рисунок 1).
- Дайте животным восстановиться после анестезии и следите за ними на предмет любых признаков инфекции.
7. Окрашивание
- Через семь дней после инъекции умерщвляйте животных с помощью асфиксии CO2 с последующим вывихом шейки матки11 в соответствии с этическими нормами. Рассеките зрительный нерв.
- Зафиксируйте зрительные нервы в 4% параформальдегиде и промойте в повышенных концентрациях сахарозы. Погрузите криоформы в раствор ОКТ-соединения в соотношении 2:1 до 20% сахарозы. Образцы мгновенной заморозки в жидком азоте, хранение при температуре -80 °C и сечение при толщине 7 мкм.
- Блокируйте криосекции зрительного нерва на 30 минут при комнатной температуре в иммуноцитохимическом (ИГХ) буфере и 3% бычьем сывороточном альбумине. Инкубируют срезы с первичным антителом к GFP крысы, разведенным в буфере ИГХ, в течение 2 ч при комнатной температуре.
- Инкубируйте секции с козьей антикрысой в буфере ИГХ еще 1 ч при комнатной температуре. Во время вторичной инкубации антител помечайте срезы 4',6-диамидино-2-фенилиндолдигидрохлоридом (DAPI) для визуализации ядра клетки. Тщательно промойте секции с помощью PBS и установите с помощью монтажной среды.
8. Визуализация
- Визуализируйте помеченные срезы с помощью вертикального конфокального микроскопа.
- В частности, используйте фиолетовый лазер с длиной волны 405 нм для визуализации маркировки DAPI и голубой лазер с длиной волны 488 нм для визуализации GFP.
ПРИМЕЧАНИЕ: Настройки для каждого лазера (т.е. мощность лазера, интенсивность/усиление, фильтры фона/шума) должны быть оптимизированы каждым пользователем для различных систем конфокальных микроскопов. Получайте изображения с помощью объектива с 20-кратным увеличением.
Результаты
Репрезентативные экспериментальные результаты с использованием этой техники для инъекции зрительного нерва крысы показаны на рисунке 2. В этом примере аденоассоциированный вирус-eGFP (AAV-eGFP) вводили в зрительный нерв крысы с использованием описанной выше трансконъюнктивальной техники с помощью иглы 33 G, подключенной к шприцу объемом 10 мкл. Эти результаты были частью эксперимента с использованием этой техники для изучения инъекции зрительного нерва в рамках конечной цели использования AAV для коррекции CRISPR зрительных нервов на модели нейрофиброматоза 1 (NF1) у крыс. Комбинация красителя и вектора AAV была использована для разработки техники инъекции. Животных умерщвляли через семь дней после инъекции в зрительный нерв. Затем нервы были препарированы и помечены антителами против GFP, чтобы обеспечить визуализацию зрительного нерва с помощью конфокальной микроскопии, чтобы подтвердить, что материал успешно проник через оболочку зрительного нерва и вошел в зрительный нерв. Успешное введение материала в зрительный нерв было подтверждено окрашиванием антителами, и на конфокальной микроскопии он выглядел зеленым, как видно на рисунке 2А. В тех случаях, когда проникновение через оболочку зрительного нерва не было полным или наблюдался отток материала из колеи иглы, окрашивание наблюдалось вдоль края оболочки зрительного нерва, а не внутри нервной ткани, как видно на рисунке 2В.
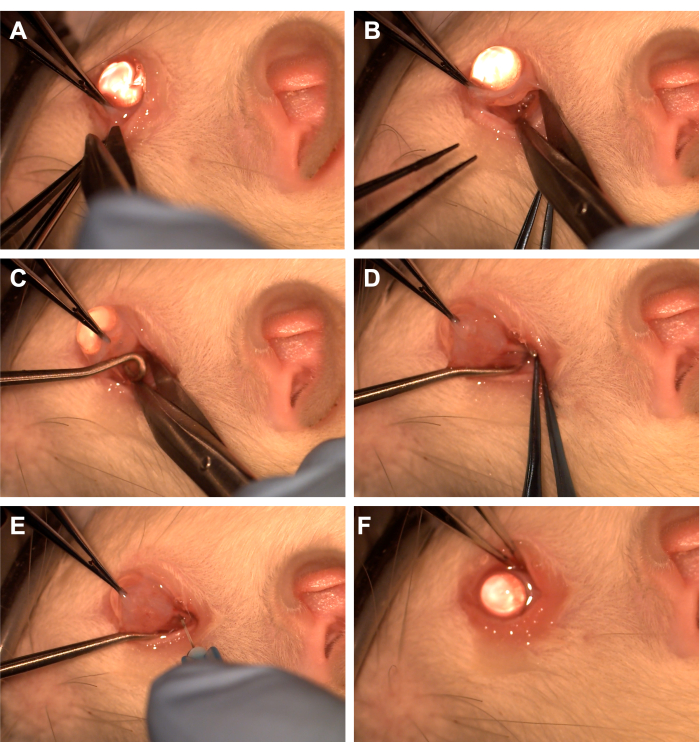
Рисунок 1: Последовательность хирургических этапов. (A) Конъюнктива захватывается зубчатыми щипцами, и ножницы Уэсткотта используются для создания лимбальной перитомии. (В) После того, как фасция шипа вскрыта и тупо рассечена, глазница обнажается с помощью ножниц Уэсткотта. (C) Вставляется крючок для спинного мозга, который используется для изоляции зрительного нерва. (D) После тупого рассечения вышележащей орбитальной ткани зрительный нерв обнажается с помощью крючка спинного мозга. (E) Игла 33 G используется для прокалывания оболочки зрительного нерва и введения аденовируса или красителя в зрительный нерв. (F) Глобус помещается на орбиту, а конъюнктива перемещается над местом перитомии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
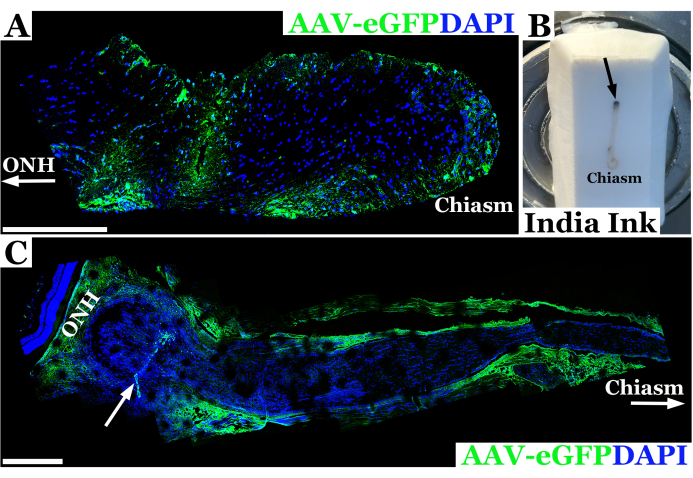
Рисунок 2: Репрезентативное флуоресцентное конфокальное панорамное изображение зрительного нерва крысы через 7 дней после успешной инъекции AAV-eGFP (зеленого цвета), в котором вектор трансдуцировал нейроны вблизи зрительного нерва. (A) Ядра зрительного нерва помечены DAPI (синим цветом). ONH со стрелкой обозначает корешок зрительного нерва или орбитальный конец нерва, в то время как конец зрительной хиазмы обозначается как «хиазма». (Б) Фотография зрительного нерва крысы от орбиты до хиазмы, встроенного в замороженный криосекционный блок. Нерв вводится индийскими чернилами непосредственно за орбитой (место инъекции обозначено черной стрелкой) для ориентации зрительного нерва. (C) Панорамное флуоресцентное изображение зрительного нерва крысы через 7 дней после неудачной инъекции AAV-eGFP (зеленый), при котором большая часть векторной суспензии, вероятно, вытекла из нервного тракта, трансдуцируя зрительную оболочку. Ядра зрительного нерва помечены DAPI (синим цветом). ONH обозначает головку зрительного нерва, расположенную непосредственно позади нервной сетчатки и места инъекции, обозначенного белой стрелкой. Хиазма и белая стрелка разграничивают в сторону оптического хиазма. Масштабные линейки = 400 мкм в (А) и 200 мкм в (С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Переменная | Подход | ||
| Трансконъюнктивальный | Превосходящий | Боковой | |
| Разрез кожи | Нет | Да | Да |
| Разрез конъюнктивы | Да | Нет | Нет |
| Микроскоп | Да | Да | Да |
| Пересечение верхней орбитальной мышцы | Нет | Да | Нет |
| Тракционный шов | Нет | Да | Да |
| Крючок для спинного мозга | Да | Нет | Нет |
| Кожный шов | Нет | Да | Да |
Таблица 1: Сравнение с ранее опубликованными методами выделения зрительного нерва крысы для экспериментального изучения. Переменные, включая необходимость разреза кожи, разреза конъюнктивы, операционного микроскопа, пересечения верхней орбитальной мышцы, тракционного шва, крючка спинного мозга и кожного шва, сравниваются с использованием трансконъюнктивального, верхнего и латерального доступов.
Обсуждение
В этой статье описывается новый метод доступа к зрительному нерву крысы для экспериментального исследования без необходимости разреза кожи. Этот подход обеспечивает потенциальные преимущества в виде эффективности и снижения риска инфицирования и кровотечения, учитывая отсутствие необходимости в разрезе кожи и меньшее количество этапов по сравнению с другими методами 8,9. В этом методе также используется новый подход к изоляции зрительного нерва с помощью крючка спинного мозга крысы, чтобы избежать травмы нерва и окружающих тканей.
Важнейшие шаги в этой технике включают в себя создание адекватного лимбального разреза для доступа к субконъюнктивальному пространству, использование крючка спинного мозга для изоляции зрительного нерва и использование иглы малого диаметра для прокалывания оболочки зрительного нерва и доставки материала к зрительному нерву. Необходимо соблюдать осторожность при вращении крючка спинного мозга для изоляции нерва. Когда нерв не изолирован четко, может потребоваться введение крючка несколько раз, чтобы убедиться, что нерв изолирован, и может быть использован аппликатор с ватным наконечником для удаления соединительной ткани из оболочки нерва для лучшей визуализации. Воздействие этого метода может быть более сложным у животных более крупного размера с большим объемом орбитального жира. Использование помощника для втягивания окружающих тканей для адекватного воздействия может быть полезным в этих ситуациях. Необходимо соблюдать осторожность, чтобы визуализировать зрительный нерв непосредственно во время инъекции. Обеспечение перпендикулярной ориентации иглы через нервную оболочку во время инъекции улучшает успех инъекции.
Этот метод основан на предыдущих работах Райковой и др. и Халласа и Уэллса 8,9. Raykova et al. описали доступ к зрительному нерву крысы с использованием превосходного подхода с разрезом кожи, созданным над орбитальным гребнем, и пересечением верхней орбитальной мышцы8. Хотя этот подход позволяет обнажить нерв, он требует пересечения экстраокулярной мышцы с более высоким риском кровотечения и необходимостью наложения швов на разрез кожи. Аналогичным образом, Халлас и Уэллс описывают латеральный подход к орбите крысы для достижения зрительного нерва9. Они описывают боковой разрез кожи с последующим боковым разрезом конъюнктивы и тракционным швом, используемым для вращения глаза и обнажения зрительного нерва9. Подобно превосходному подходу, этот метод включает в себя разрез кожи, что приводит к необходимости закрытия раны и более высокому риску инфекции и кровотечения 8,9. Представленная здесь техника трансконъюнктивы устраняет необходимость в разрезе кожи и мышц, тем самым снижая риск кровотечения/инфекции и повышая эффективность за счет исключения необходимости закрывать разрез кожи. Процедура вызывает минимальные неприятные ощущения, хорошо переносится, не требует длительного приема обезболивающих или противовоспалительных препаратов. Трансконъюнктивальная техника сравнивается и противопоставляется ранее опубликованным методикам в таблице 1.
Ограничения метода, представленного в этом исследовании, включают кривую обучения для изоляции зрительного нерва с помощью крючка спинного мозга, но после освоения эта техника позволяет эффективно и атравматично изолировать нерв. Для этой методики необходимо знакомство с использованием операционного микроскопа. Несмотря на то, что существует кривая обучения этой методике, меньшее количество этапов и отсутствие необходимости наложения швов на рану сделают эту технику более легкой для освоения по сравнению с другими опубликованными подходами 8,9. Тщательное тупое рассечение для обнажения нерва и оболочки является обязательным, так как может произойти кровоизлияние из близлежащих сосудов и мышечной ткани. У более крупных крыс может быть сложнее обнажить большие участки зрительного нерва из-за увеличенного орбитального жира/ткани, но при осторожности эту ткань обычно можно удалить с помощью тупого рассечения для улучшения визуализации нерва. Дальнейшая работа может быть направлена на использование этого метода в других модельных системах, таких как мышь, и может напрямую сравнить хирургическую эффективность с другими методами доступа к зрительному нерву.
Этот метод может быть использован другими группами, которым необходим доступ к зрительному нерву крысы для экспериментального исследования. Представленные здесь эксперименты были частью более крупного проекта, направленного на разработку способов коррекции гена CRISPR в зрительном нерве у крыс с моделями нейрофиброматоза 1-го типа (NF1). Конечной целью данного проекта является поиск способов доставки генной терапии непосредственно в зрительный нерв у пациентов с NF1 для предотвращения развития глиом зрительного нерва,которые угрожают зрению. В этом исследовании краситель индийских чернил или вектор AAV-eGFP вводили в зрительный нерв, чтобы гарантировать, что материал доставляется в зрительный нерв, и продемонстрировать, что вектор может проникнуть в зрительный нерв.
Этот метод может быть более широко использован другими исследователями, поскольку может потребоваться доступ к нерву или введение новых терапевтических средств для лечения различных состояний, угрожающих зрению, включая новообразования зрительного нерва, дегенеративные процессы, такие как наследственная оптическая нейропатия Лебера, травматическая оптическая нейропатия, глаукома и аутоиммунные заболевания, такие как неврит зрительного нерва. 14. Например, Singh et al. описывают инъекцию клеток глиомы C6 в зрительный нерв крысы как модель нейрофиброматоза 1 типа, доступного к нерву с помощью кожного разреза3, Kwon et al. получили доступ к зрительному нерву через боковой кожный доступ для исследований, включающих компрессию зрительного нерва и регенерацию стволовыми клетками6, а Negishi et al. получили доступ к зрительному нерву крысы для размещения трансплантата из шванновских клеток в качестве модели зрительного нерва Регенерация15. Представленная здесь методика может обеспечить более эффективный и безопасный подход к исследованиям, подобным тем, которые требуют доступа к зрительному нерву крысы для ответа на различные экспериментальные вопросы.
Таким образом, эта работа демонстрирует эффективность при проникновении в зрительный нерв с помощью иглы малого калибра и способность проникать в оболочку нерва без необходимости кожного разреза. Репрезентативные изображения показывают, что аденовирусный вектор успешно проник в зрительный нерв. Этот метод имеет применение в различных экспериментах со зрительным нервом в регенеративной медицине, онкологии и наследственных заболеваниях сетчатки.
Раскрытие информации
Не разглашается соответствующая информация.
Благодарности
Авторы выражают благодарность Фонду семьи Гилберт за финансирование этого проекта.
Материалы
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Ссылки
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены