Method Article
Sıçan Optik Sinirine Enjeksiyon için Transkonjonktival Yaklaşım
Bu Makalede
Özet
Bu protokol, enjeksiyonlar için sıçan optik sinirine erişmek için transkonjonktival bir yaklaşım kullanan benzersiz bir tekniği tanımlar.
Özet
Sıçan, kalıtsal, travmatik, neoplastik ve otoimmün durumlar dahil olmak üzere optik sinir bozukluklarını incelemek için önemli bir model görevi görür. Deneysel manipülasyonlar ve enjeksiyonlar için sıçan optik sinirine erişim, yörüngenin küçük boyutu ve çevredeki orbital dokuların vaskülaritesi nedeniyle zordur. Önceki teknikler, daha yüksek enfeksiyon riski taşıyan ve yaranın kapatılmasını gerektiren bir kutanöz insizyonu içeriyordu. Bu çalışma, sıçan optik sinirine erişmek için benzersiz, daha az invaziv ve potansiyel olarak daha verimli bir yaklaşımı tanımlamayı amaçlamaktadır. Deneysel enjeksiyonlar için optik siniri izole etmek için bir sıçan omurilik kancası ile birlikte bir transkonjonktival insizyon kullanılır. Bu deneylerde, gelecekte doğrudan gen terapisi uygulaması için bu tekniği kullanmak amacıyla optik sinire bir adenoviral vektör enjekte edilir. Bu teknik, ilaç dağıtımı ve optik sinir yaralanması araştırmaları da dahil olmak üzere diğer deneysel çalışmalar için sıçan optik sinirine erişim gerektiren araştırmacılar tarafından da uygulanabilir.
Giriş
Sıçan, glokom, travmatik optik nöropati, kalıtsal optik nöropati, demiyelinizan hastalık ve optik sinir tümörleri dahil olmak üzere optik sinir bozukluklarının incelenmesi için önemli bir deneysel modeldir,2,3,4,5,6,7. Bununla birlikte, orbitanın küçük boyutu ve vasküler orbital dokular göz önüne alındığında, deneysel enjeksiyon ve manipülasyonlar için optik sinire erişim sağlamak zor olabilir.
Deneysel manipülasyonlar için sıçan optik sinirine erişmek için tarif edilen önceki iki teknik, yörüngeye erişmek için ya üstün bir orbital ya da lateral transkutanöz yaklaşım kullanır 8,9. Raykova ve ark. superior orbital cilt insizyonu kullanılarak optik sinire boyalı boncukların enjeksiyonunu tarif eder8. Teknikleri etkili olsa da, hemostaz ve maruz kalma için bir traksiyon sütürüne ihtiyaç duyulmasını gerektirir, bu da bu yaklaşımla daha zor olabilir8. Başka bir grup da benzer şekilde yörüngeye erişmek için lateral bir cilt kesisi kullanan bir yaklaşımı tanımladı. Bu yaklaşımı kullanarak optik siniri başarılı bir şekilde enjekte edebildiler, ancak hemostaz ve yara kapatmagerektirdi 9. Bu teknikler deneysel çalışma için optik sinire erişimde etkili yaklaşımlar olsa da, her ikisi de kutanöz bir insizyon, hemostaz ihtiyacı ve yara kapanmasını içerir. Bu adımlar, enfeksiyon riskleri ve yara kapatma ihtiyacı nedeniyle anestezi altında potansiyel olarak artan süreye sahiptir 8,9,10.
Daha önce açıklanan tekniklerin sınırlamaları göz önüne alındığında, bu çalışmanın amacı, deneysel çalışma için sinire erişmek için daha verimli ve daha az travmatik bir yaklaşım tanımlamaktır. Optik siniri izole etmek için bir omurilik kancası kullanılır, insanlarda bir kas kancası kullanarak kas ve oküler adneksiyal yapıları izole etmek için kullanılan cerrahi tekniğe benzer şekilde. Bu teknik, ilaç dağıtımından gen terapisine kadar birçok endikasyon için sıçan optik sinirine erişmesi gereken araştırmacılar tarafından kullanılabilir.
Bu makale, bir omurilik kancası yardımıyla deneysel çalışma için sıçan orbitine ve optik sinire erişmek için transkonjonktival bir yaklaşımın yeni kullanımını açıklamaktadır.
Protokol
Tüm hayvan prosedürleri, Iowa Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi Ofisi tarafından onaylandı. Bu çalışma Gilbert Aile Vakfı tarafından finanse edilmiştir (hibe numarası 913012). Bu deneyler için 4-12 haftalık ve 100-400 g ağırlığındaki erkek ve dişi Sprague Dawley sıçanlarının bir kombinasyonu kullanıldı. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Anestezi
- İzofluran gazının solunmasını kullanarak sıçanları uyuşturun. Hayvanı indüksiyon odasına yerleştirin ve anestezi indüksiyonu için buharlaştırıcıyı %4-5'e ve anesteziyi sürdürmek için %2-3'e çevirin.
- Devam etmeden önce pedal çekme refleksinin yokluğunu değerlendirerek anestezi derinliğini doğrulayın.
- Oküler yüzeye suni gözyaşı jeli sürün.
2. Konumlandırma
- Anestezi indüklendikten sonra, hayvanı yanal yaslanmış pozisyonda bir ısıtma yastığına yerleştirin. Anesteziyi sürdürmek için bir nosekon kullanın.
- Yörüngeyi ameliyat mikroskobunun altına yerleştirin.
3. Cerrahi maruziyet
- İnferotemporal kadranda dişli forseps ile konjonktivayı kavrayın (Şekil 1).
- Radial konjonktival bir insizyon oluşturmak için Westcott makası kullanın ve ardından inferonazal kadranda Tenon'un fasyasını açın (Şekil 1). Üstteki orbital dokuyu çıkarmak için künt diseksiyon kullanın.
4. Optik sinirin izolasyonu
- Dişli forseps kullanarak gözü nazal olarak döndürün ve asistanın optik siniri izole etmek için inferotemporal kadrana bir omurilik kancası geçirmesini sağlayın (Şekil 1). Ventral oftalmik ven ve ekstraoküler kaslardan kaçınmaya dikkat edin.
- Optik siniri ve kılıfı ortaya çıkarmak için pamuk uçlu bir aplikatör veya forseps ile künt diseksiyon kullanarak üstteki orbital dokuyu ve Tenon'un fasyasını çıkarın.
5. Enjeksiyon
- Optik sinir kılıfını delmek için 10 uL veya 1 mL'lik bir şırıngaya bağlı 33 G'lik bir iğne kullanın (Şekil 1).
- Malzemenin doğrudan sinire enjekte edilmesini sağlamak için doğrudan görselleştirme altında optik sinire farklı konsantrasyonlarda adeno ilişkili virüs-eGFP veya Hindistan Mürekkep boyası enjekte edin.
- AAV-eGFP'yi değerlendirmek için, AAV viral partikülleri (toplam 2 x 10 11 vg doz için 2 x 1013 vektör genomu (vg) / mL) içeren10 μL'lik bir süspansiyon enjekte edin.
NOT: Araştırmacılar, deneysel ihtiyaçlara bağlı olarak başka boyalar veya lekeler enjekte edebilirler.
6. İşlem sonrası adımlar
- İnsizyon bölgesini kaplayacak şekilde konjonktivayı limbusa yeniden yaklaştırın ve konjonktiva üzerine antibiyotikli merhem sürün (Şekil 1).
- Hayvanların anesteziden kurtulmasına izin verin ve herhangi bir enfeksiyon belirtisi olup olmadığını izleyin.
7. Boyama
- Enjeksiyondan yedi gün sonra, hayvanları CO2 boğulması ve ardından etik kurallara uyarak servikal çıkık11 yoluyla sakit edin. Optik siniri inceleyin.
- Optik sinirleri% 4 paraformaldehit içinde sabitleyin ve artan sükroz konsantrasyonlarında durulayın. Kriyokalıpları 2: 1 OCT bileşiği çözeltisine% 20 sükroz içine gömün. Numuneleri sıvı nitrojen içinde hızlı dondurun, -80 °C'de saklayın ve 7 μm kalınlığında kesit alın.
- İmmünositokimyasal (IHC) tampon ve% 3 sığır serum albümininde oda sıcaklığında optik sinirin kriyokesitlerini 30 dakika boyunca bloke edin. Bölümleri, oda sıcaklığında 2 saat boyunca IHC tamponunda seyreltilmiş sıçan anti-GFP birincil antikoru ile inkübe edin.
- Keçi sıçan önleyici ile bölümleri IHC tamponunda oda sıcaklığında 1 saat daha inkübe edin. İkincil antikor inkübasyonu sırasında, hücre çekirdeklerini görselleştirmek için bölümleri 4 ',6-Diamidino-2-fenilindol dihidroklorür (DAPI) ile etiketleyin. Bölümleri PBS ile iyice durulayın ve bir montaj ortamı kullanarak monte edin.
8. Görüntüleme
- Etiketli bölümleri dik bir konfokal mikroskop sistemi kullanarak görüntüleyin.
- Spesifik olarak, DAPI etiketlemesini görselleştirmek için 405 nm mor lazer ve GFP'yi görselleştirmek için 488 nm camgöbeği lazer kullanın.
NOT: Her lazer için ayarlar (yani lazer gücü, yoğunluk/kazanç, arka plan/gürültü filtreleri) farklı konfokal mikroskop sistemleri için her kullanıcı tarafından optimize edilmelidir. 20x objektif lens kullanarak görüntüler elde edin.
Sonuçlar
Sıçan optik sinir enjeksiyonu için bu tekniği kullanan temsili deneysel sonuçlar Şekil 2'de gösterilmektedir. Bu örnekte, adeno-ilişkili virüs-eGFP (AAV-eGFP), 10 μL'lik bir şırıngaya bağlı 33 G'lik bir iğne ile yukarıda açıklanan transkonjonktival teknik kullanılarak sıçan optik sinirine enjekte edildi. Bu sonuçlar, bir sıçan nörofibromatozis 1 (NF1) modelinde optik sinirlere CRISPR düzeltmesi sağlamak için AAV'yi kullanma nihai amacının bir parçası olarak optik sinir enjeksiyonunu incelemek için bu tekniği kullanan bir deneyin parçasıydı. Enjeksiyon tekniğini geliştirmek için boya ve AAV vektörünün bir kombinasyonu kullanıldı. Hayvanlar, optik sinire enjeksiyondan yedi gün sonra sakrifiye edildi. Sinirler daha sonra diseke edildi ve materyalin optik sinir kılıfına başarılı bir şekilde nüfuz ettiğini ve optik sinire girdiğini doğrulamak için optik sinirin konfokal mikroskopi ile görüntülenmesine izin vermek için anti-GFP antikorları ile etiketlendi. Materyalin optik sinire başarılı bir şekilde sokulması, antikor boyaması ile doğrulandı ve Şekil 2A'da görüldüğü gibi konfokal mikroskopide yeşil göründü. Optik sinir kılıfından penetrasyonun tam olmadığı veya iğne yolundan materyal akışı olduğu durumlarda, Şekil 2C'de görüldüğü gibi sinir dokusu içinde değil, optik sinir kılıfının kenarı boyunca lekelenme görüldü.
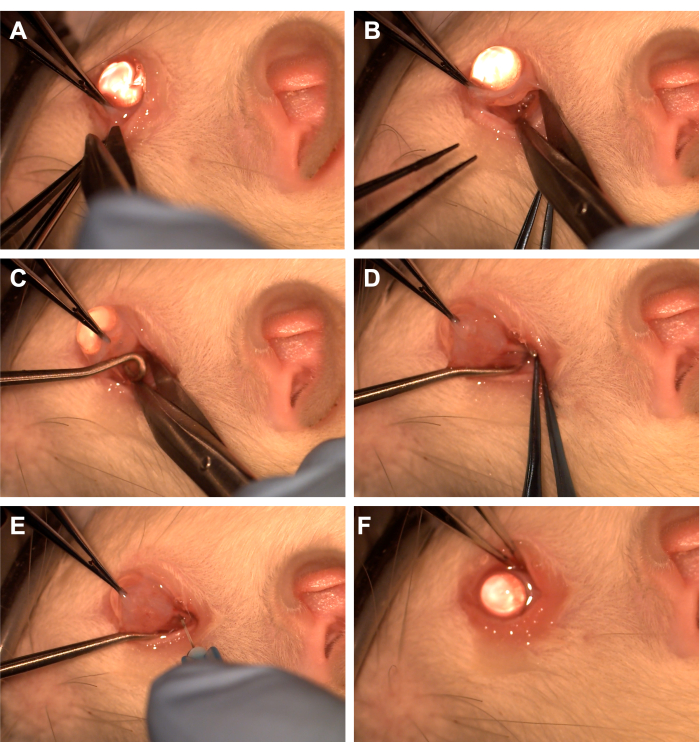
Şekil 1: Cerrahi adımların sırası. (A) Konjonktiva dişli forseps ile kavranır ve limbal peritomi oluşturmak için Westcott makası kullanılır. (B) Zıvananın fasyası açıldıktan ve künt bir şekilde diseke edildikten sonra, Westcott makası yardımıyla yörünge ortaya çıkarılır. (C) Bir omurilik kancası yerleştirilir ve optik siniri izole etmek için kullanılır. (D) Üstteki orbital dokunun künt diseksiyonundan sonra, optik sinir omurilik kancası kullanılarak açığa çıkarılır. (E) Optik sinir kılıfını delmek ve optik sinire adenovirüs veya boya enjekte etmek için 33 G'lik bir iğne kullanılır. (F) Küre yörüngeye yerleştirilir ve konjonktiva peritomi bölgesi üzerinde yeniden konumlandırılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
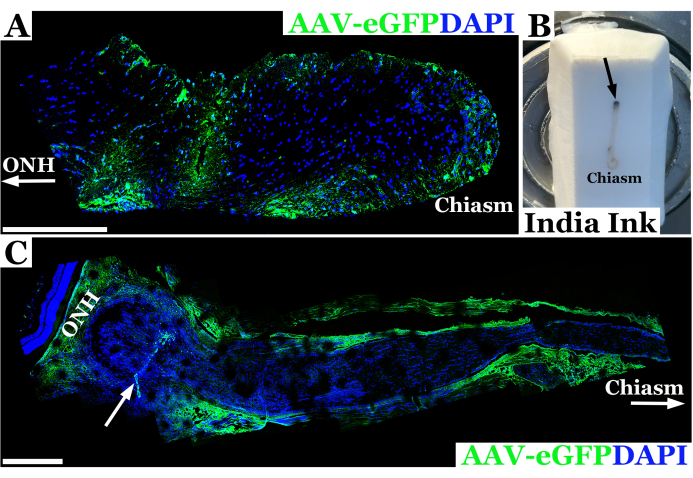
Şekil 2: AAV-eGFP (yeşil) ile başarılı enjeksiyondan 7 gün sonra sıçan optik sinirinin temsili floresan konfokal panoramik görüntüsü, burada optik kiazma yakınında vektör transdüksiyonlu nöronlar. (A) Optik sinir çekirdekleri DAPI (mavi) ile etiketlenmiştir. Oklu ONH, optik sinir başını veya sinirin orbital ucunu belirtirken, optik kiazma ucu "kiazma" olarak etiketlenir. (B) Donmuş kriyoseksiyon bloğuna gömülü bir sıçan optik sinirinin yörüngeden kiazmaya kadar olan fotoğrafı. Optik siniri yönlendirmek için sinire yörüngenin hemen arkasına (siyah okla gösterilen enjeksiyon bölgesi) Hindistan Mürekkebi enjekte edilir. (C) AAV-eGFP (yeşil) ile başarısız enjeksiyondan 7 gün sonra sıçan optik sinirinin panoramik floresan görüntüsü, burada vektör süspansiyonunun çoğu muhtemelen sinir yolundan dışarı akarak optik kılıfı transdüke eder. Optik sinir çekirdekleri DAPI (mavi) ile etiketlenmiştir. ONH, nöral retinanın hemen arkasındaki Optik Sinir Başını ve beyaz bir okla gösterilen enjeksiyon bölgesini belirtir. Kiazma ve beyaz ok, optik kiazmaya doğru sınır çizer. Ölçek çubukları = (A) içinde 400 μm ve (C) içinde 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Değişken | Yaklaşmak | ||
| Transkonjonktival | Üstün | Yanal | |
| Cilt insizyonu | Hayır | Evet | Evet |
| Konjonktival insizyon | Evet | Hayır | Hayır |
| Mikroskop | Evet | Evet | Evet |
| Superior orbital kas transeksiyonu | Hayır | Evet | Hayır |
| Çekiş sütürü | Hayır | Evet | Evet |
| Omurilik kancası | Evet | Hayır | Hayır |
| Cilt sütürü | Hayır | Evet | Evet |
Tablo 1: Deneysel çalışma için sıçan optik sinirini izole etmek için daha önce yayınlanmış tekniklerle karşılaştırma. Cilt insizyonu, konjonktival insizyon, ameliyat mikroskobu, superior orbital kas transeksiyonu, traksiyon sütürü, omurilik kancası ve cilt sütürü gibi değişkenler transkonjonktival, superior ve lateral yaklaşımlar kullanılarak karşılaştırıldı.
Tartışmalar
Bu makale, deri insizyonuna gerek kalmadan deneysel çalışma için sıçan optik sinirine erişmek için yeni bir yöntemi açıklamaktadır. Bu yaklaşım, diğer tekniklere kıyasla cilt kesisine ihtiyaç duyulmaması ve daha az adım atılması göz önüne alındığında, etkinlik ve azalmış enfeksiyon ve kanama riskinin potansiyel avantajlarını sağlar 8,9. Bu teknik aynı zamanda, sinire ve çevresindeki dokulara travmayı önlemek için optik siniri bir sıçan omurilik kancası ile izole etmeye yönelik yeni bir yaklaşım kullanır.
Teknikteki kritik adımlar arasında subkonjonktival boşluğa erişim için yeterli bir limbal insizyon yapılması, optik siniri izole etmek için omurilik kancasının kullanılması ve optik sinir kılıfını delmek ve optik sinire materyal iletmek için küçük delikli bir iğnenin kullanılması yer alır. Siniri izole etmek için omurilik kancasını döndürmeye özen gösterilmelidir. Sinir net bir şekilde izole edilmediğinde, sinirin izole edildiğinden emin olmak için kancanın birkaç kez sokulması gerekebilir ve daha iyi görüntüleme için sinir kılıfından bağ dokusunu çıkarmak için pamuk uçlu bir aplikatör kullanılabilir. Bu tekniğe maruz kalmak, daha fazla orbital yağ hacmine sahip daha büyük boyutlu hayvanlarda daha zor olabilir. Yeterli maruz kalma için çevredeki dokuları geri çekmek için bir asistanın kullanılması bu durumlarda yararlı olabilir. Enjeksiyon sırasında optik sinirin doğrudan görüntülenmesine özen gösterilmelidir. Enjeksiyon sırasında iğnenin sinir kılıfı boyunca dik bir şekilde yönlendirilmesinin sağlanması enjeksiyon başarısını artırır.
Bu teknik, Raykova ve ark. ve Hallasve Wells 8,9. Raykova ve ark. orbital sırt üzerinde oluşturulan bir cilt insizyonu ve superior orbital kasın transeksiyonu ile üstün bir yaklaşım kullanarak sıçan optik sinirine erişimi tanımladılar8. Bu yaklaşım sinirin açığa çıkmasına izin verirken, kanama riski daha yüksek olan bir göz dışı kasın transeksiyonunu ve cilt kesisinin dikilmesi ihtiyacını gerektirir. Benzer şekilde, Hallas ve Wells, optik sinir9'a ulaşmak için sıçan yörüngesine yanal bir yaklaşımı tanımlar. Lateral bir cilt insizyonu, ardından lateral konjonktival insizyon ve gözü döndürmek ve optik siniri ortaya çıkarmak için kullanılan bir traksiyon sütürünü tanımlarlar9. Üstün yaklaşıma benzer şekilde, bu teknik, yara kapanması ihtiyacı ve enfeksiyon ve kanama riski daha yüksek olan bir cilt kesisini içerir 8,9. Burada sunulan transkonjonktival teknik, cilt ve kas kesisi ihtiyacını ortadan kaldırır, bu nedenle kanama/enfeksiyon riskini azaltır ve cilt kesisini kapatma ihtiyacını ortadan kaldırarak verimliliği artırır. Prosedür minimal sıkıntıya neden olur, iyi tolere edilir ve analjezik veya antienflamatuar ilaçların uzun süreli kullanımını gerektirmez. Transkonjonktival teknik, Tablo 1'de daha önce yayınlanmış tekniklerle karşılaştırılır ve karşılaştırılır.
Bu çalışmada sunulan tekniğin sınırlamaları, omurilik kancasını kullanarak optik siniri izole etmek için bir öğrenme eğrisini içerir, ancak bir kez ustalaştıktan sonra, bu teknik sinirin verimli ve atravmatik izolasyonuna izin verir. Bu teknik için ameliyat mikroskobu kullanımına aşinalık gereklidir. Bu teknik için bir öğrenme eğrisi olsa da, daha az sayıda adım olması ve yaranın dikilmesine ihtiyaç duyulmaması, bu tekniğin diğer yayınlanmış yaklaşımlara göre ustalaşmasını kolaylaştıracaktır 8,9. Siniri ve kılıfı açığa çıkarmak için dikkatli künt diseksiyon zorunludur, çünkü yakındaki damarlardan ve kas dokusundan kanama olabilir. Daha büyük sıçanlarda, artmış orbital yağ / doku nedeniyle optik sinirin büyük bölümlerini ortaya çıkarmak daha zor olabilir, ancak dikkatli bir şekilde, sinirin görselleştirilmesini iyileştirmek için bu doku genellikle künt diseksiyon ile çıkarılabilir. Daha ileri çalışmalar, bu tekniğin fare gibi diğer model sistemlerde kullanımını ele alabilir ve cerrahi verimliliği optik sinir erişimi için diğer tekniklerle doğrudan karşılaştırabilir.
Bu teknik, deneysel çalışma için sıçan optik sinirine erişmesi gereken diğer gruplar tarafından kullanılabilir. Burada sunulan deneyler, nörofibromatozis tip 1'in (NF1) sıçan modellerinde optik sinire CRISPR gen düzeltmesi sağlamanın yollarını geliştirmeyi amaçlayan daha büyük bir projenin parçasıydı. Bu projenin nihai amacı, görmeyi tehdit eden optik sinir gliomlarının gelişmesini önlemek için NF1'li hastalarda gen terapisini doğrudan optik sinire vermenin yollarını bulmaktır12. Bu çalışmada, materyalin optik sinire iletildiğinden emin olmak ve vektörün optik sinire nüfuz edebileceğini göstermek için optik sinire Hindistan Mürekkep boyası veya AAV-eGFP vektörü enjekte edildi.
Bu teknik, diğer araştırmacılar tarafından daha geniş bir şekilde kullanılabilir, çünkü optik sinirin neoplazmları, Leber kalıtsal optik nöropati gibi dejeneratif süreçler, travmatik optik nöropati, glokom ve optik nörit13 gibi otoimmün hastalıklar dahil olmak üzere çeşitli görmeyi tehdit eden durumları tedavi etmek için sinire erişilmesi veya yeni terapötiklerin enjekte edilmesi gerekebilir. 14. Örneğin, Singh ve ark. C6 glioma hücrelerinin sıçan optik sinirine enjeksiyonunu, kutanöz bir insizyon3 kullanarak sinire erişen bir nörofibromatozis tip 1 modeli olarak tanımlar, Kwon ve ark. optik sinir kompresyonu ve kök hücrelerle rejenerasyonu içeren çalışmalar için lateral kutanöz bir yaklaşımdan optik sinire erişti6 ve Negishi ve ark. bir optik sinir modeli olarak Schwann hücre grefti yerleşimi için sıçan optik sinirine erişti Yenilenme15. Burada sunulan teknik, çeşitli deneysel soruları yanıtlamak için sıçan optik sinirine erişim gerektiren bu gibi çalışmalar için daha verimli ve daha güvenli bir yaklaşım sağlayabilir.
Özetle, bu çalışma, küçük ölçülü bir iğne yaklaşımı ile optik sinire girmede etkinliği ve kutanöz bir insizyona ihtiyaç duymadan sinir kılıfına nüfuz etme yeteneğini göstermektedir. Temsili görüntüler, adenoviral vektörün optik sinire başarılı bir şekilde nüfuz ettiğini göstermektedir. Bu tekniğin rejeneratif tıp, onkoloji ve kalıtsal retina hastalıklarında çeşitli optik sinir deneylerine uygulamaları vardır.
Açıklamalar
İlgili açıklama yok.
Teşekkürler
Yazarlar, bu projeyi finanse ettiği için Gilbert Aile Vakfı'na teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Referanslar
- Korn, P., et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383(2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695(2020).
- Ellouze, S., et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. (99), e52249(2015).
- Hallas, B. H., Wells, M. R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F., et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. (128), e56272(2017).
- Han, I. H., et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T., et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683(2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır