Method Article
Approche transconjonctivale pour l’injection dans le nerf optique du rat
Dans cet article
Résumé
Ce protocole décrit une technique unique utilisant une approche transconjonctivale pour accéder au nerf optique du rat pour des injections.
Résumé
Le rat sert de modèle important pour l’étude des troubles du nerf optique, y compris les maladies héréditaires, traumatiques, néoplasiques et auto-immunes. L’accès au nerf optique du rat pour des manipulations et des injections expérimentales est difficile en raison de la petite taille de l’orbite et de la vascularisation des tissus orbitaires environnants. Les techniques précédentes impliquaient une incision cutanée, qui comporte un risque plus élevé d’infection et nécessite la fermeture de la plaie. Cette étude vise à décrire une approche unique, moins invasive et potentiellement plus efficace pour accéder au nerf optique du rat. Une incision transconjonctivale, ainsi qu’un crochet de moelle épinière de rat, sont utilisés pour isoler le nerf optique pour des injections expérimentales. Dans ces expériences, un vecteur adénoviral est injecté dans le nerf optique dans le but d’utiliser cette technique pour l’administration directe de la thérapie génique à l’avenir. Cette technique peut également être appliquée par les chercheurs qui ont besoin d’accéder au nerf optique du rat pour d’autres études expérimentales, y compris l’administration de médicaments et la recherche sur les lésions du nerf optique.
Introduction
Le rat est un modèle expérimental clé pour l’étude des troubles du nerf optique, notamment le glaucome, la neuropathie optique traumatique, la neuropathie optique héréditaire, la maladie démyélinisante et les tumeurs du nerf optique,2,3,4,5,6,7. Cependant, il peut être difficile d’obtenir l’accès au nerf optique pour des injections et des manipulations expérimentales, compte tenu de la petite taille de l’orbite et des tissus orbitaires vasculaires.
Les deux techniques précédentes qui ont été décrites pour accéder au nerf optique du rat pour des manipulations expérimentales utilisent soit une approche orbitale supérieure, soit une approche transcutanée latérale pour accéder à l’orbite 8,9. Raykova et al. décrivent l’injection de billes teintées dans le nerf optique à l’aide d’une incision cutanée orbitaire supérieure8. Bien que leur technique ait été efficace, elle nécessite une hémostase et la nécessité d’une suture de traction pour l’exposition, ce qui peut être plus difficile avec cette approche8. Un autre groupe a également décrit une approche utilisant une incision cutanée latérale pour accéder à l’orbite. Ils ont réussi à injecter le nerf optique en utilisant cette approche, mais ont nécessité une hémostase et une fermeture de la plaie9. Bien que ces techniques soient des approches efficaces pour accéder au nerf optique pour l’étude expérimentale, elles impliquent toutes deux une incision cutanée, la nécessité d’une hémostase et la fermeture de la plaie. Ces étapes ont associé des risques d’infection et potentiellement une augmentation du temps sous anesthésie en raison de la nécessité de fermer la plaie 8,9,10.
Compte tenu des limites des techniques décrites précédemment, l’objectif de cette étude est de décrire une approche plus efficace et moins traumatisante de l’accès au nerf pour l’étude expérimentale. Un crochet de moelle épinière est utilisé pour isoler le nerf optique, analogue à la technique chirurgicale utilisée chez l’homme pour isoler les structures annexielles musculaires et oculaires à l’aide d’un crochet musculaire. Cette technique peut être utilisée par les chercheurs qui ont besoin d’accéder au nerf optique du rat pour de nombreuses indications, de l’administration de médicaments à la thérapie génique.
Cet article décrit l’utilisation novatrice d’une approche transconjonctivale pour accéder à l’orbite du rat et au nerf optique pour une étude expérimentale à l’aide d’un crochet de moelle épinière.
Protocole
Toutes les procédures relatives aux animaux ont été approuvées par le Bureau du comité institutionnel de protection et d’utilisation des animaux de l’Université de l’Iowa. Cette étude a été financée par la Fondation de la famille Gilbert (numéro de subvention 913012). Une combinaison de rats Sprague Dawley mâles et femelles, âgés de 4 à 12 semaines et pesant de 100 à 400 g, a été utilisée pour ces expériences. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Anesthésie
- Anesthésier les rats en inhalant de l’isoflurane. Placez l’animal dans la chambre d’induction et tournez le vaporisateur à 4 % à 5 % pour l’induction de l’anesthésie et à 2 % à 3 % pour maintenir l’anesthésie.
- Vérifiez la profondeur de l’anesthésie en évaluant l’absence de réflexe de retrait de la pédale avant de procéder.
- Appliquez du gel lacrymal artificiel sur la surface oculaire.
2. Positionnement
- Une fois l’anesthésie induite, placez l’animal sur un coussin chauffant en position couchée latérale. Utilisez un cône de nez pour maintenir l’anesthésie.
- Positionnez l’orbite sous le microscope opératoire.
3. Exposition chirurgicale
- Saisir la conjonctive à l’aide d’une pince dentée dans le quadrant inférotemporal (Figure 1).
- Utilisez des ciseaux Westcott pour créer une incision conjonctivale radiale, puis ouvrez le fascia de Tenon dans le quadrant inferonasal (Figure 1). Utilisez la dissection émoussée pour enlever le tissu orbitaire sus-jacent.
4. Isolement du nerf optique
- Faites pivoter l’œil nasalement à l’aide d’une pince dentée et demandez à l’assistant de passer un crochet de moelle épinière dans le quadrant inférotemporal pour isoler le nerf optique (Figure 1). Veillez à éviter la veine ophtalmique ventrale et les muscles extraoculaires.
- Retirez le tissu orbitaire sus-jacent et le fascia de Tenon à l’aide d’une dissection contondante avec un applicateur à bout de coton ou une pince pour exposer le nerf optique et la gaine.
5. L’injection
- À l’aide d’une aiguille de 33 G reliée à une seringue de 10 μl ou de 1 mL, percer la gaine du nerf optique (figure 1).
- Injectez différentes concentrations de virus adéno-associé-eGFP ou de colorant d’encre de Chine dans le nerf optique sous visualisation directe pour vous assurer que le matériau est injecté directement dans le nerf.
- Pour évaluer l’AAV-eGFP, injecter 10 μL de suspension contenant des particules virales AAV (2 x 1013 génomes vectoriels (vg)/mL pour une dose totale de 2 x 1011 vg).
REMARQUE : Les chercheurs peuvent injecter d’autres colorants ou colorants selon les besoins expérimentaux.
6. Étapes post-procédurales
- Rapprochez la conjonctive du limbe pour couvrir le site d’incision et appliquez une pommade antibiotique sur la conjonctive (Figure 1).
- Laissez les animaux se remettre de l’anesthésie et surveillez-les pour détecter tout signe d’infection.
7. Coloration
- Sept jours après l’injection, sacrifiez les animaux par asphyxie au CO2 suivie d’une luxation cervicale11 selon les directives éthiques. Disséquez le nerf optique.
- Fixez les nerfs optiques avec 4 % de paraformaldéhyde et rincez avec des concentrations accrues de saccharose. Intégrez des cryomoules dans une solution 2:1 de composé OCT à 20 % de saccharose. Congeler instantanément les échantillons dans de l’azote liquide, les conserver à -80 °C et les sectionner à une épaisseur de 7 μm.
- Bloquer les cryosections du nerf optique pendant 30 min à température ambiante dans un tampon immunocytochimique (IHC) et 3 % d’albumine sérique bovine. Incuber des sections avec un anticorps primaire anti-GFP de rat dilué dans un tampon IHC pendant 2 h à température ambiante.
- Incuber des sections avec de la chèvre anti-rat dans un tampon IHC pendant 1 h supplémentaire à température ambiante. Au cours de l’incubation secondaire de l’anticorps, étiquetez des sections avec du dichlorhydrate de 4',6-diamidino-2-phénylindole (DAPI) pour visualiser les noyaux cellulaires. Rincez abondamment les sections avec du PBS et montez à l’aide d’un support de montage.
8. Imagerie
- Imagez les coupes étiquetées à l’aide d’un système de microscope confocal vertical.
- Plus précisément, utilisez un laser violet de 405 nm pour visualiser l’étiquetage DAPI et un laser cyan de 488 nm pour visualiser la GFP.
REMARQUE : Les paramètres de chaque laser (c’est-à-dire la puissance laser, l’intensité/le gain, les filtres de fond/bruit) doivent être optimisés par chaque utilisateur pour différents systèmes de microscope confocal. Acquérez des images à l’aide d’un objectif 20x.
Résultats
Des résultats expérimentaux représentatifs utilisant cette technique pour l’injection du nerf optique chez le rat sont présentés à la figure 2. Dans cet exemple, le virus adéno-associé eGFP (AAV-eGFP) a été injecté dans le nerf optique du rat en utilisant la technique transconjonctivale décrite ci-dessus avec une aiguille de 33 G reliée à une seringue de 10 μL. Ces résultats faisaient partie d’une expérience utilisant cette technique pour étudier l’injection du nerf optique dans le cadre d’un objectif ultime visant à utiliser l’AAV pour fournir une correction CRISPR aux nerfs optiques dans un modèle de rat de neurofibromatose 1 (NF1). Une combinaison de colorant et de vecteur AAV a été utilisée pour développer la technique d’injection. Les animaux ont été sacrifiés sept jours après l’injection dans le nerf optique. Les nerfs ont ensuite été disséqués et marqués avec des anticorps anti-GFP pour permettre l’imagerie du nerf optique par microscopie confocale afin de confirmer que le matériau avait réussi à pénétrer dans la gaine du nerf optique et à pénétrer dans le nerf optique. L’introduction réussie de matériel dans le nerf optique a été confirmée par la coloration des anticorps, et il est apparu vert à la microscopie confocale, comme le montre la figure 2A. Dans les cas où la pénétration à travers la gaine du nerf optique n’était pas complète, ou s’il y avait un efflux de matière à partir de la trace de l’aiguille, une coloration a été observée le long du bord de la gaine du nerf optique plutôt qu’à l’intérieur du tissu nerveux, comme le montre la figure 2C.
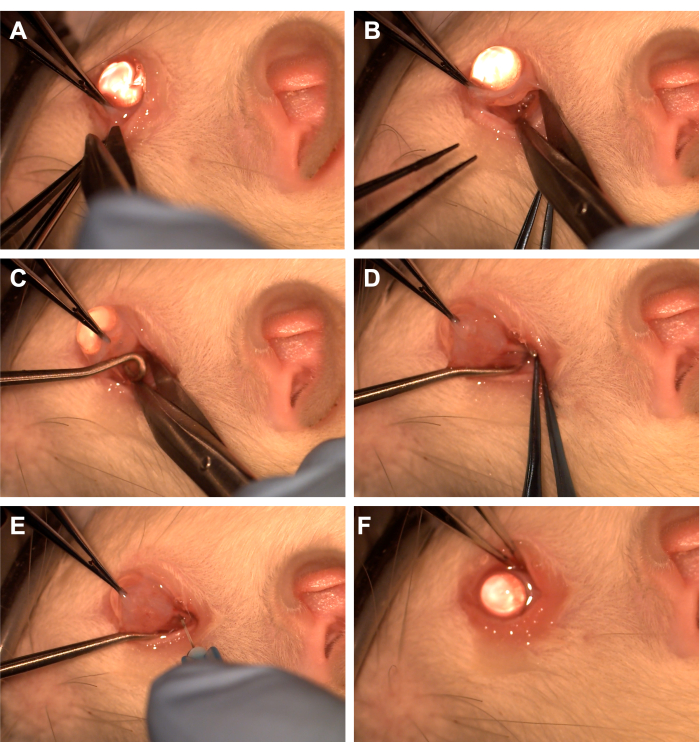
Figure 1 : Séquence des étapes chirurgicales. (A) La conjonctive est saisie à l’aide d’une pince dentée et des ciseaux Westcott sont utilisés pour créer une péritomie limbique. (B) Une fois que le fascia du tenon est ouvert et disséqué brutalement, l’orbite est exposée à l’aide de ciseaux Westcott. (C) Un crochet de moelle épinière est inséré et utilisé pour isoler le nerf optique. (D) Après dissection contondante du tissu orbitaire sus-jacent, le nerf optique est exposé à l’aide du crochet de la moelle épinière. (E) Une aiguille de 33 G est utilisée pour percer la gaine du nerf optique et injecter un adénovirus ou un colorant dans le nerf optique. (F) Le globe est déposé dans l’orbite et la conjonctive est repositionnée sur le site de la péritomie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
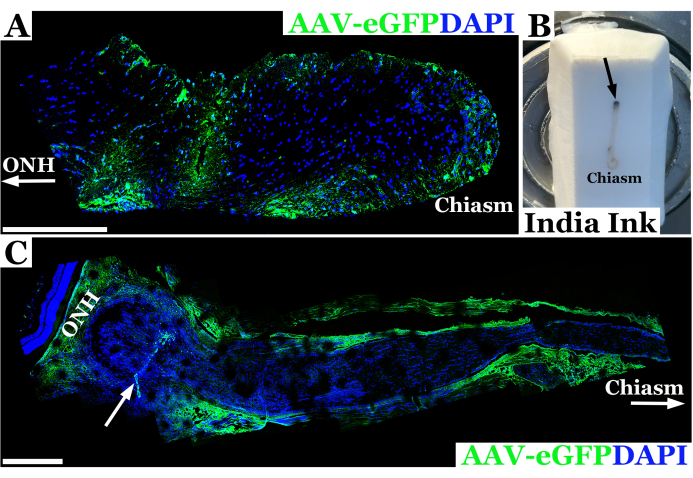
Figure 2 : Image panoramique confocale fluorescente représentative du nerf optique du rat 7 jours après l’injection réussie d’AAV-eGFP (vert) dans laquelle le vecteur a transduit les neurones près du chiasma optique. (A) Les noyaux du nerf optique sont marqués avec du DAPI (bleu). ONH avec une flèche désigne la tête du nerf optique ou l’extrémité orbitale du nerf, tandis que l’extrémité du chiasma optique est étiquetée comme « chiasma ». (B) Photographie d’un nerf optique de rat de l’orbite au chiasma encastré dans un bloc de cryosection congelé. Le nerf est injecté avec de l’encre de Chine immédiatement en arrière de l’orbite (site d’injection indiqué par une flèche noire) afin d’orienter le nerf optique. (C) Image fluorescente panoramique du nerf optique du rat 7 jours après l’injection infructueuse d’AAV-eGFP (vert) dans laquelle la majeure partie de la suspension du vecteur s’est probablement échappée du tractus nerveux, transductant la gaine optique. Les noyaux du nerf optique sont marqués avec du DAPI (bleu). ONH désigne la tête du nerf optique immédiatement en arrière de la rétine neurale et le site d’injection indiqué par une flèche blanche. Le chiasma et la flèche blanche se délimitent vers le chiasma optique. Barres d’échelle = 400 μm en (A) et 200 μm en (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Variable | Approcher | ||
| Transconjonctival | Supérieur | Latéral | |
| Incision cutanée | Non | Oui | Oui |
| Incision conjonctivale | Oui | Non | Non |
| Microscope | Oui | Oui | Oui |
| Transection du muscle orbitaire supérieur | Non | Oui | Non |
| Suture de traction | Non | Oui | Oui |
| Crochet de moelle épinière | Oui | Non | Non |
| Suture cutanée | Non | Oui | Oui |
Tableau 1 : Comparaison avec les techniques précédemment publiées pour isoler le nerf optique du rat pour l’étude expérimentale. Les variables, y compris la nécessité d’une incision cutanée, d’une incision conjonctivale, d’un microscope opératoire, d’une section du muscle orbitaire supérieur, d’une suture de traction, d’un crochet de moelle épinière et d’une suture cutanée, sont comparées à l’aide des approches transconjonctivale, supérieure et latérale.
Discussion
Cet article décrit une nouvelle méthode d’accès au nerf optique du rat pour une étude expérimentale sans avoir besoin d’une incision cutanée. Cette approche offre les avantages potentiels de l’efficacité et de la réduction du risque d’infection et de saignement, compte tenu de l’absence de besoin d’incision cutanée et du nombre réduit de marches par rapport aux autres techniques 8,9. Cette technique utilise également l’approche novatrice consistant à isoler le nerf optique à l’aide d’un crochet de moelle épinière de rat pour éviter un traumatisme du nerf et des tissus environnants.
Les étapes critiques de la technique comprennent la réalisation d’une incision limbique adéquate pour accéder à l’espace sous-conjonctival, l’utilisation du crochet de la moelle épinière pour isoler le nerf optique et l’utilisation d’une aiguille de petit calibre pour percer la gaine du nerf optique et livrer du matériel au nerf optique. Il faut prendre soin de faire pivoter le crochet de la moelle épinière pour isoler le nerf. Lorsque le nerf n’est pas clairement isolé, il peut être nécessaire d’introduire le crochet plusieurs fois afin de s’assurer que le nerf est isolé, et un applicateur à bout de coton peut être utilisé pour retirer le tissu conjonctif de la gaine nerveuse pour une meilleure visualisation. L’exposition à cette technique peut être plus difficile chez les animaux de plus grande taille avec un plus grand volume de graisse orbitaire. L’utilisation d’un assistant pour rétracter les tissus environnants afin d’une exposition adéquate peut être utile dans ces situations. Il faut prendre soin de visualiser directement le nerf optique lors de l’injection. Assurer une orientation perpendiculaire de l’aiguille à travers la gaine nerveuse pendant l’injection améliore le succès de l’injection.
Cette technique s’appuie sur des travaux antérieurs de Raykova et al. et de Hallas et Wells 8,9. Raykova et al. ont décrit l’accès au nerf optique du rat à l’aide d’une approche supérieure avec une incision cutanée créée sur la crête orbitaire et une section du muscle orbitaire supérieur8. Bien que cette approche permette d’exposer le nerf, elle nécessite la section d’un muscle extraoculaire avec un risque plus élevé de saignement et la nécessité de suturer l’incision cutanée. De même, Hallas et Wells décrivent une approche latérale de l’orbite du rat pour atteindre le nerf optique9. Ils décrivent une incision cutanée latérale suivie d’une incision conjonctivale latérale et d’une suture de traction utilisée pour faire pivoter l’œil et exposer le nerf optique9. Semblable à l’approche supérieure, cette technique implique une incision cutanée avec la nécessité de fermer la plaie et un risque plus élevé d’infection et de saignement 8,9. La technique transconjonctivale présentée ici évite la nécessité d’une incision cutanée et musculaire, réduisant ainsi le risque de saignement / infection et améliorant l’efficacité en évitant la nécessité de fermer une incision cutanée. La procédure provoque une détresse minimale, est bien tolérée et ne nécessite pas l’utilisation à long terme d’analgésiques ou d’anti-inflammatoires. La technique transconjonctivale est comparée et contrastée avec les techniques publiées précédemment dans le tableau 1.
Les limites de la technique présentée dans cette étude comprennent une courbe d’apprentissage pour isoler le nerf optique à l’aide du crochet de la moelle épinière, mais une fois maîtrisée, cette technique permet une isolation efficace et atraumatique du nerf. Une connaissance de l’utilisation d’un microscope opératoire est nécessaire pour cette technique. Bien qu’il y ait une courbe d’apprentissage pour cette technique, le plus petit nombre d’étapes et l’absence de besoin de suture de la plaie rendront cette technique plus facile à maîtriser par rapport aux autres approches publiées 8,9. Une dissection contondante soigneuse pour exposer le nerf et la gaine est impérative, car il peut y avoir une hémorragie des vaisseaux et des tissus musculaires voisins. Chez les rats plus gros, il peut être plus difficile d’exposer de grandes sections du nerf optique en raison de l’augmentation de la graisse/des tissus orbitaires, mais avec des soins, ces tissus peuvent généralement être retirés par dissection contondante pour améliorer la visualisation du nerf. D’autres travaux pourraient porter sur l’utilisation de cette technique dans d’autres systèmes modèles, tels que la souris, et pourraient comparer directement l’efficacité chirurgicale à d’autres techniques d’accès au nerf optique.
Cette technique peut être utilisée par d’autres groupes qui ont besoin d’accéder au nerf optique du rat pour une étude expérimentale. Les expériences présentées ici faisaient partie d’un projet plus vaste visant à développer des moyens de corriger le gène CRISPR au nerf optique dans des modèles de rats de neurofibromatose de type 1 (NF1). L’objectif ultime de ce projet est de trouver des moyens d’administrer une thérapie génique directement au nerf optique chez les patients atteints de NF1 afin de prévenir le développement de gliomes du nerf optique, qui menacent la vision12. Dans cette étude, le colorant à l’encre de Chine ou vecteur AAV-eGFP a été injecté dans le nerf optique pour s’assurer que le matériau était délivré dans le nerf optique et pour démontrer que le vecteur pouvait pénétrer dans le nerf optique.
Cette technique pourrait être utilisée plus largement par d’autres chercheurs, car il peut être nécessaire d’accéder au nerf ou d’injecter de nouvelles thérapies dans le but de traiter une variété de conditions menaçant la vision, y compris les néoplasmes du nerf optique, les processus dégénératifs tels que la neuropathie optique héréditaire de Leber, la neuropathie optique traumatique, le glaucome et les maladies auto-immunes telles que la névrite optique13. 14. Planche à billets Par exemple, Singh et al. décrivent l’injection de cellules de gliome C6 dans le nerf optique du rat comme un modèle de neurofibromatose de type 1 accédant au nerf par une incision cutanée3, Kwon et al. ont accédé au nerf optique à partir d’une approche cutanée latérale pour des études impliquant la compression et la régénération du nerf optique avec des cellules souches6, et Negishi et al. ont accédé au nerf optique du rat pour le placement d’une greffe de cellules de Schwann comme modèle de nerf optique Régénération15. La technique présentée ici pourrait fournir une approche plus efficace et plus sûre pour des études comme celles-ci qui nécessitent l’accès au nerf optique du rat pour répondre à une variété de questions expérimentales.
En résumé, ce travail démontre l’efficacité de l’entrée dans le nerf optique avec une aiguille de petit calibre et la capacité de pénétrer la gaine nerveuse sans avoir besoin d’une incision cutanée. Les images représentatives montrent que le vecteur adénoviral a réussi à pénétrer le nerf optique. Cette technique a des applications à une variété d’expériences sur le nerf optique en médecine régénérative, en oncologie et dans les maladies rétiniennes héréditaires.
Déclarations de divulgation
Aucune divulgation pertinente.
Remerciements
Les auteurs tiennent à remercier la Fondation de la famille Gilbert pour le financement de ce projet.
matériels
| Name | Company | Catalog Number | Comments |
| 4’,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | MilliporeSigma | D9542 | 1:10,000 dilution, used for staining cryosections |
| AAV viral particles | Vectorbuilder | N/A | Vector used for optic nerve injection |
| Aqua-Mount Mounting Medium | ThermoFisher Scientific | 14-390-5 | Used for mounting stained cryosections |
| Bovine serum albumin | Research Products International Corp | 9048-46-8 | Used in process for staining cryosections |
| Goat anti-rat Alexa Fluor 488 | Thermo Fisher Scientific | A-11006 | 1:1000 dilution, used for staining cryosections |
| Isoflorane gas | Primal Healthcare | 66794-017-10 | Gas for anesthesia |
| Leica TCS SPE upright confocal microscope system | Leica Microsystems | N/A | Confocal microscope |
| Luer lock syringe | BD | 309628 | Syringe for injection |
| Microm HM505E cryostat | Microm | M-HM360 fom Marshall Scientific | Used for specimen sectioning |
| Rat anti-GFP | BioLegend | 338002 | 1:500 dilution, used for staining cryosections |
| Spinal cord hook | F.S.T | 10162-12 | Hook used to isolate optic nerve |
| Ten microliter syringe | Hamilton | CAL 803901 | Syringe for injection |
| Thirty-three-guage needle | JBP | JBP3308B | Needle for injection |
| Tissue-Tek OCT compound | VWR International | 25608-930 | Used for cryomold processing |
| Toothed forceps | Bausch and Lomb | E1809 | Forceps to grasp conjunctiva |
| Westcott curved tenotomy scissors | Bausch and Lomb | E3323-R | Scissors to create peritomy |
Références
- Korn, P. et al. Evaluation of the neuroprotective effects of methylprednisolone and surgical decompression in a rodent model of traumatic optic neuropathy. Curr Eye Res. 47 (3), 461-467 (2022).
- Lim, J. Y., Utzschneider, D. A., Sakatani, K., Kocsis, J. D. The attenuation of GABA sensitivity in the maturing myelin-deficient rat optic nerve. Brain Res Dev Brain Res. 72 (1), 15-20 (1993).
- Singh, D., Dromel, P. C., Perepelkina, T., Baranov, P., Young, M. C6 cell injection into the optic nerve of long-evans rats: A short-term model of optic pathway gliomas. Cell Transplant. 29, 963689720964383 (2020).
- Schwaner, S. A., Feola, A. J., Ethier, C. R. Factors affecting optic nerve head biomechanics in a rat model of glaucoma. J R Soc Interface. 17 (165), 20190695 (2020).
- Ellouze, S. et al. Optimized allotopic expression of the human mitochondrial ND4 prevents blindness in a rat model of mitochondrial dysfunction. Am J Hum Genet. 83 (3), 373-387 (2008).
- Kwon, H., Park, M., Nepali, S., Lew, H. Hypoxia-preconditioned placenta-derived mesenchymal stem cells rescue optic nerve axons via differential roles of vascular endothelial growth factor in an optic nerve compression animal model. Mol Neurobiol. 57 (8), 3362-3375 (2020).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J Glaucoma. 16 (5), 483-505 (2007).
- Raykova, K., Jones, M. V., Huang, H., Hoffman, P. F., Levy, M. Minimally-invasive Technique for Injection into Rat Optic Nerve. J Vis Exp. 99, e52249 (2015).
- Hallas, B.H., Wells, M.R. A novel technique for mulitple injections into the mamallian optic nerve. Kopf Carrier. 54, 1-10 (2000).
- Yan, F. et al. Partial optic nerve transection in rats: A model established with a new operative approach to assess secondary degeneration of retinal ganglion cells. J Vis Exp. 128, e56272 (2017).
- Han I. H. et al. Biocompatibility of human induced pluripotent stem cell-derived retinal progenitor cell grafts in immunocompromised rats. Cell Transplantation. 31, 1-25 (2022).
- Tang, Y., Gutmann, D. H. Neurofibromatosis Type 1-associated optic pathway gliomas: Current challenges and future prospects. Cancer Manag Res. 15, 667-681 (2023).
- Pan, T. et al. Implantation of biomimetic polydopamine nanocomposite scaffold promotes optic nerve regeneration through modulating inhibitory microenvironment. J Nanobiotechnol. 22 (1), 683 (2024).
- Gokoffski, K. K., Peng, M., Alas, B., Lam, P. Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol. 33 (1), 93-105 (2020).
- Negishi, H., Dezawa, M., Oshitari, T., Adachi-Usami, E. Optic nerve regeneration within artificial Schwann cell graft in the adult rat. Brain Res Bull. 55 (3), 409-419 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon