Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bimolekularen Fluoreszenz Komplementation
In diesem Artikel
Zusammenfassung
Die subzelluläre Lokalisierung von Proteinen ist bei der Bestimmung der räumlich-zeitliche Regulation der zellulären Signalübertragung wichtig. Hier beschreiben wir bimolekularen Fluoreszenz Komplementation (BIFC) als eine einfache Methode zur Überwachung der räumlichen Wechselwirkungen von Proteinen in der Zelle.
Zusammenfassung
Definition der subzellulären Verteilung von Signalkomplexen ist zwingend notwendig, um das Verständnis der Ausgang aus diesem Komplex. Herkömmliche Methoden wie Immunpräzipitation liefern keine Informationen über die räumliche Lokalisierung der Komplexe. Im Gegensatz dazu überwacht BIFC das Zusammenspiel und die subzelluläre Kompartimentierung der Protein-Komplexen. In diesem Verfahren wird eine fluororescent Protein in Amino-und Carboxy-terminalen nicht-fluoreszierenden Fragmente, die dann auf zwei Proteine von Interesse sind verschmolzen aufgeteilt. Die Wechselwirkung der Proteine führt zu Wiederherstellung des Fluorophors (Abbildung 1) 1,2. Eine Einschränkung der BIFC ist, dass sobald die fragmentierte Fluorophor rekonstituierte die komplexen irreversible 3 ist. Diese Einschränkung ist von Vorteil bei der Erkennung vorübergehend oder schwachen Wechselwirkungen, sondern schließt eine kinetische Analyse der komplexen Dynamik. Eine weitere Einschränkung ist, dass die rekonstituierte flourophore 30min, um zu reifen und fluoreszieren erfordert, wieder ausschließt die Beobachtung von Echtzeit-Interaktionen 4. BIFC ist ein konkretes Beispiel für das Protein-Fragment Komplementation Assay (PCA), die Reporter-Proteine wie grün fluoreszierende Protein-Varianten (BIFC), Dihydrofolatreduktase, b-Lactamase und Luciferase an Protein zu messen beschäftigt: Protein-Interaktionen 5,6. Alternative Methoden zur Protein-Studie: Protein-Interaktionen in Zellen gehören Fluoreszenz-Co-Lokalisation und Förster resonance energy transfer (FRET) 7. Für Co-Lokalisation, sind zwei Proteine einzeln entweder direkt mit einem Fluorophor oder durch indirekte Immunfluoreszenz markiert. Allerdings führt dieser Ansatz zu hohen Hintergrund an nicht-interagierenden Proteinen macht es schwierig, Co-Lokalisation Daten zu interpretieren. Darüber hinaus aufgrund der Grenzen der Auflösung der konfokalen Mikroskopie können zwei Proteine scheinen, ohne notwendigerweise interagierenden co-lokalisiert. Mit BIFC wird die Fluoreszenz nur beobachtet, wenn die beiden Proteine von Interesse zu interagieren. FRET ist eine weitere hervorragende Methode zur Untersuchung von Protein: Protein-Interaktionen, kann aber technisch anspruchsvoll. FRET Experimente erfordern die Donor-und Akzeptor ähnlicher Helligkeit und Stöchiometrie in der Zelle. Darüber hinaus muss man für das Durchschlagen der Spender-Konto in die Akzeptor-Kanal und umgekehrt. Im Gegensatz zu FRET hat BIFC wenig Hintergrundfluoreszenz, wenig Nachbearbeitung der Bilddaten, erfordert keine hohen Überexpression und kann schwache oder transiente Wechselwirkungen zu erkennen. Biolumineszenz-Resonanz-Energie-Transfer (BRET) ist eine Methode ähnlich, außer der Spender ist ein Enzym (zB Luciferase), dass ein Substrat katalysiert zu werden Biolumineszenz so spannend Akzeptor FRET. BRET fehlen die technischen Probleme der Durchscheinen und hohe Hintergrundfluoreszenz es fehlt jedoch die Fähigkeit, räumliche Informationen durch das Fehlen von Substrat-Lokalisierung auf bestimmte Fächer 8 bereitzustellen. Insgesamt ist BIFC eine hervorragende Methode zur Visualisierung von subzelluläre Lokalisation von Protein-Komplexe, um Einblick in compartmentalized Signalisierung zu gewinnen.
Protokoll
A. BIFC Calibration
- Wählen Sie ein Fluorophor. Es gibt mehrere Fluorophore, wie YFP und Venus, die gut funktionieren, wie BIFC Fusionspartner (Tabelle 1). Amino-und Carboxy-terminalen Enden der Venus sind in der Lage, ein komplexes bei 37 ° C zu bilden, während die YFP BIFC Fragmente eine Vorinkubation erfordern bei 30 ° C, um Fluorophor Bildung 2 zu erleichtern. Diese Inkubation bei niedriger Temperatur verändern können einige zelluläre Prozesse und sollten berücksichtigt werden bei der Auswahl Fragmente. Vektoren für die Absicherung Venus zum Carboxy-Terminus von Proteinen aus Addgene (verfügbar http://www.addgene.org/pgvec1 ; seepBiFC-VN173 und pBiFC-VC155) zusammen mit weiteren Konstrukte zur Verwendung als Kontrollen, zB pBiFC-bJunVN173 und pBiFC-bFosVC155 2. Weitere Vektoren, einschließlich Amino-terminalen Venus Vektoren (pFLAG-VN173 und PHA-VC155), sind auf der folgenden Website verfügbar: http://people.pnhs.purdue.edu/ ~ hu1 / .
- Tag des Proteins von Interesse. Die BIFC Fragmente an den Amino-oder Carboxy-terminalen Enden der Kandidaten-Proteine sind verschmolzen. Einige Proteine können nicht für das Tagging erlauben an jedem Ende durch eine Störung der Funktion von Proteinen. Zum Beispiel sind viele Mitglieder der Ras-Superfamilie der GTPasen Lipid am Carboxy-terminus somit auch keine Befestigung der BIFC Fragmente an diesem Ende modifiziert. So ist es wichtig, eine Vorstellung davon, wie Befestigung der BIFC Fragmente können in Abhängigkeit von der Proteine von Interesse auswirken. Wenn es unklar ist, wie Tagging ein Protein beeinflusst die Funktion mehrere Kombinationen getestet werden sollte. Zusätzlich zu den BIFC Fragment kann ein Peptid-Linker enthalten, um die Flexibilität zwischen den fragmentierten Fluorophor und der Kandidat Proteine zu erhöhen. Während die multiple cloning sites (MCS) in der BIFC Vektoren kodieren kurzen Aminosäure Strecken, die eine ausreichende Flexibilität, die RSIAT, KQKVMNH und RPACKIPNDLKQKVMNH Linker bieten kann erfolgreich in BIFC Experimenten 3,9 verwendet
- Bestimmen Sie Transfektionsbedingungen. Vor der Prüfung mehrerer Mutanten, ein paar Kontrolle Experimente durchgeführt werden. Die ersten beiden BIFC Kombinationen, die ausprobiert werden sollten zwei Wildtyp-Proteine, die bekanntermaßen in Wechselwirkung treten und eine Wildtyp und Mutante, die nicht interagieren. Mit diesen beiden Kombinationen, sollten unterschiedliche Mengen an DNA und Transfektion mal getestet, um optimale Bedingungen für die Erkennung eines BIFC Signal für die Kandidaten-Proteine zu bestimmen. Wir empfehlen Tests 0.25ug, 0.5ug, 1.0ug jedes BIFC Konstrukt für eine einzelne Vertiefung einer 6-Well Schale. Der Tag nach der Transfektion Monitor Zellen durch Fluoreszenzmikroskopie eine optimale Zeit für das Signal der Entwicklung zu bestimmen. Die pBiFC-bJunVN173 und pBiFC-bFosVC155 2 Konstrukte sind nützliche positive Kontrollen für BIFC und werden von Addgene (siehe oben) zur Verfügung. Darüber hinaus sollten Western-Blot-Analyse durchgeführt, um gleich Ausdruck der Konstrukte zu bestätigen. Die Bedingungen sollten so gewählt, dass ein Fluoreszenzsignal zwischen den beiden Wildtyp-Proteine, aber wenig bis kein Signal beobachtet zwischen dem Wildtyp und mutierten Proteinen beobachtet werden. Schließlich ist es am besten, Proteinexpression so gering wie möglich zu halten, um alle nicht-spezifischen Wechselwirkungen zu verhindern.
- Bestimmen Sie, ob die Zugabe des BIFC Fragmente verändert die Lokalisation der Proteine von Interesse. Jeder BIFC Konstrukt enthält entweder eine HA oder FLAG-Epitop-Tag. Immunostain transefected Zellen sowohl für die HA oder FLAG-Epitop-Tag sowie auch das endogene Protein (wenn möglich), um festzustellen, ob die BIFC tag beeinflusst Lokalisation der Proteine von Interesse.
B. Plating und Transfektion von Zellen
- COS-Zellen (1.3x10 5) sind jeweils auf einen Glasboden Matek Platte und zwei Vertiefungen einer 6-Well-Platte pro Probe beschichtet. Lassen Zellen über Nacht absetzen bei 37 ° C. Alternative Zelltypen, die besser auf die Kandidaten-Proteine von Interesse sind, können ebenfalls verwendet werden.
- Bereiten DNAs für die Transfektion. Wir nutzen typischerweise Lipofectamine (Invitrogen) für COS Transfektionen. Jedoch können auch andere Reagenzien besser geeignet sein für die Zell-Linie von Interesse. Da die Transfektion Mischung zwischen einem Glasboden Satellitenschüssel mit zwei Vertiefungen einer 6-Well-Platte aufgeteilt werden, verwenden Sie die entsprechende Menge an DNA zu berücksichtigen diesem Geschäftsbereich. Verdünnen DNA in 250uL von serumfreiem (SF) DMEM. Add CFP bei 1 / 5 der Höhe von insgesamt BIFC DNAs als Transfektion Kontrolle. Für BIFC Quantifizierung, werden nur Zellen, die positiv für GFP für die Anwesenheit eines BIFC Signal analysiert werden. Beachten Sie, dass die GFP-Spektren werden mit einigen der BIFC Paaren in Tabelle 1 überlappen, daher eine alternative Transfektion KontrolleVielleicht benötigt. Verdünnen Lipofectamine in 250uL SF DMEM (10uL Lipofectamine/1ug von DNA). Mischen Sie die DNA und Lipofectamine Verdünnungen. Inkubieren bei Raumtemperatur für 20min.
Hinweis: Die Lipofectamine: DNA-Verhältnis kann je nach Zelltyp. Verwenden Sie die geeignete Methode für die Transfektion der Zelllinie von Interesse. - Spülen Zellen 2x mit warmem SF DMEM. Add 2 ml SF DMEM jedem Glas Bodenplatte oder Vertiefung einer 6-well Schale.
- Split jeder Transfektion Mischung gleichmäßig zwischen einem Glasboden Satellitenschüssel mit zwei Vertiefungen einer 6-well Schale.
- Inkubieren Zellen bei 37 ° C für 5 Stunden.
- Entfernen Sie die Transfektion Medien und ersetzen mit kompletter Medien (DMEM +10% FBS).
- Inkubieren Zellen über Nacht bei 37 ° C. Die Länge der Inkubationszeit nach der Transfektion ist abhängig von der Expression der Proteine von Interesse. Längerer Inkubation kann in nicht-spezifische Interaktion Ergebnis so wird dieser Schritt müssen empirisch ermittelt werden.
C. Herstellung von Zellen für Imaging
- Die Zellen werden zunächst im Rahmen eines Epifluoreszenz-Mikroskop, um sicherzustellen, dass die positive Kontrolle fluoreszierenden untersucht. Wenn nicht, kann es notwendig sein, um Zellen zusätzliche Zeit bei 37 ° C ermöglichen, bis das Signal zu beobachten ist.
- Spülen Zellen 3x mit PBS (pH 7,4). Um die Zellen in den Glasboden Schüssel mit 2% Paraformaldehyd (pH 7,4). Fix-Zellen für 10min auf Eis. Spülen Zellen 3x mit PBS (pH 7,4). Shop-Zellen bei 4 ° C bedeckt mit 1 ml PBS (pH 7,4). Cells müssen nicht für die Bildgebung fixiert werden, aber sobald die BIFC Fragmente Reform einer intakten Fluorophor es ist irreversibel und verhindert so Analyse von dynamischen Interaktionen 3. Auch im Auge behalten, dass nicht fixierten Zellen werden weiterhin Signal zu entwickeln. Lyse der Zellen in der 6-well Schüssel und bereitet Lysaten für Western-Blot-Analyse. Es ist wichtig, dass alle Zellen gleichzeitig bereit sind, so dass die lysierten Zellen Vertreter der abgebildeten Zellen sind.
D. Imaging Cells
- Die Fluoreszenzintensität wird pro Zelle berechnet werden. Achten Sie darauf, um einzelne Zellen.
- GFP wurde als tranfection Kontrolle eingeschlossen und nur GFP positive Zellen sind für die Analyse von BIFC Signale ausgewählt. Wir gehen davon aus, dass, wenn die Zelle mit GFP transfiziert wird, ist es auch mit dem BIFC Konstrukten transfiziert. Dieser Ansatz stellt sicher, dass die gesicherten Zellen, die eine BIFC Signal mangelnde negativ sind mangels einer Interaktion zwischen den Proteinen von Interesse und nicht wegen des Fehlens eines oder beider BIFC Expressionskonstrukte in die Zelle.
- Wir verwenden ein Zeiss LSM 510 konfokalen Mikroskop für Zell-Bildgebung. Bei Verwendung dieses Mikroskop ist es wichtig, den Zoom, Blende, Detektor zu gewinnen, Verstärker-Offset, Baugröße, Scan-Geschwindigkeit, Scan Durchschnitt, und Laserleistung konsistent zu halten. Bei der Verwendung von bildgebenden Systems ist es wichtig, dass die Einstellungen konstant, so dass die Fluoreszenz ist vergleichbar zwischen den Proben. Auch bei der Quantifizierung Fluoreszenz ist es wichtig, dass Pixel nicht gesättigt sind.
E. Quantifizierung Fluorescence
- Fluoreszenz kann quantifiziert mit jedem Bildbearbeitungs-Software werden. Wir nutzen ImageJ, die kostenlos über die NIH (http://rsb.info.nih.gov/ij/) ist. Bilddateien öffnen in ImageJ. Zum AnalyzeSet Messungen. Aktivieren Sie die Kontrollkästchen für die Fläche und mittlerer Grauwert in dem Maße ein.
- Mit der "freien Hand Auswahl" Werkzeug, ziehen eine Umrisslinie um den Rand der gesamten Zelle in der GFP-Kanal.
- Lassen Sie diesen Entwurf in Kraft, die YFP-Kanal zu verlagern. Zum AnalyzeMeasure.
Die mittlerer Grauwert ist die Summe der Grauwerte aller Pixel in die Auswahl durch die Anzahl der Pixel (dh die durchschnittliche Fluoreszenzintensität pro Fläche der Zelle) unterteilt. - Für jedes Bild einen Kreis zeichnen in der YFP-Kanal in einem Bereich, der nicht enthält eine Zelle. Nehmen Sie eine Messung für diesen Bereich als Hintergrund. Subtrahieren dem Hintergrund von jedem Bild.
- Durchschnittliche die mittlere Grauwert minus den Hintergrund für alle Zellen in einer Probe abgebildet. Dies wird die mittlere Fluoreszenzintensität für eine Population von Zellen sein. Wir würden vorschlagen, etwa 60 Zellen über drei Experimente quantifiziert werden.
F. Repräsentative Ergebnisse:
Unser Labor konzentriert sich auf die Multi-Domain-Gerüst-Protein, intersectin (ITSN), die mit zahlreichen Proteinen interagiert zu regulieren mehrere biochemische und Signalwege 10,11,12,13,14. ITSN enthält zwei Eps15 Homologie (EH)-Domänen, eine Coiled-coiled Region, und fünf Src Homologie 3 (SH3)-Domänen. Je länger Isoform ITSN enthält auch Dbl Homologie (DH) und Pleckstrin Homologie (PH)-Domänen, die an einem Strang als Guanin-Nukleotid-Austausch-Faktor für Cdc42 15. Dieser modulare Aufbau fördert Protein: Protein-Interaktionen und macht ITSN ein idealer Kandidat für BIFC Experimente. Die subzelluläre Lokalisation von ITSN verändern können ihre Bindungspartner und somit verändern die Pfade durch ITSN (unpublis geregelthed-Daten). Vor kurzem hat unser Labor nachgewiesen, dass ITSN neuronale Überleben regelt durch Verordnung einer neuen Klasse II PI3K, PI3K-C2β 11. Die Amino-terminalen Pro-reiche Domäne des PI3K-C2β enthält zwei Bindungsstellen für ITSN der SH3-Domänen. Mit Co-Immunopräzipitation mit ITSN und PI3K-C2β Abschneiden Mutanten haben wir gezeigt, dass ITSN ist SH3A und SH3C Domains mit der Amino-terminalen Region des PI3K-C2β interagieren. Als nächstes haben wir BIFC die subzelluläre Lokalisation dieses Komplexes zu visualisieren. ITSN war es, die Amino-Terminus von Venus (pFLAG-VN173) und PI3K-C2β Konstrukte, fusioniert mit dem Carboxy-terminus of Venus (PHA-VC155) fusioniert. Als weiteres Negativ-Kontrolle wurde ein nicht-spezifisches Peptid an PHA-VC155 verschmolzen. VN-ITSN und VC-PI3K-C2β bildeten eine BIFC Komplex mit einem punctuate Verteilung (Abb. 2A, obere Reihe). Mutationen in den Pro-reiche Domäne des PI3K-C2β, dass Co-Fällung von ITSN und PI3K-C2β stören sank die BIFC Signal (Abbildung 2A, untere Reihe) 11. Dieser Unterschied in BIFC Signal zwischen ITSN und die beiden PI3K-C2β Proteine nicht aufgrund von Unterschieden in der Proteinexpression (Abbildung 2B).
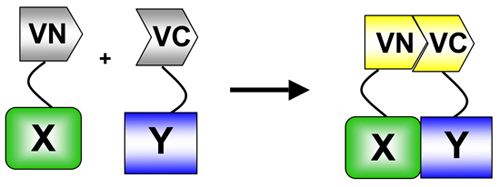
. Abbildung 1 In BIFC wird ein Fluorophor (in diesem Fall Venus) in Aminosäuren (VN) split - und Carboxy-(VC)-terminalen Enden. Diese Enden sind zwei Proteine von Interesse fusioniert. Als die beiden Proteine interagieren, die VN und VC-Fragmenten re-assoziieren sich in den Wiederaufbau des Fluorophors und Fluoreszenz an den Standorten der Interaktion. BIFC ist ein konkretes Beispiel für das Protein-Fragment Komplementation Assay (PCA) verwendet, um Protein zu messen: Protein-Interaktionen 5.
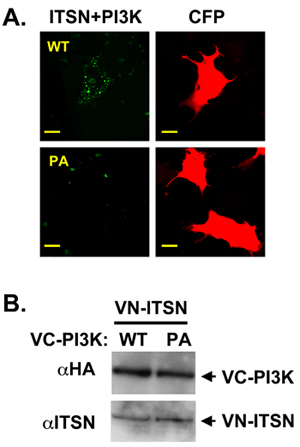
Abbildung 2. ITSN und PI3K-C2β bilden eine BIFC komplex. A. VN-tagged ITSN wurde mit VC-tagged PI3K-C3β WT oder eine Prolin-reiche Domäne co-transfiziert Mutante (PI3K-C2β-PA). ITSN und WT PI3K-C2β einen Komplex bilden (grün). CFP (rot) wurde als Kontrolle der Transfektion B. A Western-Blot durchgeführt, um gleich Ausdruck der Konstrukte zu demonstrieren verwendet wurde. Die VC-markierten Konstrukte HA getaggt.
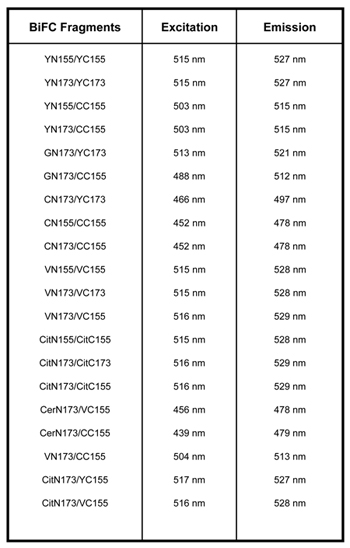
Tabelle 1. Es gibt mehrere Vektoren, die kompatibel mit BIFC sind. YN155: 1-155aa von YFP; YC155: 155-238aa von YFP; YN173: 1-172aa von YFP; YC173, 173-238aa von YFP; VN155: 1-154aa der Venus; VC155: 155-238 von Venus; VN173: 1-172aa der Venus; VC173: 173-238aa der Venus; CN155 1-154aa der GFP; CC155 155-238aa von CFP, GN173: 1-172aa von GFP, CitN155: 1-155aa von Citrin, CitC155: 155-238aa der Citrin, CitN173: 1-172aa von Citrin, CitC173: 173-238aa von Citrin, CerN173: 1-172aa von Cerulean 2,3,9.
Access restricted. Please log in or start a trial to view this content.
Diskussion
BIFC ist eine hervorragende Methode zur Visualisierung von Protein: Protein-Interaktionen in ganzen Zellen und die Bestimmung der subzellulären Lokalisation dieser Komplexe. Die Vorteile der BIFC sind, dass nur interagierende Proteine fluoreszierend sind, sind vergänglich Wechselwirkungen stabilisiert, und Post-Processing der Bilddaten ist minimal. Zwei Nachteile dieser Methode sind die Reifezeit für den Fluorophor und die Unumkehrbarkeit des Fluorophor-Komplex. Unter bestimmten Anwendungen dieser Unumkehrbarke...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Die ITSN, PI3K-C2β und Kontrolle Vektoren im Sinne dieses Protokolls sind von den Autoren auf Anfrage erhältlich, für nicht-kommerzielle Zwecke. Die Autoren möchten Dr. Chang-Deng Hu für die freundliche Beratung und die Reagenzien in die Gründung der BIFC Protokoll in der O'Bryan Labor bestätigen. KAW wurde mit Mitteln der Stiftung Jerome Lejeune unterstützt. Die Arbeit in den O'Bryan Labor ist durch Zuschüsse der NIH (HL090651), DOD (PR080428), die St. Baldrick Stiftung und der Stiftung Jerome Lejeune unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-013 | |
| Fetal bovine serum | Cellgro | 35-011-CV | |
| Glass Bottom Microwell dishes | Matek | P35G-1.5-14C | |
| 6-well dishes | Falcon BD | 35-3846 | |
| Lipofectamine | Invitrogen | 18324020 | |
| PBS | Cellgro | 21-031-CV | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Confocal Microscope | Carl Zeiss, Inc. | LSM510 META |
Referenzen
- Kerppola, T. K. Visualization of molecular interactions by fluorescence complementation. Nat Rev Mol Cell Biol. 7, 449-456 (2006).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40, 61-66 (2006).
- Hu, C. D., Chinenov, Y., Kerppola, T. K. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. Mol Cell. 9, 789-798 (2002).
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Michnick, S. W., Remy, I., Campbell-Valois, F. X., Vallee-Belisle, A., Pelletier, J. N. Detection of protein-protein interactions by protein fragment complementation strategies. Methods Enzymol. S328, 208-230 (2000).
- Michnick, S. W., MacDonald, M. L., Westwick, J. K. Chemical genetic strategies to delineate MAP kinase signaling pathways using protein-fragment complementation assays (PCA). Methods. 40, 287-293 (2006).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends Biochem Sci. 32, 407-414 (2007).
- Ciruela, F. Fluorescence-based methods in the study of protein-protein interactions in living cells. Curr Opin Biotechnol. 19, 338-343 (2008).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21, 539-545 (2003).
- Martin, N. P. Intersectin regulates epidermal growth factor receptor endocytosis, ubiquitylation, and signaling. Mol Pharmacol. 70, 1643-1653 (2006).
- Das, M. Regulation of neuron survival through an intersectin-phosphoinositide 3'-kinase C2beta-AKT pathway. Mol Cell Biol. 27, 7906-7917 (2007).
- Mohney, R. P. Intersectin activates Ras but stimulates transcription through an independent pathway involving. JNK. J Biol Chem. 278, 47038-47045 (2003).
- Tong, X. K., Hussain, N. K., Adams, A. G., O'Bryan, J. P., McPherson, P. S. Intersectin can regulate the Ras/MAP kinase pathway independent of its role in endocytosis. J Biol Chem. 275, 29894-29899 (2000).
- Adams, A., Thorn, J. M., Yamabhai, M., Kay, B. K., O'Bryan, J. P. Intersectin an adaptor protein involved in clathrin-mediated endocytosis, activates mitogenic signaling pathways. J Biol Chem. 275, 27414-27420 (2000).
- O'Bryan, J. P., Mohney, R. P., Oldham, C. E. Mitogenesis and endocytosis: What's at the INTERSECTIoN? Oncogene. 20, 6300-6308 (2001).
- Shyu, Y. J., Suarez, C. D., Hu, C. D. Visualization of AP-1 NF-kappaB ternary complexes in living cells by using a BiFC-based FRET. Proc Natl Acad Sci U S A. 105, 151-156 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten