Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Bimoléculaire complémentation de fluorescence
Dans cet article
Résumé
La localisation subcellulaire des protéines est important dans la détermination de la régulation spatio-temporelle de la signalisation cellulaire. Ici, nous décrivons bimoléculaire complémentation de fluorescence (BiFC) comme une méthode simple pour le suivi des interactions spatiale des protéines dans la cellule.
Résumé
Définition de la distribution subcellulaire des complexes de signalisation est impératif de comprendre la sortie de ce complexe. Les méthodes conventionnelles telles que immunoprécipitation ne fournissent pas d'informations sur la localisation spatiale des complexes. En revanche, BiFC surveille l'interaction et la compartimentation subcellulaire des complexes protéiques. Dans cette méthode, une protéine fluororescent est divisé en amino-et carboxy-terminale non fluorescent fragments qui sont ensuite fusionnées à deux protéines d'intérêt. Interaction des résultats des protéines dans la reconstitution du fluorophore (figure 1) 1,2. Une limitation de BiFC n'est qu'une fois que le fluorophore fragmenté est reconstitué le complexe est irréversible 3. Cette limitation est avantageuse dans la détection des interactions transitoires ou faible, mais s'oppose à une analyse cinétique de la dynamique complexe. Une mise en garde supplémentaire est que le flourophore reconstituée nécessite 30min à mûrir et à fluorescence, à nouveau obstacle à l'observation des interactions en temps réel 4. BiFC est un exemple précis du dosage de complémentation protéique fragment (PCA) qui emploie des protéines telles que le vert journaliste de variants de la protéine fluorescente (BiFC), la dihydrofolate réductase, b-lactamase, et la luciférase pour mesurer des protéines: les interactions entre protéines 5,6. Les méthodes alternatives à l'étude des protéines: les interactions entre protéines dans les cellules comprennent la fluorescence de co-localisation et de Förster Resonance Energy Transfer (FRET) 7. Pour la co-localisation, deux protéines sont individuellement marqués soit directement avec un fluorophore ou par immunofluorescence indirecte. Cependant, cette approche conduit à fond élevé de non-interaction des protéines ce qui rend difficile d'interpréter la co-localisation des données. En outre, en raison de la limite de résolution de la microscopie confocale, deux protéines peuvent apparaître co-localisées, sans nécessairement interagir. Avec BiFC, la fluorescence n'est observée lorsque les deux protéines d'intérêt interagissent. FRET est une autre excellente méthode pour étudier les protéines: les interactions entre protéines, mais peut être techniquement difficile. FRET expériences exigent des donneurs et accepteurs d'être d'une luminosité similaire et la stœchiométrie dans la cellule. En outre, on doit tenir compte de saigner à travers les bailleurs de fonds dans le canal de l'accepteur et vice versa. Contrairement FRET, BiFC a peu de fond de fluorescence, de post-traitement peu de données d'image, ne nécessite pas de surexpression élevé, et peut détecter des interactions faibles ou transitoires. Transfert d'énergie par résonance de bioluminescence (BRET) est une méthode similaire à l'exception de FRET le donateur est une enzyme (luciférase, par exemple) qui catalyse un substrat de devenir bioluminescents donc passionnante un accepteur. BRET manque les problèmes techniques de saigner à travers et la fluorescence de fond élevé, mais n'a pas la capacité de fournir des informations spatiales en raison du manque de substrat à la localisation des compartiments spécifiques 8. Globalement, BiFC est une excellente méthode pour visualiser la localisation subcellulaire des complexes de protéines afin de mieux comprendre la signalisation compartimentée.
Protocole
A. BiFC étalonnage
- Choisissez un fluorophore. Il ya des fluorophores multiples, tels que la YFP et Vénus, qui fonctionnent bien comme des partenaires de fusion BiFC (tableau 1). Extrémités amino-et carboxy-terminale de Vénus sont en mesure de former un complexe à 37 ° C, tandis que les fragments YFP BiFC nécessitent une pré-incubation à 30 ° C afin de faciliter la formation de deux fluorophores. Cette incubation à basse température peut modifier certains processus cellulaires et devraient être pris en compte lors du choix des fragments. Vecteurs pour la fusion de Vénus à l'extrémité carboxy-terminale de protéines sont disponibles à partir Addgene ( http://www.addgene.org/pgvec1 ; seepBiFC-VN173 et pBiFC-VC155) avec constructions supplémentaires pour servir de témoins, par exemple, pBiFC-bJunVN173 et pBiFC-bFosVC155 2. Vecteurs supplémentaires, y compris amino-terminale vecteurs Vénus (pFLAG-VN173 et Pha-VC155), sont disponibles sur le site suivant: http://people.pnhs.purdue.edu/ ~ HU1 / .
- Tag de la protéine d'intérêt. Les fragments BiFC sont fusionnées à l'extrémité amino-ou carboxy-terminale des protéines candidates. Certaines protéines ne peuvent pas permettre de marquage à chaque extrémité en raison de la perturbation de la fonction des protéines. Par exemple, de nombreux membres de la superfamille des Ras GTPases sont des lipides modifiés à l'extrémité carboxy-terminale de fixation empêchant ainsi des fragments BiFC à cette fin. Ainsi, il est important d'avoir une certaine idée de la façon dont l'attachement des fragments BiFC peut affecter la fonction des protéines d'intérêt. Si on voit mal comment le marquage d'une protéine aura une incidence sur ses combinaisons multiples fonctions doivent être testés. En plus de le fragment BiFC, un linker peptidique peut être inclus pour augmenter la flexibilité entre le fluorophore fragmenté et les protéines candidates. Alors que les sites de clonage multiple (MCS) dans les vecteurs BiFC encoder courte s'étend des acides aminés qui peuvent fournir suffisamment de souplesse, le RSIAT, KQKVMNH et linkers RPACKIPNDLKQKVMNH ont été utilisés avec succès dans des expériences BiFC 3,9
- Déterminer les conditions de transfection. Avant de tester des mutants multiples, un peu d'expériences de contrôle doit être effectué. Les deux premières combinaisons BiFC qui devrait être tenté sont deux protéines de type sauvage qui sont connus pour interagir et d'un type sauvage et mutantes qui n'ont pas d'interaction. L'utilisation de ces deux combinaisons, différentes quantités d'ADN et des temps de transfection doivent être testés afin de déterminer les conditions optimales pour la détection d'un signal BiFC pour les protéines candidates. Nous vous suggérons de tester 0.25ug, 0.5ug, 1.0ug de chaque construction BiFC pour un seul puits d'un plat à 6 puits. Le jour après la transfection des cellules suivre par microscopie à fluorescence pour déterminer le temps optimal pour le développement de signal. Le pBiFC-bJunVN173 et pBiFC-bFosVC155 deux constructions sont utiles pour les contrôles positifs BiFC et sont disponibles à partir Addgene (voir ci-dessus). En outre, l'analyse par Western blot doit être effectuée pour confirmer l'expression égale des constructions. Les conditions devraient être choisis de telle sorte que un signal fluorescent est observée entre les deux protéines de type sauvage, mais peu ou pas de signal est observé entre le type sauvage et de protéines mutantes. Enfin, il est préférable de garder l'expression des protéines aussi bas que possible afin d'éviter toute interaction non-spécifique.
- Déterminer si l'ajout de fragments BiFC modifie la localisation des protéines d'intérêt. Chaque construction BiFC contient soit une HA ou tag épitope FLAG. Immunocoloration transefected cellules à la fois pour l'HA ou tag épitope FLAG ainsi aussi bien la protéine endogène (si possible) afin de déterminer si la balise BiFC affecte la localisation des protéines d'intérêt.
Placage B. Transfection de cellules
- Les cellules COS (1.3x10 5) sont plaqués sur un seul de chaque fond de verre Matek plaque et deux puits d'une plaque à 6 puits par échantillon. Laisser les cellules sédimenter une nuit à 37 ° C. Types de cellules de remplacement qui sont plus pertinents pour les protéines d'intérêt candidat peut également être utilisé.
- Préparer ADN pour la transfection. Nous utilisent généralement Lipofectamine (Invitrogen) pour transfections COS. Toutefois, d'autres réactifs peuvent être plus appropriés pour la lignée cellulaire d'intérêt. Depuis le mélange de transfection sera réparti entre un plat à fond de verre et de deux puits d'une plaque de 6 puits, utiliser la quantité appropriée de l'ADN pour rendre compte de cette division. Diluer l'ADN dans des 250uL sans sérum (SF) DMEM. Ajouter PCP à 1 / 5 du montant du total des ADN BiFC comme un contrôle de la transfection. Pour la quantification BiFC, seules les cellules qui sont positifs pour la PCP seront analysés pour déterminer la présence d'un signal BiFC. Notez que les spectres de la PCP se chevauchent avec certains des paires BiFC dans le tableau 1, par conséquent un contrôle de transfection alternatifpeut-être nécessaire. Diluer Lipofectamine dans 250uL SF DMEM (10uL Lipofectamine/1ug de l'ADN). Mélanger l'ADN et des dilutions Lipofectamine. Incuber à température ambiante pendant 20min.
Note: La lipofectamine: ratio de l'ADN peut varier selon le type de cellule. Utilisez la méthode appropriée pour la transfection de la lignée cellulaire d'intérêt. - Rincer les cellules chaudes 2x avec SF DMEM. Ajouter 2 ml de DMEM SF à chaque plaque à fond de verre ou bien d'un plat à 6 puits.
- Fendez chaque mélange de transfection uniformément entre un plat à fond de verre et de deux puits d'un plat à 6 puits.
- Incuber les cellules à 37 ° C pendant 5h.
- Retirez le support de transfection et la remplacer par des médias complète (DMEM 10% FBS).
- Incuber les cellules pendant la nuit à 37 ° C. La longueur de la transfection après incubation varie selon les niveaux d'expression des protéines d'intérêt. Une incubation prolongée peut entraîner la non-spécifiques d'interaction donc cette étape devra être déterminée empiriquement.
C. Préparation des cellules pour l'imagerie
- Les cellules sont d'abord examinés sous un microscope à épifluorescence pour s'assurer que le contrôle positif est fluorescent. Si non, il peut être nécessaire de laisser le temps cellules supplémentaires à 37 ° C jusqu'à ce que le signal est observé.
- Rincer les cellules 3x avec PBS (pH 7,4). Pour les cellules dans le plat à fond de verre ajoutent paraformaldéhyde à 2% (pH 7,4). Fixer les cellules pendant 10 minutes sur la glace. Rincer les cellules 3x avec PBS (pH 7,4). Cellules Conserver à 4 ° C couvert de 1ml de PBS (pH 7,4). Les cellules n'ont pas à être fixé pour l'imagerie, mais une fois que les fragments BiFC réformer un fluorophore intact, il est irréversible empêchant ainsi l'analyse des interactions dynamiques 3. Aussi, gardez à l'esprit que les cellules non fixée continuera à développer de signal. Lyse des cellules dans le plat à 6 puits et se préparer pour les lysats analyse Western blot. Il est important que toutes les cellules sont préparées en même temps, de sorte que les cellules lysées sont représentatifs des cellules imagée.
D. Cellules Imaging
- L'intensité de fluorescence sera calculé par cellule. Soyez sûr de cellules d'image individuelle.
- PCP a été incluse comme un contrôle transfection et seulement PCP cellules positives sont sélectionnés pour l'analyse des signaux BiFC. Nous faisons l'hypothèse que si la cellule est transfectée avec PCP, il est également transfectées avec les constructions BiFC. Cette approche garantit que les cellules imagé qui manquent un signal BiFC sont négatifs en raison d'un manque d'interaction entre les protéines d'intérêt et non en raison de l'absence d'un ou de deux vecteurs d'expression BiFC dans cette cellule.
- Nous utilisons un Zeiss LSM 510 microscope confocal pour l'imagerie cellulaire. Lors de l'utilisation de ce microscope, il est important de garder le zoom, sténopé, gain du détecteur, un amplificateur de décalage, taille d'image, vitesse de balayage, la moyenne de numérisation et de laser de puissance constante. Lorsque vous utilisez un système d'imagerie, il est important de garder les paramètres de constante, de sorte que la fluorescence est comparable entre les échantillons. Aussi, lors de la quantification de fluorescence, il est important que les pixels ne sont pas saturés.
E. La quantification de fluorescence
- Fluorescence peuvent être quantifiés en utilisant n'importe quel logiciel d'imagerie. Nous utilisons ImageJ qui est disponible gratuitement à partir du NIH (http://rsb.info.nih.gov/ij/). Ouvrez les fichiers image dans ImageJ. Aller à la Mensurations AnalyzeSet. Cochez les cases pour la région et de moyenne valeur de gris dans la boîte de mesures.
- Utiliser l'outil "sélection de la main libre», tracez un contour autour du bord de la cellule entière dans le canal PCP.
- Laissant ce schéma en place, passage à la chaîne YFP. Aller à la AnalyzeMeasure.
La valeur moyenne Gray est la somme des valeurs de gris de l'ensemble des pixels de la sélection, divisé par le nombre de pixel (ie, l'intensité moyenne de fluorescence par zone de la cellule). - Pour chaque image, dessinez un cercle dans le canal de la YFP dans une zone qui ne contient pas une cellule. Prendre une mesure pour ce domaine comme arrière-plan. Soustraire le fond de chaque image.
- Moyenne de la valeur de gris moyen, moins le fond de toutes les cellules dans un échantillon imagé. Ce sera l'intensité moyenne de fluorescence pour une population de cellules. Nous suggérons d'environ 60 cellules sur trois expériences être quantifiés.
F. Résultats du représentant:
Notre laboratoire se concentre sur les protéines d'échafaudage multi-domaine, intersectine (ITSN) qui interagit avec de nombreuses protéines de réguler de multiples voies de signalisation biochimiques et 10,11,12,13,14. ITSN contient deux Eps15 homologie (EH) domaines, une région coiled-enroulé, et cinq d'homologie Src 3 (SH3) domaines. Le plus isoforme de ITSN contient également une homologie Dbl (DH) et pleckstrine homologie (PH) domaines qui agissent de concert comme un facteur d'échange nucléotidique guanine pour Cdc42 15. Cette structure modulaire favorise protéines: les interactions entre protéines et rend ITSN un candidat idéal pour des expériences BiFC. La localisation subcellulaire des ITSN peut modifier ses partenaires de liaison et donc modifier les voies régies par ITSN (unpublished données). Récemment, notre laboratoire a démontré que la survie neuronale ITSN régule grâce à une réglementation d'un roman de la PI3K de classe II, la PI3K-C2β 11. Les amino-terminal pro-riches domaine de la PI3K-C2β contient deux sites de liaison pour ITSN de domaines SH3. L'utilisation de co-immunoprécipitation avec ITSN et les mutants de troncature PI3K-C2β nous avons démontré que SH3A ITSN et domaines SH3C interagir avec la région amino-terminale de la voie PI3K-C2β. Ensuite, nous avons utilisé BiFC de visualiser la localisation subcellulaire de ce complexe. ITSN a été fusionnée à la terminaison amino de Vénus (pFLAG-VN173) et PI3K-C2β construit fusionnés à l'extrémité carboxy terminale de Vénus (PHA-VC155). Comme autre contrôle négatif, un peptide non spécifique a été fusionnée à la PHA-VC155. VN-ITSN et VC-PI3K-C2β formé un complexe avec une distribution BiFC ponctuent (figure 2A, panneaux supérieurs). Des mutations dans le domaine pro-riches de PI3K-C2β qui perturbent la co-précipitation des ITSN et PI3K-C2β diminué le signal BiFC (figure 2A, panneaux inférieurs) 11. Cette différence de signal entre les BiFC ITSN et les deux protéines PI3K-C2β n'était pas due à des différences dans l'expression des protéines (figure 2B).
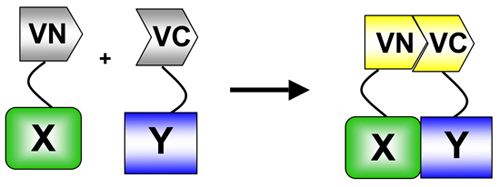
. Figure 1 Dans BiFC, un fluorophore (dans ce cas de Vénus) est divisé en aminés (VN) - et carboxy (VC)-terminales. Ces extrémités sont soudées à deux protéines d'intérêt. Lorsque les deux protéines interagissent, les fragments VN et VC réassocier résultant de la reconstitution du fluorophore et la fluorescence sur les sites d'interaction. BiFC est un exemple précis du dosage de complémentation protéique fragment (PCA) utilisé pour mesurer la protéine: les interactions entre protéines 5.
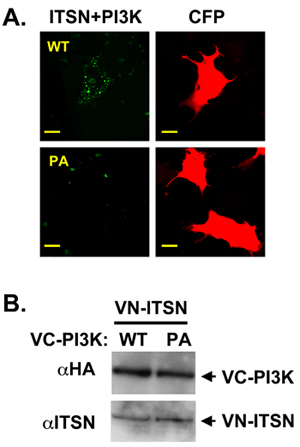
Figure 2. ITSN et PI3K-C2β former un complexe BiFC. A. VN-taggés ITSN a été co-transfectées avec VC-taggés PI3K-C3β WT ou un domaine riche en proline mutant (PI3K-C2β-PA). ITSN et WT PI3K-C2β former un complexe (vert). PCP (rouge) a été utilisé comme un contrôle de transfection B. Un Western blot a été réalisée pour démontrer l'expression égale des constructions. Le VC-constructions sont marqués HA marqués.
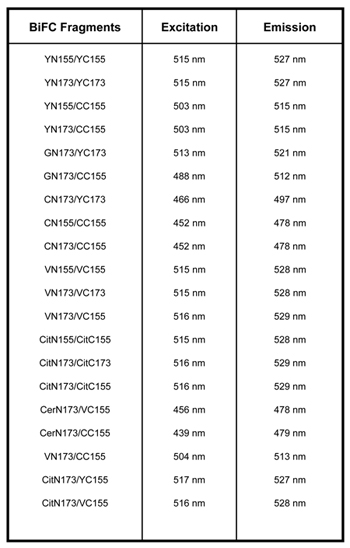
Tableau 1. Il existe de multiples vecteurs qui sont compatibles avec BiFC. YN155: 1-155aa du YFP; YC155: 155-238aa du YFP; YN173: 1-172aa du YFP; YC173, 173-238aa du YFP; VN155: 1-154aa de Vénus; VC155: 155-238 de Vénus; VN173: 1-172aa de Vénus; VC173: 173-238aa de Vénus; CN155 1-154aa du PCP; CC155 155-238aa du PCP, GN173: 1-172aa de la GFP, CitN155: 1-155aa de Citrine, CitC155: 155-238aa des Citrine, CitN173: 1-172aa de Citrine, CitC173: 173-238aa de Citrine, CerN173: 1-172aa de Cerulean 2,3,9.
Access restricted. Please log in or start a trial to view this content.
Discussion
BiFC est une excellente méthode pour visualiser des protéines: les interactions entre protéines dans des cellules entières et de déterminer la localisation subcellulaire de ces complexes. Les avantages de BiFC sont que seulement les protéines en interaction sont fluorescentes, les interactions transitoires sont stabilisées, et le post-traitement des données d'imagerie est minime. Deux inconvénients de cette méthode sont le temps de maturation pour le fluorophore et l'irréversibilité des complexes flu...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Le ITSN, PI3K-C2β, et les vecteurs de contrôle utilisés dans ce protocole sont disponibles auprès des auteurs sur demande, pour des fins non commerciales seulement. Les auteurs tiennent à remercier le Dr Chang-Hu Deng a bien voulu fournir des conseils et des réactifs utilisés dans l'établissement du protocole de BiFC dans le laboratoire O'Bryan. KAW a été soutenu par un financement de la Fondation Lejeune-Jérôme. Le travail dans le laboratoire O'Bryan est soutenu par des subventions du NIH (HL090651), le DOD (PR080428), la Fondation Saint-Baldrick, et la Fondation Jérôme Lejeune.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-013 | |
| Fetal bovine serum | Cellgro | 35-011-CV | |
| Glass Bottom Microwell dishes | Matek | P35G-1.5-14C | |
| 6-well dishes | Falcon BD | 35-3846 | |
| Lipofectamine | Invitrogen | 18324020 | |
| PBS | Cellgro | 21-031-CV | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Confocal Microscope | Carl Zeiss, Inc. | LSM510 META |
Références
- Kerppola, T. K. Visualization of molecular interactions by fluorescence complementation. Nat Rev Mol Cell Biol. 7, 449-456 (2006).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40, 61-66 (2006).
- Hu, C. D., Chinenov, Y., Kerppola, T. K. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. Mol Cell. 9, 789-798 (2002).
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Michnick, S. W., Remy, I., Campbell-Valois, F. X., Vallee-Belisle, A., Pelletier, J. N. Detection of protein-protein interactions by protein fragment complementation strategies. Methods Enzymol. S328, 208-230 (2000).
- Michnick, S. W., MacDonald, M. L., Westwick, J. K. Chemical genetic strategies to delineate MAP kinase signaling pathways using protein-fragment complementation assays (PCA). Methods. 40, 287-293 (2006).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends Biochem Sci. 32, 407-414 (2007).
- Ciruela, F. Fluorescence-based methods in the study of protein-protein interactions in living cells. Curr Opin Biotechnol. 19, 338-343 (2008).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21, 539-545 (2003).
- Martin, N. P. Intersectin regulates epidermal growth factor receptor endocytosis, ubiquitylation, and signaling. Mol Pharmacol. 70, 1643-1653 (2006).
- Das, M. Regulation of neuron survival through an intersectin-phosphoinositide 3'-kinase C2beta-AKT pathway. Mol Cell Biol. 27, 7906-7917 (2007).
- Mohney, R. P. Intersectin activates Ras but stimulates transcription through an independent pathway involving. JNK. J Biol Chem. 278, 47038-47045 (2003).
- Tong, X. K., Hussain, N. K., Adams, A. G., O'Bryan, J. P., McPherson, P. S. Intersectin can regulate the Ras/MAP kinase pathway independent of its role in endocytosis. J Biol Chem. 275, 29894-29899 (2000).
- Adams, A., Thorn, J. M., Yamabhai, M., Kay, B. K., O'Bryan, J. P. Intersectin an adaptor protein involved in clathrin-mediated endocytosis, activates mitogenic signaling pathways. J Biol Chem. 275, 27414-27420 (2000).
- O'Bryan, J. P., Mohney, R. P., Oldham, C. E. Mitogenesis and endocytosis: What's at the INTERSECTIoN? Oncogene. 20, 6300-6308 (2001).
- Shyu, Y. J., Suarez, C. D., Hu, C. D. Visualization of AP-1 NF-kappaB ternary complexes in living cells by using a BiFC-based FRET. Proc Natl Acad Sci U S A. 105, 151-156 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon