É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Complementação de fluorescência bimolecular
Neste Artigo
Resumo
A localização subcelular de proteínas é importante para determinar a regulação espaço-temporal de sinalização celular. Aqui, descrevemos complementação bimolecular de fluorescência (BiFC) como um método simples para monitorar as interações espaciais de proteínas na célula.
Resumo
Definir a distribuição subcelular de complexos de sinalização é imprescindível para a compreensão de que a saída do complexo. Métodos convencionais, tais como imunoprecipitação não fornecem informações sobre a localização espacial dos complexos. Em contraste, BiFC monitora a interação e compartimentalização subcelular de complexos de proteínas. Neste método, uma proteína fluororescent é dividido em amino-e carboxi-terminal não-fluorescentes fragmentos que são então fundidas para duas proteínas de interesse. Interação das proteínas resulta na reconstituição do fluoróforo (Figura 1) 1,2. Uma limitação do BiFC é que uma vez que o fluoróforo fragmentada é reconstituído o complexo é irreversível 3. Esta limitação é vantajoso na detecção de interações transitória ou fraco, mas impede uma análise cinética da dinâmica complexa. Uma advertência adicional é que o flourophore reconstituído requer 30min para amadurecer e fluorescentes, mais uma vez impedindo a observação de interações em tempo real 4. BiFC é um exemplo específico do ensaio complementação protéica fragmento (APC), que emprega proteínas repórter como o verde variantes proteína fluorescente (BiFC), diidrofolato redutase, b-lactamase, e luciferase para medir proteína: interações de proteínas 5,6. Métodos alternativos para o estudo de proteínas: as interações das proteínas nas células incluem fluorescência co-localização e transferência de energia de ressonância Förster (FRET) 7. Para co-localização, duas proteínas são individualmente marcados diretamente com um fluoróforo ou por imunofluorescência indireta. No entanto, esta abordagem leva a fundo elevado de proteínas não-interativas que torna difícil de interpretar co-localização de dados. Além disso, devido aos limites de resolução da microscopia confocal, duas proteínas podem aparecer co-localizadas, sem necessariamente interagir. Com BiFC, a fluorescência é observada somente quando as duas proteínas de interesse interagem. FRET é outro método excelente para estudar proteínas: interações de proteínas, mas pode ser tecnicamente desafiadora. FRET experimentos requerem o doador e receptor seja de brilho semelhantes e estequiometria na célula. Além disso, deve-se conta de sangrar através do doador para o canal receptor e vice-versa. Ao contrário FRET, BiFC tem pouco fundo de fluorescência, o pós-processamento de dados de imagem pouco, não exige a superexpressão de alta, e pode detectar interações fracas ou transitórios. Bioluminescência transferência de energia de ressonância (BRET) é um método semelhante ao FRET exceto o doador é uma enzima (luciferase, por exemplo) que catalisa um substrato para se tornar bioluminescente, assim, uma emocionante aceitador. BRET falta a problemas técnicos de sangrar através fluorescência de fundo e alta, mas não tem a capacidade de fornecer informação espacial, devido à falta de localização do substrato para compartimentos específicos 8. No geral, BiFC é um excelente método para a visualização de localização subcelular de complexos de proteínas para obter insights sobre sinalização compartimentada.
Protocolo
A. BiFC Calibração
- Escolha um fluoróforo. Existem vários fluoróforos, tais como YFP e Vênus, que funcionam bem como parceiros BiFC fusão (Tabela 1). Termina amino-e carboxi-terminal de Vênus são capazes de formar um complexo a 37 ° C, enquanto os fragmentos YFP BiFC requerem um pré-incubação a 30 ° C, a fim de facilitar a formação de fluoróforo 2. Esta incubação a baixa temperatura podem alterar alguns processos celulares e devem ser levados em conta ao escolher fragmentos. Vetores para a fusão Venus carboxi-terminal de proteínas estão disponíveis a partir Addgene ( http://www.addgene.org/pgvec1 ; seepBiFC-VN173 e pBiFC-VC155), juntamente com construções adicionais para uso como controles, por exemplo, pBiFC-bJunVN173 e pBiFC-bFosVC155 2. Vetores adicionais, incluindo vetores amino-terminal Venus (PFLAG-VN173 e PHA-VC155), estão disponíveis no seguinte site: http://people.pnhs.purdue.edu/ HU1 ~ / .
- Tag a proteína de interesse. BiFC Os fragmentos são fundidos para as extremidades amino ou carboxi-terminal das proteínas candidato. Algumas proteínas podem não permitir a marcação em cada extremidade, devido à interrupção da função da proteína. Por exemplo, muitos membros da superfamília Ras de GTPases são lipídios modificados no anexo carboxi-terminal impossibilitando dos fragmentos BiFC naquela final. Assim, é importante ter alguma idéia de como o apego dos fragmentos BiFC pode afetar a função das proteínas de interesse. Se não está claro como a marcação de uma proteína vai afetar a sua função combinações múltiplas devem ser testados. Além do fragmento BiFC, um linker peptídeo pode ser incluído para aumentar a flexibilidade entre o fluoróforo fragmentado e as proteínas candidato. Embora os sites de clonagem múltipla (MCS) nos vetores BiFC codificar pequenos trechos de aminoácido que pode fornecer flexibilidade suficiente, o RSIAT, KQKVMNH e linkers RPACKIPNDLKQKVMNH tem sido utilizado com sucesso em experimentos BiFC 3,9
- Determinar as condições de transfecção. Mutantes Antes de testar vários, um poucos experimentos de controle deve ser realizado. As duas primeiras combinações BiFC que deve ser julgado duas proteínas do tipo selvagem que são conhecidos por interagir e uma do tipo selvagem e mutante que não interagem. Usando essas duas combinações, diferentes quantidades de DNA e os tempos de transfecção devem ser testados para determinar as condições óptimas para a detecção de um sinal para as proteínas BiFC candidato. Sugerimos testes 0.25ug, 0.5ug, 1.0ug de cada construto BiFC para um único poço de um prato bem 6. O dia depois que as células transfecção monitor por microscopia de fluorescência para determinar o tempo ideal para o desenvolvimento do sinal. O pBiFC-bJunVN173 e pBiFC-bFosVC155 duas construções são úteis controles positivos para BiFC e estão disponíveis a partir Addgene (veja acima). Além disso, Western blot devem ser realizados para confirmar a expressão igual das construções. Condições devem ser escolhidos de forma que um sinal fluorescente é observada entre as duas proteínas do tipo selvagem, mas pouco ou nenhum sinal é observado entre o tipo selvagem e proteínas mutantes. Finalmente, o melhor é manter a expressão da proteína o mais baixo possível para evitar qualquer interações não-específicas.
- Determinar se a adição dos fragmentos BiFC altera a localização das proteínas de interesse. Cada construir BiFC contém quer um HA ou tag epítopo FLAG. Immunostain transefected células tanto para HA ou tag epítopo bandeira, assim como também a proteína endógena (se possível) para determinar se o tag BiFC afeta a localização das proteínas de interesse.
B. Galvanização e transfecção de células
- Células COS (1.3x10 5) são banhados em cada uma placa de vidro de fundo Matek e dois poços de uma placa de 6 poços por amostra. Permitem que as células para resolver durante a noite a 37 ° C. Tipos de células alternativas que são mais relevantes para as proteínas de interesse candidato também pode ser usado.
- Prepare DNAs de transfecção. Nós normalmente utilizam Lipofectamine (Invitrogen) para transfections COS. No entanto, outros reagentes podem ser mais apropriados para a linha de células de interesse. Uma vez que a mistura de transfecção será dividido entre um prato fundo de vidro e dois poços de uma placa de 6 poços, use a quantidade adequada de DNA para dar conta dessa divisão. Diluir DNA em 250uL de soro livre (SF) DMEM. Adicionar PCP em 05/01 a quantidade do total DNAs BiFC como um controle de transfecção. Para a quantificação BiFC, apenas as células que são positivos para o CFP serão analisadas para a presença de um sinal BiFC. Note-se que os espectros PCP vai coincidir com alguns dos pares BiFC na Tabela 1, portanto um controle alternativo de transfecçãotalvez necessário. Diluir Lipofectamine em 250uL SF DMEM (10uL Lipofectamine/1ug de DNA). Misturar o DNA e as diluições Lipofectamine. Incubar à temperatura ambiente por 20min.
Nota: O Lipofectamine: relação de DNA pode variar dependendo do tipo de célula. Use o método apropriado para a transfecção linhagem de células de interesse. - Enxágüe com água morna células 2x SF DMEM. Adicionar 2 ml de SF DMEM para cada prato fundo de vidro ou bem de um prato 6-bem.
- Dividir cada mistura de transfecção uniformemente entre um prato fundo de vidro e dois poços de um prato 6-bem.
- Incubar as células a 37 ° C por 5 horas.
- Remova a mídia de transfecção e substituir com a mídia completo (DMEM +10% SFB).
- Células incubar durante a 37 ° C. O comprimento de transfecção seguintes incubação varia de acordo com os níveis de expressão das proteínas de interesse. Incubação prolongada pode resultar em não-específicas de interação de modo que este passo terá de ser determinada empiricamente.
C. Preparação das células para criação de imagens
- Células são inicialmente examinados sob um microscópio de epifluorescência para garantir que o controlo positivo é fluorescente. Se não, pode ser necessário para permitir que as células tempo adicional a 37 ° C até que sinal é observado.
- Enxágüe células 3x com PBS (pH 7,4). Para as células no prato fundo de vidro adicionar paraformaldeído 2% (pH 7,4). Corrigir as células por 10 min no gelo. Enxágüe células 3x com PBS (pH 7,4). Células armazenar a 4 ° C coberto com 1mL de PBS (pH 7,4). Células não tem que ser corrigido para imagens, mas uma vez que os fragmentos BiFC reforma um fluoróforo intacta é a análise evitando assim irreversível de interações dinâmicas 3. Além disso, mantenha em mente que as células unfixed continuará a desenvolver sinal. Lisar as células do prato 6-bem e preparar lisados para Western blot. É importante que todas as células são preparadas ao mesmo tempo para que as células lisadas são representativos das células imagens.
Células D. Imagem
- A intensidade de fluorescência será calculado por célula. Certifique-se de células de imagem individual.
- PCP foi incluído como um controle tranfection e somente PCP células positivas são selecionados para análise de sinais BiFC. Nós fazemos a suposição de que se a célula é transfectadas com PCP, é também transfectadas com as construções BiFC. Essa abordagem garante que as células com imagens que não têm um sinal BiFC são negativos, devido à falta de uma interação entre as proteínas de interesse e não devido à ausência de um ou ambos os construtos de expressão BiFC naquela célula.
- Nós usamos uma Zeiss LSM 510 microscópio confocal para imagens de células. Ao usar este microscópio é importante para manter o zoom, pinhole, ganho de detector, amplificador offset, tamanho do quadro, velocidade de digitalização, média de verificação, e laser de potência consistente. Ao usar qualquer sistema de imagem é importante para manter as configurações constante para que a fluorescência é comparável entre as amostras. Além disso, ao quantificar a fluorescência é importante que pixels não são saturadas.
E. Quantificação de fluorescência
- Fluorescência pode ser quantificada usando qualquer software de imagem. Nós utilizamos ImageJ que está livremente disponível a partir do NIH (http://rsb.info.nih.gov/ij/). Abrir arquivos de imagem no ImageJ. Ir para Medições AnalyzeSet. Marque as caixas de Área e Valor médio cinza na caixa de Medições.
- Usando a ferramenta 'Seleção mão livre ", desenhe um contorno ao redor da borda da célula inteira no canal PCP.
- Deixando este esquema no lugar, mudar para o canal YFP. Ir para AnalyzeMeasure.
O Valor Médio Gray é a soma dos valores de cinza de todos os pixels na seleção, dividido pelo número de pixels (ou seja, a intensidade média de fluorescência por área da célula). - Para cada imagem desenhar um círculo no canal YFP em uma área que não contém uma célula. Tomar uma medida para esta área como pano de fundo. Subtrair o fundo de cada imagem.
- Valor a média menos o cinza de fundo para todas as células fotografada em uma amostra. Esta será a intensidade média de fluorescência para uma população de células. Gostaríamos de sugerir cerca de 60 células ao longo de três experimentos ser quantificado.
Resultados F. Representante:
Nosso laboratório centra-se na proteína andaime multi-domínio, intersectin (ITSN) que interage com proteínas numerosos para regular múltiplas vias bioquímicas e de sinalização 10,11,12,13,14. ITSN contém dois homologia Eps15 (EH) domínios, uma região enrolada em espiral, e cinco homologia Src 3 (SH3) domínios. Quanto mais tempo isoforma de ITSN também contém homologia Dbl (DH) e homologia pleckstrin (PH) domínios que atuam em conjunto como um fator de troca de nucleotídeos guanina para Cdc42 15. Esta estrutura modular promove proteína: interações de proteínas e faz ITSN um candidato ideal para experimentos BiFC. A localização subcelular de ITSN pode alterar os seus parceiros de ligação e, portanto, alterar as rotas regulamentada pelo ITSN (unpublished de dados). Recentemente, nosso laboratório demonstrou que ITSN regula a sobrevivência neuronal através da regulamentação de um romance de classe II PI3K, PI3K-C2β 11. O domínio amino-terminal Pro-rica de PI3K-C2β contém dois sítios de ligação para SH3 ITSN de domínios. Usando co-imunoprecipitação com ITSN e mutantes PI3K-C2β truncamento demonstramos que SH3A ITSN e domínios SH3C interagir com a região amino-terminal da PI3K C2β. Em seguida, utilizamos BiFC para visualizar a localização subcelular deste complexo. ITSN foi fundida ao amino-terminal de Vênus (PFLAG-VN173) e PI3K-C2β constrói fundido a carboxi-terminal de Vênus (PHA-VC155). Como outro controle negativo, um peptídeo não-específica foi fundida a PHA-VC155. VN-ITSN e VC-PI3K C2β formado um complexo com uma distribuição BiFC pontuam (Figura 2A, painéis superiores). Mutações no domínio Pro-rica de PI3K-C2β que perturbam co-precipitação de ITSN e PI3K-C2β diminuiu o sinal BiFC (Figura 2A, painéis inferiores) 11. Esta diferença de sinal entre BiFC ITSN e os dois PI3K C2β-proteínas não foi devido a diferenças na expressão da proteína (Figura 2B).
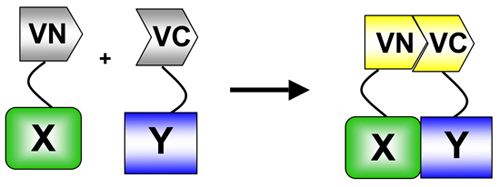
. Figura 1 Em BiFC, um fluoróforo (neste caso, Venus) é dividido em aminoácidos (VN) - e carboxi (VC)-terminal termina. Esses fins são fundidos para duas proteínas de interesse. Quando as duas proteínas interagem, os fragmentos VN e VC re-associar resultando em reconstituição do fluoróforo e fluorescência nos locais de interação. BiFC é um exemplo específico do ensaio complementação protéica fragmento (PCA) utilizado para medir proteína: interações proteína 5.
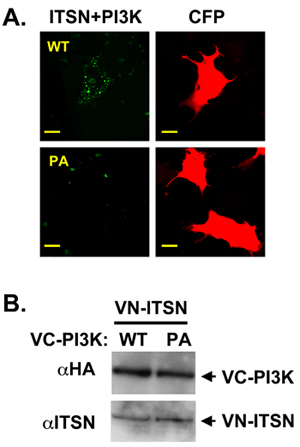
Figura 2. ITSN e PI3K-C2β formar um complexo BiFC. A. VN-tagged ITSN foi co-tranfected com VC-tagged PI3K-C3β WT ou um domínio rico em prolina mutante (PI3K-C2β-PA). ITSN e WT forma PI3K-C2β um complexo (verde). PCP (vermelho) foi usado como um controle de transfecção B. A Western blot foi realizada para demonstrar a expressão de igualdade dos construtos. O VC-tagged construções são HA marcados.
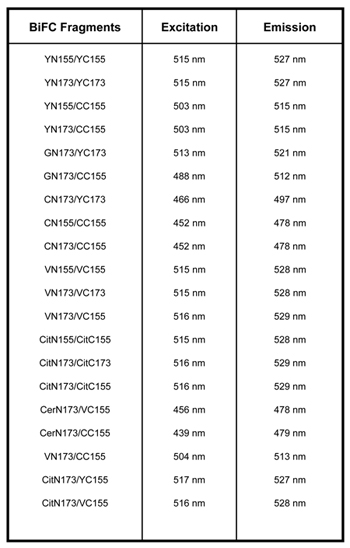
Tabela 1. Existem vários vetores que são compatíveis com BiFC. YN155: 1-155aa de YFP; YC155: 155-238aa de YFP; YN173: 1-172aa de YFP; YC173, 173-238aa de YFP; VN155: 1-154aa de Vênus; VC155: 155-238 de Vênus; VN173: 1-172aa de Vênus; VC173: 173-238aa de Vênus; CN155 1-154aa do PCP; CC155 155-238aa do PCP, GN173: 1-172aa da GFP, CitN155: 1-155aa de Citrino, CitC155: 155-238aa de citrino, CitN173: 1-172aa de Citrino, CitC173: 173-238aa de Citrino, CerN173: 1-172aa de Cerulean 2,3,9.
Discussão
BiFC é um excelente método para a visualização de proteínas: interações de proteínas em células inteiras e determinar a localização subcelular desses complexos. As vantagens de BiFC são de que apenas as proteínas que interagem são fluorescentes, as interações transitórias são estabilizadas, e pós-processamento dos dados de imagem é mínima. Duas desvantagens deste método são o tempo de maturação para a fluoróforo ea irreversibilidade do complexo fluoróforo. Em algumas aplicações este irrevers...
Divulgações
Agradecimentos
O ITSN, PI3K C2β, e vetores de controle usado neste protocolo estão disponíveis mediante solicitação aos autores, para fins não comerciais apenas. Os autores gostariam de agradecer o Dr. Chang-Deng Hu gentilmente para aconselhamento e dos reagentes utilizados no estabelecimento do protocolo BiFC no laboratório O'Bryan. KAW foi apoiada por fundos do Jerome Lejeune Foundation. Trabalho no laboratório O'Bryan é suportado por concessões do (HL090651) NIH, DOD (PR080428), a Fundação St. Baldrick, e da Fundação Jérôme Lejeune.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Cellgro | 10-013 | |
| Fetal bovine serum | Cellgro | 35-011-CV | |
| Glass Bottom Microwell dishes | Matek | P35G-1.5-14C | |
| 6-well dishes | Falcon BD | 35-3846 | |
| Lipofectamine | Invitrogen | 18324020 | |
| PBS | Cellgro | 21-031-CV | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Confocal Microscope | Carl Zeiss, Inc. | LSM510 META |
Referências
- Kerppola, T. K. Visualization of molecular interactions by fluorescence complementation. Nat Rev Mol Cell Biol. 7, 449-456 (2006).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40, 61-66 (2006).
- Hu, C. D., Chinenov, Y., Kerppola, T. K. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. Mol Cell. 9, 789-798 (2002).
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Michnick, S. W., Remy, I., Campbell-Valois, F. X., Vallee-Belisle, A., Pelletier, J. N. Detection of protein-protein interactions by protein fragment complementation strategies. Methods Enzymol. S328, 208-230 (2000).
- Michnick, S. W., MacDonald, M. L., Westwick, J. K. Chemical genetic strategies to delineate MAP kinase signaling pathways using protein-fragment complementation assays (PCA). Methods. 40, 287-293 (2006).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends Biochem Sci. 32, 407-414 (2007).
- Ciruela, F. Fluorescence-based methods in the study of protein-protein interactions in living cells. Curr Opin Biotechnol. 19, 338-343 (2008).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21, 539-545 (2003).
- Martin, N. P. Intersectin regulates epidermal growth factor receptor endocytosis, ubiquitylation, and signaling. Mol Pharmacol. 70, 1643-1653 (2006).
- Das, M. Regulation of neuron survival through an intersectin-phosphoinositide 3'-kinase C2beta-AKT pathway. Mol Cell Biol. 27, 7906-7917 (2007).
- Mohney, R. P. Intersectin activates Ras but stimulates transcription through an independent pathway involving. JNK. J Biol Chem. 278, 47038-47045 (2003).
- Tong, X. K., Hussain, N. K., Adams, A. G., O'Bryan, J. P., McPherson, P. S. Intersectin can regulate the Ras/MAP kinase pathway independent of its role in endocytosis. J Biol Chem. 275, 29894-29899 (2000).
- Adams, A., Thorn, J. M., Yamabhai, M., Kay, B. K., O'Bryan, J. P. Intersectin an adaptor protein involved in clathrin-mediated endocytosis, activates mitogenic signaling pathways. J Biol Chem. 275, 27414-27420 (2000).
- O'Bryan, J. P., Mohney, R. P., Oldham, C. E. Mitogenesis and endocytosis: What's at the INTERSECTIoN?. Oncogene. 20, 6300-6308 (2001).
- Shyu, Y. J., Suarez, C. D., Hu, C. D. Visualization of AP-1 NF-kappaB ternary complexes in living cells by using a BiFC-based FRET. Proc Natl Acad Sci U S A. 105, 151-156 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados