Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entwicklung eines
In diesem Artikel
Zusammenfassung
The current study describes the development and applications of a genetically engineered assay system based on the transfection of rat basophilic leukemia cells with the equine FcεRIα gene. Transfected cells express a functional receptor where the release of mediators of the allergic response can be activated by IgE and antigen.
Zusammenfassung
The interaction of IgE with its high-affinity Fc receptor (FcεRI) followed by an antigenic challenge is the principal pathway in IgE mediated allergic reactions. As a consequence of the high affinity binding between IgE and FcεRI, along with the continuous production of IgE by B cells, allergies usually persist throughout life, with currently no permanent cure available. Horses, especially race horses, which are commonly inbred, are a species of mammals that are very prone to the development of hypersensitivity responses, which can seriously affect their performance. Physiological responses to allergic sensitization in horses mirror that observed in humans and dogs. In this paper we describe the development of an in situ assay system for the quantitative assessment of the release of mediators of the allergic response pertaining to the equine system. To this end, the gene encoding equine FcεRIα was transfected into and expressed onto the surface of parental Rat Basophil Leukemia (RBL-2H3.1) cells. The gene product of the transfected equine α-chain formed a functional receptor complex with the endogenous rat β- and γ-chains 1. The resultant assay system facilitated an assessment of the quantity of mediator secreted from equine FcεRIα transfected RBL-2H3.1 cells following sensitization with equine IgE and antigenic challenge using β-hexosaminidase release as a readout 2, 3. Mediator release peaked at 36.68% ± 4.88% at 100 ng ml-1 of antigen. This assay was modified from previous assays used to study human and canine allergic responses 4, 5. We have also shown that this type of assay system has multiple applications for the development of diagnostic tools and the safety assessment of potential therapeutic intervention strategies in allergic disease 6, 2, 3.
Einleitung
Allergie ist seit Jahrtausenden bekannt. Ein Asthma-Behandlung wurde in der antiken ägyptischen medizinischen Text als Papyrus Ebers (~ 1550 BCE) bekannt beschrieben und diskutiert pflanzliche Heilmittel, um es 7 zu behandeln.
Heute Allergie ist als Typ I-Überempfindlichkeitsreaktion, wobei die T-Helferzell-Typ 2 (TH 2) Arm des Immunsystems steuert die Produktion von Immunglobulin E (IgE) Antikörper als Antwort auf Umweltantigene, Allergene genannt klassifiziert. Dies sind diverse Stoffe, die üblicherweise mit Zellen interagieren im Immunsystem und stimulieren die Synthese und Sekretion von proinflammatorischen Cytokinen, einschließlich IL-4 und Interleukin-13 8, 9 als weiß Partikel im Zigarettenrauch oder Dieselabgaspartikeln, die IgE-Synthese zu erhöhen 10.
Der Anstieg der allergischen Manifestationen in Industrieländern in den letzten 50 Jahren hat sich eine Kombination der Wirkung zugeschriebenUmweltschadstoffe und ein Trend zu einer keim Umgebung, die die Immunantwort gegenüber einem Profil von TH 2 Zytokine überwog verschieben kombinieren, wie durch die "Hygiene-Hypothese" 11 vorgeschlagen.
Wie oben erwähnt, sind Menschen nicht nur Säugern durch Allergie leidet. Insbesondere Pferden und Hunden entwickeln auch klassische allergische Reaktionen und eine Untersuchung von 12 zeigt, dass, wie beim Menschen, wird equine Allergie auf genetischen und Umweltfaktoren zurückzuführen. Als Folge präsentieren diese Tiere gute Modelle zur Untersuchung der Wechselwirkung zwischen genetischen und umweltbedingten Ursachen von Allergien, ihr Fortschreiten von Sensibilisierung gegen Krankheit und mögliche Interventionsstrategien einmal klinischen Manifestationen in gesetzt
1887 Stömmer war die erste Person, die Ähnlichkeit zwischen Mensch und Pferde-Asthma 13 zu beschreiben, ist die Wirkung von Histamin auf der Pferdeherzkreislaufsystemsehr ähnlich dem des Menschen 14. Pferde sind auch der Grundstein der Pferderennindustrie, die es wert USD 72 Milliarden mit einem Wettumsatz von US $ 115.000.000.000 jährlich 15.
Die meisten zeitgenössischen Rennpferde sind Nachkommen von der geringen Zahl der arabischen Pferde von Lady Anne Blunt seit 1878 gezüchtet. Moderne Rennpferde werden häufig Inzucht für Performance Fähigkeiten auszuwählen. Sie sind anfällig für genetische Erkrankungen, von denen eine ihre Anfälligkeit für allergische Reaktionen zu montieren. Sie haben auch 1000 mal höhere Serum-IgE-Spiegel als selbst die am schwersten allergischen Menschen 16. Pferde allergischen Reaktionen sind in der Regel als Insektenstich Überempfindlichkeit (IBH) 17, 18 manifestiert. IBH Ergebnisse in Dermatitis durch Bisse bilden Insekten aus der Gattung Culicoides. Eine andere Form der Pferde-allergische Erkrankung ist rezidivierenden Atemwegsobstruktionen (RAO), dies in den Lungen und Atemwegen manifestiert. Es wird von Keuchen und Labor gekennzeichnetODER-verknüpft Atmung. RAO tritt häufig als Reaktion auf Sporen zu formen, und hohe allergenspezifische IgE-Spiegel haben bei Pferden, die an RAO in einer Studie 19 registriert worden, obwohl ein anderer Untersuchung nicht bestätigt diesen 20.
Studien über equine Allergie drehte sich um die Versuch Überwachung und Neutralisieren equine IgE durch die Entwicklung anti equine IgE monoklonalen Antikörpern (mAb) 21, 22. Weiterhin die Studie von 23 diskutiert die Produktion der extrazellulären Domänen der α equinen Hochaffinitäts-Fc-Rezeptors Kette (FcεRIα) Rezeptors in einem Versuch zu detektieren und zu quantifizieren Pferdeserum IgE. Eine verwandte Studie von Ledin 24 bespricht einen neuen Ansatz bei der Neutralisierung Serum-IgE durch Priming des Immunsystems mit einem selbst / Nicht-Selbst Immunogen gerichtet. Alle diese Studien fehlte aber eine wirksame Assay, um die Sicherheit und Wirksamkeit der Testprotokolle. In diesem Artikel haben wir jetzt eine solche Assay sys präsentierentem für die Untersuchung der relevanten equinen System, in dem β-Hexosaminidase Release, als Indikator für die Zellmediator Degranulation wurde für RBL-Zellen, 2H3.1 equine FcεRIα beurteilt diagnostische und therapeutische Strategien. Dieses Protokoll basiert auf früheren Veröffentlichungen 25, 4, 5, 2, 3 das Engineering von RBL-Zellen mit den IgE-Bindungsdomäne des hochaffinen IgE-Rezeptors verschiedener Spezies kodiert, transfiziert Beschreibung basiert. Das Protokoll beschreibt, wie ein β-Hexosaminidase-Freisetzungstest durchzuführen, deren Ergebnisse sind als Mittelwert ± Standardabweichung von dreifachen Experimenten dargestellt.
Der Freisetzungstest wurde zuerst von Siraganian entwickelt und Haken 25 Menschenallergie zu untersuchen. Das Labor Gruppe von Dr. Reuben Siraganian führte entwickelte auch die RBL-Zelllinie. Diese RBL Zellen wurden entwickelt, um die menschliche FcεRIα auszudrücken und das Protokoll wurde von 4 veröffentlicht. Das letzte Stückder Test wurde mit der Entwicklung des Plasmids pSV in der Veröffentlichung von Neuberger 26, die die Produktion von IgE-Antikörpern durch Klonierung ihrer Schwerketten-Gen stromabwärts von einem Maus-Gen für eine variable Region, die IgE das Hapten 4-Hydroxy-3 zielt beschrieben nitro-Phenacetyl (NP), war die resultierende chimäre Antikörper, vollständig funktionsfähig. Die Fähigkeit, jede IgE entwickeln die die gleichen Hapten, wobei auch die Klonierung seinen Rezeptor auf der Oberfläche der RBL-Zellen führte zu der Standardisierung des Assays so dass es ein nützliches Protokoll, um die Degranulation von Basophilen Zellen zu messen.
Der Test funktioniert haben Vor- und Nachteile. Die Profis des Assays ist seine Anpassungsfähigkeit an irgendeinem Säugersystem verwendet werden, unser Labor ist somit benutzt, um die Degranulation der Mensch, Hund und Pferde Systeme zu testen, und dies ist erreichbar, einfach durch Synthetisieren des Organismus IgE und Klonieren seinen Rezeptor auf die Oberfläche der RBL-Zellen.
Andererseits,die Nachteile des Assays ist, dass die RBL-Zellen sind sehr empfindlich gegen thermische, mechanische und PH ändert, so dass sie eine Veränderung der Degranulation Ebenen innerhalb des gleichen Assay zu ergeben. Es wird daher dringend empfohlen, dass die Tests werden immer dreifach wiederholt und dann ein Mittelwert von ihnen genommen. Darüber hinaus sind die RBL-Zellen sind in der Regel zu einer nicht-freisetzenden Phänotyp verschieben, wenn sie in der Gewebekultur für längere Zeiten (> 10 Wochen) 27 übrig sind, was ihre Wartung umständlich. Sie sind auch anfällig für Infektionen durch Mycoplasma-Bakterien, die nicht von einem Lichtmikroskop sichtbar sind und nicht die Morphologie der Zelle ändern, würde aber ihre Degranulation Ebenen drastisch ändern. So regelmäßigen Mykoplasmen-Tests erforderlich.
Protokoll
1) Herstellung der Zelllinie:
- Die Entwicklung der RBL-2H3.1 Zelllinie, Pferde FcsRI α:
- Mit grundlegenden Gewebekulturtechniken für Monolayer-Zelllinien, Transfektion Eltern RBL-2H3.1 Zellen unter Verwendung des pEE6 Plasmid, die Durchführung der Pferde FcεRIα Gens (GenBank: Y18204.1) 28. Hinzufügen 2 ug ul -1 der Plasmid-DNA auf 0,8 ml Zellen bei einer Dichte von 1.2 x10 & sup7; Zellen ml -1. Elektroporieren der Zellen bei 250 V 960 uF mit einem 0,4 cm electrocuvette dann sofort auf Eis inkubieren für 10 min.
- Auswahl der transformierten Zellen unter Verwendung von Medien, die 0,4 g Geneticin G418 Sulfat, sortiert dann die verbleibenden lebenden Zellen durch FACS durch Markieren sie mit einem Fluoreszenz IgE-Antikörper. Verwenden Sie die resultierende RBL-2H3.1 ausdrücken Pferde FcεRIα Zelllinie für die Untersuchung 2, 3.
- Pre-Test Antikörper Sensibilisierung:
- Ernte der RBL-2H3.1 ausdrücken Pferde FcεRIα Zellen aus einer konfluenten Petrischale. Waschen dann erneut die Zellen in Kulturmedium bis zu einer Zelldichte von 5x10 5 Zellen ml -1.
- Hinzufügen des IgE von Interesse für die suspendierten Zellen zu einer Endkonzentration von 1 ng ml -1, dann die Platte 100 & mgr; l der Zellen auf eine Platte mit 96 Vertiefungen in den Spalten 1-6 und bei 37 ° C + 5% CO 2 + 90% relative Luftfeuchte für 16 Stunden. Nach der Inkubationszeit und vor der Durchführung der Freisetzungstest, überprüfen Sie die Brunnen unter einem Mikroskop auf gut Konfluenz und Zellhaftung.
2) Veröffentlichung Assay:
- Waschen der Zellen:
- Warm Freisetzungspuffer (25 mM PIPES, 120 mM Natriumchlorid, 5 mM Kaliumchlorid, 0,04 mM Magnesiumchlorid und 1 mM Calciumchlorid) bei 37 ° C bis zur sanften Waschen der Zellen zu ermöglichen.
- Wash-Zellen durch Schwenken der Platte an Zellmedien zu entfernen und das Hinzufügen von 100 ul warm, 37 ° C, Freisetzungspuffer. Zweimal wiederholen.
- Antigen Herausforderung:
- Bereiten Sie eine serielle Verdünnung des Antigens (NIP-HSA oder DNP-HSA) von 0 ng ml -1, 0,1 ng ml -1, 1 ng ml -1, 10 ng ml -1, 100 ng ml -1, 1.000 ng ml -1, 10.000 ng ml -1 in Freisetzungspuffer und warm bei 37 ° C.
- Nach dem zweiten Zellwäsche, entsorgen Sie die Medien und mit 100 ul der Antigenlösungen ersetzt. Sicherzustellen, daß Vertiefungen in der gleichen Reihe (A1-6 zum Beispiel) die gleiche Antigenkonzentration zu ihnen hinzugefügt.
- Eine Negativkontrolle in der Zeile A durch Zugabe von 0 ng ml -1 Antigen eingestellt. Hinzufügen zunehmender Antigenkonzentration die Reihen (BG), gefolgt von Triton-x-Puffer (5% Triton X-100) in der Reihe H-Zellen, um die Zellen zu lysieren, um als positive Kontrolle verwendet werden. Inkubieren bei 37 ° C für 20 min, um damit die Zellen ihre Mediatoren freisetzen.
- Einrichten individuelle Wohlkontrollen:
- Nach der Inkubation mit einer Pipette 50 ul Zellüberstand auf die andere Hälfte der Platte (wells A1-6 bis A7-12 Vertiefungen, etc.). Verwerfen der restlichen 50 & mgr; l des Überstands und Ersetzen mit 50 ul Triton-X-Puffer, um die Messung der Menge des freigesetzten Mediatoren in jede Vertiefung in den Spalten 7-12 als Prozentsatz der Gesamtmediatoren in den Zellen in Spalte 1-6 ermöglichen .
- Enzym-Substrat:
- Dann werden 50 ul der β-Hexosaminidase-Substrat (50 mM 4-Nitrophenyl-N-acetyl-β-D-glucosaminid in DMSO durch Zugabe zu Citratpuffer 0,2 M Zitronensäure und 0,2 M Natriumacetat auf 2 mM verdünnt, pH 4,5) zu allen Vertiefungen, um die Umwandlung des Substrats zu 4-Nitrophenol durch das β-Hexosaminidase Enzyms erleichtert. Die Inkubation erfolgt bei 37 ° C für 2 Stunden.

- Beenden der Reaktion:
- Stoppen der Reaktion durch Zugabe von 150 & mgr; l Tris-Puffer (1 M Tris-HCl, pH 9) in jede Vertiefung wie die hohe pH-Wert des Puffers wird die Reaktion gestoppt und dann die 4-Nitrophenol in einer gelben Farbe.
- Das Lesen und die Analyse der Ergebnisse:
- Lesen der Platte unter Verwendung eines Platten Spektrophotometer bei 405 nm, die Absorption der gelben Farbe gemessen. Berechnet den Prozentsatz des freigesetzten β-Hexosaminidase Verwendung der folgenden Formel:
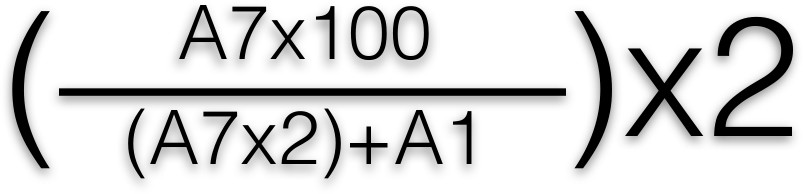
- Wenden Sie diese Formel in jede Vertiefung, wonach ein Mittelwert für jede Zeile übernommen. A1 und A7 repräsentieren die Lage der Vertiefungen der Platte mit 96 Vertiefungen. Eine Grafik mit Prozentsatz der β-Hexosaminidase Mitteilung (die Gesamtmediatorfreisetzung entspricht) against Antigenkonzentration 2, 3.
Ergebnisse
Die Eltern RBL-2H3.1 Zellen und solche mit equinen FcεRIα Rezeptorgen transfiziert wurden zuerst mit Maus-IgE-anti-DNP-HSA sensibilisiert und mit dem DNP-HSA-Antigen herausgefordert. Maus-IgE bindet an den endogenen Rezeptor aus Ratte in beiden Zelllinien und dient als Kontrolle, um die Freisetzung Lebensfähigkeit der beiden Zelllinien zu testen, um Mediatoren (Figur 1 A) lösen damit. Dies ist eine wichtige Kontrolle und sollten routine da beim verlängert (> 10 Wochen) Passage in Zellkultur durc...
Diskussion
In Zusammenfassung der Ergebnisse dieser Untersuchung zeigten, dass bei RBL-Zellen, 2H3.1 equine FcεRIα mit equinen IgE durch ein Antigen sensibilisiert und herausgefordert, geben sie einen Spitzen Mediator-Freisetzung von 36,68% ± 4,88% der Gesamtmenge des innerhalb des Vermittlers Zellen, verglichen mit dem RBL-2H3.1 Elternzellen nicht exprimiert equine FcεRIα.
Somit Dieser Test liefert ein nützliches Werkzeug für die Untersuchung und das Studium Pferde allergischen Reaktionen i...
Offenlegungen
The authors declare that they have no competing financial interests in this paper.
Danksagungen
The authors thank Dr. Lynda Partridge for the provision of advice and laboratory facilities.
Materialien
| Name | Company | Catalog Number | Comments |
| RBL-2H3.1 Expressing Equine FcεRIα | - | - | Produced in the lab |
| Equine IgE anti NIP-HSA | - | - | Produced in the lab |
| 96 Well Plate | Sigma | CLS3595 | - |
| Multi Channel Pipette | Anachem | - | - |
| Incubator | Galaxy R | - | - |
| 4Hydroxy-5-iodo-3-nitrophenylacetic acid | Cambridge Research Biochemicals | N-1070-1 | NIP-OH was conjugated with Human Serum Albumin to make NIP-HSA in the lab |
| Dinitrophenyl Conjugated to Human Serum Albumin | Sigma | A6661 | Abbreviated DNP-HSA |
| Plate Spectrophotometer | Anthos Labtec HT2 | - | - |
| Pipes | Sigma | P1851 | - |
| Sodium Chloride | Sigma | S7653 | - |
| Potassium Chloride | Sigma | P9333 | - |
| Magnesium Chloride | Sigma | M2670 | - |
| Calcium Chloride | Sigma | C1016 | - |
| Triton x100 | Sigma | X100 | - |
| 4-nitrophenyl N-acetyl-β-D-glucosaminide | Sigma | N9376 | Stock solution called β-hexosaminidase substrate was 50mM prepared in DMSO |
| Dimethyl Sulfoxide | Sigma | D2650 | - |
| Citric Acid | Sigma | 251275 | - |
| Sodium Acetate | Sigma | S7670 | - |
| Tris | Sigma | T5941 | - |
Referenzen
- Taudou, G., et al. Expression of the Alpha Chain of Human FcεRI in Transfected Rat Basophilic Leukemia Cells: Functional Activation after Sensitization with Human Mite-Specific IgE. Int Arch Allergy Immunol. 100 (4), 344-350 (1993).
- Sabban, S. . Development of an in Vitro Model System for Studying the Interaction of EquuscaballusIgE with Its High-Affinity FcεRI Receptor. , (2011).
- Sabban, S., Ye, H., Helm, B. A. Development of an in Vitro Model System for Studying the Interaction of EquuscaballusIgE with Its High-Affinity Receptor FcεRI. Vet ImmunolImmunopathol. 153 (1-2), 6-10 (2013).
- Wilson, A. P. M., Pullar, C. E., Camp, A. M., Helm, B. A. Human IgE mediates stimulus secretion coupling in rat basophilic leukemia cells transfected with the a chain of the human high-affinity receptor. Eur J Immunol. 23, 240-244 (1993).
- Hunter, M. J., Vratimos, A. P., Housden, J. E. M., Helm, B. A. Generation of canine-human Fc IgE chimeric antibodies for the determination of the canine IgE domain of interaction with FcεRIα. MolImmunol. 45 (8), 2262-2268 (2008).
- Rashid, A., et al. Review: Diagnostic and therapeutic applications of rat basophilic leukemia cells. MolImmunol. 52 (3-4), 224-228 (2012).
- Cohen, S. G. Asthma in antiquity: the Ebers Papyrus. Allergy Proc. 13 (3), 147-154 (1992).
- Dudler, T., et al. A link between catalytic activity, IgE-independent mast cell activation, and allergenicity of bee venom phospholipase A2. J. Immunol. 155, 2605-2613 (1995).
- Machado, D. C., Horton, D., Harrop, R., Peachell, P. T., Helm, B. A. Potential allergens stimulate the release of mediators of the allergic response from cells of mast cell lineage in the absence of sensitization with antigen-specific IgE. Eur J Immunol. 26 (12), 2972-2980 (1996).
- Smyth, L. J., et al. Assessment of the molecular basis of pro-allergenic effects of cigarette smoke. Environ Sci Technol. 34 (7), 1370-1374 (2000).
- Okada, H., Kuhn, C., Feillet, H., Bach, J. F. The 'hygiene hypothesis' for autoimmune and allergic diseases: an update. ClinExpImmunol. 160 (1), 1-9 (2010).
- Eder, C., et al. Influence of environmental and genetic factors on allergen-specific immunoglobulin-E levels in sera from Lipizzan horses. Equine Vet J. 33 (7), 714-720 (2001).
- Cook, W. R., Rossdale, P. D. The syndrome of 'Broken Wind' in the horse. Proceedings of the Royal Society of Medicine. 56, 972-977 (1963).
- Eyre, P., Lewis, A. J. Acute systemic anaphylaxis in the horse. Br. J. Pharmacol. 48 (3), 426-437 (1973).
- Wagner, B. IgE in horses: occurrence in health and disease. Vet ImmunolImmunopathol. 132 (1), 21-23 (2009).
- Hellberg, W., et al. Equine insect bite hypersensitivity: immunoblot analysis of IgE and IgG subclass responses to Culicoidesnubeculosus salivary gland extract. Vet. Immunol. Immunopathol. 113 (1-2), 99-112 (2006).
- Schaffartzik, A., et al. Equine insect bite hypersensitivity: what do we know. Vet ImmunolImmunopathol. 147 (3-4), 113-126 (2012).
- Künzle, F., et al. IgE-bearing cells in bronchoalveolar lavage fluid and allergen-specific IgE levels in sera from RAO-affected horses. J Vet Med A PhysiolPatholClin Med. 54 (1), 40-47 (2007).
- Tahon, L., et al. In vitro allergy tests compared to intradermal testing in horses with recurrent airway obstruction. Vet ImmunolImmunopathol. (1-2), 85-93 (2009).
- Wagner, B., Radbruch, A., Rohwer, J., Leibold, W. Monoclonal anti-equine IgE antibodies with specificity for different epitopes on the immunoglobulin heavy chain of native IgE. Vet ImmunolImmunopathol. 92 (1-2), 45-60 (2003).
- Wilson, A. D., Harwood, L., Torsteinsdottir, S., Marti, E. Production of monoclonal antibodies specific for native equine IgE and their application to monitor total serum IgE responses in Icelandic and non-Icelandic horses with insect bite dermal hypersensitivity. Vet ImmunolImmunopathol. 112 (3-4), 156-170 (2006).
- McAleese, S. M., et al. Cloning and expression of the extra-cellular part of the alpha chain of the equine high-affinity IgE receptor and its use in the detection of IgE. Vet ImmunolImmunopathol. 110 (1-2), 187-191 (2006).
- Ledin, A., et al. Generation of therapeutic antibody responses against IgE in dogs, an animal species with exceptionally high plasma IgE levels. Vaccine. 24 (1), 66-74 (2006).
- Siraganian, R. P., Hook, W. A. Histamine release and assay methods for the study of human allergy. Manual of Clinical Immunology. , (1980).
- Neuberger, M. S., et al. A hapten-specific chimaericIgE antibody with human physiological effector function. Nature. 314 (6008), 268-270 (1985).
- Bingham, B. R., Monk, P. N., Helm, B. A. Defective Protein Phosphorylation and Ca2+ Mobilization in a low secreting variant of the rat basophilic leukemia cell line. The Journal of Biological Chemistry. 269 (30), 19300-19306 (1994).
- McAleese, S. M., Halliwell, R. E., Miller, H. R. Cloning and sequencing of the horse and sheep high-affinity IgE receptor alpha chain cDNA. Immunogenetics. 1 (51), 878-881 (2000).
- Hongtu, Y. Study of the structure/function relationship in canine and human IgE as the basis for the development of rational therapeutic intervention strategies in allergic disease. , (2010).
- Sabban, S., et al. Towards a pan-anti-allergy vaccine. JIBTVA. 2 (2), 15-27 (2013).
- Moran, G., Burgos, R., Araya, O., Folch, H. In vitro bioassay to detect reaginic antibodies from the serum of horses affected with recurrent airway obstruction. Vet Res Commun. 34, 91-99 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten