Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разработка
В этой статье
Резюме
The current study describes the development and applications of a genetically engineered assay system based on the transfection of rat basophilic leukemia cells with the equine FcεRIα gene. Transfected cells express a functional receptor where the release of mediators of the allergic response can be activated by IgE and antigen.
Аннотация
The interaction of IgE with its high-affinity Fc receptor (FcεRI) followed by an antigenic challenge is the principal pathway in IgE mediated allergic reactions. As a consequence of the high affinity binding between IgE and FcεRI, along with the continuous production of IgE by B cells, allergies usually persist throughout life, with currently no permanent cure available. Horses, especially race horses, which are commonly inbred, are a species of mammals that are very prone to the development of hypersensitivity responses, which can seriously affect their performance. Physiological responses to allergic sensitization in horses mirror that observed in humans and dogs. In this paper we describe the development of an in situ assay system for the quantitative assessment of the release of mediators of the allergic response pertaining to the equine system. To this end, the gene encoding equine FcεRIα was transfected into and expressed onto the surface of parental Rat Basophil Leukemia (RBL-2H3.1) cells. The gene product of the transfected equine α-chain formed a functional receptor complex with the endogenous rat β- and γ-chains 1. The resultant assay system facilitated an assessment of the quantity of mediator secreted from equine FcεRIα transfected RBL-2H3.1 cells following sensitization with equine IgE and antigenic challenge using β-hexosaminidase release as a readout 2, 3. Mediator release peaked at 36.68% ± 4.88% at 100 ng ml-1 of antigen. This assay was modified from previous assays used to study human and canine allergic responses 4, 5. We have also shown that this type of assay system has multiple applications for the development of diagnostic tools and the safety assessment of potential therapeutic intervention strategies in allergic disease 6, 2, 3.
Введение
Аллергия, как известно, на протяжении тысячелетий. Лечение астмы был описан в древнеегипетской медицинского текста, известного как папирусе Эберса (~ 1550 г. до н.э.) и обсудили трав для лечения его 7.
Сегодня аллергии классифицируется как ответ гиперчувствительности типа I, где Т хелперов типа 2 (TH 2) рычаг иммунной системы бычков производство иммуноглобулина Е (IgE) антител в ответ на антигены окружающей среды, называемых аллергенами. Эти различные вещества, которые обычно взаимодействуют с клетками иммунной системы и стимулируют синтез и секрецию провоспалительных цитокинов, в том числе интерлейкина-4 и интерлейкина-13 8, 9, как у частицы в сигаретном дыме или дизельное выхлопных частиц, которые усиливают синтез IgE 10.
Рост аллергических проявлений в промышленно развитых странах в последние 50 лет было обусловлено сочетанием эффектазагрязнителями окружающей среды и тенденция к более облагороженная окружающей среды, сочетающие переложить иммунный ответ к профилю преобладали по ТН 2 цитокинов, предложенные «гигиеническая гипотеза» 11.
Как уже упоминалось выше, люди не единственные млекопитающие, страдающие аллергией. Примечательно лошади и собаки могут также развиваться классические аллергические реакции, а также исследование по 12 показал, что, как и у людей, лошадей аллергия приписывается генетических и экологических факторов. Как следствие, эти животные представляют хорошие модели для изучения взаимосвязи между генетическими и экологическими причинами аллергии, ее развитие от чувствительности к болезни и возможных стратегий вмешательства, как только клинические проявления установили в
В 1887 году, Stömmer был первым человеком, чтобы описать сходство между человеком и лошадей астмы 13, эффект гистамина на лошади сердечно-сосудистой системы являетсяочень похож на человека 14. Лошади также краеугольным камнем скачки промышленности, которая стоит нам $ 72 млрд с оборотом ставок по US $ 115 млрд в год 15.
Большинство современных спортивных лошадей являются потомками небольшого числа арабских лошадей разводят леди Энн Блант с 1878 года. Современные скаковых лошадей, как правило, инбредных выбрать для способностей производительности. Они склонны к генетических расстройств, одним из которых является их чувствительность к монтировать аллергические реакции. Они также имеют в 1000 раз выше сывороточных уровней IgE, чем даже наиболее сильно аллергия человека 16. Верховая аллергические реакции, как правило, проявляется в виде укуса насекомого гиперчувствительности (IBH) 17, 18. Результаты IBH в дерматита из-за укусов образуют насекомых в роду Culicoides. Другая форма лошадей аллергических заболеваний является рецидивирующие препятствия в дыхательных путях (РАО), это проявляется в легких и дыхательных путях. Она характеризуется хрипы и лабораторииORed дыхание. РАО обычно происходит в ответ на споры плесени, и высокие уровни IgE аллерген-специфическая были зафиксированы в лошадей, страдающих от РАО в одном исследовании 19 хотя новое расследование не подтвердило эту 20.
Исследования лошадей аллергии вращалась вокруг попытки мониторинга и нейтрализующих лошадей IgE путем разработки анти-лошадей IgE моноклональных антител (моноклональные антитела,) 21, 22. Кроме того, исследование, проведенное 23 обсуждает производство внеклеточных доменов α лошадиный высоким сродством Fc рецептора цепь (FcεRIα) рецепторов в попытке обнаружить и количественного определения в сыворотке IgE лошадей. Связанный с этим исследование Ledin 24 обсуждает новый подход, направленный на нейтрализацию сыворотке IgE путем заливки иммунную систему с помощью собственной / НЕСАМОУПРАВЛЯЮЩИХСЯ иммуногена. Все эти исследования, однако, отсутствует эффективная анализа для проверки безопасности и эффективности их протоколов. В этой статье, мы теперь представляем Такой анализ SYSма применимо к изучению диагностических и терапевтических стратегий, имеющих отношение к лошади системы, где β-гексозаминидазы релиз, в качестве индикатора клеток медиаторов дегрануляции, они были начислены на RBL-2H3.1 клеток, экспрессирующих лошадей FcεRIα. Этот протокол основан на предыдущих публикаций 25, 4, 5, 2, 3, описывающих инженерии RBL клеток, трансфецированных геном, кодирующим связывающий домен IgE рецептора с высоким сродством к IgE из различных видов. Протокол объясняет, как выполнить анализе высвобождения β-гексозаминидазы, результаты которого представлены как среднее ± стандартное отклонение для трех экспериментов.
Релиз анализ был впервые разработан Siraganian и Хук 25 для изучения аллергии человека. Лаборатория группа во главе с доктором Рувим Siraganian также разработал RBL клеточной линии. Эти RBL клетки были разработаны, чтобы выразить человеческую FcεRIα и протокол был опубликован 4. Заключительная частьиз анализа пришли с развитием плазмиды ПСВ в работе Neuberger 26, который, описанной производство антител IgE путем клонирования свою тяжелую цепь гена вниз по течению от мышиного гена для вариабельной области IgE, который нацелен на гаптен 4-гидрокси-3 нитро-phenacetyl (NP), в результате чего химерное антитело было полностью функциональной. Способность развивать любую IgE таргетинга то же гаптен, в то же время клонирования его рецептор на поверхности RBL клеток привело к стандартизации анализа, что делает его полезным протокол для измерения дегрануляцию базофилов клеток.
Анализ имеет плюсы и минусы. Профи из анализа является его адаптивность, которые будут использоваться в любой системе млекопитающих, наша лаборатория, таким образом, использовал его для проверки дегрануляции в человека, собак и лошадей систем, и это достижимо лишь путем синтеза IgE организма и клонирования его рецептор на поверхности клеток RBL.
С другой стороны,Недостатки анализа является то, что клетки RBL очень чувствительны к тепловых, механических и рН изменений, что делает их дать изменение уровней дегрануляции в пределах одной и той же тесте. Он, таким образом, настоятельно рекомендуется, что анализы всегда повторяется трижды, а затем берется среднее значение из них. Кроме того, RBL клетки, как правило, смещаются в сторону не-рилизинг фенотипа, если они остаются в культуре ткани в течение длительного времени (> 10 недель) 27, что делает их обслуживание громоздкой. Они также склонны к инфекциям микоплазмой бактерий, которые не видны с помощью оптического микроскопа и не меняют морфологию ячейки, но кардинально изменить их уровни дегрануляции. Таким образом регулярные тесты микоплазмы необходимы.
протокол
1) Получение клеточной линии:
- Разработка RBL-2H3.1 клеточную линию, выражающую лошадей FcεRI α:
- Использование основных методов культуры ткани для линий монослоя клеток, трансфекции родительских RBL-2H3.1 клеток с использованием плазмиды рЕЕ6, неся лошадиный ген FcεRIα (GenBank: Y18204.1) 28. Добавить мкл 2 мкг -1 плазмидной ДНК в 0,8 мл клеток при плотности 1,2 x10 7 клеток мл -1. Электропорации клетки при 250 В 960 мкФ с использованием 0,4 см electrocuvette затем сразу инкубировать на льду в течение 10 мин.
- Выберите трансформированных клеток с использованием средств массовой информации, содержащие 0,4 г сульфата генетицина G418, затем отсортировать оставшиеся живые клетки через FACS, помечая их флуоресцентным IgE антитела. Используйте полученную RBL-2H3.1 выражающее лошадей клеточной линии FcεRIα для расследования 2, 3.
- Предварительная проба антитела сенсибилизация:
- Урожай RBL-2H3.1 выражения лошадей FcεRIα клетки от сливной чашки Петри. Промыть затем повторно суспендирования клеток в культуральной среде до плотности клеток -1 5x10 5 клеток мл.
- Добавьте IgE интерес взвешенных клеток в конечной концентрации 1 нг мл -1, то пластина 100 мкл клеток на 96-луночный планшет в столбцах 1-6, и инкубируют при температуре 37 ° С ± 5% CO 2 + 90% относительной влажности в течение 16 ч. После инкубационного периода, и перед выполнением анализа высвобождения, проверить колодцы под микроскопом для а слияния и клеточной приверженности.
2) Анализ выпуска:
- Стиральная клетки:
- Буфер Теплый выпуск (25 мм труб, 120 мМ хлорида натрия, 5 мМ хлорида калия, 0,04 мМ хлорида магния и 1 мМ хлорида кальция) при 37 ° С, чтобы обеспечить осторожного промывания клеток.
- Вымойте клеток, щелкая пластину, чтобы удалить клеточную среду и добавлением 100 мкл теплой, 37 ° C, релиз буфер. Повторите два раза.
- Антигена:
- Приготовьте серийное разведение антигена (NIP-HSA или DNP-HSA) в 0 нг мл -1, 0,1 нг мл -1, 1 нг мл -1, 10 нг мл -1, 100 нг мл -1, 1000 нг мл -1, 10000 нг мл -1 в буфере выпуска и тепло при 37 ° С.
- После второй промывки клеток, отбросить носитель и заменяют 100 мкл антигена решений. Убедитесь, что скважины в той же строке (A1-6 например) имеют одинаковую концентрацию антигена добавленную к ним.
- Настройка негативного контроля в строке А, добавив 0 нг мл -1 антиген. Добавить возрастающую концентрацию антигена вниз по строкам (BG) с последующим Triton-X-буфера (5% Тритон Х-100) в строки H клеток, чтобы лизировать клетки, которые будут использоваться в качестве положительного контроля. Инкубируют при 37 ° С в течение 20 мин, чтобы позволить клетки, чтобы освободить ее медиаторы.
- Настройка отдельных элементов управления также:
- После инкубации передачи 50 мкл клеточного супернатанта к другой половине пластины (A1-6 скважин в скважинах A7-12 и т.д.). Отменить оставшиеся 50 мкл супернатанта и заменить с 50 мкл тритона-X буфера, чтобы позволить измерение количества выпущенных медиаторов в каждую лунку в колонках 7-12, как процент от общего объема медиаторов внутри клеток в колонке 1-6 ,
- Фермент субстрата:
- Добавить 50 мкл β-гексозаминидазы субстрата (50 мМ 4-нитрофенил N-ацетил-β-D-глюкозаминида подготовлен в ДМСО разбавляли до 2 мМ, добавляя его в цитратном буфере 0,2 М лимонной кислоты и 0,2 М ацетата натрия, рН 4,5) во все лунки, чтобы способствовало превращение субстрата в 4-нитрофенола в β-гексозаминидазы фермента. Инкубируйте пластин при 37 ° С в течение 2 часов.

- Завершение реакции:
- Остановить реакцию, добавив в 150 мкл трис-буфера (1 М Трис-HCl, рН 9) в каждую лунку в качестве высоких рН буфера останавливает реакцию и превращает 4-нитрофенол в желтый цвет.
- Чтение и анализ результатов:
- Read пластину с использованием планшет-спектрофотометре при длине волны 405 нм для измерения оптической плотности желтого цвета. Расчетное процентное содержание β-опубликованном гексозаминидазы, используя следующую формулу:
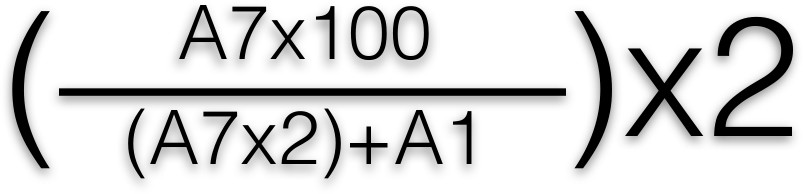
- Применить эту формулу в каждую лунку, после чего берется среднее значение для каждой строки. A1 и A7 представляют расположение скважин в 96-луночный планшет. Показать график процент β-гексозаминидазы выпуска (что соответствует общей выпуска медиатора) AgaiНСТ антиген концентрация 2, 3.
Результаты
Родительские RBL-2H3.1 клетки и те, трансфицируют с лошадиного гена рецептора FcεRIα были впервые сенсибилизированные мыши с IgE анти DNP-HSA и вызов с антигена DNP-HSA. Мышь IgE связывается с эндогенным рецептором крыс в обеих клеточных линий и, таким образом, действует в качестве контроля для провер?...
Обсуждение
В целом результаты этого исследования показали, что, когда RBL-2H3.1 клетки, экспрессирующие лошадей FcεRIα были осведомлены с лошади IgE и оспорены антигена, они дают пик высвобождения медиаторов из 36,68% ± 4,88% от общего количества медиатора внутри клетки, по сравнению с RBL-2H3.1 родительские клет?...
Раскрытие информации
The authors declare that they have no competing financial interests in this paper.
Благодарности
The authors thank Dr. Lynda Partridge for the provision of advice and laboratory facilities.
Материалы
| Name | Company | Catalog Number | Comments |
| RBL-2H3.1 Expressing Equine FcεRIα | - | - | Produced in the lab |
| Equine IgE anti NIP-HSA | - | - | Produced in the lab |
| 96 Well Plate | Sigma | CLS3595 | - |
| Multi Channel Pipette | Anachem | - | - |
| Incubator | Galaxy R | - | - |
| 4Hydroxy-5-iodo-3-nitrophenylacetic acid | Cambridge Research Biochemicals | N-1070-1 | NIP-OH was conjugated with Human Serum Albumin to make NIP-HSA in the lab |
| Dinitrophenyl Conjugated to Human Serum Albumin | Sigma | A6661 | Abbreviated DNP-HSA |
| Plate Spectrophotometer | Anthos Labtec HT2 | - | - |
| Pipes | Sigma | P1851 | - |
| Sodium Chloride | Sigma | S7653 | - |
| Potassium Chloride | Sigma | P9333 | - |
| Magnesium Chloride | Sigma | M2670 | - |
| Calcium Chloride | Sigma | C1016 | - |
| Triton x100 | Sigma | X100 | - |
| 4-nitrophenyl N-acetyl-β-D-glucosaminide | Sigma | N9376 | Stock solution called β-hexosaminidase substrate was 50mM prepared in DMSO |
| Dimethyl Sulfoxide | Sigma | D2650 | - |
| Citric Acid | Sigma | 251275 | - |
| Sodium Acetate | Sigma | S7670 | - |
| Tris | Sigma | T5941 | - |
Ссылки
- Taudou, G., et al. Expression of the Alpha Chain of Human FcεRI in Transfected Rat Basophilic Leukemia Cells: Functional Activation after Sensitization with Human Mite-Specific IgE. Int Arch Allergy Immunol. 100 (4), 344-350 (1993).
- Sabban, S. . Development of an in Vitro Model System for Studying the Interaction of EquuscaballusIgE with Its High-Affinity FcεRI Receptor. , (2011).
- Sabban, S., Ye, H., Helm, B. A. Development of an in Vitro Model System for Studying the Interaction of EquuscaballusIgE with Its High-Affinity Receptor FcεRI. Vet ImmunolImmunopathol. 153 (1-2), 6-10 (2013).
- Wilson, A. P. M., Pullar, C. E., Camp, A. M., Helm, B. A. Human IgE mediates stimulus secretion coupling in rat basophilic leukemia cells transfected with the a chain of the human high-affinity receptor. Eur J Immunol. 23, 240-244 (1993).
- Hunter, M. J., Vratimos, A. P., Housden, J. E. M., Helm, B. A. Generation of canine-human Fc IgE chimeric antibodies for the determination of the canine IgE domain of interaction with FcεRIα. MolImmunol. 45 (8), 2262-2268 (2008).
- Rashid, A., et al. Review: Diagnostic and therapeutic applications of rat basophilic leukemia cells. MolImmunol. 52 (3-4), 224-228 (2012).
- Cohen, S. G. Asthma in antiquity: the Ebers Papyrus. Allergy Proc. 13 (3), 147-154 (1992).
- Dudler, T., et al. A link between catalytic activity, IgE-independent mast cell activation, and allergenicity of bee venom phospholipase A2. J. Immunol. 155, 2605-2613 (1995).
- Machado, D. C., Horton, D., Harrop, R., Peachell, P. T., Helm, B. A. Potential allergens stimulate the release of mediators of the allergic response from cells of mast cell lineage in the absence of sensitization with antigen-specific IgE. Eur J Immunol. 26 (12), 2972-2980 (1996).
- Smyth, L. J., et al. Assessment of the molecular basis of pro-allergenic effects of cigarette smoke. Environ Sci Technol. 34 (7), 1370-1374 (2000).
- Okada, H., Kuhn, C., Feillet, H., Bach, J. F. The 'hygiene hypothesis' for autoimmune and allergic diseases: an update. ClinExpImmunol. 160 (1), 1-9 (2010).
- Eder, C., et al. Influence of environmental and genetic factors on allergen-specific immunoglobulin-E levels in sera from Lipizzan horses. Equine Vet J. 33 (7), 714-720 (2001).
- Cook, W. R., Rossdale, P. D. The syndrome of 'Broken Wind' in the horse. Proceedings of the Royal Society of Medicine. 56, 972-977 (1963).
- Eyre, P., Lewis, A. J. Acute systemic anaphylaxis in the horse. Br. J. Pharmacol. 48 (3), 426-437 (1973).
- Wagner, B. IgE in horses: occurrence in health and disease. Vet ImmunolImmunopathol. 132 (1), 21-23 (2009).
- Hellberg, W., et al. Equine insect bite hypersensitivity: immunoblot analysis of IgE and IgG subclass responses to Culicoidesnubeculosus salivary gland extract. Vet. Immunol. Immunopathol. 113 (1-2), 99-112 (2006).
- Schaffartzik, A., et al. Equine insect bite hypersensitivity: what do we know. Vet ImmunolImmunopathol. 147 (3-4), 113-126 (2012).
- Künzle, F., et al. IgE-bearing cells in bronchoalveolar lavage fluid and allergen-specific IgE levels in sera from RAO-affected horses. J Vet Med A PhysiolPatholClin Med. 54 (1), 40-47 (2007).
- Tahon, L., et al. In vitro allergy tests compared to intradermal testing in horses with recurrent airway obstruction. Vet ImmunolImmunopathol. (1-2), 85-93 (2009).
- Wagner, B., Radbruch, A., Rohwer, J., Leibold, W. Monoclonal anti-equine IgE antibodies with specificity for different epitopes on the immunoglobulin heavy chain of native IgE. Vet ImmunolImmunopathol. 92 (1-2), 45-60 (2003).
- Wilson, A. D., Harwood, L., Torsteinsdottir, S., Marti, E. Production of monoclonal antibodies specific for native equine IgE and their application to monitor total serum IgE responses in Icelandic and non-Icelandic horses with insect bite dermal hypersensitivity. Vet ImmunolImmunopathol. 112 (3-4), 156-170 (2006).
- McAleese, S. M., et al. Cloning and expression of the extra-cellular part of the alpha chain of the equine high-affinity IgE receptor and its use in the detection of IgE. Vet ImmunolImmunopathol. 110 (1-2), 187-191 (2006).
- Ledin, A., et al. Generation of therapeutic antibody responses against IgE in dogs, an animal species with exceptionally high plasma IgE levels. Vaccine. 24 (1), 66-74 (2006).
- Siraganian, R. P., Hook, W. A. Histamine release and assay methods for the study of human allergy. Manual of Clinical Immunology. , (1980).
- Neuberger, M. S., et al. A hapten-specific chimaericIgE antibody with human physiological effector function. Nature. 314 (6008), 268-270 (1985).
- Bingham, B. R., Monk, P. N., Helm, B. A. Defective Protein Phosphorylation and Ca2+ Mobilization in a low secreting variant of the rat basophilic leukemia cell line. The Journal of Biological Chemistry. 269 (30), 19300-19306 (1994).
- McAleese, S. M., Halliwell, R. E., Miller, H. R. Cloning and sequencing of the horse and sheep high-affinity IgE receptor alpha chain cDNA. Immunogenetics. 1 (51), 878-881 (2000).
- Hongtu, Y. Study of the structure/function relationship in canine and human IgE as the basis for the development of rational therapeutic intervention strategies in allergic disease. , (2010).
- Sabban, S., et al. Towards a pan-anti-allergy vaccine. JIBTVA. 2 (2), 15-27 (2013).
- Moran, G., Burgos, R., Araya, O., Folch, H. In vitro bioassay to detect reaginic antibodies from the serum of horses affected with recurrent airway obstruction. Vet Res Commun. 34, 91-99 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены