JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
개발
요약
The current study describes the development and applications of a genetically engineered assay system based on the transfection of rat basophilic leukemia cells with the equine FcεRIα gene. Transfected cells express a functional receptor where the release of mediators of the allergic response can be activated by IgE and antigen.
초록
The interaction of IgE with its high-affinity Fc receptor (FcεRI) followed by an antigenic challenge is the principal pathway in IgE mediated allergic reactions. As a consequence of the high affinity binding between IgE and FcεRI, along with the continuous production of IgE by B cells, allergies usually persist throughout life, with currently no permanent cure available. Horses, especially race horses, which are commonly inbred, are a species of mammals that are very prone to the development of hypersensitivity responses, which can seriously affect their performance. Physiological responses to allergic sensitization in horses mirror that observed in humans and dogs. In this paper we describe the development of an in situ assay system for the quantitative assessment of the release of mediators of the allergic response pertaining to the equine system. To this end, the gene encoding equine FcεRIα was transfected into and expressed onto the surface of parental Rat Basophil Leukemia (RBL-2H3.1) cells. The gene product of the transfected equine α-chain formed a functional receptor complex with the endogenous rat β- and γ-chains 1. The resultant assay system facilitated an assessment of the quantity of mediator secreted from equine FcεRIα transfected RBL-2H3.1 cells following sensitization with equine IgE and antigenic challenge using β-hexosaminidase release as a readout 2, 3. Mediator release peaked at 36.68% ± 4.88% at 100 ng ml-1 of antigen. This assay was modified from previous assays used to study human and canine allergic responses 4, 5. We have also shown that this type of assay system has multiple applications for the development of diagnostic tools and the safety assessment of potential therapeutic intervention strategies in allergic disease 6, 2, 3.
서문
알레르기는 천년 알려져있다. 천식 치료는 Ebers 파피루스 (~ 1550 BCE)로 알려진 고대 이집트 의료 텍스트에 설명하고 7을 치료하는 한약을 논의했다.
현재 알레르기는 T 헬퍼 세포 유형 2 (TH (2)) 면역계의 아암 알레르겐이라고 환경 항원에 반응하여 면역 글로불린 E (IgE의) 항체의 생산을 조향 타입 I의 과민 반응으로 분류된다. 이들은 일반적으로 면역계 세포와 상호 작용 된 IgE 합성을 담배 연기 또는 디젤 배기 미립자 입자 향상 않은로서 인터루킨 -4 및 인터루킨 13 (8, 9)을 포함하여 합성 및 염증성 사이토 카인의 분비를 자극하는 다양한 물질이다 10.
지난 50 년 동안 선진국에서 알레르기 증상의 상승의 효과의 조합에 기인 된'위생 가설'(11)에 의해 제안 된 TH 사이토 카인이 지배적 프로파일 향해 면역 반응을 전환하기 위해 결합 환경 오염 물질 및보다 위생적 환경 동향.
전술 한 바와 같이, 인간 알레르기 시달리다 만 포유류 아니다. 특히 말과 개는 클래식 알레르기 반응을 개발할 수 있고, 말 알레르기가 유전 적, 환경 적 요인에 기인 인간에로 (12)의 연구는 것을 보여 주었다. 결과적으로,이 동물은 한 번 임상 증상이에서 설정 한 알레르기의 유전 적, 환경 적 원인, 질병에 감작에서의 진행, 가능한 한 개입 전략 사이의 상호 작용 연구를위한 좋은 모델을 제시
1887 년, Stömmer는 말 심혈관 시스템 히스타민의 효과는 인간과 말, 천식 (13) 사이의 유사성을 설명하는 첫 번째 사람이었다인간 (14)의 그것과 매우 유사합니다. 말은 15 매년 115,000,000,000달러 미국의 도박 매출과 가치가 미국 720 억 달러 인 경마 산업의 초석이다.
대부분의 현대 경주마는 이후 1878에서 레이디 앤 블런트가 자란 아라비아 말의 적은 수의 자손입니다. 현대 경주마는 일반적으로 성능 능력에 대한 선택 근친된다. 이들은 알레르기 반응을 탑재 감수성 중 하나는 유전 질환,되기 쉽다. 또한 심지어 가장 심각한 알레르기 인간 (16)보다 1000 배 더 높은 혈청 IgE의 수준을 가지고있다. 말 알레르기 반응은 일반적으로 곤충 물린 과민 반응 (IBH) 17, 18로 나타나있다. 때문에 물기에 피부염에 IBH 결과가 속 Culicoides 곤충을 형성한다. 말 알레르기 질환의 또 다른 형태는 재발 성기도에 장애물 (RAO)이이 폐와기도에 명시되어 있습니다. 그것은 천명 및 실험실 특징OR 연산 호흡. RAO 일반적 포자를 성형하는 응답하여 발생하고, 다른 조사이 20를 확인되지 않았지만 높은 알레르겐 - 특이 IgE 수준 한 연구 19 RAO 앓고 말에 기록되었다.
말 알레르기에 대한 연구가 시도 모니터링에서 안티 말 IgE의 단클론 항체 (21, 22)을 개발하여 말 IgE의 중화 주위에 회귀. 또한 23 의한 연구 말 고친 화성 Fc 수용체의 α의 세포 외 도메인의 생성을 논의 말 혈청의 IgE를 감지하고 정량화하려는 시도에 체인 (FcεRIα) 수용체. Ledin (24)에 의해 관련 연구는 자기 / 비 자기 면역원을 사용하여 면역 체계를 프라이밍에 의해 혈청의 IgE를 중화하기위한 새로운 접근 방법에 대해 설명합니다. 이러한 모든 연구는, 그러나, 이들 프로토콜의 안전성과 효능을 테스트하기 위해 효과적인 분석 결여. 이 글에서, 우리는 지금 이러한 분석 SYS을 제시β-소사 미나을 출시, 세포 매개 탈과립의 지표로, 말 FcεRIα을 표현 RBL-2H3.1 세포에 평가 된 말 시스템, 관련 진단 및 치료 전략의 연구에 적용 TEM. 이 프로토콜은 다른 종으로부터 IgE에 대한 고친 화성 수용체의 IgE 결합 도메인을 코딩하는 유전자로 형질 RBL 세포 공학 기술하는 이전의 간행물 25, 4, 5, 2, 3에 기초한다. 이 프로토콜의 결과는 세중의 실험 표준 편차 평균 ±로 표시되는 β-소사 미나 자료 분석을 수행하는 방법에 대해 설명합니다.
자료 분석은 처음 Siraganian에 의해 개발과 인간의 알레르기를 연구하는 25 후크했다. 닥터 루벤 Siraganian 이끄는 실험 그룹은 RBL 세포주를 개발했다. 이러한 RBL 세포는 인간 FcεRIα을 표현하기 위해 개발되었고, 프로토콜은 (4)에 의해 출판되었다. 마지막 조각분석은 4- 히드 록시 3 합텐을 대상 IgE의 가변 영역에 대한 마우스 유전자의 하류 중쇄 유전자를 클로닝하여 IgE 항체의 생산을 설명 NEUBERGER (26)에 의해 종이 PSV 플라스미드의 개발과 함께의 니트로 - phenacetyl은 (NP), 결과 키메라 항체는 완벽하게 작동했다. 또한 호 염기성 세포의 탈과립을 측정하는 데 유용하게 분석 프로토콜의 표준화 결과 RBL 세포 표면 수용체를 클로닝하는 동안 능력은 동일한 합텐 타겟팅 임의의 IgE를 개발.
분석은 장점과 단점을 가지고있다. 분석의 장점은 우리 실험실 따라서 인간, 송곳니와 말 시스템의 탈과립을 테스트하는 데 사용되는 한 모든 포유류 시스템에서 사용되는 적응성이며,이 단순히 유기체의 IgE의 합성과 이의 수용체를 복제하여 달성 RBL 세포의 표면 상.
한편,분석의 단점 RBL 세포들이 동일한 분석 내에서 탈과립 레벨의 변화를 만들어주고, 열적, 기계적, PH 변화에 매우 민감하다는 것이다. 따라서 그것은 강하게 분석은 항상 3 회 반복 반복 한 후 평균 그들로부터 촬영하는 것이 좋습니다. 나아가, RBL 세포는 그들의 유지 관리를 복잡하게 연장 된 시간 (> 10 주) 27 조직 배양에 남아 있다면 비 방출 표현형을 향해 이동하는 경향이있다. 또한 광학 현미경에서 볼 수없는 셀의 형태를 변경하지 않는 마이코 플라스마 균에 의한 감염,하는 경향이 있지만, 크게 자신의 탈과립 수준을 변경합니다. 따라서 정기적 인 마이코 플라스마 시험이 필요하다.
프로토콜
세포주의 1) 준비 :
- 말 FcεRI α의 발현 RBL-2H3.1 세포주 개발 :
- 28 : 단층 세포 라인에 대한 기본 조직 배양 기술을 이용하여 말 FcεRIα 유전자 (GenBank 등록 Y18204.1)를 들고, pEE6 플라스미드를 사용하는 부모 RBL-2H3.1 세포를 형질. 1.2 X10 7 셀 ML -1의 밀도로 세포의 0.8 ml의 플라스미드 DNA의 2 μg의 μL -1을 추가합니다. 즉시 10 분 동안 얼음에서 인큐베이션 0.4 cm의 electrocuvette를 이용한 250 V 960 μF에서 세포 Electroporate.
- 네티의 G418 황산 0.4 g을 포함하는 미디어를 사용하여 형질 전환 된 세포를 선택한 다음, 형광 면역 글로불린 항체로 태그를 지정하여 FACS를 통해 남아있는 살아있는 세포를 정렬 할 수 있습니다. 수사 2, 3에 대해 말 FcεRIα 세포주를 발현 RBL-얻어진 2H3.1 사용.
- 사전 분석 항체 감작 :
- 수확 합류 페트리 접시에서 말 FcεRIα 세포 발현 RBL-2H3.1. 5 × 5 셀 ML의 -1의 세포 밀도로 배양 배지에 세포를 다시 중단 후 씻는다.
- 1 NG ml의 -1의 최종 농도로 일시 중단 된 세포에 관심 IgE에 추가 한 후 1-6 열에서 96 웰 플레이트에 세포를 100 μl를 판 37 ° C ~ + 5 % CO 2 + 90 % 부화 16 시간 동안 상대 습도. 배양 시간 후 및 박리 시험을 수행하기 전에, 잘 자랄 및 세포 부착에 대한 현미경 웰을 확인.
2) 자료 분석 :
- 세포를 세척 :
- 따뜻한 방출 완충액 37 ° C에서 (25 밀리미터 PIPES, 120 mM 염화나트륨, 5 mM 염화칼륨, 0.04 mM의 염화 마그네슘, 및 1mM의 염화칼슘)은 부드러운 셀 세정을 허용한다.
- 세포 용지를 제거하기 위해 판을 튕기 따뜻한 100 μl를 추가하여 3 세포를 씻으7 ° C를 방출 버퍼입니다. 두 번 반복합니다.
- 항원 과제 :
- 항원의 용액을 희석 0 NG ml의 -1, 0.1 NG ml의 -1, 1 NG ml의 -1, 10 NG ml의 -1, 100 NG ml의 -1 (NIP-HSA 또는 DNP-HSA), 1000 NG ml의 준비 -1, 10,000 NG 릴리스 버퍼 ml의 -1, 37 ° C에서 따뜻한.
- 두 번째 셀을 세척 한 후, 미디어를 무시하고 항원 용액 100 ㎕로 대체. 같은 행의 우물 (예를 들어 A1-6)이 그들에 추가 된 동일한 항원 농도가 있는지 확인하십시오.
- 0 NG ml의 -1 항원을 추가하여 행에서 음성 대조군을 설정합니다. 트리톤 X-완충액 (5 % 트리톤 X-100), 행 H 세포는 세포를 용해하는 다음 행 (BG) 아래로 증가하는 항원의 농도를 추가 양성 대조군으로 사용한다. 20 분 세포는 매개체를 해제 할 수 있도록, 37 ° C에서 배양하라.
- 개별 잘 컨트롤을 설정 :
- 배양 후, 플레이트의 나머지 절반 (A1-6 웰 웰 A7-12 행, 등)에 세포 상청액 50 μl를 옮긴다. 상청액의 나머지 50 μl를 버리고 컬럼 1-6 셀 내부 전체 매개체의 비율로 잘 컬럼 7-12의 각 매개체 방출의 양의 측정을 허용하도록 트리톤 X-완충액 50㎕의 교체 .
- 효소 기판 :
- β-소사 미나 기판 (50 mM의 4- 니트로 N 아세틸 β-D-글루코 시트르산 완충액, 0.2 M 시트르산 및 0.2 M 아세트산 나트륨을 첨가하여 2 mM의 아래로 희석 된 DMSO에서 제조하여 pH 4.5) 50 μl를 추가 모든 웰에 β-소사 미나 제 효소에 의해 4- 니트로 페놀에 대한 기판의 전환을 촉진한다. 2 시간 동안 37 ° C에서 번호판을 품어.

- 반응을 종료 :
- 각각 150 ㎕를 첨가 트리스 완충액 (1 M 트리스 -HCl, pH가 9)뿐만 아니라 버퍼의 높은 pH로 반응을 정지하여, 반응을 정지하고 황색로 -4- 니트로 페놀 변.
- 결과를 읽고 분석 :
- 노란 색의 흡광도를 측정하기 위해 405 nm에서 플레이트 분광 광도계를 사용하여 판을 읽어보십시오. 다음 식을 이용하여 풀어 β 헥 소사 미나 백분율 계산 값 :
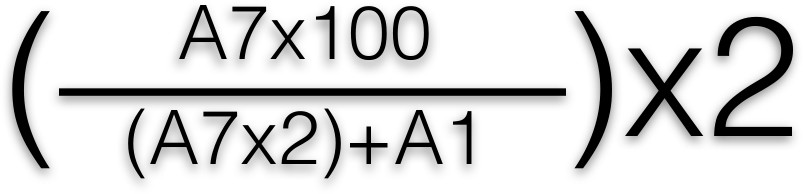
- 평균이 각 행에 대해 수행 된 후 각 웰에이 수식을 적용합니다. A1 및 A7은 96 웰 플레이트에서 웰의 위치를 나타낸다. 전압 강하 (총 중재자 릴리스에 해당) β-소사 미나 릴리스의 비율의 그래프를 그린다NST 항원 농도 (2, 3).
결과
부모 RBL-2H3.1 세포 및 말 FcεRIα 수용체 유전자로 형질들은 먼저 마우스의 IgE 항 DNP-HSA 감작과 DNP-HSA 항원으로 감염시켰다. 마우스 IgE의 양쪽 세포주에서 내인성 쥐 수용체에 결합하므로 매개체 (그림 1 A)를 풀어 두 세포주의 분리 가능성을 테스트하기 위해 대조군으로서 작용한다. 이 중요한 검사이며, 세포 배양에 확장 (> 10 주) 통과에 정기적으로 이후 수행되어야한다, RBL-2H3.1 세포...
토론
요약하면,이 조사 결과는 말 FcεRIα 발현 RBL-2H3.1 세포는 항원에 의해 말의 IgE로 감작 및 도전 될 때, 그들은 내부 매개체의 총량 4.88 % ± 36.68 %의 피크 매개체 방출을주는 것으로 나타났다 세포, RBL-2H3.1에 비해 부모의 세포가 말 FcεRIα을 표현하지.
따라서이 분석은 조사하고 체외에서 말 알레르기 반응을 연구하기위한 유용한 도구를 제공합니다. 그는 비만 세포 / ?...
공개
The authors declare that they have no competing financial interests in this paper.
감사의 말
The authors thank Dr. Lynda Partridge for the provision of advice and laboratory facilities.
자료
| Name | Company | Catalog Number | Comments |
| RBL-2H3.1 Expressing Equine FcεRIα | - | - | Produced in the lab |
| Equine IgE anti NIP-HSA | - | - | Produced in the lab |
| 96 Well Plate | Sigma | CLS3595 | - |
| Multi Channel Pipette | Anachem | - | - |
| Incubator | Galaxy R | - | - |
| 4Hydroxy-5-iodo-3-nitrophenylacetic acid | Cambridge Research Biochemicals | N-1070-1 | NIP-OH was conjugated with Human Serum Albumin to make NIP-HSA in the lab |
| Dinitrophenyl Conjugated to Human Serum Albumin | Sigma | A6661 | Abbreviated DNP-HSA |
| Plate Spectrophotometer | Anthos Labtec HT2 | - | - |
| Pipes | Sigma | P1851 | - |
| Sodium Chloride | Sigma | S7653 | - |
| Potassium Chloride | Sigma | P9333 | - |
| Magnesium Chloride | Sigma | M2670 | - |
| Calcium Chloride | Sigma | C1016 | - |
| Triton x100 | Sigma | X100 | - |
| 4-nitrophenyl N-acetyl-β-D-glucosaminide | Sigma | N9376 | Stock solution called β-hexosaminidase substrate was 50mM prepared in DMSO |
| Dimethyl Sulfoxide | Sigma | D2650 | - |
| Citric Acid | Sigma | 251275 | - |
| Sodium Acetate | Sigma | S7670 | - |
| Tris | Sigma | T5941 | - |
참고문헌
- Taudou, G., et al. Expression of the Alpha Chain of Human FcεRI in Transfected Rat Basophilic Leukemia Cells: Functional Activation after Sensitization with Human Mite-Specific IgE. Int Arch Allergy Immunol. 100 (4), 344-350 (1993).
- Sabban, S. . Development of an in Vitro Model System for Studying the Interaction of EquuscaballusIgE with Its High-Affinity FcεRI Receptor. , (2011).
- Sabban, S., Ye, H., Helm, B. A. Development of an in Vitro Model System for Studying the Interaction of EquuscaballusIgE with Its High-Affinity Receptor FcεRI. Vet ImmunolImmunopathol. 153 (1-2), 6-10 (2013).
- Wilson, A. P. M., Pullar, C. E., Camp, A. M., Helm, B. A. Human IgE mediates stimulus secretion coupling in rat basophilic leukemia cells transfected with the a chain of the human high-affinity receptor. Eur J Immunol. 23, 240-244 (1993).
- Hunter, M. J., Vratimos, A. P., Housden, J. E. M., Helm, B. A. Generation of canine-human Fc IgE chimeric antibodies for the determination of the canine IgE domain of interaction with FcεRIα. MolImmunol. 45 (8), 2262-2268 (2008).
- Rashid, A., et al. Review: Diagnostic and therapeutic applications of rat basophilic leukemia cells. MolImmunol. 52 (3-4), 224-228 (2012).
- Cohen, S. G. Asthma in antiquity: the Ebers Papyrus. Allergy Proc. 13 (3), 147-154 (1992).
- Dudler, T., et al. A link between catalytic activity, IgE-independent mast cell activation, and allergenicity of bee venom phospholipase A2. J. Immunol. 155, 2605-2613 (1995).
- Machado, D. C., Horton, D., Harrop, R., Peachell, P. T., Helm, B. A. Potential allergens stimulate the release of mediators of the allergic response from cells of mast cell lineage in the absence of sensitization with antigen-specific IgE. Eur J Immunol. 26 (12), 2972-2980 (1996).
- Smyth, L. J., et al. Assessment of the molecular basis of pro-allergenic effects of cigarette smoke. Environ Sci Technol. 34 (7), 1370-1374 (2000).
- Okada, H., Kuhn, C., Feillet, H., Bach, J. F. The 'hygiene hypothesis' for autoimmune and allergic diseases: an update. ClinExpImmunol. 160 (1), 1-9 (2010).
- Eder, C., et al. Influence of environmental and genetic factors on allergen-specific immunoglobulin-E levels in sera from Lipizzan horses. Equine Vet J. 33 (7), 714-720 (2001).
- Cook, W. R., Rossdale, P. D. The syndrome of 'Broken Wind' in the horse. Proceedings of the Royal Society of Medicine. 56, 972-977 (1963).
- Eyre, P., Lewis, A. J. Acute systemic anaphylaxis in the horse. Br. J. Pharmacol. 48 (3), 426-437 (1973).
- Wagner, B. IgE in horses: occurrence in health and disease. Vet ImmunolImmunopathol. 132 (1), 21-23 (2009).
- Hellberg, W., et al. Equine insect bite hypersensitivity: immunoblot analysis of IgE and IgG subclass responses to Culicoidesnubeculosus salivary gland extract. Vet. Immunol. Immunopathol. 113 (1-2), 99-112 (2006).
- Schaffartzik, A., et al. Equine insect bite hypersensitivity: what do we know. Vet ImmunolImmunopathol. 147 (3-4), 113-126 (2012).
- Künzle, F., et al. IgE-bearing cells in bronchoalveolar lavage fluid and allergen-specific IgE levels in sera from RAO-affected horses. J Vet Med A PhysiolPatholClin Med. 54 (1), 40-47 (2007).
- Tahon, L., et al. In vitro allergy tests compared to intradermal testing in horses with recurrent airway obstruction. Vet ImmunolImmunopathol. (1-2), 85-93 (2009).
- Wagner, B., Radbruch, A., Rohwer, J., Leibold, W. Monoclonal anti-equine IgE antibodies with specificity for different epitopes on the immunoglobulin heavy chain of native IgE. Vet ImmunolImmunopathol. 92 (1-2), 45-60 (2003).
- Wilson, A. D., Harwood, L., Torsteinsdottir, S., Marti, E. Production of monoclonal antibodies specific for native equine IgE and their application to monitor total serum IgE responses in Icelandic and non-Icelandic horses with insect bite dermal hypersensitivity. Vet ImmunolImmunopathol. 112 (3-4), 156-170 (2006).
- McAleese, S. M., et al. Cloning and expression of the extra-cellular part of the alpha chain of the equine high-affinity IgE receptor and its use in the detection of IgE. Vet ImmunolImmunopathol. 110 (1-2), 187-191 (2006).
- Ledin, A., et al. Generation of therapeutic antibody responses against IgE in dogs, an animal species with exceptionally high plasma IgE levels. Vaccine. 24 (1), 66-74 (2006).
- Siraganian, R. P., Hook, W. A. Histamine release and assay methods for the study of human allergy. Manual of Clinical Immunology. , (1980).
- Neuberger, M. S., et al. A hapten-specific chimaericIgE antibody with human physiological effector function. Nature. 314 (6008), 268-270 (1985).
- Bingham, B. R., Monk, P. N., Helm, B. A. Defective Protein Phosphorylation and Ca2+ Mobilization in a low secreting variant of the rat basophilic leukemia cell line. The Journal of Biological Chemistry. 269 (30), 19300-19306 (1994).
- McAleese, S. M., Halliwell, R. E., Miller, H. R. Cloning and sequencing of the horse and sheep high-affinity IgE receptor alpha chain cDNA. Immunogenetics. 1 (51), 878-881 (2000).
- Hongtu, Y. Study of the structure/function relationship in canine and human IgE as the basis for the development of rational therapeutic intervention strategies in allergic disease. , (2010).
- Sabban, S., et al. Towards a pan-anti-allergy vaccine. JIBTVA. 2 (2), 15-27 (2013).
- Moran, G., Burgos, R., Araya, O., Folch, H. In vitro bioassay to detect reaginic antibodies from the serum of horses affected with recurrent airway obstruction. Vet Res Commun. 34, 91-99 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유