Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kinematische Analyse der Zellteilung und Expansion: Die Quantifizierung der zellulären Grundlagen der Wachstums- und Sampling Entwicklungszonen in
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Quantifying cell division and expansion is of crucial importance to the understanding of whole-plant growth. Here, we present a protocol to calculate cellular parameters determining maize leaf growth rates and highlight the use of these data for investigating molecular growth regulatory mechanisms by directing developmental stage-specific sampling strategies.
Zusammenfassung
Growth analyses are often used in plant science to investigate contrasting genotypes and the effect of environmental conditions. The cellular aspect of these analyses is of crucial importance, because growth is driven by cell division and cell elongation. Kinematic analysis represents a methodology to quantify these two processes. Moreover, this technique is easy to use in non-specialized laboratories. Here, we present a protocol for performing a kinematic analysis in monocotyledonous maize (Zea mays) leaves. Two aspects are presented: (1) the quantification of cell division and expansion parameters, and (2) the determination of the location of the developmental zones. This could serve as a basis for sampling design and/or could be useful for data interpretation of biochemical and molecular measurements with high spatial resolution in the leaf growth zone. The growth zone of maize leaves is harvested during steady-state growth. Individual leaves are used for meristem length determination using a DAPI stain and cell-length profiles using DIC microscopy. The protocol is suited for emerged monocotyledonous leaves harvested during steady-state growth, with growth zones spanning at least several centimeters. To improve the understanding of plant growth regulation, data on growth and molecular studies must be combined. Therefore, an important advantage of kinematic analysis is the possibility to correlate changes at the molecular level to well-defined stages of cellular development. Furthermore, it allows for a more focused sampling of specified developmental stages, which is useful in case of limited budget or time.
Einleitung
Wachstumsanalyse hängt von einer Reihe von Werkzeugen, die von Pflanzenwissenschaftler häufig verwendet werden, Genotyp bestimmt Wachstumsunterschiede und / oder phänotypische Reaktionen auf Umweltfaktoren zu beschreiben. Dazu gehören Größe und Gewichtsmessungen der gesamten Anlage oder ein Organ und Berechnungen der Wachstumsraten, die zugrunde liegenden Mechanismen des Wachstums zu erkunden. Organwachstum wird durch Zellteilung und Expansion auf der zellulären Ebene bestimmt. Daher analysiert die Quantifizierung dieser beiden Prozesse in Wachstum einschließlich ist der Schlüssel zum Verständnis der Unterschiede in Vollorganwachstum 1. Folglich ist es wichtig, eine geeignete Methodik haben zellulären Wachstumsparameter zu bestimmen, der relativ leicht von nicht spezialisierten Labors zu verwenden.
Kinematic Analyse wurde bereits als Ansatz etabliert 2 einen leistungsstarken Rahmen für die Entwicklung von Organwachstumsmodelle bieten. Die Technik wurde für lineare Systeme optimiert,wie Arabidopsis thaliana Wurzeln und monokotyle Blätter, sondern auch für nichtlineare Systeme, wie dikotyle Blätter 3. Heute wird diese Methode immer mehr, wie genetische Studie verwendet wird, hormonelle, entwicklungs und Umweltfaktoren beeinflussen die Zellteilung und die Expansion in verschiedenen Organen (Tabelle 1). Darüber hinaus bietet sie auch einen Rahmen zelluläre Prozesse auf die ihnen zugrunde liegenden biochemischen, molekularen und physiologischen Bestimmungen (Tabelle 2) zu verbinden, obwohl Einschränkungen können durch Organgröße und räumliche Organisation für Techniken , die höhere Mengen an Pflanzenmaterial erfordern auferlegt werden (zB Metaboliten Messungen, Proteomics, etc.).
Monokotylen Blätter, wie beispielsweise Mais (Zea mays) Blatt-, für lineare Systeme , in denen Zellen von der Basis des Blattes gegen die Spitze zu bewegen, der Reihe nach durch die Meristem und Dehnungszone Leiten des reifen zu erreichenZone. Dies macht es zu einem idealen Modellsystem für quantitative Untersuchungen der räumlichen Muster des Wachstums 4. Darüber hinaus haben Maisblätter große Wachstumszonen (Meristem und Dehnungszone über mehrere Zentimeter 5) und in anderen Organisationsebenen Möglichkeiten für Studien. Dies ermöglicht die Untersuchung der (vermeintlichen) Regulationsmechanismen der Zellteilung steuern und Expansion, durch kinematische Analyse durch eine Reihe von molekularen Techniken quantifiziert, physiologische Messungen und Zellbiologie Ansätze (Tabelle 2).
Hier stellen wir ein Protokoll für eine kinematische Analyse in monokotylen Blätter durchführt. Zuerst wird erklärt, wie eine richtige Analyse der sowohl die Zellteilung und Zell Dehnung als Funktion der Position längs der Blattachse zu leiten und wie kinematischen Parameter zu berechnen. Zweitens zeigen wir auch, wie diese als Grundlage für die Stichprobenplan verwendet werden können. Hier diskutieren wir zwei Fälle: hochauflösende Abtastung eind konzentriert Probenahme, verbesserte Dateninterpretation und die Einsparung von Zeit / Geld ermöglicht, respectively.
Tabelle 1 Übersicht der kinematischen Analysen Methoden zur Quantifizierung der Zellteilung und Expansion in verschiedenen Organen.
| Organ | Referenz |
| monokotylen Blätter | 16, 20, 21, 22 |
| Wurzelspitzen | 2, 23, 24, 25, 26, 27, 28, 29 |
| dikotylen Blätter | 21, 30, 31 |
| Sprossapikalmeristem | 32 |
Tabelle 1 Übersicht der kinematischen Analysen Methoden zur Quantifizierung der Zellteilung und Expansion in verschiedenen Organen.
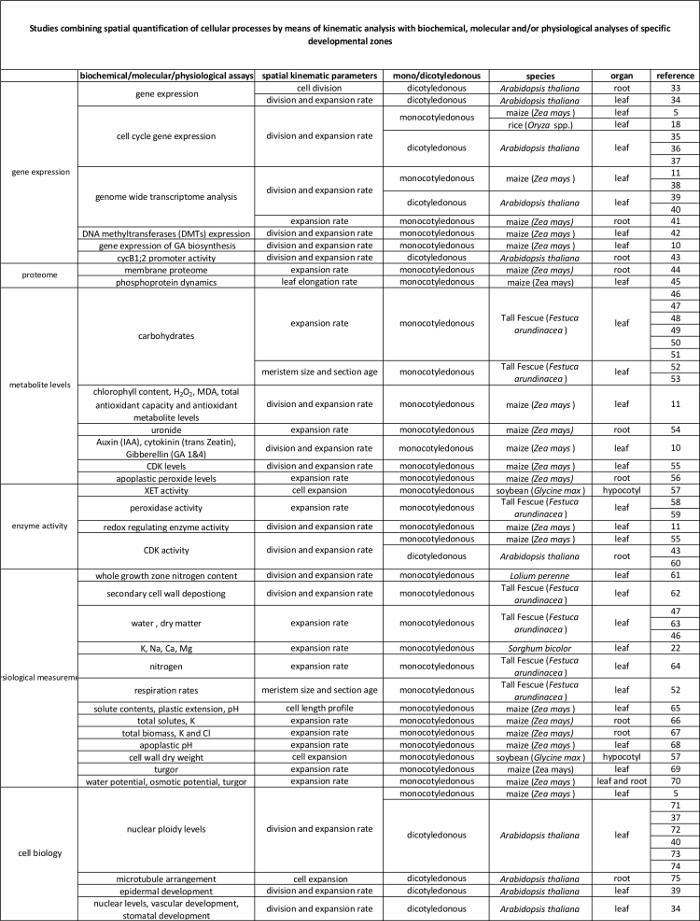
Tabelle 2 Zusammenhang zwischen zellulärer Prozesse quantifiziert durch die kinematische Analyse auf ihre Regulation auf molekularer Ebene. Verweise auf verschiedene Studien , die die Quantifizierung von zellulären Prozessen zu den Ergebnissen von biochemischen und molekularen Assays in verschiedenen Spezies und Organen. Xyloglucan endotransglucosylase (XET), Malondialdehyd (MDA), Cyclin-abhängigen Kinasen (CDK). Bitte hier klicken , um eine größere Version dieser Tabelle anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
HINWEIS: Das folgende Protokoll für kinematische Analyse gilt nur für Blätter im stationären Zustand Wachstum. Dies impliziert eine stabile Blattdehnungsrate und räumlichen Muster der Zellenlänge und Expansion in einem Blatt während eines Zeitraums von mehreren Tagen 6.
1. Pflanzenwachstum und die Messungen der Blattdehnungsrate (LER)
- Wählen Sie ein Blatt im Steady-State-Wachstum und eine Entwicklungsphase von Interesse.
HINWEIS: Es gibt einen Unterschied zwischen Steady-State-Wachstum und repetitive Wachstum, das auf aufeinanderfolgenden Blättern auf der gleichen Achse ähnliche räumliche Muster impliziert. Während der frühen Stadien der Sämlingwachstum wachsen sukzessive Blätter typischerweise immer schneller durch die zunehmende Größe der Wachstumszone 7. Obwohl einige höhere Blattpositionen ein ähnliches Wachstumsmuster 8 haben kann, ist dies eine Übergangsphase , die durch Behandlungen zu untersuch beeinträchtigt werden kann. Es ist daher wichtig zu vergleichen Linien und tr eatments streng auf der gleichen Blattposition, auch wenn es zu einer anderen Zeit entwickeln kann. Selbst bei einer konstanten Dehnungsrate, ist die Wachstumsrate Profil nicht notwendigerweise gleich in verschiedenen Entwicklungsstadien. Daher ist es wichtig , Blätter an der gleichen Entwicklungsstufe 8 zu analysieren, in der Regel durch die Anzahl der Tage nach dem Auflaufen definiert. - Um eine vollständige kinematische Analyse des Blattwachstums in Monokotyledonen zuführen, wachsen mindestens 15 Pflanzen für jede Behandlung und Genotyp unter kontrollierten Bedingungen in einem Wachstumsraum.
- Zu der Zeit , das Blatt von Interesse erscheint (Austritt aus dem Quirl der umliegenden Blätter), starten Sie die Länge der Blattmess täglich mit einem Lineal , bis das Blatt vollständig erweitert ist (Abbildung 1 i). Blattlänge bedeutet die Länge vom Bodenniveau bis zur Spitze des Blattes. Achten Sie darauf, das Blatt zu brechen oder beschädigt werden, da dies möglicherweise sein Wachstum zu verändern.
re 1 "src =" / files / ftp_upload / 54887 / 54887fig1.jpg "/>
Abb . 1: Schematische Darstellung einer kinematischen Analyse von Maisblättern Das Blatt von Interesse wird mit einem Lineal gemessen an drei aufeinanderfolgenden Tagen das Blatt Dehnungsrate (LER) zu berechnen. Danach wird das Blatt geerntet und drei Zentimeter Segment für die Bestimmung der Meristem-Größe verwendet. Dies wird durch Messen der Länge von der Basis bis zu dem distalsten mitotische Figur nach DAPI-Färbung durchgeführt. (A) Beispiele für proliferative Mitosen und (B) gestaltende Mitosen. Die ersten elf Zentimeter von der Blattunterseite auf der anderen Seite der Mitte Vene verwendet 1001 Zentimeter Segmente für die Zelllängenmessungen zu schneiden. Diese Messungen bilden die Grundlage für die Erstellung der Zellenlänge Profil, das die reife Zelllänge (l mat) und die Länge der Zellen , so dass die Meristem (l div) zu bestimmen dient. Das LER und l Matte verwendet , um die Zellproduktionsrate (P) zu berechnen, während l div und L mer verwendet , um die Anzahl der Zellen im Meristem (N - mer) zu berechnen. Wiederum P und N mer verwendet , um die durchschnittliche Zellenteilungsrate (D) zu berechnen, die die Umkehrung der Zellzyklusdauer (T c). Pfeile in der gleichen Farbe zeigen Parameter, die die Parameter folgende auf diese Pfeile werden verwendet, um zu berechnen. Maßstabsbalken = 40 um. Römische Zahlen werden verwendet , um bestimmte experimentelle Verfahren in der beschriebenen Protokoll zu beziehen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
2. Ernte
- In der Entwicklungsphase von Interesse (zB, am dritten Tag nach dem Schlüpfen), wählen Sie mindestens fünf Vertreter pMittelführerinnen aus dem Ansatz, auf dem die kinematische Analyse durchzuführen. Wodurch der Rest der Pflanzen messen, wie in Schritt 1.3 erläutert die endgültige Blattlänge zu bestimmen.
- Schneiden Sie das oberirdische Teil der Pflanze. Damit die meristematic Teil intakt, schneiden Sie so nah wie möglich an die Wurzeln (Abbildung 1II).
- Ausgehend von den äußeren Blättern, entfernen Sie alle Blätter auf dem Blatt von Interesse, indem sie sanft eins nach dem anderen Abrollen. Entfernen Sie ggf. ein paar zusätzliche Millimeter von der Basis, um die Blätter zu lösen. Entfernen Sie auch die Spitze und kleine Blätter durch die Blatt von Interesse (Abbildung 1III) eingeschlossen.
- Schneiden Sie ein 3 cm-Segment, von der Basis auf einer Seite der mittleren Ader beginnen, und bewahren Sie sie in einem 1,5 ml-Röhrchen mit 3 gefüllt: 1 (v: v) absolutem Ethanol: Essigsäure-Lösung (ACHTUNG: Handschuhe tragen) bei 4 ° C für 24 Stunden bis zu mehreren Monaten (Abb 1IV). Dieses Segment wird später verwendet werden, um die Länge des Meristem zu bestimmen.
- Von demandere Seite der Vene, ein 11 cm - Segment von der Basis (1 v) geschnitten und in einem 15 ml Röhrchen mit absolutem Ethanol bei 4 ° C für mindestens 6 h gefüllten Pigmente (1 vi) zu entfernen.
HINWEIS: Später, wenn Sie nur die ersten 10 cm der Zellenlänge Profil (siehe Diskussion) zu bestimmen. - Erneuern Sie die absolute Ethanol für eine weitere Runde von mindestens 24 Stunden bei 4 ° C Reinigung (Abbildung 1vi).
- Schließlich ersetzen die absolute Ethanol mit reinem Milchsäure (ACHTUNG: Handschuhe tragen) für die Reinigung und Lagerung bei 4 ° C für 24 Stunden oder bis zur weiteren Verwendung (Abbildung 1vi).
3. Meristem Längenmessungen
- Bereiten Sie eine Spülung Puffer, der 50 mM Natriumchlorid (NaCl), 5 mM Ethylendiamintetraessigsäure (EDTA; ACHTUNG: Handschuhe tragen) und 10 mM Tris (hydroxymethyl) aminomethan-Salzsäure (TRIS-HCl, pH 7).
- Nehmen Sie die 3 cm Segment aus dem Abschnitt 2.4 und soak es in dem Puffer für 20 min (Abbildung 1vii).
- Während des Wartens, verwenden Sie den Spülpuffer ein 4 ', 6-diamidino-2-phenylindole (DAPI) Färbelösung von 1 ug / ml herzustellen, es auf Eis und im Dunkeln zu halten.
- Stain die Kerne durch das meristem Segment für 2-5 min in der DAPI-Färbelösung platzieren. Die Arbeiten auf dem Eis und in der Dunkelheit (Abbildung 1vii).
- Prüfen Sie, ob Fluoreszenzsignal durch schnell das Segment auf einem Mikroskopie Glasmontage und Abdecken mit einem Deckglas. Die epidermalen Zellen sollten Fluoreszenz zeigen, während die zugrunde liegenden Zellschichten sollten nicht.
- Wenn die Färbung nicht ausreichend ist, legte das Segment wieder in den DAPI-Färbung Lösung für einige zusätzliche Minuten.
- Um die Färbung zu stoppen, montieren Sie die Segmente in einem Tropfen Pufferspülung auf einer Mikroskopie Objektträger und Deck mit einem Deckglas.
- Verwenden Sie ein Mikroskop mit UV-Fluoreszenz bei einer 20-facher Vergrößerung ausgestattet, so dass für die Visualisierung von rund 1.000 epidermal-Zellen auf einmal. Blättern Sie im gesamten Segment und sucht proliferative Mitosefiguren (Metaphase, Anaphase, Telophase und Zytokinese), aber vermeiden prägenden Zellteilung der Entwicklung Stomata (Abbildung 1viii) 9. Definieren Sie, wo die am weitesten distal gelegene Mitose befindet.
- Bestimmen die Länge des Meristem durch den Abstand zwischen der Basis des Blattes gemessen wird und die distalste epidermal mitotische Figur. Verwenden Sie eine Bildanalyse - Software (zB ImageJ) über die volle Länge des Bildrahmens zu messen.
- Zählen Sie die Anzahl der Bilder , die die volle meristem Länge (von der Blattbasis zu dem am weitesten entfernten Mitose) und multiplizieren Sie diese Zahl durch die Länge eines Rahmens decken die gesamte meristem Länge (Abbildung 1ix) zu erhalten.
4. Zell Länge Profil
- Nehmen Sie das Segment, das in Milchsäure (Schritt 2.5) und vorsichtig auf der Bank gespeichert. Schneiden Sie die Segmente Witzha Skalpell in 10 Segmente von 1 cm jeweils (Abbildung 1x).
- Montieren der aufeinanderfolgenden Blattsegmente auf einem Mikroskopie Schieber in einem kleinen Tropfen Milchsäure. Stellen Sie sicher, konsequent auf einen Blick auf die adaxial oder abaxial Seite nach oben. Im Prinzip gibt es keine Präferenz für eine bestimmte Seite.
- Verwenden Sie ein Mikroskop mit differentiellen Interferenzkontrast (DIC) Optik ausgestattet, um die Segmente zu analysieren, von der Blattbasis beginnen. Messung mit einer Bildanalysesoftware, die Länge von mindestens 20 replicate Epidermiszellen in Dateien unmittelbar neben der Stomata Dateien, um konsequent die gleichen Zelltyp auszuwählen.
- Tun Sie dies in gleich beabstandeten Positionen entlang jedes der Segmente (4 Positionen pro Segment ausreichend), und stellen Sie sicher , die entsprechende Position für jede Messung im gesamten Blatt (Abbildung 1 xi) zu notieren.
- Bestimmen Sie die mittlere Zellenlänge an jedem mm entlang der Blattachse durch eine lokale Polynom Glättung p mitERFAHREN, implementiert in einem R-Skript (Abbildung 1xii; Ergänzende Datei 1).
HINWEIS: Die R-Skript stellt eine Reihe von Daten mit Glättung erhöht. Die erforderliche Menge der Glättung ist etwas willkürlich und sollte idealerweise nur das lokale Rauschen zu entfernen, aber nicht die gesamte Kurve beeinflussen. Sicherstellen, dass die gleiche Menge an Glättung für alle Proben in einem Experiment zu verwenden. - Der Mittelwert der Zellenlänge an jeder Position zwischen den Pflanzen und berechnen Sie die Standardfehler eine Zellenlänge Profil entlang der Blattachse zu schaffen.
5. Die Berechnung der kinematischen Parameter (siehe Zusatz Datei 2)
- Berechne die LER , indem die Änderung in der Blattlänge zwischen zwei aufeinanderfolgenden Zeitpunkten nehmen (beispielsweise 24 Stunden, wie in Schritt 1.3) , und es durch das Zeitintervall dividiert wird .
- Berechnen der Länge der Wachstumszone (L gz) entsprechend der Position distal von der Basis , wo Zellen 95% ihrer reifen ce erreichenll Länge auf der Zelllängenprofil geglättet.
- Nehmen Sie für jede Position auf der geglättete Zellenlänge Profil 95% des Durchschnitts aller Zellenlängen nach dieser Position (Abbildung 2).
- Vergleichen Sie die geglättete Zellenlängen (Schritt 4.4) mit der berechneten 95% Zelllänge in jeder Position. Ausgehend von der Basis des Blattes endet die Wachstumszone an der Position , wo die tatsächliche Zellenlänge entspricht 95% der folgenden Zelllängen (2; siehe Zusatz Data 2).
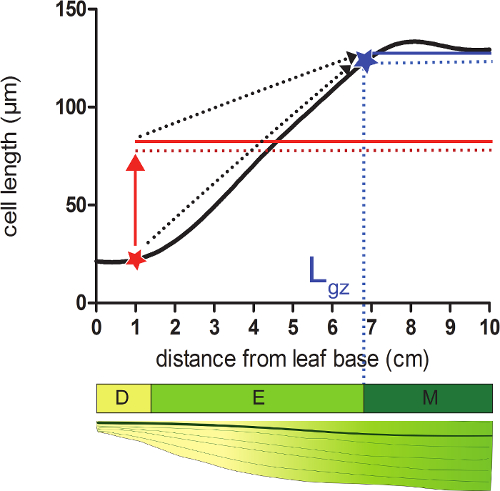
Abbildung 2:. Die Bestimmung des Endes der Wachstumszone Meristem: An der Stelle , mit einem roten Stern angegeben, ist die tatsächliche Zellengröße von weniger als 95% (rot gestrichelte Linie) der durchschnittlichen Zellgröße aller in dieser Position folgende Zellen (rot solide Linie). Das Ende der Wachstumszone (L gz, angegeben mit ablue Sterne) liegt dort, wo 95% (gestrichelte blaue Linie) der durchschnittliche Zellgröße aller Zellen im Anschluss an diese Position (durchgezogene blaue Linie) ist gleich der tatsächlichen Zellgröße. Abteilung Zone (D), Dehnungszone (E) und reifen Zone (M). Eine gestrichelte Pfeile , um die Konvergenz zwischen der lokalen Größe und 95% der mittleren Größe über den distalen Teil des Blattes zeigen , wenn sie von den basalen Positionen an der Spitze des Blattes bewegt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Berechnen der Länge der Dehnungszone (L EL) als die Differenz zwischen der Länge der Wachstumszone (L gz) und Meristem Größe (L mer; bestimmt in Schritt 3).
- Berechnen Sie die reifen Zelllänge (l mat) als auch die durchschnittliche Zellenlänge in der reifen Zone.
- Teilen Sie die LER von l Matte zu erhalten , dieZellproduktionsrate (P).
- Berechnen der Anzahl von Zellen in der Dehnungszone (N el) als die Differenz zwischen N und N gz mer. Die Anzahl der Zellen in dem Meristem (N mer) gleich der Gesamtzahl der in den Intervallen zu Meristem entsprechenden befindlichen Zellen. Die Anzahl der Zellen in der Wachstumszone (N gz) gleich der Gesamtzahl der in den Intervallen zu der Wachstumszone entsprechenden befindlichen Zellen.
- Berechnen Sie die durchschnittliche Zellteilungsrate (D) als P / N mer. Die Zellzyklusdauer (T c) ist gleich ln (2) / D.
- Berechnen Sie die Zeit in der Dehnungszone (T el) durch Teilen N el durch P. Die Zeit , in der Teilungszone gleich log 2 (N - mer) * T c. Die Länge der Zellen Verlassen des meristem (l div)gleich der Zelle aus dem geglätteten Zellenlänge Profil am Ende der Meristem Länge.
- Berechnen Sie die durchschnittliche Zellexpansionsrate (R el) unter Verwendung folgender Formel: ln (l Matte) -ln (l div)] / T el.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Hier zeigen wir einen Vergleich zwischen gut bewässerten Pflanzen (Kontrolle, 54% Wassergehalt des Bodens, (SWC)) und Pflanzen ausgesetzt Dürre Stressbedingungen (Dürre, 34% SWC) in Bezug auf ihre Blattwachstum. Alle Pflanzen wurden in einer Wachstumskammer unter kontrollierten Bedingungen (16 Stunden Tag / 8 h Nacht, 25 ° C / 18 ° C Tag / Nacht, 300-400 & mgr; Em gewachsen -2 s -1 photosynthetisch aktive Strahlung (PAR). Die Trockenheit bis die richtige SW...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Eine vollständige kinematische Analyse auf Maisblättern ermöglicht die Bestimmung der zellulären Basis des Blattwachstums und ermöglicht die Gestaltung effizienter Probenahmestrategien. Obwohl das Protokoll relativ einfach ist, ist eine gewisse Vorsicht in den folgenden kritischen Schritte empfohlen: (1) Es ist wichtig, die jüngeren, geschlossenen Blätter zu lösen (2.3 Schritt), ohne die meristem zu beschädigen, da meristem Längenbestimmung (Schritt 3) erfordert die vollständige meristem vorhanden sein. Einig...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde durch ein Promotionsstipendium an der Universität von Antwerpen nach VA unterstützt; ein Promotionsstipendium der flämischen Science Foundation (FWO, 11ZI916N) zu KS; Projektzuschüsse von der FWO (G0D0514N); eine konzertierte Forschungstätigkeit (GOA) Forschungsstipendium: "Ein systembiologischer Ansatz der Blatt Morphogenese" von der Forschungsgemeinschaft der Universität Antwerpen; und das Interuniversitäre Anziehungsschwerpunkte (IUAP VII / 29, MARS), "Mais und Arabidopsis Wurzel und Sprosswachstum" von der Föderale Wissenschaftspolitik (BELSPO) zu GTSB Han Asard, Bulelani L. Sizani und Hamada Abdelgawad alle zum Video beigetragen .
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Pots | Any | Any | We use pots with the following measures, but can be different depending on the treatment/study: bottom diameter: 11 cm, opening diameter: 15 cm, height: 12 cm. We grow one maize plant per pot. |
| Planting substrate | Any | Any | We use potting medium (Jiffy, The Netherlands), but other substrates can be used, depending on treatment/study. |
| Ruler | Any | Any | An extension ruler that covers at least 1.5 meters is needed to measure the final leaf length of the plants. |
| Seeds | Any | NA | Seeds can be ordered from a breeder. |
| Scalpel | Any | Any | The scalpel is used during leaf harvesting to detach the leaf of interest from its surrounding leaves and right after harvesting to cut a proper sample for cell length and meristem length measurements. |
| 15 mL falcon tubes | Any | Any | The 15 mL falcon tubes are used for storing samples used for cell length measurements during sample clearing with absolute ethanol and lactic acid. |
| Eppendorf tubes | Any | Any | The eppendorf tubes are used for storing samples used for meristem length measurements in ethanol:acetic acid 3:1 (v:v) solution. |
| Gloves | Any | Any | Latex gloves, which protect against corrosive reagents. |
| Acetic acid | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1; Flammable liquids, categories 1,2,3 |
| Absolute ethanol | Any | Any | CAUTION: Hazardous in case of skin contact (irritant), of eye contact (irritant), of inhalation. Slightly hazardous in case of skin contact (permeator), of ingestion |
| Lactic acid >98% | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1 |
| Sodium chloride (NaCl) | Any | Any | |
| Ethylenediaminetetraacetic acid (EDTA) | Any | Any | CAUTION: Acute toxicity (oral, dermal, inhalation), category 4 Skin irritation, category 2 Eye irritation, category 2 Skin sensitisation, category 1 Specific Target Organ Toxicity – Single exposure, category 3 |
| Tris(hydroxymethyl)aminomethane hydrochloride (Tris-HCl) | Any | Any | This material can be an irritant, contact with eyes and skin should be avoided. Inhalation of dust may be irritating to the respiratory tract. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Any | Any | Cell permeable fluorescent minor groove-binding probe for DNA. Causes skin irritation. May cause an allergic skin reaction. May cause respiratory irritation. |
| Ice | Any | NA | The DAPI solution has to be kept on ice. |
| Fluorescent microscope | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any fluorescent microscope can be used for determining meristem length. | |
| Microscopic slide | Any | Any | |
| Cover glass | Any | Any | |
| Tweezers | Any | Any | Tweezers are needed for unfolding the rolled maize leaf right after harvesting in order to cut a proper sample for cell length and meristem length measurements. |
| Image-analysis software | Axiovision (Release 4.8) from Zeiss | NA | The software can be downloaded at: http://www.zeiss.com/microscopy/en_de/downloads/axiovision.html. Other softwares such as ImageJ (https://imagej.nih.gov/ij/) could be used as well. |
| Microscope equipped with DIC | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any microscope, equipped with differential interference contrast (DIC) can be used to measure cell lengths. | |
| R statistical analysis software | R Foundation for Statistical Computing | NA | Open source; Could be downloaded at https://www.r-project.org/ |
| R script | NA | NA | We use the kernel smoothing function locpoly of the Kern Smooth package (Wand MP, Jones MC. Kernel Smoothing: Chapman & Hall/CRC (1995)). The script is available for Mac and Windows upon inquiry with the corresponding author. |
Referenzen
- Fiorani, F., Beemster, G. T. S. Quantitative analyses of cell division in plants. Plant Mol. Biol. 60, 963-979 (2006).
- Silk, W. K., Erickson, R. O. Kinematics of Plant-Growth. J. Theor. Biol. 76, 481-501 (1979).
- Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S. Kinematic Analysis of Cell Division and Expansion. Plant Developmental Biology. Hennig, L., Köhler, C. , Chapter 14 (2010).
- Avramova, V., Sprangers, K., Beemster, G. T. S. The Maize Leaf: Another Perspective on Growth Regulation. Trends Plant Sci. 20, 787-797 (2015).
- Rymen, B., et al. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol. 143, 1429-1438 (2007).
- Muller, B., Reymond, M., Tardieu, F. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot. 52, 1259-1268 (2001).
- Beemster, G. T. S., Masle, J., Williamson, R. E., Farquhar, G. D. Effects of soil resistance to root penetration on leaf expansion in wheat (Triticum aestivum L): Kinematic analysis of leaf elongation. J. Exp. Bot. 47, 1663-1678 (1996).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Spatial and Temporal Aspects of Leaf Growth-Inhibition. Planta. 191, 433-439 (1993).
- Sylvester, A. W., Smith, L. G. Cell Biology of Maize Leaf Development. Handbook of maize: It's Biology. Bennetzen, J. L., Hake, S. C. , Springer. NY. (2009).
- Nelissen, H., et al. A Local Maximum in Gibberellin Levels Regulates Maize Leaf Growth by Spatial Control of Cell Division. Curr. Biol. 22, 1183-1187 (2012).
- Avramova, V., et al. Drought Induces Distinct Growth Response, Protection, and Recovery Mechanisms in the Maize Leaf Growth Zone. Plant Physiol. 169, 1382-1396 (2015).
- Picaud, J. C., et al. Total malondialdehyde (MDA) concentrations as a marker of lipid peroxidation in all-in-one parenteral nutrition admixtures (APA) used in newborn infants. Pediatr. Res. 53, 406(2003).
- Basu, P., Pal, A., Lynch, J. P., Brown, K. M. A novel image-analysis technique for kinematic study of growth and curvature. Plant Physiol. 145, 305-316 (2007).
- Vander Weele, C. M., et al. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132, 1138-1148 (2003).
- Nelissen, H., Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S. Plant Organogenesis. DeSmet, I. , Chapter 17 (2013).
- Ben-Haj-Salah, H., Tardieu, F. Temperature Affects Expansion Rate of Maize Leaves without Change in Spatial-Distribution of Cell Length - Analysis of the Coordination between Cell-Division and Cell Expansion. Plant Physiol. 109, 861-870 (1995).
- Fiorani, F., Beemster, G. T. S., Bultynck, L., Lambers, H. Can meristematic activity determine variation in leaf size and elongation rate among four Poa species? A kinematic study. Plant Physiol. 124, 845-855 (2000).
- Pettko-Szandtner, A., et al. Core cell cycle regulatory genes in rice and their expression profiles across the growth zone of the leaf. J. Plant Res. 128, 953-974 (2015).
- Poorter, H., Remkes, C. Leaf-Area Ratio and Net Assimilation Rate of 24 Wild-Species Differing in Relative Growth-Rate. Oecologia. 83, 553-559 (1990).
- Macadam, J. W., Volenec, J. J., Nelson, C. J. Effects of Nitrogen on Mesophyll Cell-Division and Epidermal-Cell Elongation in Tall Fescue Leaf Blades. Plant Physiol. 89, 549-556 (1989).
- Tardieu, F., Granier, C. Quantitative analysis of cell division in leaves: methods, developmental patterns and effects of environmental conditions. Plant Mol. Biol. 43, 555-567 (2000).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Possible Role of Some Mineral Elements in Growth-Inhibition. Planta. 196, 699-705 (1995).
- Erickson, R. O., Sax, K. B. Rates of Cell-Division and Cell Elongation in the Growth of the Primary Root of Zea-Mays. P. Am. Philos. Soc. 100, 499-514 (1956).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Goodwin, R. H., Stepka, W. Growth and differentiation in the root tip of Phleum pratense. Am. J. Bot. 32, 36-46 (1945).
- Hejnowicz, Z. Growth and Cell Division in the Apical Meristem of Wheat Roots. Physiologia Plantarum. 12, 124-138 (1959).
- Gandar, P. W. Growth in Root Apices .1. The Kinematic Description of Growth. Bot. Gaz. 144, 1-10 (1983).
- Baskin, T. I., Cork, A., Williamson, R. E., Gorst, J. R. Stunted-Plant-1, a Gene Required for Expansion in Rapidly Elongating but Not in Dividing Cells and Mediating Root-Growth Responses to Applied Cytokinin. Plant Physiol. 107, 233-243 (1995).
- Sacks, M. M., Silk, W. K., Burman, P. Effect of water stress on cortical cell division rates within the apical meristem of primary roots of maize. Plant Physiol. 114, 519-527 (1997).
- Granier, C., Tardieu, F. Spatial and temporal analyses of expansion and cell cycle in sunflower leaves - A common pattern of development for all zones of a leaf and different leaves of a plant. Plant Physiol. 116, 991-1001 (1998).
- De Veylder, L., et al. Functional analysis of cyclin-dependent kinase inhibitors of Arabidopsis. Plant Cell. 13, 1653-1667 (2001).
- Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. J. Exp. Bot. 55, 1021-1032 (2004).
- Kutschmar, A., et al. PSK-alpha promotes root growth in Arabidopsis. New Phytol. 181, 820-831 (2009).
- Vanneste, S., et al. Plant CYCA2s are G2/M regulators that are transcriptionally repressed during differentiation. Embo J. 30, 3430-3441 (2011).
- Eloy, N. B., et al. Functional Analysis of the anaphase-Promoting Complex Subunit 10. Plant J. 68, 553-563 (2011).
- Eloy, N. B., et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization. P. Natl. Acad. Sci. USA. 109, 13853-13858 (2012).
- Dhondt, S., et al. SHORT-ROOT and SCARECROW Regulate Leaf Growth in Arabidopsis by Stimulating S-Phase Progression of the Cell Cycle. Plant Physiol. 154, 1183-1195 (2010).
- Baute, J., et al. Correlation analysis of the transcriptome of growing leaves with mature leaf parameters in a maize RIL population. Genome Biol. 16, (2015).
- Andriankaja, M., et al. Exit from Proliferation during Leaf Development in Arabidopsis thaliana: A Not-So-Gradual Process. Dev. Cell. 22, 64-78 (2012).
- Beemster, G. T. S., et al. Genome-wide analysis of gene expression profiles associated with cell cycle transitions in growing organs of Arabidopsis. Plant Physiol. 138, 734-743 (2005).
- Spollen, W. G., et al. Spatial distribution of transcript changes in the maize primary root elongation zone at low water potential. Bmc Plant Biol. 8, (2008).
- Candaele, J., et al. Differential Methylation during Maize Leaf Growth Targets Developmentally Regulated Genes. Plant Physiol. 164, 1350-1364 (2014).
- West, G., Inze, D., Beemster, G. T. S. Cell cycle modulation in the response of the primary root of Arabidopsis to salt stress. Plant Physiol. 135, 1050-1058 (2004).
- Zhang, Z., Voothuluru, P., Yamaguchi, M., Sharp, R. E., Peck, S. C. Developmental distribution of the plasma membrane-enriched proteome in the maize primary root growth zone. Front. Plant Sci. 4, (2013).
- Bonhomme, L., Valot, B., Tardieu, F., Zivy, M. Phosphoproteome Dynamics Upon Changes in Plant Water Status Reveal Early Events Associated With Rapid Growth Adjustment in Maize Leaves. Mol. Cell Proteomics. 11, 957-972 (2012).
- Schnyder, H., Nelson, C. J. Growth-Rates and Assimilate Partitioning in the Elongation Zone of Tall Fescue Leaf Blades at High and Low Irradiance. Plant Physiol. 90, 1201-1206 (1989).
- Schnyder, H., Nelson, C. J., Spollen, W. G. Diurnal Growth of Tall Fescue Leaf Blades .2. Dry-Matter Partitioning and Carbohydrate-Metabolism in the Elongation Zone and Adjacent Expanded Tissue. Plant Physiol. 86, 1077-1083 (1988).
- Schnyder, H., Nelson, C. J. Growth-Rates and Carbohydrate Fluxes within the Elongation Zone of Tall Fescue Leaf Blades. Plant Physiol. 85, 548-553 (1987).
- Vassey, T. L., Shnyder, H. S., Spollen, W. G., Nelson, C. J. Cellular Characterisation and Fructan Profiles in Expanding Tall Fescue. Curr. T. Pl. B. 4, 227-229 (1985).
- Allard, G., Nelson, C. J. Photosynthate Partitioning in Basal Zones of Tall Fescue Leaf Blades. Plant Physiol. 95, 663-668 (1991).
- Spollen, W. G., Nelson, C. J. Response of Fructan to Water-Deficit in Growing Leaves of Tall Fescue. Plant Physiol. 106, 329-336 (1994).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .1. Relationship to Genetically Altered Leaf Elongation Rates. Plant Physiol. 74, 590-594 (1984).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .2. Relationship to Leaf Elongation Rates Modified by Nitrogen-Fertilization. Plant Physiol. 74, 595-600 (1984).
- Silk, W. K., Walker, R. C., Labavitch, J. Uronide Deposition Rates in the Primary Root of Zea-Mays. Plant Physiol. 74, 721-726 (1984).
- Granier, C., Inze, D., Tardieu, F. Spatial distribution of cell division rate can be deduced from that of p34(cdc2) kinase activity in maize leaves grown at contrasting temperatures and soil water conditions. Plant Physiol. 124, 1393-1402 (2000).
- Voothuluru, P., Sharp, R. E. Apoplastic hydrogen peroxide in the growth zone of the maize primary root under water stress.1. Increased levels are specific to the apical region of growth maintenance. J. Exp. Bot. 64, 1223-1233 (2012).
- Wu, Y. J., Jeong, B. R., Fry, S. C., Boyer, J. S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential. Planta. 220, 593-601 (2005).
- Macadam, J. W., Nelson, C. J., Sharp, R. E. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .1. Spatial-Distribution of Ionically Bound Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 872-878 (1992).
- Macadam, J. W., Sharp, R. E., Nelson, C. J. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .2. Spatial-Distribution of Apoplastic Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 879-885 (1992).
- Beemster, G. T. S., De Vusser, K., De Tavernier, E., De Bock, K., Inze, D. Variation in growth rate between Arabidopsis ecotypes is correlated with cell division and A-type cyclin-dependent kinase activity. Plant Physiol. 129, 854-864 (2002).
- Kavanova, M., Lattanzi, F. A., Schnyder, H. Nitrogen deficiency inhibits leaf blade growth in Lolium perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates. Plant Cell Environ. 31, 727-737 (2008).
- Macadam, J. W., Nelson, C. J. Secondary cell wall deposition causes radial growth of fibre cells in the maturation zone of elongating tall fescue leaf blades. Ann. Bot-London. 89, 89-96 (2002).
- Schnyder, H., Nelson, C. J. Diurnal Growth of Tall Fescue Leaf Blades .1. Spatial-Distribution of Growth, Deposition of Water, and Assimilate Import in the Elongation Zone. Plant Physiol. 86, 1070-1076 (1988).
- Gastal, F., Nelson, C. J. Nitrogen Use within the Growing Leaf Blade of Tall Fescue. Plant Physiol. 105, 191-197 (1994).
- Vanvolkenburgh, E., Boyer, J. S. Inhibitory Effects of Water Deficit on Maize Leaf Elongation. Plant Physiol. 77, 190-194 (1985).
- Silk, W. K., Hsiao, T. C., Diedenhofen, U., Matson, C. Spatial Distributions of Potassium, Solutes, and Their Deposition Rates in the Growth Zone of the Primary Corn Root. Plant Physiol. 82, 853-858 (1986).
- Meiri, A., Silk, W. K., Lauchli, A. Growth and Deposition of Inorganic Nutrient Elements in Developing Leaves of Zea-Mays L. Plant Physiol. 99, 972-978 (1992).
- Neves-Piestun, B. G., Bernstein, N. Salinity-induced inhibition of leaf elongation in maize is not mediated by changes in cell wall acidification capacity. Plant Physiol. 125, 1419-1428 (2001).
- Bouchabke, O., Tardieu, F., Simonneau, T. Leaf growth and turgor in growing cells of maize (Zea mays L.) respond to evaporative demand under moderate irrigation but not in water-saturated soil. Plant Cell Environ. 29, 1138-1148 (2006).
- Westgate, M. E., Boyer, J. S. Transpiration-Induced and Growth-Induced Water Potentials in Maize. Plant Physiol. 74, 882-889 (1984).
- Horiguchi, G., Gonzalez, N., Beemster, G. T. S., Inze, D., Tsukaya, H. Impact of segmental chromosomal duplications on leaf size in the grandifolia-D mutants of Arabidopsis thaliana. Plant J. 60, 122-133 (2009).
- Fleury, D., et al. The Arabidopsis thaliana homolog of yeast BRE1 has a function in cell cycle regulation during early leaf and root growth. Plant Cell. 19, 417-432 (2007).
- Vlieghe, K., et al. The DP-E2F-like gene DEL1 controls the endocycle in Arabidopsis thaliana. Curr. Biol. 15, 59-63 (2005).
- Boudolf, V., et al. The plant-specific cyclin-dependent kinase CDKB1;1 and transcription factor E2Fa-DPa control the balance of mitotically dividing and endoreduplicating cells in Arabidopsis. Plant Cell. 16, 2683-2692 (2004).
- Baskin, T. I., Beemster, G. T. S., Judy-March, J. E., Marga, F. Disorganization of cortical microtubules stimulates tangential expansion and reduces the uniformity of cellulose microfibril alignment among cells in the root of Arabidopsis. Plant Physiol. 135, 2279-2290 (2004).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten