É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise cinemática da Divisão Celular e Expansão: Quantificar a base celular de crescimento e de amostragem de desenvolvimento zonas em
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Quantifying cell division and expansion is of crucial importance to the understanding of whole-plant growth. Here, we present a protocol to calculate cellular parameters determining maize leaf growth rates and highlight the use of these data for investigating molecular growth regulatory mechanisms by directing developmental stage-specific sampling strategies.
Resumo
Growth analyses are often used in plant science to investigate contrasting genotypes and the effect of environmental conditions. The cellular aspect of these analyses is of crucial importance, because growth is driven by cell division and cell elongation. Kinematic analysis represents a methodology to quantify these two processes. Moreover, this technique is easy to use in non-specialized laboratories. Here, we present a protocol for performing a kinematic analysis in monocotyledonous maize (Zea mays) leaves. Two aspects are presented: (1) the quantification of cell division and expansion parameters, and (2) the determination of the location of the developmental zones. This could serve as a basis for sampling design and/or could be useful for data interpretation of biochemical and molecular measurements with high spatial resolution in the leaf growth zone. The growth zone of maize leaves is harvested during steady-state growth. Individual leaves are used for meristem length determination using a DAPI stain and cell-length profiles using DIC microscopy. The protocol is suited for emerged monocotyledonous leaves harvested during steady-state growth, with growth zones spanning at least several centimeters. To improve the understanding of plant growth regulation, data on growth and molecular studies must be combined. Therefore, an important advantage of kinematic analysis is the possibility to correlate changes at the molecular level to well-defined stages of cellular development. Furthermore, it allows for a more focused sampling of specified developmental stages, which is useful in case of limited budget or time.
Introdução
Análise de crescimento depende de um conjunto de ferramentas que são comumente usados por cientistas de planta para descrever as diferenças de crescimento genótipo determinado e / ou respostas fenotípicas a fatores ambientais. Eles incluem tamanho e peso medições da planta inteira ou um órgão e cálculos de taxas de crescimento para explorar os mecanismos subjacentes de crescimento. Crescimento dos órgãos é determinada por divisão celular e de expansão ao nível celular. Portanto, incluindo a quantificação desses dois processos no crescimento análises é fundamental para compreender as diferenças no crescimento do órgão inteiro 1. Por conseguinte, é fundamental ter uma metodologia adequada para determinar os parâmetros de crescimento celular que é relativamente fácil de usar por laboratórios não especializados.
A análise cinemática já foi estabelecida como uma abordagem fornecendo uma estrutura poderosa para o desenvolvimento de modelos de crescimento de órgãos 2. A técnica foi optimizado para sistemas lineares,tais como raízes e folhas de Arabidopsis thaliana monocotiledóneas, mas também para os sistemas não lineares, tais como folhas dicotiledóneas 3. Hoje em dia, esta metodologia está cada vez mais sendo usado para estudar como genética, hormonal, de desenvolvimento e fatores ambientais influenciam a divisão celular e expansão em vários órgãos (Tabela 1). Além disso, também fornece uma estrutura para conectar processos celulares aos seus regulamentos bioquímicas, moleculares e fisiológicos subjacentes (Tabela 2), embora as limitações podem ser impostas por tamanho do órgão e da organização espacial para técnicas que exigem maiores quantidades de material vegetal (por exemplo, metabólitos medições, proteômica, etc.).
Folhas de monocotiledóneas, como o milho (Zea mays) da folha, representam sistemas lineares em que as células se movem a partir da base da folha em direcção a ponta, passando sequencialmente através da zona de meristema e alongamento para atingir a maturidadezona. Isto o torna um sistema modelo ideal para estudos quantitativos dos padrões espaciais de crescimento de 4. Além disso, folhas de milho têm zonas de grande crescimento (meristema e zona de alongamento abrangendo vários centímetros 5) e proporcionar possibilidades para estudos em outros níveis organizacionais. Isto permite a investigação dos mecanismos de regulação (putativos) que controlam a divisão celular e expansão, quantificada por análise cinemática através de uma série de técnicas moleculares, medições fisiológicas e abordagens de biologia celular (Tabela 2).
Aqui, nós fornecemos um protocolo para a realização de uma análise cinemática em folhas de monocotiledôneas. Em primeiro lugar, vamos explicar como conduzir uma análise adequada de ambos divisão celular e alongamento celular como uma função da posição ao longo do eixo da folha e como calcular parâmetros cinemáticos. Em segundo lugar, também mostrar como este pode ser usado como uma base para a concepção de amostragem. Aqui, discutimos dois casos: de alta resolução de uma amostragemd focado amostragem, permitindo uma melhor interpretação dos dados e economia de tempo / dinheiro, respectivamente.
Tabela 1. Visão Geral de cinemática analisa métodos de quantificação da divisão celular e expansão em vários órgãos.
| órgão | referência |
| folhas monocotiledôneas | 16, 20, 21, 22 |
| dicas de raiz | 2, 23, 24, 25, 26, 27, 28, 29 |
| folhas de dicotiledôneas | 21, 30, 31 |
| atirar meristema apical | 32 |
Tabela 1. Visão Geral de cinemática analisa métodos de quantificação da divisão celular e expansão em vários órgãos.
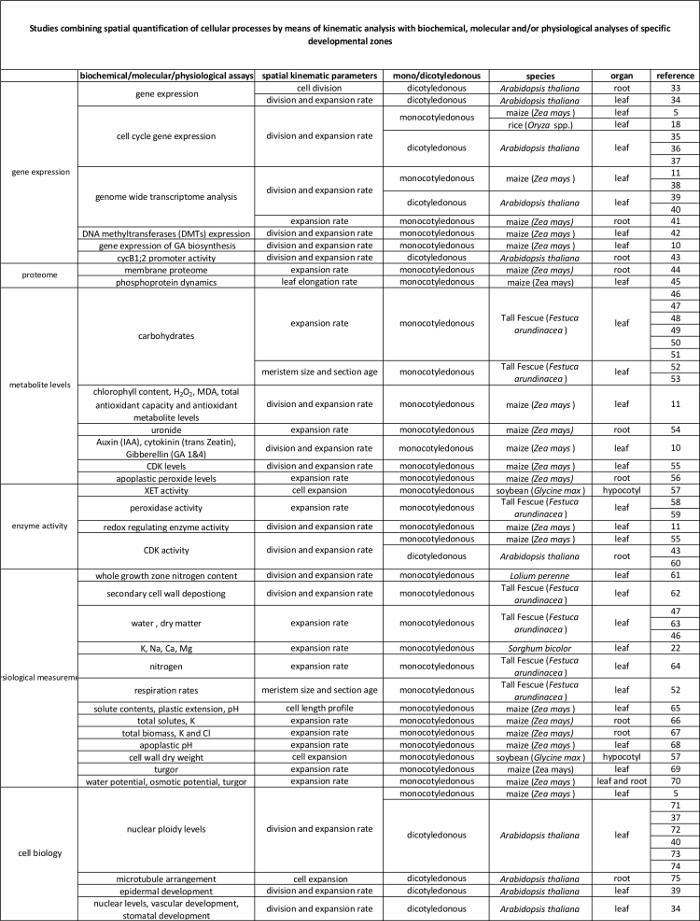
Tabela 2. A ligação entre os processos celulares quantificados pela análise cinemática a sua regulação ao nível molecular. As referências a diversos estudos de ligação a quantificação de processos celulares com os resultados de ensaios bioquímicos e moleculares em várias espécies e órgãos. Endotransglucosylase xiloglucano (XET), malondialdeído (MDA), quinases dependentes da ciclina (CDK). Por favor clique aqui para ver uma versão maior desta tabela.
Protocolo
NOTA: O protocolo a seguir para análise cinemática é válida apenas para as folhas durante o crescimento em estado estacionário. Tal implica uma taxa de alongamento foliar estável e padrões espaciais de comprimento e expansão celular em uma folha durante um período de vários dias 6.
1. crescimento da planta e Medidas de alongamento foliar Rate (LER)
- Escolha uma folha em crescimento em estado estacionário e um estágio de desenvolvimento de interesse.
NOTA: Há uma diferença entre o crescimento do steady-state e crescimento repetitivo, o que implica padrões espaciais semelhantes nas folhas sucessivas no mesmo eixo. Durante as fases iniciais de crescimento das mudas, folhas sucessivas normalmente crescem cada vez mais rápido devido ao tamanho crescente da zona de crescimento de 7. Embora algumas posições folha superior pode ter um padrão de crescimento semelhante 8, isto é uma fase transitória que podem ser afectados pelos tratamentos sob investigação. Por isso, é importante comparar as linhas e tr eatments estritamente na mesma posição da folha, mesmo que possa ser desenvolvimento em um momento diferente. Mesmo a uma taxa de alongamento constante, o perfil da taxa de crescimento não é necessariamente a mesma em diferentes fases de desenvolvimento. Portanto, é importante analisar as folhas no mesmo estágio de desenvolvimento 8, normalmente definido pelo número de dias após a emergência. - Para executar uma análise cinemática cheia de crescimento da folha em monocotiledôneas, crescer pelo menos 15 plantas para cada tratamento eo genótipo sob condições controladas em sala de crescimento.
- No momento em que a folha de interesse é exibida (surgimento do verticilo de folhas vizinhas), iniciar a medição do comprimento da folha diariamente com uma régua até que a folha seja totalmente expandida (Figura 1-I). comprimento da folha implica o comprimento a partir do nível do solo para a ponta da folha. Tenha cuidado para não quebrar ou danificar a folha, uma vez que este possa alterar o seu crescimento.
re 1 "src =" / files / ftp_upload / 54887 / 54887fig1.jpg "/>
Figura 1:. Visão esquemática de uma análise cinemática de folhas de milho A folha de interesse é medida com uma régua por três dias consecutivos para calcular o alongamento foliar Rate (LER). Em seguida, a folha é colhida e um segmento de três centímetros é usada para a determinação do tamanho de meristema. Isto é feito através da medição do comprimento desde a base até a figura mitótico mais distal, após coloração com DAPI. (A) Os exemplos de figuras de mitose proliferativa e (B) figuras de mitose formativos. As primeiras onze centímetros da base da folha do outro lado da veia meados são usados para cortar dez segmentos de um centímetro de comprimento para medições de células. Essas medições fornecem a base para a criação do perfil de comprimento celular, que serve para determinar o comprimento maduro de células (l MAT) e o comprimento das células que saem do meristema (l div). o l e LER esteira são utilizados para calcular a taxa de produção de células (P), enquanto que L e L div mer são utilizadas para calcular o número de células no meristema (mer N). Por sua vez, P e N mer são utilizadas para calcular a taxa de divisão celular média (D), que é o inverso da duração do ciclo celular (t c). Setas da mesma cor indicam parâmetros que são usados para calcular o parâmetro a seguir nesses flechas. Barras de escala = 40 uM. Algarismos romanos são usados para se referir a procedimentos experimentais específicos descritos no protocolo. Por favor clique aqui para ver uma versão maior desta figura.
2. A colheita
- Na fase de desenvolvimento de interesse (por exemplo, no terceiro dia após a emergência), escolher pelo menos cinco representante plantes do lote em que a condução da análise cinemática. Continuar a medir o resto das plantas, tal como explicado no passo 1.3 para determinar o comprimento da folha final.
- Corte a parte aérea da planta. Para manter a parte meristematic intacta, corte o mais próximo possível às raízes (Figura 1ii).
- A partir das folhas externas, remover todos deixa-se à folha de interesse delicadamente desenrolando-los um por um. Se necessário, remover alguns milímetros adicionais a partir da base para separar as folhas. Também remover as folhas apicais e pequenas fechados pela folha de interesse (Figura 1iii).
- Cortar um segmento de 3 cm, a partir da base de um lado da veia meio, e armazená-la num tubo de 1,5 ml de teste preenchido com 3: 1 (v: v) de etanol absoluto: uma solução de ácido acético (CUIDADO: usar luvas) a 4 ° C durante 24 horas até vários meses (Figura 1iv). Este segmento será mais tarde utilizada para determinar o comprimento do meristema.
- Deoutro lado da veia, cortar um segmento de 11 centímetros a partir da base (Figura 1 v) e colocá-lo em um tubo de 15 ml cheio com etanol absoluto a 4 ° C durante pelo menos 6 horas para remover pigmentos (Figura 1 VI).
NOTA: Mais tarde, usar apenas os primeiros 10 cm para determinar o perfil de comprimento celular (ver Discussão). - Renovar o etanol absoluto para outra rodada de limpeza a 4 ° C durante pelo menos 24 horas (Figura 1vi).
- Finalmente, a substituição de etanol absoluto com ácido láctico puro (CUIDADO: usar luvas) para a limpeza e armazenagem a 4 ° C durante 24 h ou até à sua utilização (Figura 1vi).
3. das medições de comprimento meristema
- Preparar um tampão de lavagem contendo 50 mM de cloreto de sódio (NaCl), ácido etilenodiaminotetra-acético 5 mM (EDTA; CUIDADO: usar luvas) e 10 mM de Tris (hidroximetil) aminometano-ácido clorídrico (Tris-HCl; pH 7).
- Leve o segmento de 3 cm do ponto 2.4 e assimak-lo no tampão durante 20 minutos (Figura 1vii).
- Enquanto espera, usar o tampão de lavagem para preparar uma solução de coloração 4 ', 6-diamidino-2-fenilindole (DAPI) de 1 ug / ml, mantendo-o em gelo e no escuro.
- Manchar os núcleos através da colocação do segmento de meristema para 2-5 min em solução de coloração DAPI. Trabalhar no gelo e no escuro (Figura 1vii).
- Verifique se há sinal de fluorescência por rapidamente a montagem do segmento em um vidro microscopia e cobrindo-o com uma tampa de vidro. As células epidérmicas deve mostrar fluorescência, enquanto que as camadas de células subjacentes não deveria.
- Se a coloração não é suficiente, colocar o segmento de volta na solução de coloração DAPI durante alguns minutos adicionais.
- Para parar a coloração, montar os segmentos em uma gota de tampão de lavagem em uma lâmina de microscopia e cubra com uma tampa de vidro.
- Usar um microscópio equipado com UV de fluorescência com uma ampliação de 20X, permitindo a visualização de cerca de 1,000 epidermecélulas ao mesmo tempo. Rolar em todo o segmento e procurar números de proliferação de mitose (metáfase, anáfase, telófase e citocinese), mas evitar a divisão celular formativa dos estômatos em desenvolvimento (Figura 1viii) 9. Definir onde a figura mitótico mais distal está localizado.
- Determinar o comprimento do meristema através da medição da distância entre a base da folha e a figura mitótico mais distai epidérmica. Use um software de análise de imagens (por exemplo, ImageJ) para medir o comprimento total do quadro da imagem.
- Contar o número de quadros que cobrem o comprimento total meristema (a partir da base da folha a figura mitótico mais distal) e multiplicando este número pelo comprimento de um quadro para obter o comprimento meristema completo (Figura 1ix).
4. celular Comprimento Perfil
- Leve o segmento que é armazenado em ácido lático (passo 2.5) e colocá-lo cuidadosamente no banco. Corte a sagacidade segmentosha bisturi em 10 segmentos de aproximadamente 1 cm de cada (Figura 1x).
- Montar os segmentos de folhas sucessivas sobre uma lâmina de microscópio em uma pequena gota de ácido láctico. Certifique-se para enfrentar de forma consistente ou o adaxial ou abaxial para cima. Em princípio, não existe uma preferência para um lado particular.
- Usar um microscópio equipado com contraste de interferência diferencial (DIC) a óptica, para analisar os segmentos, a partir da base da folha. Medida com um software de análise de imagem do comprimento de pelo menos 20 células epidérmicas replicar em ficheiros directamente adjacentes aos ficheiros estomática, a fim de seleccionar de forma consistente o mesmo tipo de célula.
- Faça isso em posições igualmente espaçadas ao longo de cada um dos segmentos (4 posições por bastam segmento), e certifique-se de anotar a posição correspondente para cada medição em toda a folha (Figura 1xi).
- Determinar o comprimento médio de célula a cada mm ao longo do eixo da folha usando um local de polinomial suavização pROCEDIMENTO, implementado em um R-script (Figura 1xii; Documento Suplementar 1).
NOTA: O R-script fornece uma série de dados com o aumento da suavização. A quantidade de suavização necessário é um pouco arbitrária e, idealmente, deve apenas remover o ruído local, mas não afeta a curva geral. Certifique-se de usar a mesma quantidade de suavização para todas as amostras dentro de um experimento. - Calcular a média dos comprimento de célula em cada posição de entre plantas e calcular o erro padrão para criar um perfil de comprimento de célula ao longo do eixo da folha.
5. Cálculos de cinemáticas parâmetros (veja Documento Suplementar 2)
- Calcular a LER tomando a mudança no comprimento da folha entre os dois pontos de tempo sucessivos (por exemplo, 24 horas, tal como no passo 1.3) e dividindo-a pelo intervalo de tempo.
- Calcular o comprimento da zona de crescimento (G GZ) correspondente à posição distai a partir da base em que as células atingem a 95% do seu ce maduracomprimento LL do perfil de comprimento celular smoothened.
- Aqui, para cada posição sobre o perfil smoothened comprimento célula 95% da média de todos os comprimentos de células seguintes que a posição (Figura 2).
- Comparar os comprimentos de células smoothened (passo 4.4) com o comprimento de células 95%, calculado em cada posição. A partir da base da folha, a zona de crescimento termina na posição onde o comprimento real da célula é igual a 95% dos seguintes comprimentos de células (Figura 2; ver Dados Suplementar 2).
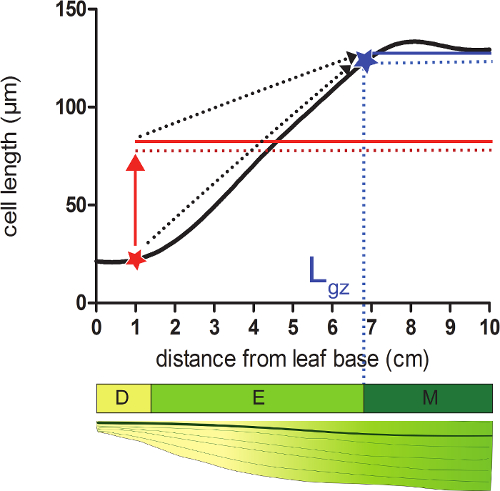
Figura 2:. Determinar o final da zona de crescimento do meristema: na posição indicada com um asterisco vermelho, o tamanho real da célula é mais pequeno do que 95% (linha pontilhada vermelho) do tamanho de célula médio de todas as células que se segue nesta posição (sólido vermelho linha). A extremidade da zona de crescimento (G GZ; indicada com abestrela lue) está localizado em que 95% (linha pontilhada azul) do tamanho de célula médio de todas as células que se segue nesta posição (linha azul sólido) é igual ao tamanho real da célula. Divisão zona (D), zona de alongamento (E), e zona madura (M). As setas tracejadas indicam a convergência entre a dimensão local e 95% do tamanho médio sobre a porção distal da folha quando se deslocam a partir das posições basal até a ponta da folha. Por favor clique aqui para ver uma versão maior desta figura.
- Calcular o comprimento da zona de alongamento (L EL) como a diferença entre o comprimento da zona de crescimento (G GZ) e o tamanho do meristema (L mer; determinado no passo 3).
- Calcular o comprimento da célula madura (l MAT) como o comprimento médio de célula na zona madura.
- Divida a LER por l tapete para obter otaxa de produção de células (P).
- Calcular o número de células na zona de alongamento (N EL) como a diferença entre o N e N GZ mer. O número de células do meristema (mer N) é igual ao número total de células localizadas nos intervalos correspondentes ao meristema. O número de células na zona de crescimento (GZ N) é igual ao número cumulativo de células localizadas nos intervalos correspondentes à zona de crescimento.
- Calcula-se a taxa de divisão celular média (D) como mer P / N. A duração do ciclo celular (t c) é igual a ln (2) / D.
- Calcular o tempo na zona de alongamento (t el) dividindo N el por P. O tempo na zona de divisão igual a 2 log (N mer) * T c. O comprimento de células que saem do meristema (l div)é igual ao comprimento da célula a partir do perfil de comprimento smoothened celular no final do meristema.
- Calcular a taxa média de expansão celular (R el) usando seguinte fórmula: ln (l mat) -ln (l div)] / T el.
Resultados
Aqui, mostramos uma comparação entre as plantas bem irrigadas (controle, o conteúdo de água no solo de 54%, (SWC)) e plantas submetidas a condições de seca de stress (seca, 34% SWC) em termos de crescimento da folha. Todas as plantas foram cultivadas numa câmara de crescimento, sob condições controladas (16 h dia / noite de 8 h, 25 ° C / 18 ° C dia / noite, 300-400 μEm -2 seg -1 radiação fotossinteticamente activa (PAR). As condições de seca foram es...
Discussão
Uma análise cinemática em folhas de milho integral permite a determinação da base celular de crescimento da folha e permite a concepção de estratégias de amostragem eficientes. Embora o protocolo é relativamente simples, alguma cautela é recomendado nas seguintes passos críticos: (1) É importante destacar as, folhas mais jovens fechados (passo 2.3), sem danificar o meristema, uma vez que a determinação comprimento meristema (passo 3) requer a completa meristema de estar presente. Alguma prática de antemão...
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado por uma bolsa de doutoramento da Universidade de Antuérpia para VA; uma bolsa de doutoramento do Flamengo Science Foundation (FWO, 11ZI916N) para KS; subvenções de projectos do FWO (G0D0514N); uma bolsa de investigação actividades de investigação concertada (GOA), "A Biologia de Sistemas Abordagem de Folha Morfogênese" do conselho da Universidade de Antuérpia pesquisa; eo Interuniversitário de atração poloneses (IUAP VII / 29, MARS), "Milho e Arabidopsis raízes e parte aérea" do Escritório Belga Federal de Ciência Política (BELSPO) para GTSB Han Asard, Bulelani L. Sizani e Hamada AbdElgawad contribuíram para o vídeo .
Materiais
| Name | Company | Catalog Number | Comments |
| Pots | Any | Any | We use pots with the following measures, but can be different depending on the treatment/study: bottom diameter: 11 cm, opening diameter: 15 cm, height: 12 cm. We grow one maize plant per pot. |
| Planting substrate | Any | Any | We use potting medium (Jiffy, The Netherlands), but other substrates can be used, depending on treatment/study. |
| Ruler | Any | Any | An extension ruler that covers at least 1.5 meters is needed to measure the final leaf length of the plants. |
| Seeds | Any | NA | Seeds can be ordered from a breeder. |
| Scalpel | Any | Any | The scalpel is used during leaf harvesting to detach the leaf of interest from its surrounding leaves and right after harvesting to cut a proper sample for cell length and meristem length measurements. |
| 15 mL falcon tubes | Any | Any | The 15 mL falcon tubes are used for storing samples used for cell length measurements during sample clearing with absolute ethanol and lactic acid. |
| Eppendorf tubes | Any | Any | The eppendorf tubes are used for storing samples used for meristem length measurements in ethanol:acetic acid 3:1 (v:v) solution. |
| Gloves | Any | Any | Latex gloves, which protect against corrosive reagents. |
| Acetic acid | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1; Flammable liquids, categories 1,2,3 |
| Absolute ethanol | Any | Any | CAUTION: Hazardous in case of skin contact (irritant), of eye contact (irritant), of inhalation. Slightly hazardous in case of skin contact (permeator), of ingestion |
| Lactic acid >98% | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1 |
| Sodium chloride (NaCl) | Any | Any | |
| Ethylenediaminetetraacetic acid (EDTA) | Any | Any | CAUTION: Acute toxicity (oral, dermal, inhalation), category 4 Skin irritation, category 2 Eye irritation, category 2 Skin sensitisation, category 1 Specific Target Organ Toxicity – Single exposure, category 3 |
| Tris(hydroxymethyl)aminomethane hydrochloride (Tris-HCl) | Any | Any | This material can be an irritant, contact with eyes and skin should be avoided. Inhalation of dust may be irritating to the respiratory tract. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Any | Any | Cell permeable fluorescent minor groove-binding probe for DNA. Causes skin irritation. May cause an allergic skin reaction. May cause respiratory irritation. |
| Ice | Any | NA | The DAPI solution has to be kept on ice. |
| Fluorescent microscope | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any fluorescent microscope can be used for determining meristem length. | |
| Microscopic slide | Any | Any | |
| Cover glass | Any | Any | |
| Tweezers | Any | Any | Tweezers are needed for unfolding the rolled maize leaf right after harvesting in order to cut a proper sample for cell length and meristem length measurements. |
| Image-analysis software | Axiovision (Release 4.8) from Zeiss | NA | The software can be downloaded at: http://www.zeiss.com/microscopy/en_de/downloads/axiovision.html. Other softwares such as ImageJ (https://imagej.nih.gov/ij/) could be used as well. |
| Microscope equipped with DIC | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any microscope, equipped with differential interference contrast (DIC) can be used to measure cell lengths. | |
| R statistical analysis software | R Foundation for Statistical Computing | NA | Open source; Could be downloaded at https://www.r-project.org/ |
| R script | NA | NA | We use the kernel smoothing function locpoly of the Kern Smooth package (Wand MP, Jones MC. Kernel Smoothing: Chapman & Hall/CRC (1995)). The script is available for Mac and Windows upon inquiry with the corresponding author. |
Referências
- Fiorani, F., Beemster, G. T. S. Quantitative analyses of cell division in plants. Plant Mol. Biol. 60, 963-979 (2006).
- Silk, W. K., Erickson, R. O. Kinematics of Plant-Growth. J. Theor. Biol. 76, 481-501 (1979).
- Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., Hennig, L., Köhler, C. Kinematic Analysis of Cell Division and Expansion. Plant Developmental Biology. , (2010).
- Avramova, V., Sprangers, K., Beemster, G. T. S. The Maize Leaf: Another Perspective on Growth Regulation. Trends Plant Sci. 20, 787-797 (2015).
- Rymen, B., et al. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol. 143, 1429-1438 (2007).
- Muller, B., Reymond, M., Tardieu, F. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot. 52, 1259-1268 (2001).
- Beemster, G. T. S., Masle, J., Williamson, R. E., Farquhar, G. D. Effects of soil resistance to root penetration on leaf expansion in wheat (Triticum aestivum L): Kinematic analysis of leaf elongation. J. Exp. Bot. 47, 1663-1678 (1996).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Spatial and Temporal Aspects of Leaf Growth-Inhibition. Planta. 191, 433-439 (1993).
- Sylvester, A. W., Smith, L. G., Bennetzen, J. L., Hake, S. C. Cell Biology of Maize Leaf Development. Handbook of maize: It's Biology. , (2009).
- Nelissen, H., et al. A Local Maximum in Gibberellin Levels Regulates Maize Leaf Growth by Spatial Control of Cell Division. Curr. Biol. 22, 1183-1187 (2012).
- Avramova, V., et al. Drought Induces Distinct Growth Response, Protection, and Recovery Mechanisms in the Maize Leaf Growth Zone. Plant Physiol. 169, 1382-1396 (2015).
- Picaud, J. C., et al. Total malondialdehyde (MDA) concentrations as a marker of lipid peroxidation in all-in-one parenteral nutrition admixtures (APA) used in newborn infants. Pediatr. Res. 53, 406 (2003).
- Basu, P., Pal, A., Lynch, J. P., Brown, K. M. A novel image-analysis technique for kinematic study of growth and curvature. Plant Physiol. 145, 305-316 (2007).
- Vander Weele, C. M., et al. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132, 1138-1148 (2003).
- Nelissen, H., Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., DeSmet, I. . Plant Organogenesis. , (2013).
- Ben-Haj-Salah, H., Tardieu, F. Temperature Affects Expansion Rate of Maize Leaves without Change in Spatial-Distribution of Cell Length - Analysis of the Coordination between Cell-Division and Cell Expansion. Plant Physiol. 109, 861-870 (1995).
- Fiorani, F., Beemster, G. T. S., Bultynck, L., Lambers, H. Can meristematic activity determine variation in leaf size and elongation rate among four Poa species? A kinematic study. Plant Physiol. 124, 845-855 (2000).
- Pettko-Szandtner, A., et al. Core cell cycle regulatory genes in rice and their expression profiles across the growth zone of the leaf. J. Plant Res. 128, 953-974 (2015).
- Poorter, H., Remkes, C. Leaf-Area Ratio and Net Assimilation Rate of 24 Wild-Species Differing in Relative Growth-Rate. Oecologia. 83, 553-559 (1990).
- Macadam, J. W., Volenec, J. J., Nelson, C. J. Effects of Nitrogen on Mesophyll Cell-Division and Epidermal-Cell Elongation in Tall Fescue Leaf Blades. Plant Physiol. 89, 549-556 (1989).
- Tardieu, F., Granier, C. Quantitative analysis of cell division in leaves: methods, developmental patterns and effects of environmental conditions. Plant Mol. Biol. 43, 555-567 (2000).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Possible Role of Some Mineral Elements in Growth-Inhibition. Planta. 196, 699-705 (1995).
- Erickson, R. O., Sax, K. B. Rates of Cell-Division and Cell Elongation in the Growth of the Primary Root of Zea-Mays. P. Am. Philos. Soc. 100, 499-514 (1956).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Goodwin, R. H., Stepka, W. Growth and differentiation in the root tip of Phleum pratense. Am. J. Bot. 32, 36-46 (1945).
- Hejnowicz, Z. Growth and Cell Division in the Apical Meristem of Wheat Roots. Physiologia Plantarum. 12, 124-138 (1959).
- Gandar, P. W. Growth in Root Apices .1. The Kinematic Description of Growth. Bot. Gaz. 144, 1-10 (1983).
- Baskin, T. I., Cork, A., Williamson, R. E., Gorst, J. R. Stunted-Plant-1, a Gene Required for Expansion in Rapidly Elongating but Not in Dividing Cells and Mediating Root-Growth Responses to Applied Cytokinin. Plant Physiol. 107, 233-243 (1995).
- Sacks, M. M., Silk, W. K., Burman, P. Effect of water stress on cortical cell division rates within the apical meristem of primary roots of maize. Plant Physiol. 114, 519-527 (1997).
- Granier, C., Tardieu, F. Spatial and temporal analyses of expansion and cell cycle in sunflower leaves - A common pattern of development for all zones of a leaf and different leaves of a plant. Plant Physiol. 116, 991-1001 (1998).
- De Veylder, L., et al. Functional analysis of cyclin-dependent kinase inhibitors of Arabidopsis. Plant Cell. 13, 1653-1667 (2001).
- Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. J. Exp. Bot. 55, 1021-1032 (2004).
- Kutschmar, A., et al. PSK-alpha promotes root growth in Arabidopsis. New Phytol. 181, 820-831 (2009).
- Vanneste, S., et al. Plant CYCA2s are G2/M regulators that are transcriptionally repressed during differentiation. Embo J. 30, 3430-3441 (2011).
- Eloy, N. B., et al. Functional Analysis of the anaphase-Promoting Complex Subunit 10. Plant J. 68, 553-563 (2011).
- Eloy, N. B., et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization. P. Natl. Acad. Sci. USA. 109, 13853-13858 (2012).
- Dhondt, S., et al. SHORT-ROOT and SCARECROW Regulate Leaf Growth in Arabidopsis by Stimulating S-Phase Progression of the Cell Cycle. Plant Physiol. 154, 1183-1195 (2010).
- Baute, J., et al. Correlation analysis of the transcriptome of growing leaves with mature leaf parameters in a maize RIL population. Genome Biol. 16, (2015).
- Andriankaja, M., et al. Exit from Proliferation during Leaf Development in Arabidopsis thaliana: A Not-So-Gradual Process. Dev. Cell. 22, 64-78 (2012).
- Beemster, G. T. S., et al. Genome-wide analysis of gene expression profiles associated with cell cycle transitions in growing organs of Arabidopsis. Plant Physiol. 138, 734-743 (2005).
- Spollen, W. G., et al. Spatial distribution of transcript changes in the maize primary root elongation zone at low water potential. Bmc Plant Biol. 8, (2008).
- Candaele, J., et al. Differential Methylation during Maize Leaf Growth Targets Developmentally Regulated Genes. Plant Physiol. 164, 1350-1364 (2014).
- West, G., Inze, D., Beemster, G. T. S. Cell cycle modulation in the response of the primary root of Arabidopsis to salt stress. Plant Physiol. 135, 1050-1058 (2004).
- Zhang, Z., Voothuluru, P., Yamaguchi, M., Sharp, R. E., Peck, S. C. Developmental distribution of the plasma membrane-enriched proteome in the maize primary root growth zone. Front. Plant Sci. 4, (2013).
- Bonhomme, L., Valot, B., Tardieu, F., Zivy, M. Phosphoproteome Dynamics Upon Changes in Plant Water Status Reveal Early Events Associated With Rapid Growth Adjustment in Maize Leaves. Mol. Cell Proteomics. 11, 957-972 (2012).
- Schnyder, H., Nelson, C. J. Growth-Rates and Assimilate Partitioning in the Elongation Zone of Tall Fescue Leaf Blades at High and Low Irradiance. Plant Physiol. 90, 1201-1206 (1989).
- Schnyder, H., Nelson, C. J., Spollen, W. G. Diurnal Growth of Tall Fescue Leaf Blades .2. Dry-Matter Partitioning and Carbohydrate-Metabolism in the Elongation Zone and Adjacent Expanded Tissue. Plant Physiol. 86, 1077-1083 (1988).
- Schnyder, H., Nelson, C. J. Growth-Rates and Carbohydrate Fluxes within the Elongation Zone of Tall Fescue Leaf Blades. Plant Physiol. 85, 548-553 (1987).
- Vassey, T. L., Shnyder, H. S., Spollen, W. G., Nelson, C. J. Cellular Characterisation and Fructan Profiles in Expanding Tall Fescue. Curr. T. Pl. B. 4, 227-229 (1985).
- Allard, G., Nelson, C. J. Photosynthate Partitioning in Basal Zones of Tall Fescue Leaf Blades. Plant Physiol. 95, 663-668 (1991).
- Spollen, W. G., Nelson, C. J. Response of Fructan to Water-Deficit in Growing Leaves of Tall Fescue. Plant Physiol. 106, 329-336 (1994).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .1. Relationship to Genetically Altered Leaf Elongation Rates. Plant Physiol. 74, 590-594 (1984).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .2. Relationship to Leaf Elongation Rates Modified by Nitrogen-Fertilization. Plant Physiol. 74, 595-600 (1984).
- Silk, W. K., Walker, R. C., Labavitch, J. Uronide Deposition Rates in the Primary Root of Zea-Mays. Plant Physiol. 74, 721-726 (1984).
- Granier, C., Inze, D., Tardieu, F. Spatial distribution of cell division rate can be deduced from that of p34(cdc2) kinase activity in maize leaves grown at contrasting temperatures and soil water conditions. Plant Physiol. 124, 1393-1402 (2000).
- Voothuluru, P., Sharp, R. E. Apoplastic hydrogen peroxide in the growth zone of the maize primary root under water stress.1. Increased levels are specific to the apical region of growth maintenance. J. Exp. Bot. 64, 1223-1233 (2012).
- Wu, Y. J., Jeong, B. R., Fry, S. C., Boyer, J. S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential. Planta. 220, 593-601 (2005).
- Macadam, J. W., Nelson, C. J., Sharp, R. E. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .1. Spatial-Distribution of Ionically Bound Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 872-878 (1992).
- Macadam, J. W., Sharp, R. E., Nelson, C. J. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .2. Spatial-Distribution of Apoplastic Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 879-885 (1992).
- Beemster, G. T. S., De Vusser, K., De Tavernier, E., De Bock, K., Inze, D. Variation in growth rate between Arabidopsis ecotypes is correlated with cell division and A-type cyclin-dependent kinase activity. Plant Physiol. 129, 854-864 (2002).
- Kavanova, M., Lattanzi, F. A., Schnyder, H. Nitrogen deficiency inhibits leaf blade growth in Lolium perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates. Plant Cell Environ. 31, 727-737 (2008).
- Macadam, J. W., Nelson, C. J. Secondary cell wall deposition causes radial growth of fibre cells in the maturation zone of elongating tall fescue leaf blades. Ann. Bot-London. 89, 89-96 (2002).
- Schnyder, H., Nelson, C. J. Diurnal Growth of Tall Fescue Leaf Blades .1. Spatial-Distribution of Growth, Deposition of Water, and Assimilate Import in the Elongation Zone. Plant Physiol. 86, 1070-1076 (1988).
- Gastal, F., Nelson, C. J. Nitrogen Use within the Growing Leaf Blade of Tall Fescue. Plant Physiol. 105, 191-197 (1994).
- Vanvolkenburgh, E., Boyer, J. S. Inhibitory Effects of Water Deficit on Maize Leaf Elongation. Plant Physiol. 77, 190-194 (1985).
- Silk, W. K., Hsiao, T. C., Diedenhofen, U., Matson, C. Spatial Distributions of Potassium, Solutes, and Their Deposition Rates in the Growth Zone of the Primary Corn Root. Plant Physiol. 82, 853-858 (1986).
- Meiri, A., Silk, W. K., Lauchli, A. Growth and Deposition of Inorganic Nutrient Elements in Developing Leaves of Zea-Mays L. Plant Physiol. 99, 972-978 (1992).
- Neves-Piestun, B. G., Bernstein, N. Salinity-induced inhibition of leaf elongation in maize is not mediated by changes in cell wall acidification capacity. Plant Physiol. 125, 1419-1428 (2001).
- Bouchabke, O., Tardieu, F., Simonneau, T. Leaf growth and turgor in growing cells of maize (Zea mays L.) respond to evaporative demand under moderate irrigation but not in water-saturated soil. Plant Cell Environ. 29, 1138-1148 (2006).
- Westgate, M. E., Boyer, J. S. Transpiration-Induced and Growth-Induced Water Potentials in Maize. Plant Physiol. 74, 882-889 (1984).
- Horiguchi, G., Gonzalez, N., Beemster, G. T. S., Inze, D., Tsukaya, H. Impact of segmental chromosomal duplications on leaf size in the grandifolia-D mutants of Arabidopsis thaliana. Plant J. 60, 122-133 (2009).
- Fleury, D., et al. The Arabidopsis thaliana homolog of yeast BRE1 has a function in cell cycle regulation during early leaf and root growth. Plant Cell. 19, 417-432 (2007).
- Vlieghe, K., et al. The DP-E2F-like gene DEL1 controls the endocycle in Arabidopsis thaliana. Curr. Biol. 15, 59-63 (2005).
- Boudolf, V., et al. The plant-specific cyclin-dependent kinase CDKB1;1 and transcription factor E2Fa-DPa control the balance of mitotically dividing and endoreduplicating cells in Arabidopsis. Plant Cell. 16, 2683-2692 (2004).
- Baskin, T. I., Beemster, G. T. S., Judy-March, J. E., Marga, F. Disorganization of cortical microtubules stimulates tangential expansion and reduces the uniformity of cellulose microfibril alignment among cells in the root of Arabidopsis. Plant Physiol. 135, 2279-2290 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados