Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Кинематический анализ клеточного деления и расширения: Количественная клеточная основа роста и отбора проб Развивающие зон в
* Эти авторы внесли равный вклад
В этой статье
Резюме
Quantifying cell division and expansion is of crucial importance to the understanding of whole-plant growth. Here, we present a protocol to calculate cellular parameters determining maize leaf growth rates and highlight the use of these data for investigating molecular growth regulatory mechanisms by directing developmental stage-specific sampling strategies.
Аннотация
Growth analyses are often used in plant science to investigate contrasting genotypes and the effect of environmental conditions. The cellular aspect of these analyses is of crucial importance, because growth is driven by cell division and cell elongation. Kinematic analysis represents a methodology to quantify these two processes. Moreover, this technique is easy to use in non-specialized laboratories. Here, we present a protocol for performing a kinematic analysis in monocotyledonous maize (Zea mays) leaves. Two aspects are presented: (1) the quantification of cell division and expansion parameters, and (2) the determination of the location of the developmental zones. This could serve as a basis for sampling design and/or could be useful for data interpretation of biochemical and molecular measurements with high spatial resolution in the leaf growth zone. The growth zone of maize leaves is harvested during steady-state growth. Individual leaves are used for meristem length determination using a DAPI stain and cell-length profiles using DIC microscopy. The protocol is suited for emerged monocotyledonous leaves harvested during steady-state growth, with growth zones spanning at least several centimeters. To improve the understanding of plant growth regulation, data on growth and molecular studies must be combined. Therefore, an important advantage of kinematic analysis is the possibility to correlate changes at the molecular level to well-defined stages of cellular development. Furthermore, it allows for a more focused sampling of specified developmental stages, which is useful in case of limited budget or time.
Введение
Анализ роста зависит от набора инструментов, которые обычно используются учеными для описания растений генотип определяют различия роста и / или ответы фенотипические к факторам окружающей среды. Они включают в себя измерения размера и веса всего растения или органа и расчеты темпов роста, чтобы изучить основные механизмы роста. роста органов определяется делением клеток и расширения на клеточном уровне. Поэтому, в том числе количественной оценки этих двух процессов роста анализов является ключом к пониманию различий в росте целого органа 1. Следовательно, крайне важно иметь соответствующую методологию для определения клеточных параметров роста, что является относительно простым в использовании, не специализированных лабораториях.
Кинематический анализ уже создан в качестве подхода , обеспечивающего мощную основу для разработки моделей роста органа 2. Методика была оптимизирована для линейных систем,такие как Резуховидка Таля корней и листьев однодольных, но и для нелинейных систем, таких как двудольных листьев 3. В настоящее время эта методика чаще используется для изучения того, как генетические, гормональные, развития, а также факторы окружающей среды влияют на деление клеток и расширение в различных органах (Таблица 1). Кроме того, он также обеспечивает основу для связи клеточных процессов их основных биохимических, молекулярных и физиологических норм (таблица 2), хотя ограничения могут быть наложены по размеру органа и пространственной организации для методов , которые требуют больших количеств растительного материала (например, метаболит измерения, протеомики и т.д.).
Однодольные листья, такие как кукуруза (Zea Мейс - ) листа, представляют собой линейные системы , в которых клетки перемещаются от основания листа к кончику, последовательно проходя через меристемы и удлинение зоны , чтобы достичь зрелогозона. Это делает его идеальной моделью системы для количественных исследований пространственных закономерностей роста 4. Кроме того, листья кукурузы имеют большие зоны роста (меристемы и относительное удлинение зоны , занимающие несколько сантиметров 5) и предоставляют возможности для проведения исследований на других организационных уровнях. Это позволяет при исследовании (мнимых) регуляторных механизмов , контролирующих деление клеток и расширения, количественно с помощью кинематического анализа с помощью ряда молекулярных методов, физиологических измерений и клеточной биологии подходов (таблица 2).
Здесь мы приводим протокол для выполнения анализа кинематики в однодольных листьях. Во-первых, мы объясним, как провести надлежащее анализ как клеточного деления и удлинения клеток в зависимости от положения вдоль оси листа и, как вычислить кинематических параметров. Во-вторых, мы также показывают, как это может быть использовано в качестве основы для формирования выборки. Здесь мы рассмотрим два случая: в высоком разрешении по отбору пробd сосредоточены выборки, позволяя улучшить интерпретацию данных и экономии времени / денег, соответственно.
Таблица 1. Обзор кинематических методы анализа для количественного определения клеточного деления и расширения в различных органах.
| орган | Справка |
| однодольные листья | 16, 20, 21, 22 |
| кончики корней | 2, 23, 24, 25, 26, 27, 28, 29 |
| двудольные листья | 21, 30, 31 |
| стрелять апикальной меристемы | 32 |
Таблица 1. Обзор кинематических методы анализа для количественного определения клеточного деления и расширения в различных органах.
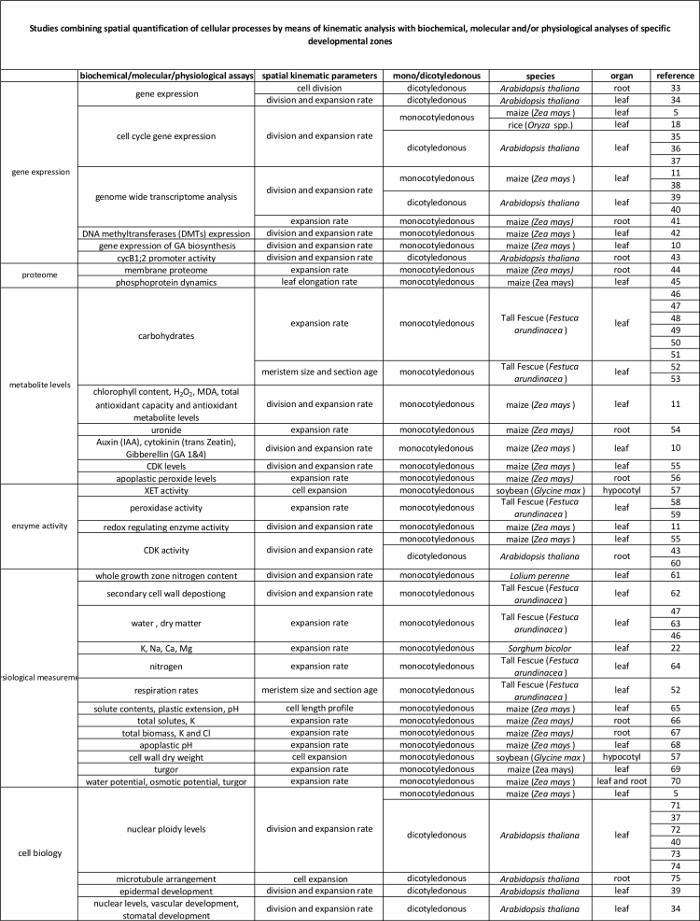
Таблица 2. Связь между клеточными процессами количественно с помощью кинематического анализа их регуляции на молекулярном уровне. Ссылки на различных исследований , связывающих количественное клеточных процессов на результатах биохимических и молекулярных анализов в различных видах и органах. Ксилоглюкан endotransglucosylase (XET), малонового (MDA), циклин-зависимых киназ (CDK). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой таблицы.
Access restricted. Please log in or start a trial to view this content.
протокол
Примечание: Следующий протокол для кинематического анализа действительна только для листьев во время стационарного роста. Это предполагает стабильную скорость листа удлинением и пространственные структуры , длины клеток и расширения в листе в течение периода нескольких дней 6.
1. Рост растений и измерения листьев Удлинение Rate (МПУ)
- Выберите лист в установившемся роста и стадии развития интереса.
Примечание: Существует разница между стационарному роста и повторяющегося роста, что предполагает сходные пространственные узоры на последовательных листьев на той же оси. На ранних стадиях роста всходов, последующие листья , как правило , становятся все более быстрее из - за увеличения размера зоны роста 7. Хотя несколько более высокие позиции листа могут иметь аналогичные показатели роста 8, это переходная фаза , которая может повлиять на лечение под следствием. Поэтому важно, чтобы сравнить линии и тр eatments строго на том же самом положении листа, даже если оно может развиваться в разное время. Даже при постоянной скорости удлинения профиль скорости роста не обязательно же на разных стадиях развития. Поэтому, важно , чтобы проанализировать листьев на той же стадии развития 8, как правило , определяется количеством дней после появления всходов. - Для того, чтобы выполнить полный кинематический анализ роста листьев у однодольных, растут по крайней мере 15 растений для каждой обработки и генотипа в контролируемых условиях в помещении роста.
- В то время , лист интереса появляется (выход из мутовки окружающих листьев), начать измерение длины листа ежедневно с линейкой , пока лист не будет полностью расширен (рис 1i). Длина листа подразумевает длину от уровня почвы до кончика листа. Будьте осторожны, чтобы не сломать или повредить лист, так как это может изменить свой рост.
Re 1 "SRC =" / файлы / ftp_upload / 54887 / 54887fig1.jpg "/>
Рисунок 1:. Схематический обзор кинематической анализа листьев кукурузы Лист интерес измеряется с помощью линейки в течение трех дней подряд , чтобы вычислить Leaf Удлинение Rate (LER). После этого лист собирают и сегмент трехсантиметрового используется для определения размера меристемы. Это делается путем измерения длины от основания до самой дистальной митотической фигуры после DAPI окрашивания. (A) Примеры пролиферативных митотических фигур и (В) формообразующих фигур митоза. Первые одиннадцать сантиметров от основания листа на другой стороне средней вены используются для резки десять сегментов одного сантиметра для измерения длины ячейки. Эти измерения служат основой для создания профиля длины ячейки, которая служит для определения длины зрелой клетки (л мат) и длину клеток , выходящих из меристемы (л дел). LER и л мат используются для расчета скорости производства клеток (P), а л DIV и L - мер используются для расчета количества клеток в меристемы (N меров). В свою очередь, Р и N - мер используются для вычисления средней скорости деления клеток (D), который является обратным к длительности клеточного цикла (T c). Стрелки одного и того же цвета указывают на параметры, которые используются для вычисления параметра следующее на этих стрелок. Шкала баров = 40 мкм. Римские цифры используются для обозначения конкретных экспериментальных процедур , описанных в протоколе. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
2. Уборка урожая
- На стадии развития интереса (например, на третий день после появления всходов), выбрать по крайней мере , пять представительную рЛанц из партии, на котором для проведения кинематического анализа. Продолжить измерения остальных растений, как описано в пункте 1.3 для определения конечной длины листа.
- Вырезать наземную часть растения. Чтобы сохранить меристематическую часть нетронутыми, вырезать как можно ближе к корням (рис 1II).
- Начиная от внешних листьев, удалить все листья до листа интереса, осторожно разворачивая их один за другим. При необходимости, удалите несколько дополнительных миллиметров от основания, чтобы отделить листья. Также удалите апекса и маленькие листья приложенные листом интереса (рис 1iii).
- Вырезать сегмент 3 см, начиная от основания на одной стороне средней вены, и хранить ее в 1,5 мл пробирку, наполненную смесью 3: 1 (по объему), абсолютный этанол: раствор уксусной кислоты (ОСТОРОЖНО: носить перчатки) на 4 ° С в течение 24 ч до нескольких месяцев (Рисунок 1IV). Этот сегмент будет позже использоваться для определения длины меристемы.
- ИзДругая сторона вены, вырезать сегмент 11 см от основания (рис 1 V) и поместите его в 15 мл пробирку , заполненную абсолютным этанолом при температуре 4 ° С в течение по меньшей мере 6 ч для удаления пигментов (рисунок 1 VI).
Примечание: В дальнейшем, использовать только первые 10 см для определения профиля длины ячейки (см Обсуждение). - Заменить абсолютный этанол для другого раунда очистки при 4 ° С в течение по меньшей мере 24 ч (рис 1vi).
- И, наконец, заменить абсолютный этанол с чистой молочной кислоты (ОСТОРОЖНО: носить перчатки) для очистки и хранения при 4 ° С в течение 24 ч или до дальнейшего использования (рисунок 1vi).
3. Длина Измерения меристемы
- Приготовьте полоскание буфера, содержащего 50 мМ хлорида натрия (NaCl), 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА; ВНИМАНИЕ: носить перчатки) и 10 мМ Трис (гидроксиметил) хлористоводородной кислоты (Tris-HCl, рН 7).
- Возьмем сегмент 3 см из раздела 2.4 и такак его в буфере в течение 20 мин (рис 1vii).
- Во время ожидания, используют промывную буфер для подготовки 4 ', 6-диамидино-2-фенилиндола (DAPI) окрашивающий раствор 1 мкг / мл, держа его на льду и в темноте.
- Пятно ядра путем размещения сегмента меристемы в течение 2-5 мин в растворе для окрашивания DAPI. Работа на льду и в темноте (рис 1vii).
- Проверьте флуоресцентного сигнала путем быстрого монтажа сегмент на стекле микроскопа и покрывая ее покровным стеклом. В эпидермальные клетки должны проявлять флуоресценцию, в то время как основные клеточные слои не должны.
- Если окрашивание недостаточно, поместить сегмент обратно в окрашивающего раствора DAPI в течение нескольких дополнительных минут.
- Чтобы остановить окрашивания, смонтировать сегменты в капле ополаскивания буфера на слайде микроскопа и крышкой с защитным стеклом.
- С помощью микроскопа, оборудованного УФ-флуоресценции при увеличении 20Х, что позволяет визуализации около 1000 эпидермисаAl клетки сразу. Прокрутка по всему сегменту и искать пролиферативных фигуры митоза (метафазных, анафазе, телофазе и цитокинеза), но избежать формирующее деление клеток развивающегося устьиц (рис 1viii) 9. Определите, где наиболее дистальной фигура митоза находится.
- Определить длину меристемы путем измерения расстояния между основанием листа и наиболее дистальной эпидермальной митотической фигуры. Используйте программное обеспечение анализа изображений (например, ImageJ) для измерения полной длины кадра изображения.
- Подсчитайте количество кадров , которые охватывают всю длину меристемы (от основания листа к наиболее дистальной митотической фигуры) и умножить это число на длину одного кадра , чтобы получить полную длину меристемы (рис 1ix).
4. Ячейка Длина профиля
- Возьмите сегмент, который хранится в молочной кислоте (этап 2.5) и аккуратно поместите его на скамейке запасных. Обрежьте сегменты остроумиега скальпель в 10 сегментах 1 см каждая (рис 1x).
- Установите последовательные сегменты листьев на микроскопии горкой в небольшую каплю молочной кислоты. Убедитесь в том, чтобы постоянно сталкиваться либо адаксиальная или абаксиальный стороной вверх. В принципе, нет никакого предпочтения определенной стороны.
- С помощью микроскопа, снабженного дифференциального интерференционного контраста (DIC) оптики для анализа сегментов, начиная от основания листа. Измерение с помощью программного обеспечения для анализа изображений в длину по меньшей мере 20 Репликация эпидермальных клеток в файлах, непосредственно примыкающих к устьичными файлов для того, чтобы последовательно выбрать один и тот же тип клеток.
- Делайте это в равномерно расположенных местах вдоль каждого из сегментов (4 позиции в сегменте) хватает, и убедитесь в том , чтобы записать соответствующее положение для каждого измерения на протяжении всего листа (рис 1xi).
- Определить среднюю длину ячейки в каждый мм вдоль оси листа с помощью локального полиномиального сглаживания рrocedure, реализованный в R-сценария (рис 1xii; Дополнительный файл 1).
Примечание: R-сценарий предоставляет ряд данных с увеличением разглаживанию. Количество сглаживания требуется несколько произвольно и в идеале должен просто удалить локальный шум, но не влияет на общую кривую. Убедитесь в том, чтобы использовать такое же количество сглаживания для всех образцов в течение одного эксперимента. - Нормальное длину ячейки в каждой позиции между растениями и вычислить стандартную ошибку, чтобы создать профиль длина ячейки вдоль оси листа.
5. Расчеты кинематических параметров (см Дополнительный файл 2)
- Вычислить LER, принимая изменение длины листа между двумя последовательными моментами времени (например, 24 часа в сутки, как на стадии 1.3) и разделив его на интервал времени.
- Вычислить длину зоны роста (L ГЗ) , соответствующий положению дистально от основания , где клетки достигают 95% их зрелого CEдлина LL на сглаженного профиле длины ячейки.
- Возьмем для каждой позиции на сглаженного длина ячейки профиля 95% от среднего значения всех длин клеток после этой позиции (рисунок 2).
- Сравните сглажена длины ячейки (шаг 4.4) с расчетной длины ячейки 95% на каждой позиции. Начиная от основания листа, зона роста заканчивается в положении , когда фактическая длина ячейки равна 95% от следующей длины клеток (рисунок 2, см дополнительные данные 2).
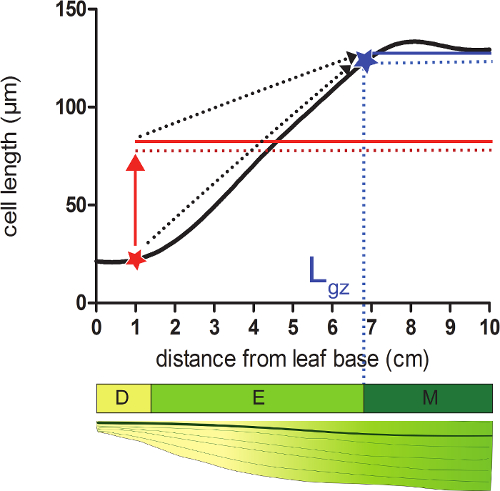
Рисунок 2:. Определение конца зоны роста меристемы: В положении , указанном с красной звездой, фактический размер ячейки меньше , чем 95% (красная пунктирная линия) от среднего размера ячейки всех клеток после этой позиции (красного твердого вещества линия). Конец зоны роста (L GZ, обозначается ABLUE звезда) находится где 95% (пунктирная синяя линия) от среднего размера ячейки всех клеток после этой позиции (сплошная синяя линия) равен действительному размеру ячейки. Разделение зоны (D), удлинение зоны (Е), и зрелыми зона (М). Пунктирные стрелки указывают на сближение между местным размером до 95% от среднего размера по сравнению с дистальной части листа при перемещении из базальных позиций до кончика листа. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Вычислить длину удлинения зоны (L ЭБ) как разность между длиной зоны роста (L ГЗ) и размер меристемы (L мерным, определенный на стадии 3).
- Вычислить длину зрелой клетки (л мат) в качестве средней длины ячейки в зрелой зоне.
- Разделите LER на л коврик , чтобы получитьскорость производства клеток (P).
- Подсчитать количество клеток в зоне растяжения (N - эль) как разность между N ГЗ и N меров. Число клеток в меристемы (N меров) равен совокупному количеству клеток , расположенных в интервалах , соответствующих меристемы. Число клеток в зоне роста (N ГЗ) равен совокупному количеству клеток , расположенных в интервалах , соответствующих зоне роста.
- Вычислить среднюю скорость деления клеток (D) , как P / N меров. Продолжительность клеточного цикла (Т с) равен п (2) / D.
- Рассчитайте время в зоне растяжения (Т - эль) путем деления N EL Р. Время в зоне деления равна Log 2 (N мерная) * Т с. Длина клеток , выходящих из меристемы (л дел)равна длине ячейки из сглаженного профиля длины клеток в конце меристемы.
- Вычислить среднюю скорость расширения ячейки (R - эль) , используя следующую формулу: п (л мат) -ln (L дел)] / T эл.
Access restricted. Please log in or start a trial to view this content.
Результаты
Здесь мы покажем, сравнение между хорошо орошаемые растений (контроль, 54% содержания воды в почве, (SWC)) и растений, подвергнутых условиях засухи (засуха, 34% ПВС) с точки зрения их роста листа. Все растения выращивали в ростовой камере в контролируемых условиях (16 ч день / 8 ?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Полный кинематический анализ на листьях кукурузы позволяет определять клеточной основе роста листьев и позволяет для разработки эффективных стратегий выборки. Хотя протокол относительно проста, некоторая осторожность рекомендуется в следующих важных шагов: (1) Важно отделить молоды...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана кандидатской стипендий из Университета Антверпен VA; доктора философии стипендии от фламандского научного фонда (FWO, 11ZI916N) в КС; Проектные гранты от FWO (G0D0514N); исследовательский грант совместные научно-исследовательской деятельности (ГОА), "Системный подход биологии листьев морфогенеза" из исследовательского совета Университета Антверпена; и межвузовская Привлечение поляков (IUAP VII / 29, MARS), "Маис и Arabidopsis корней и проростков роста» от бельгийского Федерального управления научной политики (BELSPO) до GTSB Хань Asard, Bulelani Л. Sizani и Hamada AbdElgawad все это способствовало видео ,
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Pots | Any | Any | We use pots with the following measures, but can be different depending on the treatment/study: bottom diameter: 11 cm, opening diameter: 15 cm, height: 12 cm. We grow one maize plant per pot. |
| Planting substrate | Any | Any | We use potting medium (Jiffy, The Netherlands), but other substrates can be used, depending on treatment/study. |
| Ruler | Any | Any | An extension ruler that covers at least 1.5 meters is needed to measure the final leaf length of the plants. |
| Seeds | Any | NA | Seeds can be ordered from a breeder. |
| Scalpel | Any | Any | The scalpel is used during leaf harvesting to detach the leaf of interest from its surrounding leaves and right after harvesting to cut a proper sample for cell length and meristem length measurements. |
| 15 mL falcon tubes | Any | Any | The 15 mL falcon tubes are used for storing samples used for cell length measurements during sample clearing with absolute ethanol and lactic acid. |
| Eppendorf tubes | Any | Any | The eppendorf tubes are used for storing samples used for meristem length measurements in ethanol:acetic acid 3:1 (v:v) solution. |
| Gloves | Any | Any | Latex gloves, which protect against corrosive reagents. |
| Acetic acid | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1; Flammable liquids, categories 1,2,3 |
| Absolute ethanol | Any | Any | CAUTION: Hazardous in case of skin contact (irritant), of eye contact (irritant), of inhalation. Slightly hazardous in case of skin contact (permeator), of ingestion |
| Lactic acid >98% | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1 |
| Sodium chloride (NaCl) | Any | Any | |
| Ethylenediaminetetraacetic acid (EDTA) | Any | Any | CAUTION: Acute toxicity (oral, dermal, inhalation), category 4 Skin irritation, category 2 Eye irritation, category 2 Skin sensitisation, category 1 Specific Target Organ Toxicity – Single exposure, category 3 |
| Tris(hydroxymethyl)aminomethane hydrochloride (Tris-HCl) | Any | Any | This material can be an irritant, contact with eyes and skin should be avoided. Inhalation of dust may be irritating to the respiratory tract. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Any | Any | Cell permeable fluorescent minor groove-binding probe for DNA. Causes skin irritation. May cause an allergic skin reaction. May cause respiratory irritation. |
| Ice | Any | NA | The DAPI solution has to be kept on ice. |
| Fluorescent microscope | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any fluorescent microscope can be used for determining meristem length. | |
| Microscopic slide | Any | Any | |
| Cover glass | Any | Any | |
| Tweezers | Any | Any | Tweezers are needed for unfolding the rolled maize leaf right after harvesting in order to cut a proper sample for cell length and meristem length measurements. |
| Image-analysis software | Axiovision (Release 4.8) from Zeiss | NA | The software can be downloaded at: http://www.zeiss.com/microscopy/en_de/downloads/axiovision.html. Other softwares such as ImageJ (https://imagej.nih.gov/ij/) could be used as well. |
| Microscope equipped with DIC | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any microscope, equipped with differential interference contrast (DIC) can be used to measure cell lengths. | |
| R statistical analysis software | R Foundation for Statistical Computing | NA | Open source; Could be downloaded at https://www.r-project.org/ |
| R script | NA | NA | We use the kernel smoothing function locpoly of the Kern Smooth package (Wand MP, Jones MC. Kernel Smoothing: Chapman & Hall/CRC (1995)). The script is available for Mac and Windows upon inquiry with the corresponding author. |
Ссылки
- Fiorani, F., Beemster, G. T. S. Quantitative analyses of cell division in plants. Plant Mol. Biol. 60, 963-979 (2006).
- Silk, W. K., Erickson, R. O. Kinematics of Plant-Growth. J. Theor. Biol. 76, 481-501 (1979).
- Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S. Kinematic Analysis of Cell Division and Expansion. Plant Developmental Biology. Hennig, L., Köhler, C. , Chapter 14 (2010).
- Avramova, V., Sprangers, K., Beemster, G. T. S. The Maize Leaf: Another Perspective on Growth Regulation. Trends Plant Sci. 20, 787-797 (2015).
- Rymen, B., et al. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol. 143, 1429-1438 (2007).
- Muller, B., Reymond, M., Tardieu, F. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot. 52, 1259-1268 (2001).
- Beemster, G. T. S., Masle, J., Williamson, R. E., Farquhar, G. D. Effects of soil resistance to root penetration on leaf expansion in wheat (Triticum aestivum L): Kinematic analysis of leaf elongation. J. Exp. Bot. 47, 1663-1678 (1996).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Spatial and Temporal Aspects of Leaf Growth-Inhibition. Planta. 191, 433-439 (1993).
- Sylvester, A. W., Smith, L. G. Cell Biology of Maize Leaf Development. Handbook of maize: It's Biology. Bennetzen, J. L., Hake, S. C. , Springer. NY. (2009).
- Nelissen, H., et al. A Local Maximum in Gibberellin Levels Regulates Maize Leaf Growth by Spatial Control of Cell Division. Curr. Biol. 22, 1183-1187 (2012).
- Avramova, V., et al. Drought Induces Distinct Growth Response, Protection, and Recovery Mechanisms in the Maize Leaf Growth Zone. Plant Physiol. 169, 1382-1396 (2015).
- Picaud, J. C., et al. Total malondialdehyde (MDA) concentrations as a marker of lipid peroxidation in all-in-one parenteral nutrition admixtures (APA) used in newborn infants. Pediatr. Res. 53, 406(2003).
- Basu, P., Pal, A., Lynch, J. P., Brown, K. M. A novel image-analysis technique for kinematic study of growth and curvature. Plant Physiol. 145, 305-316 (2007).
- Vander Weele, C. M., et al. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132, 1138-1148 (2003).
- Nelissen, H., Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S. Plant Organogenesis. DeSmet, I. , Chapter 17 (2013).
- Ben-Haj-Salah, H., Tardieu, F. Temperature Affects Expansion Rate of Maize Leaves without Change in Spatial-Distribution of Cell Length - Analysis of the Coordination between Cell-Division and Cell Expansion. Plant Physiol. 109, 861-870 (1995).
- Fiorani, F., Beemster, G. T. S., Bultynck, L., Lambers, H. Can meristematic activity determine variation in leaf size and elongation rate among four Poa species? A kinematic study. Plant Physiol. 124, 845-855 (2000).
- Pettko-Szandtner, A., et al. Core cell cycle regulatory genes in rice and their expression profiles across the growth zone of the leaf. J. Plant Res. 128, 953-974 (2015).
- Poorter, H., Remkes, C. Leaf-Area Ratio and Net Assimilation Rate of 24 Wild-Species Differing in Relative Growth-Rate. Oecologia. 83, 553-559 (1990).
- Macadam, J. W., Volenec, J. J., Nelson, C. J. Effects of Nitrogen on Mesophyll Cell-Division and Epidermal-Cell Elongation in Tall Fescue Leaf Blades. Plant Physiol. 89, 549-556 (1989).
- Tardieu, F., Granier, C. Quantitative analysis of cell division in leaves: methods, developmental patterns and effects of environmental conditions. Plant Mol. Biol. 43, 555-567 (2000).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Possible Role of Some Mineral Elements in Growth-Inhibition. Planta. 196, 699-705 (1995).
- Erickson, R. O., Sax, K. B. Rates of Cell-Division and Cell Elongation in the Growth of the Primary Root of Zea-Mays. P. Am. Philos. Soc. 100, 499-514 (1956).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Goodwin, R. H., Stepka, W. Growth and differentiation in the root tip of Phleum pratense. Am. J. Bot. 32, 36-46 (1945).
- Hejnowicz, Z. Growth and Cell Division in the Apical Meristem of Wheat Roots. Physiologia Plantarum. 12, 124-138 (1959).
- Gandar, P. W. Growth in Root Apices .1. The Kinematic Description of Growth. Bot. Gaz. 144, 1-10 (1983).
- Baskin, T. I., Cork, A., Williamson, R. E., Gorst, J. R. Stunted-Plant-1, a Gene Required for Expansion in Rapidly Elongating but Not in Dividing Cells and Mediating Root-Growth Responses to Applied Cytokinin. Plant Physiol. 107, 233-243 (1995).
- Sacks, M. M., Silk, W. K., Burman, P. Effect of water stress on cortical cell division rates within the apical meristem of primary roots of maize. Plant Physiol. 114, 519-527 (1997).
- Granier, C., Tardieu, F. Spatial and temporal analyses of expansion and cell cycle in sunflower leaves - A common pattern of development for all zones of a leaf and different leaves of a plant. Plant Physiol. 116, 991-1001 (1998).
- De Veylder, L., et al. Functional analysis of cyclin-dependent kinase inhibitors of Arabidopsis. Plant Cell. 13, 1653-1667 (2001).
- Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. J. Exp. Bot. 55, 1021-1032 (2004).
- Kutschmar, A., et al. PSK-alpha promotes root growth in Arabidopsis. New Phytol. 181, 820-831 (2009).
- Vanneste, S., et al. Plant CYCA2s are G2/M regulators that are transcriptionally repressed during differentiation. Embo J. 30, 3430-3441 (2011).
- Eloy, N. B., et al. Functional Analysis of the anaphase-Promoting Complex Subunit 10. Plant J. 68, 553-563 (2011).
- Eloy, N. B., et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization. P. Natl. Acad. Sci. USA. 109, 13853-13858 (2012).
- Dhondt, S., et al. SHORT-ROOT and SCARECROW Regulate Leaf Growth in Arabidopsis by Stimulating S-Phase Progression of the Cell Cycle. Plant Physiol. 154, 1183-1195 (2010).
- Baute, J., et al. Correlation analysis of the transcriptome of growing leaves with mature leaf parameters in a maize RIL population. Genome Biol. 16, (2015).
- Andriankaja, M., et al. Exit from Proliferation during Leaf Development in Arabidopsis thaliana: A Not-So-Gradual Process. Dev. Cell. 22, 64-78 (2012).
- Beemster, G. T. S., et al. Genome-wide analysis of gene expression profiles associated with cell cycle transitions in growing organs of Arabidopsis. Plant Physiol. 138, 734-743 (2005).
- Spollen, W. G., et al. Spatial distribution of transcript changes in the maize primary root elongation zone at low water potential. Bmc Plant Biol. 8, (2008).
- Candaele, J., et al. Differential Methylation during Maize Leaf Growth Targets Developmentally Regulated Genes. Plant Physiol. 164, 1350-1364 (2014).
- West, G., Inze, D., Beemster, G. T. S. Cell cycle modulation in the response of the primary root of Arabidopsis to salt stress. Plant Physiol. 135, 1050-1058 (2004).
- Zhang, Z., Voothuluru, P., Yamaguchi, M., Sharp, R. E., Peck, S. C. Developmental distribution of the plasma membrane-enriched proteome in the maize primary root growth zone. Front. Plant Sci. 4, (2013).
- Bonhomme, L., Valot, B., Tardieu, F., Zivy, M. Phosphoproteome Dynamics Upon Changes in Plant Water Status Reveal Early Events Associated With Rapid Growth Adjustment in Maize Leaves. Mol. Cell Proteomics. 11, 957-972 (2012).
- Schnyder, H., Nelson, C. J. Growth-Rates and Assimilate Partitioning in the Elongation Zone of Tall Fescue Leaf Blades at High and Low Irradiance. Plant Physiol. 90, 1201-1206 (1989).
- Schnyder, H., Nelson, C. J., Spollen, W. G. Diurnal Growth of Tall Fescue Leaf Blades .2. Dry-Matter Partitioning and Carbohydrate-Metabolism in the Elongation Zone and Adjacent Expanded Tissue. Plant Physiol. 86, 1077-1083 (1988).
- Schnyder, H., Nelson, C. J. Growth-Rates and Carbohydrate Fluxes within the Elongation Zone of Tall Fescue Leaf Blades. Plant Physiol. 85, 548-553 (1987).
- Vassey, T. L., Shnyder, H. S., Spollen, W. G., Nelson, C. J. Cellular Characterisation and Fructan Profiles in Expanding Tall Fescue. Curr. T. Pl. B. 4, 227-229 (1985).
- Allard, G., Nelson, C. J. Photosynthate Partitioning in Basal Zones of Tall Fescue Leaf Blades. Plant Physiol. 95, 663-668 (1991).
- Spollen, W. G., Nelson, C. J. Response of Fructan to Water-Deficit in Growing Leaves of Tall Fescue. Plant Physiol. 106, 329-336 (1994).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .1. Relationship to Genetically Altered Leaf Elongation Rates. Plant Physiol. 74, 590-594 (1984).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .2. Relationship to Leaf Elongation Rates Modified by Nitrogen-Fertilization. Plant Physiol. 74, 595-600 (1984).
- Silk, W. K., Walker, R. C., Labavitch, J. Uronide Deposition Rates in the Primary Root of Zea-Mays. Plant Physiol. 74, 721-726 (1984).
- Granier, C., Inze, D., Tardieu, F. Spatial distribution of cell division rate can be deduced from that of p34(cdc2) kinase activity in maize leaves grown at contrasting temperatures and soil water conditions. Plant Physiol. 124, 1393-1402 (2000).
- Voothuluru, P., Sharp, R. E. Apoplastic hydrogen peroxide in the growth zone of the maize primary root under water stress.1. Increased levels are specific to the apical region of growth maintenance. J. Exp. Bot. 64, 1223-1233 (2012).
- Wu, Y. J., Jeong, B. R., Fry, S. C., Boyer, J. S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential. Planta. 220, 593-601 (2005).
- Macadam, J. W., Nelson, C. J., Sharp, R. E. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .1. Spatial-Distribution of Ionically Bound Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 872-878 (1992).
- Macadam, J. W., Sharp, R. E., Nelson, C. J. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .2. Spatial-Distribution of Apoplastic Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 879-885 (1992).
- Beemster, G. T. S., De Vusser, K., De Tavernier, E., De Bock, K., Inze, D. Variation in growth rate between Arabidopsis ecotypes is correlated with cell division and A-type cyclin-dependent kinase activity. Plant Physiol. 129, 854-864 (2002).
- Kavanova, M., Lattanzi, F. A., Schnyder, H. Nitrogen deficiency inhibits leaf blade growth in Lolium perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates. Plant Cell Environ. 31, 727-737 (2008).
- Macadam, J. W., Nelson, C. J. Secondary cell wall deposition causes radial growth of fibre cells in the maturation zone of elongating tall fescue leaf blades. Ann. Bot-London. 89, 89-96 (2002).
- Schnyder, H., Nelson, C. J. Diurnal Growth of Tall Fescue Leaf Blades .1. Spatial-Distribution of Growth, Deposition of Water, and Assimilate Import in the Elongation Zone. Plant Physiol. 86, 1070-1076 (1988).
- Gastal, F., Nelson, C. J. Nitrogen Use within the Growing Leaf Blade of Tall Fescue. Plant Physiol. 105, 191-197 (1994).
- Vanvolkenburgh, E., Boyer, J. S. Inhibitory Effects of Water Deficit on Maize Leaf Elongation. Plant Physiol. 77, 190-194 (1985).
- Silk, W. K., Hsiao, T. C., Diedenhofen, U., Matson, C. Spatial Distributions of Potassium, Solutes, and Their Deposition Rates in the Growth Zone of the Primary Corn Root. Plant Physiol. 82, 853-858 (1986).
- Meiri, A., Silk, W. K., Lauchli, A. Growth and Deposition of Inorganic Nutrient Elements in Developing Leaves of Zea-Mays L. Plant Physiol. 99, 972-978 (1992).
- Neves-Piestun, B. G., Bernstein, N. Salinity-induced inhibition of leaf elongation in maize is not mediated by changes in cell wall acidification capacity. Plant Physiol. 125, 1419-1428 (2001).
- Bouchabke, O., Tardieu, F., Simonneau, T. Leaf growth and turgor in growing cells of maize (Zea mays L.) respond to evaporative demand under moderate irrigation but not in water-saturated soil. Plant Cell Environ. 29, 1138-1148 (2006).
- Westgate, M. E., Boyer, J. S. Transpiration-Induced and Growth-Induced Water Potentials in Maize. Plant Physiol. 74, 882-889 (1984).
- Horiguchi, G., Gonzalez, N., Beemster, G. T. S., Inze, D., Tsukaya, H. Impact of segmental chromosomal duplications on leaf size in the grandifolia-D mutants of Arabidopsis thaliana. Plant J. 60, 122-133 (2009).
- Fleury, D., et al. The Arabidopsis thaliana homolog of yeast BRE1 has a function in cell cycle regulation during early leaf and root growth. Plant Cell. 19, 417-432 (2007).
- Vlieghe, K., et al. The DP-E2F-like gene DEL1 controls the endocycle in Arabidopsis thaliana. Curr. Biol. 15, 59-63 (2005).
- Boudolf, V., et al. The plant-specific cyclin-dependent kinase CDKB1;1 and transcription factor E2Fa-DPa control the balance of mitotically dividing and endoreduplicating cells in Arabidopsis. Plant Cell. 16, 2683-2692 (2004).
- Baskin, T. I., Beemster, G. T. S., Judy-March, J. E., Marga, F. Disorganization of cortical microtubules stimulates tangential expansion and reduces the uniformity of cellulose microfibril alignment among cells in the root of Arabidopsis. Plant Physiol. 135, 2279-2290 (2004).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены