Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Chemischen Niederschlag-Methode für die Synthese von Nb2O5 geändert, Bulk-Nickel-Katalysatoren mit hoher spezifischer Oberfläche
In diesem Artikel
Zusammenfassung
Ein Protokoll für die Synthese von schwammartige und Falten-wie Ni1 XNbXO Nanopartikel durch chemische Fällung wird vorgestellt.
Zusammenfassung
Wir zeigen eine Methode für die Synthese von NiXNb1 XO Katalysatoren mit schwammartige und Falten-wie Nanostrukturen. Durch Variation der Nb:Ni Verhältnis, eine Reihe von NiXNb1 XO-Nanopartikel mit einer unterschiedlichen atomaren Zusammensetzung (X = 0,03, 0,08, 0,15 bis 0,20) durch chemische Fällung vorbereitet worden. Diese NiXNb1 XO Katalysatoren zeichnen sich durch x-ray Diffraction, Röntgen-Photoelektronen-Spektroskopie und Rasterelektronenmikroskopie. Die Studie ergab das schwammartige und Falten-wie Aussehen des Ni0,97Nb0,03O und Ni0,92Nb0,08O auf die NiO-Oberfläche und die größere Fläche dieser NiXNb1 XO Katalysatoren, verglichen mit der Masse NiO. Maximale Fläche von 173 m2/g erhalten Sie für Ni0,92Nb0,08O Katalysatoren. Darüber hinaus wurden die katalytische Hydroconversion von Lignin-abgeleitete Verbindungen mit der synthetisierten Ni0,92Nb0,08O Katalysatoren untersucht.
Einleitung
Die Vorbereitung von Nanocomposites hat zunehmende Aufmerksamkeit durch ihre entscheidende Anwendung in verschiedenen Bereichen erhalten. Um Ni-Nb-O gemischt-Nanopartikeln vorzubereiten, haben wie trockene Mischverfahren,71,2,3,4,5,6 verschiedene Methoden entwickelt worden, 9,10,11,12,13 Sol-Gel-Methode, 8 Verdunstung Methode,15 ,14 thermische Zersetzung Methode und Auto-Verbrennung. 16 in einem typischen Verdunstung Methode9, wässrigen Lösungen, die mit der entsprechenden Menge an Metall Vorstufen Nickel Nitrat Hexahydrat und Ammonium Niob Oxalat waren beheizt bei 70 ° C. Nach dem Entfernen des Lösungsmittels und weitere Trocknung und Kalzinieren erhielt das Mischoxid. Dieser Oxid-Katalysatoren weisen hervorragende katalytische Aktivität und Selektivität gegenüber oxidativen Dehydrierung (ODH) von Ethan, bezogen auf die elektronischen und strukturellen Neuordnung induziert durch den Einbau von Niob kationen im NiO Gitter . 11 die Einfügung von Nb sinkt drastisch die elektrophiler Sauerstoffspezies, die Oxidationsreaktionen von Ethan12verantwortet. Infolgedessen Erweiterungen dieser Methode hätte bei der Vorbereitung von verschiedenen Arten von Ni-Me-O Mischoxiden, wo mir = Li, Mg, Al, Ga, Ti und Ta. 13 es wird festgestellt, dass die Variation des Metall Dotierstoffe könnte unselektiv und elektrophiler Sauerstoffradikale von NiO zu ändern, damit systematisch optimieren die ODH Aktivität und Selektivität gegenüber Ethan. Jedoch im Allgemeinen die Oberfläche diese Oxide ist relativ klein (< 100 m2/g), aufgrund der erweiterten Phase Trennung und die Bildung von großen Nb2O5 Kristallite, und behindert somit ihre Verwendung in anderen katalytische Anwendungen.
Trocken mischen Methode, auch bekannt als die Solid-State-Schleifen, ist eine andere häufig verwendete Methode, die gemischt-Oxid-Katalysatoren vorzubereiten. Da die katalytische Materialien in ein Lösungsmittel-freie Weise erhalten werden, bietet diese Methode eine vielversprechende grüne und nachhaltige Alternative zur Vorbereitung der gemischt-Oxid. Die höchste Fläche, die durch diese Methode erhalten ist 172 m2/g für Ni80Nb20 bei Kalzinierung Temperatur von 250 ° C. 8 allerdings ist diese Solid-State-Methode nicht zuverlässig als Reaktionspartner auf atomarer Skala nicht gut gemischt sind. Daher eine bessere Kontrolle über chemische Homogenität und bestimmte Partikelgrößenverteilung und Morphologie, andere geeigneten Methoden zur Vorbereitung der Ni-Nb-O gemischt Oxid, die Nanopartikel noch gesucht werden. 7
Unter den verschiedenen Strategien bei der Entwicklung von Nanopartikeln dient chemische Fällung als eine der vielversprechende Methoden, um die Nanocatalysts zu entwickeln, da es die komplette Niederschlag von Metallionen erlaubt. Außerdem sind Nanopartikel aus höheren Flächen häufig mithilfe dieser Methode vorbereitet. Um die katalytischen Eigenschaften von Ni-Nb-O Nanopartikeln zu verbessern, berichten wir hier das Protokoll für die Synthese einer Reihe von Ni-Nb-O gemischt Oxid Katalysatoren mit hoher Oberfläche durch chemische Fällung Methode. Wir bewiesen, dass das Molverhältnis von Nb:Ni ein entscheidender Faktor ist bei der Bestimmung der katalytischen Aktivität von Oxiden in Richtung der Hydrodeoxygenation Lignin abgeleitet organischer Verbindungen. Mit hohen Nb:Ni Verhältnis oben 0,087 bildeten sich inaktive NiNb2O6 Arten. NI0,92Nb0,08O, die die größte Fläche (173 m2/g), Exponate Falten-wie Nanosheets Strukturen und zeigte die beste Aktivität und Selektivität gegenüber der Hydrodeoxygenation der Anisole zu Cyclohexan.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Vorsicht: Für den richtigen Umgang mit Methoden, Eigenschaften und Toxizität von Chemikalien, die in diesem Dokument beschriebenen beziehen sich auf die entsprechenden Sicherheitsdatenblätter (SDB). Einige der verwendeten Chemikalien sind giftig und krebserregende und besondere sorgen müssen getroffen werden. Nanomaterialien können möglicherweise Gefahren für die Sicherheit und Gesundheitseffekte darstellen. Einatmen und Haut Kontakt sollte vermieden werden. Aus Sicherheitsgründen muss ausgeübt werden, z. B. das Durchführen der Katalysator-Synthesis in der Dunst Haube und Katalysator Leistungsbewertung mit Autoklav Reaktoren. Persönlicher Schutzausrüstung muss getragen werden.
1. Vorbereitung des Ni0,97Nb0,03O Katalysatoren wo Nb:(Ni+Nb) molare Verhältnissen 0,03 gleich
- Kombinieren Sie 0,161 g von Niob (V) Oxalat Hydrat mit 2,821 g Nickel Nitrat in 100 mL entionisiertem Wasser in einem drei-necked Rundboden 250-mL-Kolben mit Stir Bar ausgestattet.
- Rühren Sie die Lösung bei 50 u/min und 70 ° C, um die Verbindungen bis das Verschwinden des Niederschlags mit einer Heizung Magnetrührer auflösen.
- Die Temperatur rasch auf 80 ° C mit einer Rate von 2 ° C/min zu erhöhen.
- Fügen Sie eine gemischte Basislösung [wässrigen Ammonium Hydroxid (50 mL, 1,0 M) und Natriumhydroxid (50 mL, 0,2 M)] in das Reaktionsgemisch tropfenweise, bis der pH-Wert der Lösung Ni/Nb 9,0 erreicht.
- Unter ständigem Rühren das Reaktionsgemisch, erhöhen Sie die Temperatur auf 120 ° C bei 2 ° C/min.
- Rühren Sie das Reaktionsgemisch über Nacht bei 50 u/min bei 120 ° C das völlige Verschwinden der grünen Farbe der Lösung.
- Induktiv gekoppelte Plasma-optische Emission-Spektrometrie (ICP-OES) Analyse nach der Lösung für die Konzentration der verbleibenden Ni2 + und Nb5 + -Ionen in der Lösung zu bewerten und gewährleisten die vollständige Fällung von verbleibenden nickel Nitrat.
- Das Solid durch Filtration mit Büchner Flasche zu sammeln. Waschen Sie den Volumenkörper durch Zugabe von 2 L entionisiertem Wasser wiederholt innerhalb von 20 min, das restliche Na+ -kation zu entfernen.
- Der Feststoff in einem Uhrglas zu sammeln. Trocknen Sie das Solid bei 110 ° C für 12 h im trockenen Ofen.
- Durch Erhitzen der Feststoffe in synthetischer Luft (20 mL/min O2 und 80 mL/min N2) bei 450 ° C für 5 h im Rohrofen Calcine. Überprüfen Sie alle Glaswaren für Mangel vor der Verwendung der hohen Temperatur der Reaktion.
- Erhalten Sie nach der Kalzinierung 1 g Ni0,97Nb0,03O Katalysator. Verwenden Sie geeigneten Schutzausrüstung wie Schutzbrille, Handschuhe, Kittel und Rauch Haube, Nanocrystal Reaktion aufgrund der potenziellen Gefahren für die Sicherheit und gesundheitliche Auswirkungen von Nanomaterialien durchzuführen.
2. Vorbereitung des Ni0,92Nb0,08O Katalysatoren wo Nb:(Ni+Nb) molare Verhältnissen 0,08 gleich
- Dieses Verfahren ist ähnlich der von 1 bis auf die ersten beiden Schritte:
- 0,43 g von Niob (V) Oxalat Hydrat in 100 mL entionisiertem Wasser auflösen.
- Separat, 2,675 g Nickel Nitrat in 100 mL entionisiertem Wasser auflösen.
3. Vorbereitung des Ni0,85Nb0,15O Katalysatoren wo Nb:(Ni+Nb) molare Verhältnissen 0,15 gleich
- Das Verfahren ist ähnlich der von 1 bis auf die ersten beiden Schritte:
- 0,807 g von Niob (V) Oxalat Hydrat in 100 mL entionisiertem Wasser auflösen.
- Separat, 2,472 g Nickel Nitrat in 100 mL entionisiertem Wasser auflösen.
4. Vorbereitung der Ni0,80Nb0,20O Katalysatoren wo Nb:(Ni+Nb) molare Verhältnissen 0,20 gleich
- Das Verfahren ist ähnlich der von 1 bis auf die ersten beiden Schritte:
- 1,076 g von Niob (V) Oxalat Hydrat in 100 mL entionisiertem Wasser auflösen.
- Separat, 2,326 g Nickel Nitrat in 100 mL entionisiertem Wasser auflösen.
5. Vorbereitung des Nb2O5 mit chemischen Fällung Methode
- Calcine niobic Säure (Nb2O5·nH2O) in synthetischer Luft für 5 h bei 450 ° C, pure Nb2O5 Partikel zu erhalten.
Hinweis: Bestätigen Sie die Fertigstellung der Reaktion unter Verwendung der Pulver Beugung (XRD) Röntgenstrahlanalyse, wo Nb2O5·nH2O ist amorph und Nb2O5 ist kristallin. Nach der Analyse war der Kalzinierung für 5 h bei 450 ° C genug, um die Reaktion abgeschlossen.
6. Synthese von β-O-4 Lignin Modell Verbindung, 2-(2-methoxyphenoxy)-1-phenylethan-1-one
- Bromoacetophenone (9,0 g, 45 Mmol) und 2-Methoxyphenol (6,6 g, 53 Mmol) in 200 mL Dimethylformamid (DMF) in einen 500-mL konische Kolben mit einem Magnetrührer auflösen. Verwenden Sie geeignete Ausrüstung und Rauch Schutzhaube, um die Reaktion mit korrosiven und krebserregende Chemikalien und Reagenzien durchzuführen.
- Mischen Sie die oben genannte DMF-Lösung mit Kaliumhydroxid (3,0 g, 53 Mmol) und rühren Sie die Mischung über Nacht bei 50 u/min bei Raumtemperatur mit magnetischen Rührer.
- Das Produkt mit der Mischung Lösung von H2O 200 mL und 600 mL Diethylether zu extrahieren (1:3, V/V) mit Trennung Trichter. Erhalten Sie die oberen Diethylether Schicht der Lösung.
- Fügen Sie MgSO4 (10 g) zur Aufnahme von Feuchtigkeit der Diethylether Lösung hinzu. Filtern Sie die MgSO4 um die Diethylether Lösung zu erhalten, durch die Verwendung von Filterpapier und Trichter.
- Nach Entfernung der Diethylether Lösung unter vermindertem Druck bei 0,08 MPa mit Drehverdampfer lösen sich die Rückstände in 5 mL Ethanol.
- Langsam verdunstet das Lösungsmittel Ethanol um das Produkt in einen 10-mL-Becherglas recrystallize. Ware (11,5 g) als gelbliches Pulver beziehen und die Ausbeute ist 90 % bezogen auf die Bromoacetophenone. Von 1H NMR-Analyse, 1H NMR (DMSO): δ 3,78 (s, 3 H, OCH3) 5.54 (s, 2 H, CH2) 6,82-8.01 (m, 9 H, aromatisch) ppm. 17
7. Hydrodeoxygenation Lignin-abgeleitete aromatische Ether
Hinweis: Die gewählten Lignin-abgeleitete aromatische Ether ist Anisole bei diesem Experiment und der Katalysator ist Ni0,92Nb0,08O. Einsatz geeigneter Schutzausrüstung und Abzugshaube, die Reaktion unter Verwendung der krebserregende Reagenzien durchzuführen.
- Rüsten Sie einen 50-mL-Edelstahl Autoklaven Reaktor mit einer Heizung und einem Magnetrührer.
- Reduzieren Sie Ni0,92Nb0,08O Katalysator (1 g) aus Schritt 2 im Autoklaven Reaktor in H2 Atmosphäre bei 400 ° C für 2 Stunden gewonnen und dann passiviert des Katalysators unter Argon (50 mL/min) über Nacht.
- Anisole (1,1712 g, 8 Gew.-%) in n-Decane (20 mL) mit dem Einsatz von n-Dodecane (0,2928 g, 2 Gew.-%) als interner Standard für die Analyse der quantitativen Gaschromatographie (GC) auflösen.
- Die reduzierte Katalysatoren (0,1 g) in den Autoklaven Reaktor Langzeitbelichtung mit Luft (< 5 min.) schnell zu stellen.
- Versiegeln des Autoklaven-Reaktors, Spülen mit H2 wiederholt (3 Mal, bei 3 MPa Druck), um Luft, und dann die Reaktionsmischung bei Atmosphärendruck zu beseitigen.
- Die Rührgeschwindigkeit bei 700 u/min eingestellt.
- Nach dem Erhitzen auf die gewünschte Temperatur bei 160-210 ° C bei 2 ° C/min, unter Druck den Autoklaven-Reaktor bis 3 MPa und stellen Sie die Null-Zeitpunkt (t = 0).
Hinweis: Der Temperaturbereich von 160-210 ° C eignet sich in diesem Bericht. - Anschließend kühlen Sie die Mischung auf Raumtemperatur bei 10 ° C/min sofort und analysieren Sie die sauerstoffarmes Produkte mit Gaschromatographie mit Masse selektive Detektor. 17
- Bestimmen Sie die Umwandlung von Lignin Modell Verbindung nach folgender Gleichung:

- Bestimmen Sie die Produktselektivität nach folgender Gleichung:
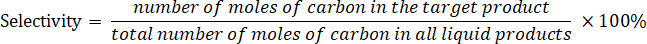
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Röntgendiffraktometrie (XRD) Muster (Abbildung 1 und Abbildung 2), BET Flächen, Temperatur programmierte Reduktion des Wasserstoffs mit Wasserstoff (H2- TPR), Rasterelektronenmikroskopie (SEM) ausgestattet mit einem Energy-dispersive x-ray (EDX )-Analysator, Röntgen-Photoelektronen-Spektroskopie (XPS) wurden für die Nanopartikel NiO, Ni-Nb-O und Nb2O5 Oxide17 (
Access restricted. Please log in or start a trial to view this content.
Diskussion
Eine der häufigsten Methoden zur Vorbereitung der Nickel-dotierte Bulk Niob-Nanopartikeln ist rotary Verdunstung-Methode. 9 durch den Einsatz von verschiedenen Bedingungen von Druck und Temperatur während des Prozesses der rotary Verdunstung, Niederschlag des Ni-Nb-O Partikel Handels mit dem langsamen Abbau des Lösungsmittels. Im Gegensatz zur rotary Verdunstung erhielt die chemische Fällung Methode berichtet in dieser Studie verstärkt um die Nanopartikel zu bereiten, wie dies erfordern nicht...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Wir haben nichts zu veröffentlichen.
Danksagungen
Wir erkennen dankbar die finanzielle Unterstützung durch National Key Research & Development Program des Ministeriums für Wissenschaft und Technologie der National Natural Science Foundation of China (Nr. 21573031 und 21373038), China (2016YFB0600305), Programm für hervorragende Talente in Dalian Stadt (2016RD09) und technologische und höhere Bildung Institute of Hong Kong (THEi SG1617105 und THEi SG1617127).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Niobium(V) oxalate hydrate, 98% | Alfa | L04481902 | |
| Nickel nitrate hexahydrate, 99% | Aladdin | N108891 | |
| Sodium hydroxide, 98% | Aladdin | S111501 | |
| Ammonium hydroxide, 23-25% | Aladdin | A112077 | |
| Anisole, 99% | Sinopharm | 81001728 | |
| Diphenyl ether, 98% | Aladdin | D110644 | |
| Phenol, 98% | Sinopharm | 100153008 | |
| 2-Methoxyphenol, 98% | Sinopharm | 30114526 | |
| Vanillin, 99.5% | Sinopharm | 69024316 | |
| Potassium hydroxide, AR | Aladdin | P112284 | |
| N,N-Dimethylformamide, 99.5% | Sinopharm | 40016462 | |
| 2-Bromoacetophenone,98% | Aladdin | B103328 | |
| Diethyl ether,99.5% | Sinopharm | 10009318 | |
| Decane,98% | Aladdin | D105231 | |
| Dodecane,99% | Aladdin | D119697 | |
| Niobic acid | CBMM | 1313968 | |
| Heating and Drying Oven | DHG Series (shanghai jinghong laboratory instrument co. ltd) | ||
| Autoclave Reactor | CJF-0.05—0.1L (Dalian Tongda Equipment Technology Development Co., Ltd) | ||
| Tube furnace | SK2-1-10/12 (Luoyang Huaxulier Electric Stove Co., Ltd) | ||
| Heating magnetic stirrer | DF-101 (Yu Hua Instrument Co. Ltd.) | ||
| Rotary evaporator | RE-3000A (Shanghai Yarong Biochemical Instrument Factory) | ||
| Synthetic air | |||
| Hydrogen gas | |||
| Argon gas |
Referenzen
- Zhou, Y., Yang, M., Sun, K., Tang, Z., Kotov, N. A. Similar topological origin of chiral centers in organic and nanoscale inorganic structures: effect of stabilizer chirality on optical isomerism and growth of CdTe nanocrystals. J. Am. Chem. Soc. 132 (17), 6006-6013 (2010).
- Zhou, Y., et al. Optical Coupling Between Chiral Biomolecules and Semiconductor Nanoparticles: Size-Dependent Circular Dichroism Absorption. Angew. Chem. Int. Ed. 50, 11456-11459 (2011).
- Li, Z., et al. Reversible plasmonic circular dichroism of Au nanorod and DNA assemblies. J. Am. Chem. Soc. 134 (7), 3322-3325 (2012).
- Zhu, Z., et al. Manipulation of collective optical activity in one-dimensional plasmonic assembly. ACS Nano. 6 (3), 2326-2332 (2012).
- Liu, W., et al. Gold nanorod@chiral mesoporous silica core-shell nanoparticles with unique optical properties. J. Am. Chem. Soc. 135 (26), 9659-9664 (2013).
- Han, B., Zhu, Z., Li, Z., Zhang, W., Tang, Z. Conformation Modulated Optical Activity Enhancement in Chiral Cysteine and Au Nanorod Assemblies. J. Am. Chem. Soc. 136, 16104-16107 (2014).
- Rao, C. N. R., Gopalakrishnan, J. New Directions in Solid State Chemistry. , Cambridge University Press. (1989).
- Zhu, H., Rosenfeld, D. C., Anjum, D. H., Caps, V., Basset, J. -M. Green Synthesis of Ni-Nb Oxide Catalysts for Low-Temperature Oxidative Dehydrogenation of Ethane. ChemSusChem. 8, 1254-1263 (2015).
- Heracleous, E., Lemonidou, A. A. Ni-Nb-O Mixed Oxides as Highly Active and Selective Catalysts for Ethene Production via Ethane Oxidative Dehydrogenation. Part I: Characterization and Catalytic Performance. J. Cat. 237, 162-174 (2006).
- Savova, B., Loridant, S., Filkova, D., Millet, J. M. M. Ni-Nb-O Catalysts for Ethane Oxidative Dehygenation. Appl. Catal. A. 390 (1-2), 148-157 (2010).
- Heracleous, E., Delimitis, A., Nalbandian, L., Lemonidou, A. A. HRTEM Characterization of the Nanostructural Features formed in Highly Active Ni-Nb-O Catalysts for Ethane ODH. Appl. Catal. A. 325 (2), 220-226 (2007).
- Skoufa, Z., Heracleous, E., Lemonidou, A. A. Unraveling the Contribution of Structural Phases in Ni-Nb-O mixed oxides in Ethane Oxidative Dehydrogenation. Catal. Today. 192 (1), 169-176 (2012).
- Heracleous, E., Lemonidou, A. A. Ni-Me-O Mixed Metal Oxides for the Effective Oxidative Dehydrogenation of Ethane to Ethylene - Effect of Promoting Metal Me. J. Cat. 270, 67-75 (2010).
- Zhu, H., et al. Nb Effect in the Nickel Oxide-Catalyzed Low-Temperature Oxidative Dehydrogenation of Ethane. J. Cat. 285, 292-303 (2012).
- Sadovskaya, E. M., et al. Mixed Spinel-type Ni-Co-Mn Oxides: Synthesis, Structure and Catalytic Properties. Catal. Sustain. Energy. 3, 25-31 (2016).
- Alvarez, J., et al. Ni-Nb-Based Mixed Oxides Precursors for the Dry Reforming of Methane. Top. Catal. 54, 170-178 (2011).
- Jin, S., Guan, W., Tsang, C. -W., Yan, D. Y. S., Chan, C. -Y., Liang, C. Enhanced hydroconversion of lignin-derived oxygen-containing compounds over bulk nickel catalysts though Nb2O5 modification. Catal. Lett. 147, 2215-2224 (2017).
- Taghavinezhad, P., Haghighi, M., Alizadeh, R. CO2/O2-oxidative dehydrogenation of ethane to ethylene over highly dispersed vanadium oxide on MgO-promoted sulfated-zirconia nanocatalyst: Effect of sulfation on catalytic properties and performance. Korean J. Chem. Eng. 34 (5), 1346-1357 (2017).
- Muralidharan, G., Subramanian, L., Nallamuthu, S. K., Santhanam, V., Kumar, S. Effect of Reagent Addition Rate and Temperature on Synthesis of Gold Nanoparticles in Microemulsion Route. Ind. Eng. Chem. Res. 50 (14), 8786-8791 (2011).
- Sosa, Y. D., Rabelero, M., Treviño, M. E., Saade, H., López, R. G. High-Yield Synthesis of Silver Nanoparticles by Precipitation in a High-Aqueous Phase Content Reverse Microemulsion. J. Nanomater. , 1-6 (2010).
- Morterra, C., Cerrato, G., Pinna, F. Infrared spectroscopic study of surface species and of CO adsorption: a probe for the surface characterization of sulfated zirconia catalysts. Spectrochim. Acta. A Molecul. Biomolecul. Spectrosc. 55, 95-107 (1998).
- Yang, F., Wang, Q., Yan, J., Fang, J., Zhao, J., Shen, W. Preparation of High Pore Volume Pseudoboehmite Doped with Transition Metal Ions through Direct Precipitation Method. Ind. Eng. Chem. Res. 51 (47), 15386-15392 (2012).
- Saleh, R., Djaja, N. F. Transition-metal-doped ZnO nanoparticles: Synthesis, characterization and photocatalytic activity under UV light. Spectrochim. Acta. A Molecul. Biomolecul. Spectrosc. 130, 581-590 (2014).
- Ertis, I. F., Boz, I. Synthesis and Characterization of Metal-Doped (Ni, Co, Ce, Sb) CdS Catalysts and Their Use in Methylene Blue Degradation under Visible Light Irradiation. Modern Research in Catalysis. 6, 1-14 (2017).
- Jin, S., et al. Cleavage of Lignin-Derived 4-O-5 Aryl Ethers over Nickel Nanoparticles Supported on Niobic Acid-Activated Carbon Composites. Ind. Eng. Chem. Res. 54 (8), 2302-2310 (2015).
- Rojas, E., Delgado, J. J., Guerrero-Pérez, M. O., Bañares, M. A. Performance of NiO and Ni-Nb- O Active Phases during the Ethane Ammoxidation into Acetonitrile. Catal. Sci. Technol. 3 (12), 3173-3182 (2013).
- Lee, S. -H., et al. Raman Spectroscopic Studies of Ni-W Oxide Thin Films. Solid State Ionics. 140 (1), 135-139 (2001).
- Mondal, A., Mukherjee, D., Adhikary, B., Ahmed, M. A. Cobalt nanoparticles as recyclable catalyst for aerobic oxidation of alcohols in liquid phase. J. Nanopart. Res. 18 (5), 1-12 (2016).
- Wang, K., Yang, L., Zhao, W., Cao, L., Sun, Z., Zhang, F. A facile synthesis of copper nanoparticles supported on an ordered mesoporous polymer as an efficient and stable catalyst for solvent-free sonogashira coupling Reactions. Green Chem. 19, 1949-1957 (2017).
- Song, Y., et al. High-Selectivity Electrochemical Conversion of CO2 to Ethanol using a Copper Nanoparticle/N-Doped Graphene Electrode. Chemistry Select. 1, 6055-6061 (2016).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten