Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthode de précipitation chimique pour la synthèse de Nb2O5 modifiée catalyseurs Nickel en vrac avec le haute surface spécifique
Dans cet article
Résumé
Un protocole pour la synthèse de l’éponge et pli-like Ni1-xNbxO nanoparticules par précipitation chimique est présenté.
Résumé
Nous démontrons une méthode pour la synthèse de catalyseurs NixNb1-xO nanostructures spongieux et pli-like. En faisant varier le rapport de Nb:Ni, une série de NixNb1-xO nanoparticules avec différentes compositions atomiques (x = 0,03 0,08, 0,15 et 0,20) ont été préparés par précipitation chimique. Ces catalyseurs NixNb1-xO sont caractérisés par diffraction des rayons x, spectroscopie photoélectronique des rayons x et microscopie électronique à balayage. L’étude a révélé l’aspect spongieux et pli-comme du Ni0,97Nb0,03O et Ni0,92Nb0,08O sur la surface de NiO et la plus grande surface de ces catalyseurs pour Nb1-xO Nix, par rapport à la majeure partie NiO. Surface maximale de 173 m2/g peut être obtenue pour Ni0,92Nb0,08O catalyseurs. En outre, la hydroconversion catalytique des composés dérivés de la lignine, utilisant les synthèse Ni0,92Nb0,08O catalyseurs ont été étudiées.
Introduction
L’élaboration de nanocomposites a reçu une attention croissante en raison de leur application cruciale dans divers domaine. Pour préparer les nanoparticules d’oxyde Ni-Nb-O mélangé,1,2,3,4,5,6 méthodes différentes ont été développés comme méthode de mélange sec,7, méthode d’évaporation de 8 ,9,10,11,12,13 sol gel méthode, méthode de décomposition thermique de14 ,15 et auto-combustion. 16 une évaporation typique méthode9, solutions aqueuses contenant la quantité appropriée de précurseurs métalliques, nitrate de nickel hexahydraté et ammonium oxalate niobium étaient chauffées à 70 ° C. Après l’élimination du solvant et des sécher et de calcination, le MOX a été obtenue. Ces catalyseurs d’oxyde pièce excellente activité catalytique et sélectivité envers la déshydrogénation oxydante (ODH) de l’éthane, qui est lié à la transposition électronique et structurelle induite par l’incorporation des cations de niobium dans le réseau de NiO . 11 l’insertion du Nb diminue drastiquement les espèces oxygène électrophile, qui est responsables pour les réactions d’oxydation de l’éthane12. En conséquence, les extensions de cette méthode ont été faites sur la préparation de différents types d’oxydes mixtes de Ni-Me-O, où Me = Li, Mg, Al, Ga, Ti et Ta. 13 il est constaté que la variation des dopants métalliques pourrait altérer les radicaux d’oxygène non sélective et électrophile du NiO, donc systématiquement accorder l’ODH activité et la sélectivité à l’éthane. Cependant, en général la superficie de ces oxydes est relativement petit (< 100 m2/g), en raison de la ségrégation phase prolongée et de la formation du grand Nb2O5 petits cristaux et ainsi entravé leurs utilisations en autres catalytique applications.
Méthode, également connu sous le nom de la méthode broyage à l’état solide, de mélange sec est une autre méthode couramment utilisée pour préparer les catalyseurs oxydes mixtes. Étant donné que les matériaux catalytiques sont obtenus d’une manière sans solvant, cette méthode fournit une alternative prometteuse écologiques et durable pour la préparation de mélange d’oxydes. La zone de surface plus élevée obtenue par cette méthode est de 172 m2/g pour Ni80Nb20 à température de la calcination de 250 ° C. 8 cependant, cette méthode à l’état solide n’est pas fiable comme réactifs ne sont pas bien mélangés à l’échelle atomique. Donc, pour un meilleur contrôle de l’homogénéité chimique et spécifiques de la distribution granulométrique et de la morphologie, autres méthodes appropriées pour préparer Ni-Nb-O mélangé d’oxyde de nanoparticules sont toujours recherchés. 7
Parmi les différentes stratégies dans le développement des nanoparticules, précipitation chimique sert comme l’une des méthodes prometteuses pour développer les NANOCATALYSEURS, puisqu’elle permet la précipitation complète des ions métalliques. Aussi, nanoparticules des surfaces supérieures sont généralement préparés en utilisant cette méthode. Pour améliorer les propriétés catalytiques des nanoparticules de Ni-Nb-O, nous rapportons ici le protocole pour la synthèse d’une série de catalyseurs d’oxyde Ni-Nb-O mélangé avec grande surface par méthode de précipitation chimique. Nous avons démontré que le rapport molaire de Nb:Ni est un facteur déterminant de l’activité catalytique des oxydes vers l’hydrodésoxygénation des composés organiques dérivés de la lignine. Avec haute Nb:Ni ratio supérieur à 0,087, inactive NiNb2O6 espèces ont été formés. Ni0,92Nb0,08O, qui avait la plus grande surface (173 m2/g), structures nanofeuillets pli-comme des expositions et a montré la meilleure activité et la sélectivité à l’hydrodésoxygénation d’anisole en cyclohexane.
Access restricted. Please log in or start a trial to view this content.
Protocole
Mise en garde : Pour le bon maniement méthodes, les propriétés et les effets toxiques des substances chimiques décrits dans cet article, reportez-vous aux les fiches signalétiques (FS). Certains produits chimiques utilisés sont toxiques et cancérigènes et spéciales soins doivent être prises. Nanomatériaux peut-être potentiellement poser les dangers et les effets sur la santé. Contact par inhalation et la peau doit être évité. Les précautions de sécurité doivent être exercée, comme effectuant la synthèse de catalyseur dans l’évaluation du rendement des fumées hotte et catalyseur des réacteurs de l’autoclave. Équipement de protection individuelle doit être porté.
1. préparation du Ni0,97Nb0,03O catalyseurs où les rapports molaires Nb:(Ni+Nb) égal à 0,03
- Allient 0,161 g d’hydrate de niobium (V) oxalate 2,821 g de nitrate de nickel dans 100 mL d’eau désionisée dans un ballon à fond rond à col trois de 250 mL équipé d’un bar de remuer.
- Mélanger la solution à 50 tr/min et 70 ° C pour dissoudre les composés jusqu'à la disparition du précipité à l’aide d’un agitateur magnétique chauffage.
- Augmenter la température de 80 ° C à un débit de 2 ° C/min rapidement.
- Ajouter un mélange de la solution base [aqueuses d’hydroxyde d’ammonium (50 mL, 1.0 M) et d’hydroxyde de sodium (50 mL, 0,2 M)] dans le mélange réactionnel goutte jusqu'à ce que le pH de la solution Ni/Nb atteint 9,0.
- En remuant le mélange réactionnel, augmenter la température jusqu'à 120 ° C à 2 ° C/min.
- Remuer le mélange réactionnel du jour au lendemain à 50 tr/min à 120 ° C jusqu'à la disparition complète de la couleur verte de la solution.
- Effectuer une analyse de spectrométrie (ICP-OES) spectrométrie d’émission plasma optique pour la solution évaluer la concentration des autres Ni2 + et Nb5 + ions dans la solution et s’assurer que la précipitation complète du nickel reste nitrate.
- Recueillir le solide par filtration à l’aide de fiole Büchner. Laver le solide par addition d’eau de 2 L eau désionisée à plusieurs reprises dans les 20 min pour enlever le cation Na+ résiduel.
- Recueillir le solide dans un verre de montre. Sécher le solide à 110 ° C pendant 12 h dans le four sec.
- Calcine en chauffant les solides dans l’air synthétique (20 mL/min O2 et 80 mL/min N2) à 450 ° C pendant 5 h dans le four de tube. Vérifier toute la verrerie pour défaut avant d’utiliser la haute température de réaction.
- Après la calcination, obtenir 1 gramme de Ni0,97catalyseur0,03O Nb. Utiliser les équipements de protection appropriés tels que des lunettes de protection, gants, blouse de laboratoire et les vapeurs hotte pour effectuer la réaction de nanocristaux semiconducteurs en raison des risques potentiels et les effets sur la santé des nanomatériaux.
2. préparation du Ni0,92Nb0,08O catalyseurs où les rapports molaires Nb:(Ni+Nb) égale à 0,08
- Cette procédure est similaire à celle de 1 sauf pour les deux premières étapes :
- Dissoudre 0,43 g d’hydrate d’oxalate de niobium (V) dans 100 mL d’eau désionisée.
- Séparément, dissoudre 2,675 g de nitrate de nickel dans 100 mL d’eau désionisée.
3. préparation du Ni0,85Nb0,15O catalyseurs où les rapports molaires Nb:(Ni+Nb) égal à 0,15
- La procédure est similaire à celle de 1 sauf pour les deux premières étapes :
- Dissoudre 0,807 g d’hydrate d’oxalate de niobium (V) dans 100 mL d’eau désionisée.
- Séparément, dissoudre 2,472 g de nitrate de nickel dans 100 mL d’eau désionisée.
4. préparation de Ni0,80Nb0,20O catalyseurs où les rapports molaires Nb:(Ni+Nb) égal à 0,20
- La procédure est similaire à celle de 1 sauf pour les deux premières étapes :
- Dissoudre 1,076 g d’hydrate d’oxalate de niobium (V) dans 100 mL d’eau désionisée.
- Séparément, dissoudre 2,326 g de nitrate de nickel dans 100 mL d’eau désionisée.
5. préparation du Nb2O5 à l’aide de la méthode de précipitation chimique
- Calcine niobic acide (Nb2O5·nH2O) dans l’air synthétique pendant 5 h à 450 ° C pour obtenir pur Nb2particules5 O.
Remarque : Vérifier l’achèvement de la réaction à l’aide de rayons x poudre analyse par diffraction (XRD), où Nb2O5·nH2O est amorphe et Nb2O5 est cristalline. Selon l’analyse, la calcination pendant 5 h à 450 ° C a été suffisant pour achever la réaction.
6. synthèse de la β-O-4 lignine composé de modèle, 2-(2-methoxyphenoxy)-1-phenylethan-1-one
- Dissoudre bromoacétophénone (9,0 g, 45 mmol) et 2-méthoxyphénol (6,6 g, 53 mmol) dans 200 mL de diméthylformamide (DMF) dans une fiole conique de 500 mL avec un agitateur magnétique. Approprié câpot de matériel et de fumées permet d’effectuer la réaction à l’aide de réactifs et produits chimiques corrosifs et cancérigènes.
- Mélanger la solution DMF ci-dessus avec l’hydroxyde de potassium (3,0 g, 53 mmol) et agiter le mélange toute la nuit à 50 tr/min à température ambiante à l’aide d’agitateurs magnétiques.
- Extrait le produit avec la solution de mélange de 200 mL de H2O et 600 mL d’éther diéthylique (1:3, v/v) à l’aide de décanter. Obtenir la couche supérieure l’éther de la solution.
- Ajouter MgSO4 (10 g) pour absorber l’humidité de la solution d’éther diéthylique. Filtrer les MgSO4 pour obtenir la solution de l’éther à l’aide de papier filtre et entonnoir.
- Après le retrait de la solution d’éther diéthylique sous pression réduite à 0,08 MPa à l’aide d’évaporateur rotatif, dissoudre le résidu dans 5 mL d’éthanol.
- Lentement s’évaporer le solvant éthanol pour recristalliser le produit dans un becher de 10 mL. Se procurer le produit (11,5 g) sous forme de poudre jaunâtre et le rendement du produit est de 90 % selon la bromoacétophénone. De la 1H RMN analyse, 1H RMN (DMSO) : δ 3,78 (s, 3 H, OCH3), 5,54 (s, 2 H, CH2), ppm de 6,82-8.01 (m, H 9, aromatique). 17
7. hydrodésoxygénation d’éther aromatique dérivés de la lignine
Remarque : L’éther aromatique dérivés de la lignine de choisie est anisole dans cette expérience et le catalyseur est Ni0,92Nb0,08équipement de protection approprié O. utilisation et hotte de laboratoire à effectuer la réaction à l’aide de réactifs cancérigènes.
- Équiper un réacteur autoclave de 50 mL en acier inoxydable avec un chauffage et un agitateur magnétique.
- Réduire la Ni0,92catalyseur de0,08O Nb (1 g) obtenu à l’étape 2 dans le réacteur autoclave en atmosphère à 400 ° C pendant 2 h à2 H et puis passiver le catalyseur sous Argon (50 mL/min) pendant la nuit.
- Dissoudre l’anisole (g 1,1712, 8 % en poids) en n-décane (20 mL) avec l’utilisation du n-dodécane (0,2928 g, 2 % en poids) comme étalon interne pour l’analyse quantitative chromatographie en phase gazeuse (GC).
- Introduire les catalyseurs réduits (0,1 g) dans le réacteur autoclave rapidement afin d’éviter les temps d’exposition long avec de l’air (< 5 mins).
- Sceller le réacteur autoclave, purge avec H2 à plusieurs reprises (3 fois, à une pression de 3 MPa) pour éliminer l’air, puis le mélange réactionnel à la pression de l’atmosphère.
- Définir la vitesse d’agitation à 700 tr/min.
- Après chauffage à la température souhaitée entre 160 et 210 ° C à 2 ° C/min, pression du réacteur autoclave à 3 MPa et définir le point de temps zéro (t = 0).
Remarque : La température de 160 à 210 ° C est appropriée dans le présent rapport. - Par la suite, laisser refroidir le mélange à température ambiante comprise entre 10 ° C/min immédiatement et d’analyser les produits désoxygénés utilise la chromatographie en phase gazeuse avec détecteur sélective de masse. 17
- Déterminer la conversion du modèle de la lignine composé selon l’équation suivante :

- Déterminer la sélectivité du produit selon l’équation suivante :
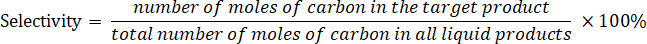
Access restricted. Please log in or start a trial to view this content.
Résultats
Diffraction des rayons x (DRX) patterns (Figure 1 et Figure 2), BET surfaces, réduction de température programmée de l’hydrogène avec de l’hydrogène (H2- TPR), microscopie électronique (MEB) équipée avec un rayons x dispersive en énergie (EDX ) analyseur, spectrométrie de photoélectrons (XPS) ont été prélevés pour les nanoparticules NiO, Ni-Nb-O et Nb2O5 oxydes...
Access restricted. Please log in or start a trial to view this content.
Discussion
Une des méthodes courantes pour préparer les nanoparticules d’oxyde de nickel dopé en vrac niobium est méthode évaporateur rotatif. 9 en employant différentes conditions de pression et de température au cours du processus d’évaporateur rotatif, la précipitation du commerce de particules Ni-Nb-O avec la lente élimination du solvant. Contrairement à la méthode de l’évaporateur rotatif, la méthode de précipitation chimique mentionnée dans cette étude a reçu une attention crois...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n’avons rien à divulguer.
Remerciements
Nous reconnaissons l’appui financier fourni par la National clé recherche et programme de développement du ministère de la Science et la technologie de Chine (2016YFB0600305), Fondation nationale des sciences naturelles de Chine (nos 21573031 et 21373038), programme d’excellents Talents dans la ville de Dalian (2016RD09) et de l’enseignement technologique et supérieur Institute de Hong Kong (THEi SG1617105 et THEi SG1617127).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Niobium(V) oxalate hydrate, 98% | Alfa | L04481902 | |
| Nickel nitrate hexahydrate, 99% | Aladdin | N108891 | |
| Sodium hydroxide, 98% | Aladdin | S111501 | |
| Ammonium hydroxide, 23-25% | Aladdin | A112077 | |
| Anisole, 99% | Sinopharm | 81001728 | |
| Diphenyl ether, 98% | Aladdin | D110644 | |
| Phenol, 98% | Sinopharm | 100153008 | |
| 2-Methoxyphenol, 98% | Sinopharm | 30114526 | |
| Vanillin, 99.5% | Sinopharm | 69024316 | |
| Potassium hydroxide, AR | Aladdin | P112284 | |
| N,N-Dimethylformamide, 99.5% | Sinopharm | 40016462 | |
| 2-Bromoacetophenone,98% | Aladdin | B103328 | |
| Diethyl ether,99.5% | Sinopharm | 10009318 | |
| Decane,98% | Aladdin | D105231 | |
| Dodecane,99% | Aladdin | D119697 | |
| Niobic acid | CBMM | 1313968 | |
| Heating and Drying Oven | DHG Series (shanghai jinghong laboratory instrument co. ltd) | ||
| Autoclave Reactor | CJF-0.05—0.1L (Dalian Tongda Equipment Technology Development Co., Ltd) | ||
| Tube furnace | SK2-1-10/12 (Luoyang Huaxulier Electric Stove Co., Ltd) | ||
| Heating magnetic stirrer | DF-101 (Yu Hua Instrument Co. Ltd.) | ||
| Rotary evaporator | RE-3000A (Shanghai Yarong Biochemical Instrument Factory) | ||
| Synthetic air | |||
| Hydrogen gas | |||
| Argon gas |
Références
- Zhou, Y., Yang, M., Sun, K., Tang, Z., Kotov, N. A. Similar topological origin of chiral centers in organic and nanoscale inorganic structures: effect of stabilizer chirality on optical isomerism and growth of CdTe nanocrystals. J. Am. Chem. Soc. 132 (17), 6006-6013 (2010).
- Zhou, Y., et al. Optical Coupling Between Chiral Biomolecules and Semiconductor Nanoparticles: Size-Dependent Circular Dichroism Absorption. Angew. Chem. Int. Ed. 50, 11456-11459 (2011).
- Li, Z., et al. Reversible plasmonic circular dichroism of Au nanorod and DNA assemblies. J. Am. Chem. Soc. 134 (7), 3322-3325 (2012).
- Zhu, Z., et al. Manipulation of collective optical activity in one-dimensional plasmonic assembly. ACS Nano. 6 (3), 2326-2332 (2012).
- Liu, W., et al. Gold nanorod@chiral mesoporous silica core-shell nanoparticles with unique optical properties. J. Am. Chem. Soc. 135 (26), 9659-9664 (2013).
- Han, B., Zhu, Z., Li, Z., Zhang, W., Tang, Z. Conformation Modulated Optical Activity Enhancement in Chiral Cysteine and Au Nanorod Assemblies. J. Am. Chem. Soc. 136, 16104-16107 (2014).
- Rao, C. N. R., Gopalakrishnan, J. New Directions in Solid State Chemistry. , Cambridge University Press. (1989).
- Zhu, H., Rosenfeld, D. C., Anjum, D. H., Caps, V., Basset, J. -M. Green Synthesis of Ni-Nb Oxide Catalysts for Low-Temperature Oxidative Dehydrogenation of Ethane. ChemSusChem. 8, 1254-1263 (2015).
- Heracleous, E., Lemonidou, A. A. Ni-Nb-O Mixed Oxides as Highly Active and Selective Catalysts for Ethene Production via Ethane Oxidative Dehydrogenation. Part I: Characterization and Catalytic Performance. J. Cat. 237, 162-174 (2006).
- Savova, B., Loridant, S., Filkova, D., Millet, J. M. M. Ni-Nb-O Catalysts for Ethane Oxidative Dehygenation. Appl. Catal. A. 390 (1-2), 148-157 (2010).
- Heracleous, E., Delimitis, A., Nalbandian, L., Lemonidou, A. A. HRTEM Characterization of the Nanostructural Features formed in Highly Active Ni-Nb-O Catalysts for Ethane ODH. Appl. Catal. A. 325 (2), 220-226 (2007).
- Skoufa, Z., Heracleous, E., Lemonidou, A. A. Unraveling the Contribution of Structural Phases in Ni-Nb-O mixed oxides in Ethane Oxidative Dehydrogenation. Catal. Today. 192 (1), 169-176 (2012).
- Heracleous, E., Lemonidou, A. A. Ni-Me-O Mixed Metal Oxides for the Effective Oxidative Dehydrogenation of Ethane to Ethylene - Effect of Promoting Metal Me. J. Cat. 270, 67-75 (2010).
- Zhu, H., et al. Nb Effect in the Nickel Oxide-Catalyzed Low-Temperature Oxidative Dehydrogenation of Ethane. J. Cat. 285, 292-303 (2012).
- Sadovskaya, E. M., et al. Mixed Spinel-type Ni-Co-Mn Oxides: Synthesis, Structure and Catalytic Properties. Catal. Sustain. Energy. 3, 25-31 (2016).
- Alvarez, J., et al. Ni-Nb-Based Mixed Oxides Precursors for the Dry Reforming of Methane. Top. Catal. 54, 170-178 (2011).
- Jin, S., Guan, W., Tsang, C. -W., Yan, D. Y. S., Chan, C. -Y., Liang, C. Enhanced hydroconversion of lignin-derived oxygen-containing compounds over bulk nickel catalysts though Nb2O5 modification. Catal. Lett. 147, 2215-2224 (2017).
- Taghavinezhad, P., Haghighi, M., Alizadeh, R. CO2/O2-oxidative dehydrogenation of ethane to ethylene over highly dispersed vanadium oxide on MgO-promoted sulfated-zirconia nanocatalyst: Effect of sulfation on catalytic properties and performance. Korean J. Chem. Eng. 34 (5), 1346-1357 (2017).
- Muralidharan, G., Subramanian, L., Nallamuthu, S. K., Santhanam, V., Kumar, S. Effect of Reagent Addition Rate and Temperature on Synthesis of Gold Nanoparticles in Microemulsion Route. Ind. Eng. Chem. Res. 50 (14), 8786-8791 (2011).
- Sosa, Y. D., Rabelero, M., Treviño, M. E., Saade, H., López, R. G. High-Yield Synthesis of Silver Nanoparticles by Precipitation in a High-Aqueous Phase Content Reverse Microemulsion. J. Nanomater. , 1-6 (2010).
- Morterra, C., Cerrato, G., Pinna, F. Infrared spectroscopic study of surface species and of CO adsorption: a probe for the surface characterization of sulfated zirconia catalysts. Spectrochim. Acta. A Molecul. Biomolecul. Spectrosc. 55, 95-107 (1998).
- Yang, F., Wang, Q., Yan, J., Fang, J., Zhao, J., Shen, W. Preparation of High Pore Volume Pseudoboehmite Doped with Transition Metal Ions through Direct Precipitation Method. Ind. Eng. Chem. Res. 51 (47), 15386-15392 (2012).
- Saleh, R., Djaja, N. F. Transition-metal-doped ZnO nanoparticles: Synthesis, characterization and photocatalytic activity under UV light. Spectrochim. Acta. A Molecul. Biomolecul. Spectrosc. 130, 581-590 (2014).
- Ertis, I. F., Boz, I. Synthesis and Characterization of Metal-Doped (Ni, Co, Ce, Sb) CdS Catalysts and Their Use in Methylene Blue Degradation under Visible Light Irradiation. Modern Research in Catalysis. 6, 1-14 (2017).
- Jin, S., et al. Cleavage of Lignin-Derived 4-O-5 Aryl Ethers over Nickel Nanoparticles Supported on Niobic Acid-Activated Carbon Composites. Ind. Eng. Chem. Res. 54 (8), 2302-2310 (2015).
- Rojas, E., Delgado, J. J., Guerrero-Pérez, M. O., Bañares, M. A. Performance of NiO and Ni-Nb- O Active Phases during the Ethane Ammoxidation into Acetonitrile. Catal. Sci. Technol. 3 (12), 3173-3182 (2013).
- Lee, S. -H., et al. Raman Spectroscopic Studies of Ni-W Oxide Thin Films. Solid State Ionics. 140 (1), 135-139 (2001).
- Mondal, A., Mukherjee, D., Adhikary, B., Ahmed, M. A. Cobalt nanoparticles as recyclable catalyst for aerobic oxidation of alcohols in liquid phase. J. Nanopart. Res. 18 (5), 1-12 (2016).
- Wang, K., Yang, L., Zhao, W., Cao, L., Sun, Z., Zhang, F. A facile synthesis of copper nanoparticles supported on an ordered mesoporous polymer as an efficient and stable catalyst for solvent-free sonogashira coupling Reactions. Green Chem. 19, 1949-1957 (2017).
- Song, Y., et al. High-Selectivity Electrochemical Conversion of CO2 to Ethanol using a Copper Nanoparticle/N-Doped Graphene Electrode. Chemistry Select. 1, 6055-6061 (2016).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon