Method Article
Beobachtungsstudienprotokoll für die wiederholte klinische Untersuchung und den Intensivsonographie im Rahmen der einfachen Intensivstudien
In diesem Artikel
Zusammenfassung
Strukturierte Protokolle sind notwendig, um Antworten auf Forschungsfragen bei kritisch kranken Patienten zu geben. Die Simple Intensive Care Studies (SICS) bieten eine Infrastruktur für wiederholte Messungen bei kritisch kranken Patienten, einschließlich klinischer Untersuchung, biochemischer Analyse und Ultraschall. SICS-Projekte haben einen spezifischen Schwerpunkt, aber die Struktur ist flexibel für andere Untersuchungen.
Zusammenfassung
Längsschnittuntersuchungen kritisch kranker Patienten durch Kombinationen aus klinischer Untersuchung, biochemischer Analyse und Intensivsonographie (CCUS) können unerwünschte Ereignisse von Eingriffen wie Flüssigkeitsüberlastung in einem frühen Stadium erkennen. Die Simple Intensive Care Studies (SICS) sind eine Forschungslinie, die sich auf den prognostischen und diagnostischen Wert von Kombinationen klinischer Variablen konzentriert.
Das SICS-I konzentrierte sich speziell auf die Verwendung klinischer Variablen, die innerhalb von 24 Stunden nach der akuten Aufnahme zur Vorhersage des Herzzeitvolumens (CO) und der Mortalität ermittelt wurden. Der Nachfolger, SICS-II, konzentriert sich auf wiederholte Bewertungen während der Aufnahme auf die Intensivstation. Die erste klinische Untersuchung durch geschulte Forscher wird innerhalb von 3 Stunden nach der Aufnahme durchgeführt und besteht aus körperlicher Untersuchung und gebildetem Raten. Die zweite klinische Untersuchung wird innerhalb von 24 Stunden nach der Aufnahme durchgeführt und umfasst eine körperliche Untersuchung und fundiertes Raten, biochemische Analysen und CCUS-Untersuchungen von Herz, Lunge, unterer Hohlvene (IVC) und Niere. Diese Bewertung wird an den Tagen 3 und 5 nach der Aufnahme wiederholt. Die CCUS-Bilder werden von einem unabhängigen Experten validiert und alle Daten werden in einer gesicherten Online-Datenbank registriert. Die Nachbeobachtung nach 90 Tagen umfasst die Registrierung von Komplikationen und des Überlebensstatus gemäß den Krankenakten des Patienten und dem kommunalen Personenregister. Der Schwerpunkt von SICS-II liegt auf dem Zusammenhang zwischen venöser Stauung und Organdysfunktion.
Der Zweck der Veröffentlichung dieses Protokolls besteht darin, Details über die Struktur und die Methoden dieser laufenden prospektiven Beobachtungskohortenstudie bereitzustellen, die die Beantwortung mehrerer Forschungsfragen ermöglicht. Das Design der Datenerhebung von kombinierten klinischen Untersuchungen und CCUS-Assessments bei kritisch kranken Patienten wird erläutert. Das SICS-II ist offen für die Teilnahme anderer Zentren und ist offen für andere Forschungsfragen, die mit unseren Daten beantwortet werden können.
Einleitung
Patienten, die auf die Intensivstation (ICU) eingeliefert werden, sind die am schwersten erkrankten Patienten mit hohen Raten an Kom- und Multimorbiditäten, unabhängig von ihrer Aufnahmediagnose. Daher ist die Intensivstation der Ort, um Kom- und Multimorbidität, ihre negativen Auswirkungen auf die Patientenergebnisse und die Frage, wie eine kritische Erkrankung zu Komplikationen führen kann, die zu zusätzlichen Multimorbiditäten beitragen, zu untersuchen. Um einen Einblick in diese heterogene Patientengruppe zu gewinnen, ist eine detaillierte Untersuchung jedes einzelnen Patienten von größtem Interesse.
Die Forschungslinie Simple Intensive Care Studies (SICS) wurde mit dem Ziel entwickelt, den prognostischen und diagnostischen Wert einer umfassenden Auswahl klinischer, hämodynamischer und biochemischer Variablen bei Intensivpatienten zu bewerten, die von einem engagierten Team von studentischen Forschern unter Koordination medizinischer Experten gesammelt wurden. Eines der primären Ziele des SICS-I ist es, die Kombination klinischer Untersuchungsbefunde zu untersuchen, die am besten mit einem Schock assoziiert sind, der durch das Herzzeitvolumen (CO) definiert wird, das durch die Intensivsonographie (CCUS) gemessen wird1. Das SICS-II verwendet die Struktur des SICS-I, fügt jedoch wiederholte klinische Untersuchungen, biochemische Analysen und CCUS hinzu. Der Hauptfokus von SICS-II liegt auf der Quantifizierung der venösen Stauung und der Identifizierung von Variablen, die zu ihrer Entwicklung beitragen können. Wiederholte Messungen liefern dynamische Informationen über den Krankheitsverlauf eines Patienten. Studien zeigen, dass bei kritisch kranken Patienten eine Flüssigkeitsüberladung vorliegt und eine Flüssigkeitsüberladung mit neuen Morbiditäten verbunden ist. Wir konzentrieren uns daher auf die venöse Stauung bei diesen Patienten. Darüber hinaus haben mehrere Studien auf die möglichen negativen Auswirkungen einer übermäßigen Flüssigkeitsverabreichung hingewiesen 2,3,4,5,6. Eine Flüssigkeitsüberlastung kann als venöse Stauung oder venöse Flüssigkeitsüberladung wahrgenommen werden, die sich durch einen erhöhten zentralvenösen Druck (ZVP) oder ein peripheres Ödem äußern kann. Ein erhöhter Druck im zentralen Venensystem kann zu einer verminderten Organperfusion mit anschließendem Organversagen beitragen, aber es gibt keine genaue Definition einer venösen Stauung.
Frühere Studien, die auf negative Auswirkungen im Zusammenhang mit einer übermäßigen Flüssigkeitsverabreichung hindeuteten, verwendeten einzelne Surrogatmessungen von venösen Stauungen wie ZVP, IVC-Kollapsierbarkeit, Flüssigkeitshaushalt und/oder periphere Ödeme 7,8,9,10. Nach unserem besten Wissen ist das SICS-II die erste Studie, die eine wiederholte CCUS mehrerer Organe in Kombination mit Befunden aus der klinischen Untersuchung durchführt, um den hämodynamischen Status von Intensivpatienten zu beurteilen. Der Fokus auf diese Multiorgan-Sonographie ist wichtig, da Organversagen oder verminderte Organfunktion immer das gesamte hämodynamische System beeinflussen. Wir erwarten, dass Daten aus wiederholten Untersuchungen in SICS-II dazu beitragen werden, die Pathophysiologie und die Folgen einer venösen Stauung zu entschlüsseln. Folglich kann dies dazu beitragen, die frühere Identifizierung kritisch kranker Patienten mit dem Risiko einer venösen Stauung zu verbessern und die Optimierung der Flüssigkeitsverabreichung zu unterstützen. Darüber hinaus kann der Zusammenhang zwischen venöser Stauung und kurz- und langfristigem Organversagen untersucht werden. Schließlich würde die erfolgreiche Implementierung des SICS-II-Protokolls deutlich machen, dass die Durchführung einer großen prospektiven Studie mit einem engagierten Team von studentischen Forschern machbar ist und qualitativ hochwertige Daten zur Untersuchung klinischer Probleme liefern kann.
Hier wird das Verfahren zur Durchführung einer umfassenden klinischen Untersuchung von Intensivpatienten mit dem Ziel der Messung von venösen Stauungen demonstriert. Ein kurzes Protokoll von SICS-II wurde am11. clinicaltrials.gov veröffentlicht. Nach der ersten klinischen Erstuntersuchung werden maximal drei weitere klinische Untersuchungen, biochemische Analysen und CCUS durchgeführt. Die körperliche Untersuchung umfasst Variablen, die die periphere Perfusion/Mikrozirkulation widerspiegeln, wie z. B. die Kapillarauffüllzeit (CRT) oder die Fleckenbildung, sowie Variablen der Makrozirkulation wie Blutdruck, Herzfrequenz und Urinausscheidung. Außerdem werden Laborwerte der Standardversorgung registriert (z. B . Laktat, pH-Wert). Anschließend wird eine CCUS des Herzens, der Lunge, der IVC und der Niere durchgeführt, um Informationen über die Perfusion zu erhalten. Weitere Methoden werden im Rahmen unseres statistischen Analyseplans ausgearbeitet, wie dies im SICS-I12 geschehen ist.
Basierend auf 138 Patienten, die zwischen dem 14.05.2018 und dem 15.08.2018 eingeschlossen wurden, scheinen wiederholte Messungen einer breiten Palette klinischer Variablen innerhalb dieser Struktur machbar zu sein. Wir zeigen auch, dass eine unabhängige Validierung machbar ist. Das SICS-II ist ein Beispiel für eine wertvolle Methodik, die es Forschern ermöglicht, Veränderungen von interessierenden Variablen genau zu registrieren, und kann somit als Leitfaden für die Durchführung von Forschungsarbeiten dienen, die die Entwicklung des Zustands von Patienten in der täglichen Praxis widerspiegeln. Die SICS-II-Studie wird täglich von einem Team von 2-3 studentischen Forschern durchgeführt, wobei ein leitender Betreuer auf Abruf zur Verfügung steht. Diese studentischen Forscher werden in der Durchführung der körperlichen Untersuchung und der CCUS geschult. Sie führen alle Schritte des folgenden Protokolls aus und sind für die Einbeziehung der Patienten sowohl während der Arbeitszeit als auch an den Wochenenden verantwortlich. Darüber hinaus nimmt ein größeres studentisches Team von rund 30 Studenten der Intensivstation in Abend- und Nachtschichten teil, um die klinische Erstuntersuchung (innerhalb von 3 Stunden nach der Aufnahme) neuer Patienten durchzuführen. Abbildung 1 zeigt eine schematische Zusammenfassung des Studienprotokolls, und Abbildung 2 und 3 zeigen die Fallberichtsformulare (CRF), die zur Registrierung der Daten bei der Erhebung verwendet werden.
Protokoll
Diese Studie wird nach den Prinzipien der Deklaration von Helsinki (64. Version, Brasilien 2013) und in Übereinstimmung mit dem Medical Research Involving Human Subjects Act (WMO), den Richtlinien der Guten Klinischen Praxis und dem lokalen institutionellen Prüfungsausschuss (Medisch Ethische Toetsingscommissie; M18.228393).
1. Aufnahme von Patienten auf die Intensivstation und Screening
ANMERKUNG: Für das Screening wird im Laufe des Tages eine digitale Liste mit minimalen Patientendaten aktualisiert, und Ein- und Ausschlüsse werden registriert. Die Screening-Liste wird in einem gesicherten elektronischen System des Krankenhauses gespeichert, auf das die Forscher ausschließlich zugreifen können. Um die Privatsphäre der Patienten zu schützen, werden alle physischen Kopien der Listen am Ende des Tages vernichtet. Einschlusskriterien sind: akute und ungeplante Aufnahme; und Patienten über 18 Jahren.
- Durchsuchen Sie das Patientenmanagementsystem auf alle Neuaufnahmen und prüfen Sie, ob Patienten die Einschlusskriterien erfüllen.
- Wiedereinweisungen, elektive Einweisungen, Patienten unter 18 Jahren und Patienten, die keine Einwilligungserklärung geben können, sind sofort auszuschließen.
ANMERKUNG: Wir schließen auch Patienten mit einem nicht-traumatischen neurologischen Aufnahmegrund aus, da wir mehrere Patientengruppen in SICS-I etabliert haben, in denen diese Gruppe hämodynamisch stabil war und die Aufnahme auf die Intensivstation hauptsächlich die neurologische Behandlung betraf1. - Fügen Sie die möglichen Einschlüsse zu einer laufend aktualisierten Patientenliste hinzu. Verwenden Sie diese Liste, um täglich neue und wiederholte Messungen basierend auf dem Zeitpunkt der Aufnahme/Aufnahme zu planen.
2. Klinische Untersuchung 1
ANMERKUNG: Die erste klinische Untersuchung wird bei allen Patienten, die die Einschlusskriterien erfüllen, innerhalb von 3 h nach der Aufnahme durchgeführt. Diese Untersuchung wird von den studentischen Forschern durchgeführt, wenn der Patient während der Tagschicht aufgenommen wird. Bei Patienten, die während der Abend- oder Nachtschicht aufgenommen werden, wird diese erste klinische Untersuchung von einem Mitglied des Studententeams der Intensivstation durchgeführt und die Daten werden am nächsten Tag von den studentischen Forschern verarbeitet und abgeschlossen. Eine vollständige Beschreibung des Protokolls der ersten klinischen Untersuchung finden Sie in clinicaltrials.gov13. Wenn möglich am Krankenbett, werden die Patienten gefragt, ob sie zu diesem Zeitpunkt mit der klinischen Untersuchung einverstanden sind. Die schriftliche Einwilligungserklärung wird später eingeholt: siehe Schritt 1.2 für Anweisungen und Schritt 7 .
- Ärztliche Untersuchung
- Beginnen Sie damit, die erforderlichen Sicherheits-/Isolationsregeln für den Patienten zu gewährleisten: Desinfizieren Sie Hände und Handgelenke gemäß den üblichen Krankenhausverfahren mit 70 % Alkohol und verwenden Sie unsterile Handschuhe und eine Plastikschürze oder zusätzliche Vorsichtsmaßnahmen wie einen Isolationskittel während des Patientenkontakts.
- Stellen Sie sich vor und bitten Sie den Patienten um Erlaubnis, die Untersuchung durchzuführen, wenn er nicht sediert, bei Bewusstsein und ausreichend ist. Erklären Sie dem Patienten, was getan wird.
ANMERKUNG: Die formelle Einwilligung nach Aufklärung wird zu einem späteren Zeitpunkt während der Aufnahme auf die Intensivstation oder nach der Entlassung auf die Station eingeholt, entweder vom Patienten selbst oder von den nächsten Angehörigen, wenn der Patient dazu nicht in der Lage ist. Dies wird in Schritt 7 näher beschrieben. - Registrieren Sie die hämodynamischen Variablen Herzfrequenz, Atemfrequenz, systolischer Blutdruck (SBP), diastolischer Blutdruck (DBP), mittlerer arterieller Druck (MAP) und zentralvenöser Druck (CVP) über den Monitor am Krankenbett.
- Registrieren Sie die Sauerstoffsättigung (SpO2) und ob der Patient eine nicht-invasive Atemunterstützung erhält oder mechanisch beatmet wird. Wenn ja, registrieren Sie den exspiratorischen Druck (PEEP) des positiven Endes und den Anteil des eingeatmeten O2 (FiO2).
- Bestimmen Sie die Reperfusion des Knies und des Brustbeins, indem Sie 10 s auf die Haut drücken und loslassen, dann die Anzahl der Sekunden bis zur vollständigen Reperfusion zählen.
- Ermitteln Sie die subjektive Hauttemperatur, indem Sie die Extremitäten mit den Händen abtasten und abschätzen, ob sie kalt oder warm sind.
- Zeichnen Sie die Blasentemperatur auf dem Monitor auf, der die Temperatur anzeigt, die von einem Sensor gemessen wird, der an einem Verweilkatheter befestigt ist.
- Bestimmen Sie die Hauttemperatur am Fußrücken, indem Sie einen zusätzlichen Temperatursensor in der Mitte des Fußrückens platzieren und mit dem Monitor verbinden. Schließen Sie den Blasentemperatursensor nach dieser Messung wieder an den Monitor an.
- Bewerten Sie den Grad der Fleckenbildung, falls beobachtbar, mithilfe der Ait-Oufella-Knieskala14.
- Registrieren Sie, ob der Patient eine Sedierung erhält und wenn ja, welches Medikament, mit welcher Pumpendrehzahl und in welcher Dosierung.
- Bestimmen und registrieren Sie die Glasgow-Koma-Skala (GCS) des Patienten15.
- Schätzung des Überlebens des Patienten im Krankenhaus, des Überlebens von 6 Monaten und der Fähigkeit, an seinen ursprünglichen Wohnort zurückzukehren, basierend auf einer fundierten Vermutung und den Ergebnissen dieser klinischen Untersuchung16,17. Fragen Sie die Krankenschwester und den Arzt ebenfalls nach ihren Schätzungen und registrieren Sie alle Schätzungen auf dem CRF.
3. Klinische Untersuchung 2
ANMERKUNG: Die zweite klinische Untersuchung wird innerhalb von 24 Stunden nach der Aufnahme durchgeführt und umfasst CCUS-Messungen. Diese Prüfung wird immer von studentischen Forschern durchgeführt, die in CCUS ausgebildet wurden, und nicht von Mitgliedern des Studententeams der Intensivstation. Darüber hinaus werden bei Patienten, die die Einschlusskriterien erfüllen und klinisch untersucht wurden 1, aber später nachweislich ausschließlich an einer neurologischen Erkrankung leiden (z. B. nicht-traumatische Subarachnoidalblutung), keine wiederholten Messungen einschließlich CCUS durchgeführt und diese letztendlich ausgeschlossen.
- Holen Sie eine Einwilligungserklärung ein.
HINWEIS: Gemäß den Vorschriften des Universitätsklinikums Groningen (UMCG) für Beobachtungsmessungen ab dem 1. Januar 2016 können diewährend der klinischen Untersuchung gesammelten Ultraschallbilder ohne ausdrückliche Zustimmung verwendet werden. Es ist jedoch die Politik der SICS-II-Studie, die informierte Zustimmung der Patienten zum frühestmöglichen Zeitpunkt einzuholen und gleichzeitig die Prinzipien der Minimierung des "Stresses" für den Patienten, der Erhöhung der gemeinsamen Entscheidungsfindung und der Bereitstellung von genügend Zeit für die Teilnahme des Patienten einzuhalten. Da die meisten Patienten zu Beginn ihres Aufenthalts auf der Intensivstation nicht in der Lage sind, ihre Einwilligung zu erteilen, wird in der Regel eine "verzögerte" Einwilligung eingeholt. Sind sie hingegen in der Lage, vor oder nach den Untersuchungen Einwilligungen zu erteilen oder zu verweigern, werden diese entweder nicht durchgeführt bzw. alle bereits erhobenen Daten gelöscht.- Stellen Sie vor Beginn der Untersuchung fest, ob der Patient wach/bei Bewusstsein ist und in der Lage ist, mit den studentischen Forschern in Kontakt zu treten, indem Sie seinen GCS-Score bestimmen. Erläutern Sie mündige Patienten über die durchzuführende Untersuchung und hinterlassen Sie ein standardisiertes, schriftliches Schreiben, das sie unterschreiben müssen.
- Sollte der Patient nicht in der Lage sein, um eine Einwilligung gebeten zu werden (aufgrund von Bewusstseinsstörungen, eingeschränkter geistiger Leistungsfähigkeit usw.), überwachen Sie täglich seinen GCS-Wert und erwägen Sie, die Zustimmung der Familie einzuholen, wenn Familienmitglieder erreichbar sind (wie in Schritt 7.1 beschrieben).
- Führen Sie die körperliche Untersuchung gemäß den in Klinische Untersuchung 1 beschriebenen Schritten durch.
- Führen Sie eine CCUS des Herzens und der Lunge durch.
ANMERKUNG: Dieses Protokoll gilt bei Verwendung eines Ultraschallgeräts in der Tabelle der Materialien, den Herzschallkopf für die parasternale Langachsenansicht (PLAX) und den kardialen Phased-Array-Schallkopf für die apikalen Vier- und Fünfkammeransichten (AP4CH, AP5CH). Bei anderen Ultraschallsystemen sollten Benutzer die Bedienungsanleitungen ihres jeweiligen Geräts konsultieren.- Schalten Sie die Maschine ein. Registrieren Sie die anonyme Studien-ID des Patienten, starten Sie eine neue Untersuchung und warten Sie, bis der automatische 2D-Bildgebungsmodus auf dem Bildschirm angezeigt wird.
- Wenn der Patient bekleidet ist, knöpfen Sie seinen Kittel auf, um die Brust freizulegen. Bringen Sie neue Elektrokardiogramm (EKG)-Aufkleber an und verbinden Sie diese bei Bedarf mit dem Ultraschallgerät.
- Verbinden Sie das EKG-Kabel vom Gerät mit dem Monitor am Patientenbett. Warten Sie, bis es sich stabilisiert hat, und registrieren Sie die per EKG gemessene Herzfrequenz im CRF.
- Wenn möglich, positionieren Sie den Patienten leicht gedreht auf der linken Seite. Dies verbessert die Qualität sowohl der Herz- als auch der Nierenbildgebung.
ANMERKUNG: Technische Überlegungen: Bevor Sie mit der Untersuchung beginnen, klicken Sie auf die Schaltfläche Konfigurieren und stellen Sie die Bildeinstellungen auf fünf Herzzyklen, eine Tiefe von 10–15 cm, eine Bildbreite von 65° und eine Frequenz von 1,7/3,4 MHz ein. Überprüfen Sie, ob die richtige Sonde ausgewählt ist, indem Sie auf die Schaltfläche Sonde klicken. - Geben Sie eine ausreichende Menge Ultraschallgel auf den Ultraschallschallkopf und platzieren Sie den Schallkopf seitlich links am Brustbein, zwischen dem 3. und 5. Interkostalraum, um die PLAX-Ansicht im 2D-Modus zu erhalten. Passen Sie die Tiefe nach Bedarf an, um Bilder für die Messungen des linksventrikulären Ausflusstrakts aufzuzeichnen, und speichern Sie das Bild.
ANMERKUNG: Die maximale Breite des linken Ventrikels sollte bei einer maximalen Öffnung der Mitralklappe sichtbar sein. Es sollte kein Muskel der Klappe sichtbar sein. Bevor Sie den Schallkopf auf die Brust des Patienten legen, warnen Sie ihn, dass das Gel kalt ist und sich unangenehm anfühlen kann und dass er einen gewissen Druck spüren wird (insbesondere um das Brustbein herum, wenn Bilder für den linksventrikulären Ausflusstrakt (LVOT) aufgenommen werden). Beachten Sie, dass bei Patienten mit Rippenfrakturen einige Stellen vermieden werden sollten, da dies für den Patienten unangenehm sein kann). - Stellen Sie im 2D-Modus die Tiefe auf 15–20 cm ein und platzieren Sie den Schallkopf über der Herzspitze, kaudal zum linken Warzenhof. Es wird die AP4CH-Ansicht erhalten, in der alle vier Kammern übersichtlich visualisiert sind. Speichern Sie das Bild.
- Rollen Sie den Trackball so, dass sich der Cursor auf der Grenze zwischen der Trikuspidalklappe und der rechten Ventrikelwand befindet, um die systolische Exkursion der Trikuspidalringebene (TAPSE) zu erhalten. Drücken Sie die M-Mode-Taste , um das richtige Bild zu erhalten und es zu speichern, wenn definierte Sinuswellen zu sehen sind. Speichern Sie das Bild.
- Platzieren Sie den Cursor mit dem Trackball über der Trikuspidalklappe. Verringern Sie die Breite des Bildes, um die Anzahl der Bilder pro Sekunde zu erhöhen, die für die Qualität des RV S erforderlich ist. Drücken Sie zuerst die TVI-Taste und dann die PW-Taste , um das richtige Bild für das RV S zu erhalten und zu speichern.
- Neigen Sie den Schallkopf in der AP4CH-Ansicht nach oben (d. h. flachen Sie ihn ab), um die AP5CH-Ansicht zu erhalten und die Aortenwurzel auf dem Bildschirm zu sehen. Speichern Sie das Bild.
- Platzieren Sie den Cursor direkt über der Aortenklappe und drücken Sie die PW-Taste , um den LVOT-Pulswellen-Doppler zu erhalten. Platzieren Sie den Cursor genau an der Stelle, an der der LVOT-Durchmesser gemessen wurde. Speichern Sie das Bild in höchster Qualität (scharfe Dopplerwellengrenzen, innen hohl und gut von retrograder oder Mitralströmung unterscheidbar). Diese werden später zur Berechnung des Geschwindigkeits-Zeit-Integrals (VTI) und anschließend des CO verwendet.
ANMERKUNG: Versuchen Sie immer, für jede Messung mindestens drei Strömungswellen zu erhalten. Bei einem unregelmäßigen Rhythmus sollten mindestens fünf Wellen eingespart werden. - Fahren Sie mit dem Lungenultraschall mit demselben Phased-Array-Herzschallkopf fort und ändern Sie die Einstellungen auf eine Frequenz von 3,7 MHz, eine Tiefe von 15 cm und zeichnen Sie die Bilder nur während 2 Herzzyklen auf. Platzieren Sie den Schallkopf an 6 verschiedenen Stellen, wobei das Licht des Schallkopfs bei 12 Uhr steht, gemäß dem BLAUEN Protokoll18. Achten Sie darauf, das Bild immer in der gleichen Reihenfolge zu erhalten, um Verwirrung beim späteren Betrachten von Bildern zu vermeiden.
- Erhalten Sie eine obere vordere mittlere Schlüsselbeinansicht der Lunge, indem Sie den Schallkopf auf beiden Seiten auf dem Interkostalraum der 2. und 3. Rippe platzieren. Speichern Sie die Bilder für jede Seite.
- Erhalten Sie eine untere vordere mittlere Schlüsselbeinansicht der Lunge, indem Sie den Schallkopf 2 bis 3 Rippen tiefer platzieren. Speichern Sie die Bilder für jede Seite.
- Erhalten Sie eine mittelaxiale Ansicht der Lunge, indem Sie den Schallkopf unter den Achselhöhlen des Patienten platzieren. Speichern Sie die Bilder für jede Seite.
- Sobald die kardiale und pulmonale Bildgebung abgeschlossen ist, wischen Sie überschüssiges Gel von der Brust des Patienten ab.
- Führen Sie eine CCUS der IVC und der Niere durch.
- Klicken Sie auf die Schaltfläche Sonde und verwenden Sie den Trackball, um die aktive Sonde für die IVC- und Nierenuntersuchung in den konvexen/krummlinigen Array-Schallkopf (Abdomen) zu ändern. Das Licht des Schallkopfes, das zur Orientierung verwendet werden kann, sollte bei beiden Messungen bei 12 Uhr liegen.
- Platzieren Sie im 2D-Modus und mit Einstellungen auf einer Tiefe von 10 bis 20 cm und einer Frequenz von 2,5/5,0 MHz den Schallkopf direkt unter dem Xiphoid-Prozess und verschieben Sie ihn etwa 2 cm nach rechts vom Patienten. Die IVC sollte sichtbar werden. Speichern Sie das Bild.
- Platzieren Sie den Cursor mit dem Trackball knapp über der oberen Wand des IVC und außerhalb des Lumens und drücken Sie die M-Mode-Taste . Speichern Sie das Bild.
- Für den Nierenultraschall beginnen Sie mit dem 2D-Modus und stellen Sie die Einstellungen auf eine Tiefe von 10–15 cm und eine Frequenz von 2,2/4,4 MHz ein. Platzieren Sie den Schallkopf dorsal und kaudal des Brustkorbs. Holen Sie sich die ausgewählte Niere zentral im Bild und speichern Sie es.
ANMERKUNG: Achten Sie darauf, den Schallkopf so dorsal wie möglich zu platzieren, um Lebergewebe und Darmschlingen herauszufiltern. Für eine zuverlässige Messung der Nierenlänge sollten die Grenzen der Niere deutlich sichtbar sein, und der Abstand zwischen dem zentralen Sinuskomplex (dem echogeneren Zentrum der Niere) und der Hirnrinde sollte im gesamten Bild ähnlich sein. - Drücken Sie die Farbtaste, um ein Farbdopplerbild der Niere zu erhalten und den Fluss im Nierengefäßsystem zu bestimmen. Platzieren Sie den Cursor über einer beliebigen Arterie an der kortikomedullären Verbindung in der Mitte der Niere, wo der Dopplerfluss mit dem Trackball deutlich sichtbar ist.
- Stellen Sie den Cursorwinkel ein und drücken Sie die PW-Taste . Passen Sie bei Bedarf die Signalamplitude und den Kontrast im aktiven Modus an. Speichern Sie das Bild.
- Stellen Sie fest, ob auch ein ausreichendes venöses Signal vorhanden ist (d. h. ein Fluss, der in der negativen Hälfte der y-Achse sichtbar ist), das für spätere Messungen erforderlich ist. Wenn nicht, wiederholen Sie Schritt 3.4.5 und platzieren Sie den Cursor über einer Vene an der kortikomedullären Verbindung in der Mitte, wo der venöse Fluss sichtbar ist. Speichern Sie das Bild.
- Sobald die gesamte Bildgebung abgeschlossen ist, trennen Sie alle Kabel, wischen Sie überschüssiges Gel vom Patienten und dem Schallkopf ab, ziehen Sie den Patienten neu an oder decken Sie ihn ab und reinigen Sie den Schallkopf mit ultraschallzugelassenen Desinfektionstüchern.
4. Klinische Untersuchungen 3 und 4
ANMERKUNG: Die dritte und vierte klinische Untersuchung werden an den Tagen 3 und 5 nach der Aufnahme durchgeführt, wenn sich der Patient noch auf der Intensivstation befindet (d.h. kein Todesfall oder eine Verlegung auf die Station stattgefunden hat).
- Ärztliche Untersuchung
- Führen Sie die körperliche Untersuchung gemäß den in der klinischen Untersuchung 1 beschriebenen Schritten durch.
- CCUS des Herzens und der Lunge
- Führen Sie die sonographische Untersuchung von Herz und Lunge gemäß Schritt 3.3 durch. Erfassen Sie LVOT nur einmal, da es sich um eine statische Messung handelt und daher nicht in den klinischen Untersuchungen 3 und 4 aufgezeichnet werden muss.
- CCUS der IVC und der Niere
- Führen Sie die sonographische Untersuchung der IVC und der Niere gemäß Schritt 3.4 durch. Die Nierenlänge wird nur einmal ermittelt, da es sich um eine statische Messung handelt und sie daher nicht in den klinischen Untersuchungen 3 und 4 aufgezeichnet werden muss.
5. Messungen und Auswertung der Ultraschalluntersuchungen
ANMERKUNG: Die während der klinischen Untersuchung gespeicherten Bilder werden nach jeder Untersuchung verwendet, um die gewünschten Variablen zu messen. Die Messwerte werden auf dem CRF registriert und in ein klinisches Online-Patientendatenmanagementsystem übertragen. Bilder, in denen Messungen durchgeführt werden und sichtbar sind, sollten zusätzlich zu den Originalbildern, die später zur Validierung verwendet werden, ebenfalls gespeichert werden.
- LVOT-Messung
- Klicken Sie auf die Schaltfläche Sonde , um den Herzschallkopf auszuwählen und die Messungen zu starten.
- Halten Sie das Bild anhand des in Schritt 3.3.5 gespeicherten Bildes an, wenn die Ventile vollständig geöffnet sind.
- Klicken Sie auf die Schaltfläche Messen , und wählen Sie dann im Menü auf der rechten Seite die Optionen Kardio-Bemaßung-LVOT aus, um die Messung zu starten.
- Sobald der Cursor erscheint, wählen Sie während der Enddiastole zwei Punkte an der Basis der Aortenklappe aus, einen auf jeder Seite des Lumens, vom inneren zum inneren Rand. Speichern Sie das Bild.
HINWEIS: Die LVOT-Messung muss vor der CO-Messung durchgeführt und gespeichert werden, damit diese automatisch von der Maschine ermittelt werden kann.
- CO-Messung
- Verfolgen Sie mit dem in Schritt 3.3.10 gespeicherten Bild den linksventrikulären Ausgang. Stellen Sie den horizontalen Sweep auf 100 cm/s ein.
- Wählen Sie drei wohlgeformte, hohle Wellen mit klaren Rändern, die mit dem EKG übereinstimmen. Klicken Sie auf die Schaltfläche "Messen" und wählen Sie mit dem Trackball die Optionen "Kardiak-Aorten-LVOT-Verfolgung" aus.
- Verfolgen Sie die Wellenformlinie, beginnend und endend an der Basislinie, und das Ultraschallgerät berechnet automatisch die CO. Wiederholen Sie dies für drei Wellen und speichern Sie dieses Bild.
ANMERKUNG: Im Falle eines unregelmäßigen Rhythmus ist der durchschnittliche CO-Wert aufzuzeichnen, der für fünf Wellen erhalten wurde.
- TAPSE
- Klicken Sie mit dem in Schritt 3.3.7 gespeicherten M-Modus-Bild auf die Schaltfläche Messen und wählen Sie mit dem Trackball die Optionen Cardiac-Dimension-TAPSE im Menü auf der rechten Seite aus.
- Platzieren Sie den Cursor zuerst auf den tiefsten Punkt einer wohldefinierten Sinuswelle und dann auf den höchsten Punkt. Der Unterschied zwischen den beiden (TAPSE) sollte in der oberen linken Ecke des Bildschirms angezeigt werden. Tun Sie dies in drei Sinuswellen und nehmen Sie den Durchschnitt der drei TAPSE-Messungen. Speichern Sie das Bild.
- Rechtsventrikuläre systolische Exkursion (RV S')
- Klicken Sie mit dem in Schritt 3.3.8 gespeicherten Bild auf die Schaltfläche Messschieber und platzieren Sie den Cursor auf der höchsten Spitze einer klar definierten Kurve. Tun Sie dies in drei Kurven und nehmen Sie den Durchschnitt. Speichern Sie das Bild.
- Bewertung von Kerley-B-Linien-Artefakten
HINWEIS: Die horizontalen A-Linien, die eine normale Lungenoberfläche darstellen, können als Referenz für die Detektion von B-Linien verwendet werden. Diese entspringen dem Brustfell und sind im Vergleich zu A-Linien hyperechoarm.- Passen Sie den Kontrast des Bildes und/oder die Verstärkung an. B-Linien sind in den gespeicherten Bildern nicht immer sofort sichtbar.
- Bestimmen und registrieren Sie die Anzahl der Kerley-B-Linien für jedes der sechs erhaltenen Bilder. Da die Anzahl der B-Linien nicht in der Maschine gespeichert wird, muss sie sofort auf dem CRF (zwischen 0 und 5) registriert werden.
- IVC-Durchmesser und Zusammenklappbarkeit
- Klicken Sie auf die Schaltfläche Sonde , um den Abdominalschallkopf auszuwählen und die Messungen zu starten.
- Klicken Sie unter Verwendung des in Schritt 3.4.2 gespeicherten 2D-Bildes auf die Schaltfläche Messschieber und messen Sie den Abstand zwischen den beiden Wänden des IVC in einem Abstand von 2 cm von der Stelle, an der er in das rechte Atrium eintritt. Dies ist der IVC-Durchmesser, speichern Sie dieses Bild.
- Klicken Sie unter Verwendung des in Schritt 3.4.3 gespeicherten M-Modus-Bildes auf die Schaltfläche Messschieber und messen Sie die exspiratorischen und inspiratorischen IVC-Durchmesser. Speichern Sie dieses Bild.
ANMERKUNG: Der exspiratorische und der inspiratorische Durchmesser des IVC sind die maximalen bzw. minimalen Durchmesser, die im M-Mode-Bild zu sehen sind.
- Nierenlänge und Durchblutung
- Klicken Sie mit dem in Schritt 3.4.4 gespeicherten 2D-Bild auf die Schaltfläche Messschieber und zeichnen Sie die längste Linie, die sich von den kaudalen bis zu den kranialen Enden der Nierenrinde erstreckt. Dies ist die Nierenlänge in cm, registrieren Sie diesen Befund in der CRF. Speichern Sie dieses Bild.
- Analysieren Sie anhand des in Schritt 3.4.6 gespeicherten Dopplerbildes die venöse Flusslinie, die unterhalb der Basislinie als kontinuierlich, monophasisch oder biphasisch zu sehen ist. Registrieren Sie die Befunde in der CRF.
- Klicken Sie mit dem in Schritt 3.4.6 gespeicherten Bild auf die Schaltfläche Messen und wählen Sie mit dem Trackball die Optionen Abdominal-Renal-PS/ED/RI im Menü auf der rechten Seite aus.
- Platzieren Sie den Cursor auf dem Peak und auf dem tiefsten Punkt der pulsierenden Strömungswelle in der positiven Hälfte der y-Achse.
ANMERKUNG: Das G6-Gerät kann den Doppler-Nierenwiderstandsindex (RRI) automatisch berechnen, wenn eine kontinuierliche pulsierende Flusswelle gespeichert wird, indem es die Formel verwendet: RRI = (maximale systolische Geschwindigkeit – enddiastolische Geschwindigkeit)/maximale systolische Geschwindigkeit. Speichern Sie das Bild mit der Messung vom Ultraschallgerät auf dem Bildschirm. - Klicken Sie unter Verwendung des in Schritt 3.4.6 oder 3.4.7 gespeicherten Bildes auf die Schaltfläche "Messschieber " und platzieren Sie den Cursor zuerst über der maximalen maximalen Strömungsgeschwindigkeit und dann über der maximalen Strömungsgeschwindigkeit am Nadir (d. h. am Ende diastolisch)19. Speichern Sie das Bild nach der Messung.
ANMERKUNG: Der venöse Impedanzindex (VII) wird berechnet aus: VII = (systolische Spitzengeschwindigkeit — diastolische Endgeschwindigkeit) / systolische Spitzengeschwindigkeit20,21. Bei monophasischer Strömung wird die VII nicht registriert, da dann nur ein Peak sichtbar ist und keine diastolische und systolische Phase unterscheidbar sind.
6. Datenregistrierung, Speicherung und Validierung von Ultraschallbildern
ANMERKUNG: Wie Abbildung 1 zeigt, erfolgt die Datenregistrierung nach jeder klinischen Untersuchung. Im Folgenden wird das Verfahren zur Eingabe der aus den Messungen, der klinischen Untersuchung und den biochemischen Informationen (Tabelle 2) gewonnenen Daten (Tabelle 2) in die anonymisierte Online-Datei des Studienteilnehmers beschrieben.
- Greifen Sie auf das gesicherte Online-Patientenmanagementsystem zu und öffnen Sie die Akte des kürzlich aufgenommenen Patienten. Registrieren Sie die Werte der Blutgasanalyse, die allgemeinen Serumvariablen, die Serumnierenvariablen und die 24-Stunden-Urinanalyse. Die Liste aller Variablen, die abgerufen werden, und die entsprechenden Anweisungen sind in Tabelle 2 aufgeführt.
- Validieren Sie die kardialen CCUS-Bilder.
HINWEIS: Diese Validierung wird von unabhängigen Experten eines Kernlabors für kardiovaskuläre Bildgebung gemäß den EACVI-Richtlinien22 durchgeführt. Die Qualität der von den studentischen Forschern erhaltenen Bilder wird bewertet und die durchgeführten Messungen werden wiederholt, um die erforderliche Qualität der dimensionalen Messungen und der Verfolgung von Geschwindigkeitsprofilen sicherzustellen.- Führen Sie die LVOT-Messungen an der Enddiastole durch, wie auf dem EKG-Signal zu sehen, direkt unter der Aortenklappe.
- Verfolgen Sie das PW-Signal, das vom LVOT in einer AP5CH-Ansicht entnommen wurde, um das linksventrikuläre Schlagvolumen und die linksventrikuläre CO zu erhalten.
- Validieren Sie alle Bilder und Messungen der IVC und der Nieren. Dies sollte von einem unabhängigen, erfahrenen abdominalen Radiologen durchgeführt werden. Sollte es während der klinischen Untersuchung Probleme bei der Gewinnung der gewünschten Bilder geben, kann der unabhängige abdominale Radiologe zur Durchführung der CCUS gerufen werden, in diesem Fall findet keine weitere Validierung statt.
7. Nachsorge der Patienten
- Registrierung der Einwilligungserklärung
- Wenn bei einer der klinischen Untersuchungen oder nach Abschluss des klinischen Untersuchungsprotokolls die Einwilligung des Patienten oder der Familie eingeholt wird, der Patient aber noch im Krankenhaus aufgenommen wird, registrieren Sie dies im Patientendatenmanagementsystem und laden Sie die handsignierte Einverständniserklärung hoch.
- Wenn die Einwilligung verweigert wurde, registrieren Sie dies im Patientendatenmanagementsystem zusammen mit dem Grund für die Nichteinholung der Einwilligung und benachrichtigen Sie den Studienkoordinator, der alle Patientendaten löscht.
- Daten zur Sterblichkeit
- Bei Patienten, die während der Aufnahme versterben, erfassen Sie die Sterblichkeit direkt aus der elektronischen Patientenakte und die damit verbundene Todesursache.
- Für Patienten ohne Krankenhaussterblichkeit erhalten Sie die Mortalitätsdaten aus dem kommunalen Register in den Niederlanden, das alle 90 Tage aktualisiert wird.
Ergebnisse
Der Zweck dieser repräsentativen Ergebnisse besteht darin, die Machbarkeit des Protokolls zu veranschaulichen.
Patienten
Insgesamt wurden zwischen dem 14.05.2018 und dem 15.08.2018 663 Patienten auf die Intensivstation eingeliefert. Davon kamen 208 Patienten für den Einschluss in Frage (die Ausschlussgründe sind in Abbildung 4 dargestellt). Eine Reihe von 49 Patienten wurde ausgeschlossen, da es aufgrund der laufenden Wiederbelebungsbemühungen keine Möglichkeit gab, die CCUS durchzuführen. Sieben Patienten verweigerten die Teilnahme (keine Einwilligungserklärung) und bei vier Patienten war eine CCUS nicht möglich, z. B. aufgrund der Bauchlage für die mechanische Beatmung oder des vakuumassistierten Verschlusses großer Wunden, was dazu führte, dass 138 Patienten mit Daten für die Analyse eingeschlossen wurden.
CCUS-Validierung und Bildqualität
Eine umfassende Validierung der kardialen Bildgebung ist geplant. Die Validierung des Nierenultraschalls wurde eingeleitet. Bisher wurden Bilder von 21 Patienten (15%) validiert. Bei 18 Patienten (86%) erschienen die Bilder von ausreichender Qualität. Alle Gründe für die Ablehnung der Bilder wurden aufgelistet und zur Rückmeldung an den Forscher zurückgeschickt, der die Ultraschalluntersuchung durchgeführt hat. Der Name des Forschers, der die Sonographie durchgeführt hat, wird aufgezeichnet, um die Variabilität zwischen und innerhalb des Beobachters mit Hilfe des Intraklassenkorrelationskoeffizienten (ICC) beurteilen zu können. Genaue statistische Methoden werden in unserem statistischen Analyseplan beschrieben, wie es im SICS-I12 geschehen ist.
Fallbeispiel: Patient X, Frau mittleren Alters
Patientin X wurde aufgenommen, nachdem bei ihr Bewusstseinsstörungen und niedriger Blutdruck festgestellt worden waren. Alle erhaltenen Messungen sind in Tabelle 1 dargestellt. Alle Variablen wurden innerhalb der vorgeschriebenen Zeit ohne fehlende Daten erhalten, was die mögliche Machbarkeit dieses Protokolls verdeutlicht. Innerhalb von 3 Stunden nach der Aufnahme wurde die erste klinische Untersuchung durchgeführt. Während dieser Untersuchung wurde der Patient sediert, intubiert und benötigte eine Vasopressorbehandlung. Die zweite klinische Untersuchung wurde zehn Stunden später durchgeführt und zeigte stabile Vitalwerte nach 700 ml Flüssigkeitsinfusion. Die Vasopressoren wurden reduziert. CCUS und biochemische Analysen zeigten eine normale Herz-, IVC- und Nierenfunktion (Abbildung 5, Abbildung 6 und Abbildung 7). Bei T3, zwei Tage später, wurden die Vasopressoren gestoppt, aber die kumulative positive Flüssigkeitsbilanz war auf 6 Liter gestiegen, begleitet von einem erhöhten CO, einer breiteren IVC und einer verminderten Nierenperfusion und -funktion, die sich in einem erhöhten Serumkreatinin widerspiegelte. Bei T4, 5 Tage nach der Aufnahme, waren der Flüssigkeitshaushalt und das Serumkreatinin noch weiter angestiegen, wo der Patient AKI im Stadium 3 entwickelte. Der Patient starb 2 Tage später an einem Multiorganversagen mit unklarer Ursache, 7 Tage nach der Aufnahme.
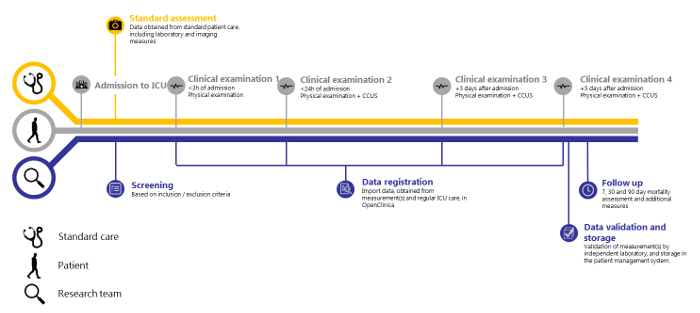
Abbildung 1: Überblick über die SICS-II-Studie. Zeitleiste der SICS-II-Studie von der Aufnahme des Patienten auf die Intensivstation bis zum letzten Schritt der Datenregistrierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Fallberichtsformular (CRF) für die klinische Untersuchung 1. CRF ist von den Studenten des Intensivteams oder den studentischen Forschern bei der Durchführung der ersten klinischen Untersuchung auszufüllen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Case Report Form (CRF) für die klinischen Untersuchungen 2, 3 und 4. CRF wird von den Studenten des Intensivteams oder den studentischen Forschern bei der Durchführung der zweiten, dritten und vierten klinischen Untersuchung ausgefüllt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
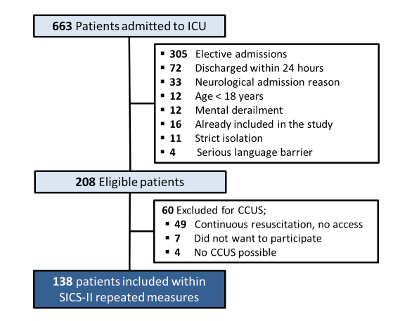
Abbildung 4: SICS-II-Patientenein- und -ausschlussdiagramm. Flussdiagramm, das die Kriterien für den Ein- und Ausschluss von Patienten in der SICS-II-Studie bis zum 15.08.2018 beschreibt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
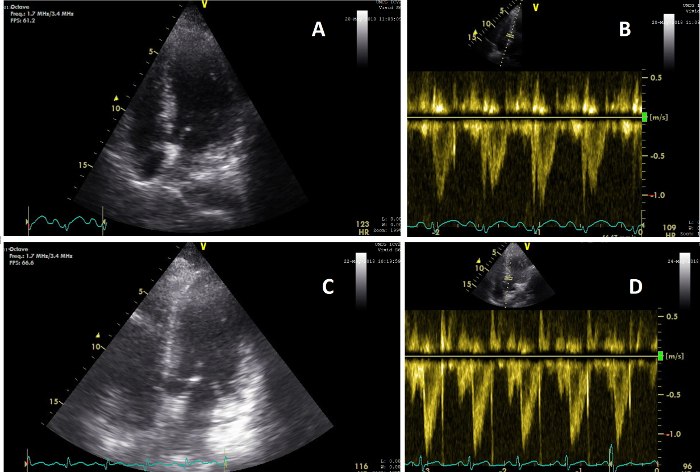
Abbildung 5: Apikale Ansichten, die eine Veränderung der Herzfunktion zeigen. (A) Bild des Herzens in einer AP4CH-Ansicht während der CCUS, durchgeführt während der klinischen Untersuchung 2 (T=2); (B) Bild des VTI-Pulswellensignals des Herzens auf T=2, das einen CO-Wert von 5,6 l/min zeigt; (C) Bild des Herzens in einer AP5CH-Ansicht während der CCUS, durchgeführt während der klinischen Untersuchung 3 (T=3); (D) Bild des VTI-Pulswellensignals des Herzens auf T=3, das einen CO von 8,3 l/min zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
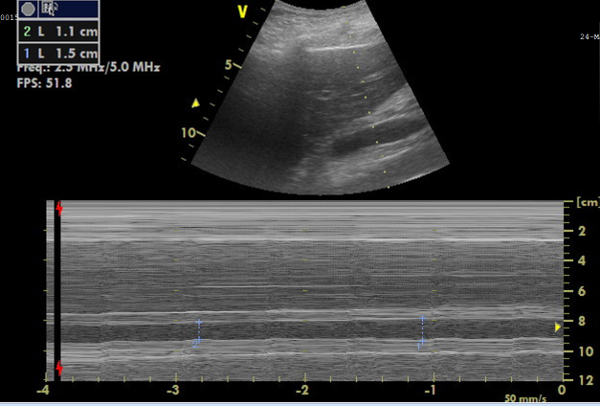
Abbildung 6: M-Mode-Aufnahme der Vena cava inferior (IVC) für Durchmessermessungen. Das Bild, das oben den IVC in Echtzeit zeigt, und unten das M-Modus-Bild, das die IVC-Durchmesseränderungen darstellt und aus dem die Kollabierbarkeit berechnet werden kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
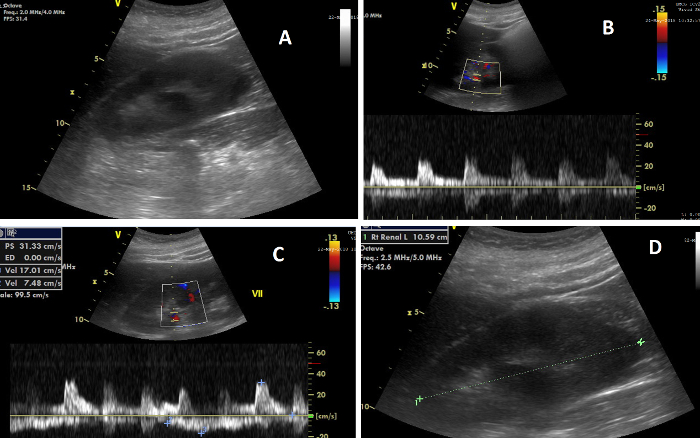
Abbildung 7: Die verschiedenen Elemente der renalen Sonographie. (A) Bild der rechten Niere während der CCUS; (B) Bild, das oben den Dopplerfluss in den Nierenarterien und unten die Strömungswelle zeigt, aus der der Nierenwiderstandsindex berechnet wird; (C) Bild, das oben den Dopplerfluss in den Nierenvenen und unten die Strömungswelle zeigt, aus der der venöse Impedanzindex berechnet wird; (D) Bild, das die Messung der Nierenlänge veranschaulicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Variable | Nr.1 Tag 1, um 00:38 Uhr | Nr.2 Tag 1, um 10:53 Uhr | Nr.3 Tag 3, um 10:14 Uhr | Nr.4 Tag 5, um 10:20 Uhr |
| Herzfrequenz (bpm) | 110 | 124 | 122 | 98 |
| Atemfrequenz (Atemzüge pro Minute) | 24 | 15 | 26 | 12 |
| Systolischer Blutdruck (mmhg) | 100 | 115 | 130 | 118 |
| Diastolischer Blutdruck (mmhg) | 61 | 69 | 66 | 65 |
| Mittlerer arterieller Druck (mmhg) | 73 | 80 | 84 | 81 |
| Kumulativer Flüssigkeitshaushalt (ml) | 0 | 704 | 7272 | 12338 |
| Mechanische Beatmung | PEEP 5, FiO2 40% | PEEP 5, FiO2 40% | PEEP 5, FiO2 30% | PEEP 5, FiO2 30% |
| CRT-Brustbein (Sekunden) | 1.5 | 2 | 4 | 3 |
| Zentrale Temperatur (◦ C) | 37.6 | 37.5 | 38.0 | 37.4 |
| Harnausscheidung in der letzten Stunde (ml) | 117 | 60 | 0 | 10 |
| Verabreichte inotrope Mittel | Noradrenalin 0,1 mg/ml 3,0 ml/h | Noradrenalin 0,1 mg/ml 1,0 ml/h | nichts | nichts |
| Verabreichte Beruhigungsmittel | Propofol 20 mg/ml 5,0 ml/h | nichts | nichts | nichts |
| APACHE IV-Punktzahl | 92 | 88 | 87 | 90 |
| SOFA Punktzahl | 8 | 8 | 5 | 8 |
| LVOT (cm) | N.A. | 2.4 | 2.4 | 2.4 |
| Herzzeitvolumen (L/min) | N.A. | 5.6 | 8.34 | 9.89 |
| TAPSE (mm) | N.A. | 25 | 26 | 21 |
| RV S' (cm/s) | N.A. | 14 | 15 | 12 |
| IVC-Inspirationsdurchmesser (cm) | N.A. | 1.14 | 1.24 | 1.10 |
| Exspiratorischer Durchmesser der IVC (cm) | N.A. | 1.27 | 1.38 | 1.50 |
| Kerley B-Linien (gesamt) | N.A. | 6 | 2 | 4 |
| Nierenlänge (cm) | N.A. | 10.59 | N.A. | N.A. |
| Intrarenierendes venöses Flussmuster | N.A. | Stetig | Stetig | Stetig |
| Doppler-Nieren-RI | N.A. | 0.61 | 0.75 | 0.70 |
| VII | N.A. | 0.33 | 0.56 | 0.68 |
Tabelle 1: Ein zufälliger SICS-II-Patient. Patientin X, eine Frau mittleren Alters, die auf die Intensivstation eingeliefert wurde, nachdem sie mit Bewusstseinsstörungen aufgefunden wurde. Abkürzungen: bpm = Schläge pro Minute, CRT = Kapillarauffüllzeit, LVOT = linksventrikulärer Ausflusstrakt, TAPSE = systolische Exkursion in der Trikuspidalringebene, RV S' = rechtsventrikuläre systolische Exkursion, IVC = Vena cava inferior, RRI = Nierenwiderstandsindex, VII = venöser Impedanzindex, N.A. = nicht anwendbar.
| Variable | Einheit | Quelle | Bezogen bei |
| Lactat | mmol/L | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Chlorid | mmol/L | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Ph | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 ho Unterschied | |
| PCO2 | kPa | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| PaO2 | kPa | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| HCO3- | mmol/L | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Hämoglobin | mmol/L | Arterielle Blutgasanalyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Leukozyten | 10 x 10-9/L | Serum-Analyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Trombozyten | 10 x 10-9/L | Serum-Analyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| HS Troponin | ng/L | Serum-Analyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| ASAT | U/L | Serum-Analyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| ALAT | U/L | Serum-Analyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Gesamt-Bilirubin | uoml/L | Serum-Analyse | Von der Standardversorgung, so nah wie möglich auch an jeder klinischen Untersuchung, max. 12 h Unterschied |
| Kreatinin | umol/L | Serum-Analyse | Alle Messungen ab Beginn der Aufnahme auf die Intensivstation |
| Urinvolumen | Ml | Urinsammlung von 24 h | Alle Messungen ab Beginn der Aufnahme auf die Intensivstation |
| Kreatinin | mmol/24 h | Urin-Analyse | Alle Messungen ab Beginn der Aufnahme auf die Intensivstation |
Tabelle 2: Liste der erhaltenen biochemischen Variablen. Alle biochemischen Variablen der Patienten, die während der Studie gesammelt wurden, sind hier aufgeführt.
Diskussion
Alle Untersuchungen müssen gemäß dem Protokoll durchgeführt werden. Eine körperliche Untersuchung hat nur dann einen Wert, wenn sie nach den vorgegebenen Definitionen durchgeführtwird 23. Die Laborwerte sollten gemäß dem Protokoll erhoben werden, um alle Werte zu erhalten. Klare, interpretierbare CCUS-Bilder sind der Schlüssel zur Beantwortung der Forschungsfrage dieser Studie, wie in Schritt 3.3 beschrieben. Wenn Bilder von schlechter Qualität erhalten werden, können die in Schritt 5 beschriebenen Messungen und Analysen nicht durchgeführt werden, und der Zweck wiederholter Messungen erlischt. Es werden drei wichtige Maßnahmen ergriffen, um das Risiko von Bildern mit geringer Qualität zu minimieren. Zunächst werden die studentischen Forscher, die in unserer Studie CCUS durchführen, von einem erfahrenen Kardiologen und Intensivmediziner geschult. Die Literatur zeigt, dass ein kurzes Trainingsprogramm gut geeignet ist, um die Grundkompetenz in CCUS24 zu erlangen. Zweitens werden die studentischen Forscher während ihrer ersten 20 Prüfungen von einem älteren studentischen Forscher betreut, so dass sie praktisches Feedback erhalten können. Zuletzt werden alle aufgenommenen Herz- und Nierenbilder von einem unabhängigen Experten eines Kernlabors für kardiale Bildgebung bzw. einem erfahrenen abdominalen Radiologen neu bewertet und validiert, um sicherzustellen, dass die Daten zuverlässig sind.
Um die Bildqualität zu gewährleisten, müssen Forschende auch auf andere Aspekte achten. Manchmal ist es erforderlich, das Ultraschallgel erneut aufzutragen oder die Sonde so neu zu positionieren, dass sie einen besseren Kontakt mit der Haut des Patienten hat, um eine optimale Bildqualität zu gewährleisten. Es ist auch wichtig, sich genügend Zeit zu nehmen, um ein optimales Bild zu erhalten, und im Zweifelsfall sollte ein leitender Forscher, d.h. ein betreuender Kardiologe-Intensivmediziner oder ein Kernlaborant, konsultiert werden, bevor die klinische Untersuchung abgeschlossen ist. Die kontinuierliche Auswertung und Validierung aller Ultraschallbilder wird durch die Durchsetzung der in Abbildung 1 dargestellten protokollierten Schritte gewährleistet. Darüber hinaus tauschen sich studentische Forscher und Experten häufig aus, was es einfach macht, Protokolländerungen schnell umzusetzen, um die Qualität von Bildern und Messungen weiter zu verbessern. Durch diese häufige Überprüfung lassen sich systematische Fehler leicht erkennen, so dass das CCUS-Training für zukünftige studentische Forscher entsprechend angepasst werden kann. Darüber hinaus ermöglichen monatliche Treffen, die allen Teammitgliedern offen stehen, eine gründliche Bewertung und (falls erforderlich) Änderungen des Protokolls.
Die Rund-um-die-Uhr-Verfügbarkeit für das Patientenscreening und den Patienteneinschluss ist ein weiteres Schlüsselelement für die erfolgreiche Durchführung dieser Studie. Dies kann nur durch ein engagiertes Team von studentischen Forschern, ein großes Team von Studenten zur Unterstützung und eine gute Koordination mit den Pflegekräften auf der Intensivstation erreicht werden. Diese Koordination erfolgt durch regelmäßigen, geringen Kontakt zwischen Pflegekräften und Forschern über mögliche Verbesserungen zur Optimierung der Zusammenarbeit mit der Standardversorgung.
Eine Einschränkung dieses Protokolls besteht darin, dass die erfolgreiche Durchführung von CCUS von der Zugänglichkeit der vordefinierten Positionen abhängt, an denen die Sonde platziert wird. Während des SICS-I konnte bereits gezeigt werden, dass eine kardiale CCUS nicht durchgeführt werden kann, wenn Patienten Drainagen, Gaze oder Wundauflagen benötigen, die das theoretisch optimale echokardiographische Fensterblockieren 1. Darüber hinaus hat sich bereits gezeigt, dass die Möglichkeit, über die transthorakale Echokardiographie ein geeignetes subkostales Fenster zu erhalten, das für die IVC-Messungen erforderlich ist, in einer allgemeinen Intensivpopulation möglicherweise eingeschränkt ist25. Die von diesem Protokoll geforderte 24/7-Verfügbarkeit, um die verschiedenen Untersuchungen zu unterschiedlichen Zeitpunkten durchzuführen, ist ebenfalls eine mögliche Einschränkung, da einige Zentren möglicherweise nicht über die Kapazitäten verfügen, dies zu tun. Selbst in einem großen akademischen Krankenhaus wie der UMCG hat die Sicherstellung zu Verzögerungen beim Studienstart geführt. Eine weitere Einschränkung bei ultrasonographischen Messungen ist die Variabilität der Messungen zwischen den Beobachtern. Um den Patienteneinschluss 24/7 zu gewährleisten, ist es für einen Forscher unmöglich, alle klinischen Untersuchungen bei allen eingeschlossenen Patienten durchzuführen. Diese Studie zielt darauf ab, dass derselbe Forscher alle Ultraschallmessungen an ein und demselben Patienten durchführt, um die Variabilität auf individueller Ebene zu minimieren, aber für die gesamte Kohorte bleibt die Variabilität zwischen den Beobachtern ein Problem.
Die sonographische Bildgebung mehrerer Organe kann eine schnelle, sichere und effektive Struktur zur Visualisierung der Organdurchblutung und -funktion sein. Es ist ein praktisches Werkzeug, das alle Mediziner verwenden können sollten und für das wenige Messungen, die auf einem einfachen, standardisierten Protokoll basieren, in der Regel zuverlässige Messungen liefern sollten.
Darüber hinaus sind die meisten Beobachtungsstudien zur Bewertung des Einsatzes von Ultraschall und insbesondere von Echokardiographie retrospektiver Natur oder umfassen nur eine kleine Anzahl von Patienten. 26 Dieses Protokoll ermöglicht ein strukturelles 24/7-Screening einer nicht selektierten Kohorte kritisch kranker Patienten, von denen Subpopulationen von Interesse definiert werden können, wodurch die gleichzeitige Untersuchung mehrerer Forschungsfragen ermöglicht wird.
Obwohl bekannt ist, dass klinische Variablen in der Intensivmedizin hochdynamisch sind und sich gegenseitig beeinflussen, haben die meisten Studien nur den additiven Wert singulärer Ultraschallmessungen bestimmter Organe untersucht27,28. Dies ist das erste Protokoll, das sich auf wiederholte Messungen, Ganzkörperultraschall und venöse Stauung konzentriert. Wir gehen davon aus, dass das SICS-II den hämodynamischen Status der Patienten während der Aufnahme auf die Intensivstation genauer widerspiegeln wird.
Die derzeitige Struktur, die in SICS verwendet wird, kann auf eine große Anzahl von Einstellungen angewendet werden, und die Hinzufügung weiterer Elemente wird derzeit untersucht. Seine Stärke liegt in der Kombination aus einer Grundlagenforschungslinie und einer adaptiven Linie, in der neue Variablen einfach zu den CRFs hinzugefügt werden können, um neue Forschungsfragen untersuchen zu können. Ein Beispiel für diese Anpassungsfähigkeit ist die Ergänzung des regulären Protokolls bei einer bestimmten Untergruppe von Patienten um eine umfassende Beurteilung der ventrikulären Wand durch Deformationsbildgebung, d. h. kurzfristige Belastung.
Darüber hinaus findet die Patienteninklusion derzeit ausschließlich auf der Intensivstation statt und ein Teil der Patientenversorgung wird nun verpasst. Patienten auf der Intensivstation werden oft zuerst in die Notaufnahme (ED) eingewiesen und bleiben nach der Entlassung aus der Intensivstation auf der regulären Krankenstation. Daher zielt das SICS darauf ab, Patienten in einem früheren Stadium einzubeziehen, indem Patienten bei der Ankunft in der Notaufnahme einbezogen und Interventionen und hämodynamische Funktionen ab der ersten Krankenhausaufnahme registriert werden. Darüber hinaus ist geplant, eine CCUS nach der Entlassung aus der Intensivstation auf reguläre Stationen durchzuführen, damit alle Patienten zu jedem vordefinierten Studienzeitpunkt gemessen werden können. Ein weiterer wichtiger Aspekt ist die Erweiterbarkeit des Protokolls auf andere Zentren: Seine Einfachheit ermöglicht eine einfache Anpassung durch Zentren, die selbst mit der Inklusion beginnen können.
Schließlich kann die Entwicklung und erfolgreiche Implementierung eines strukturierten CCUS-Protokolls auch klinische Auswirkungen haben. Obwohl es nur zu Forschungszwecken eingesetzt wird, könnte es nach der vorgeschlagenen kurzen Ausbildungszeit von Ärzten für die klinische CCUS eingesetzt werden. Es wäre dann interessant zu beurteilen, ob die Erleichterung der CCUS-Schulung für (unerfahrene) Ärzte zusätzliche diagnostische Tests verringern würde.
Offenlegungen
Autoren haben nichts offenzulegen.
Danksagungen
Wir möchten uns bei allen Mitgliedern der SICS-Studiengruppe bedanken, die sich im Rahmen des SICS-I beteiligt haben und an Brainstorming-Sitzungen über das aktuelle Protokoll teilgenommen haben. Wir möchten uns auch beim Forschungsbüro unserer Abteilung für Intensivpflege und seinen Koordinatoren für ihre Unterstützung bedanken. Dr. W. Dieperink und M. Onrust. Darüber hinaus möchten wir uns beim ICU Studentsteam und den studentischen Forschern bedanken, die bisher strukturell Patienten in SICS-II aufgenommen haben; J. A. de Bruin, B. E. Keuning, drs. K. Selles.
Materialien
| Name | Company | Catalog Number | Comments |
| Ultrasound machine | GE Healthcare | 0144VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound machine | GE Healthcare | 3507VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound machine | GE Healthcare | 0630VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound gel | Parker | 01-08 | Aquasonic 100 ultrasound transmission gel |
| Temperature probe | DeRoyal | 81-010400EU | Skin Temperature Sensor |
Referenzen
- Hiemstra, B., et al. Clinical examination, critical care ultrasonography and outcomes in the critically ill: cohort profile of the Simple Intensive Care Studies-I. BMJ open. 7 (9), 017170(2017).
- Lee, J., et al. Association between fluid balance and survival in critically ill patients. Journal of Internal Medicine. 277 (4), 468-477 (2015).
- Perner, A., et al. Fluid management in acute kidney injury. Intensive Care Medicine. 43 (6), 807-815 (2017).
- Balakumar, V., et al. Both Positive and Negative Fluid Balance May Be Associated With Reduced Long-Term Survival in the Critically Ill. Critical care medicine. 45 (8), 749-757 (2017).
- Hjortrup, P. B., et al. Restricting volumes of resuscitation fluid in adults with septic shock after initial management: the CLASSIC randomised, parallel-group, multicentre feasibility trial. Intensive Care Medicine. 42 (11), 1695-1705 (2016).
- Prowle, J. R., Kirwan, C. J., Bellomo, R. Fluid management for the prevention and attenuation of acute kidney injury. Nature reviews. Nephrology. 10 (1), 37-47 (2014).
- Gambardella, I., et al. Congestive kidney failure in cardiac surgery: the relationship between central venous pressure and acute kidney injury. Interactive CardioVascular and Thoracic Surgery. 23 (5), 800-805 (2016).
- Chen, K. P., et al. Peripheral Edema, Central Venous Pressure, and Risk of AKI in Critical Illness. Clinical journal of the American Society of Nephrology : CJASN. 11 (4), 602-608 (2016).
- Song, J., et al. Value of the combination of renal resistance index and central venous pressure in the early prediction of sepsis-induced acute kidney injury. Journal of critical care. 45, 204-208 (2018).
- Zhang, L., Chen, Z., Diao, Y., Yang, Y., Fu, P. Associations of fluid overload with mortality and kidney recovery in patients with acute kidney injury: A systematic review and meta-analysis. Journal of Critical Care. 30 (4), (2015).
- Simple Intensive Care Studies II - Full Text View. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ct2/show/NCT03577405? term=simple+intensive+care+studies (2018).
- Wetterslev, J. Statistical analysis plan Simple Intensive Care Studies-I DETAILED STATISTICAL ANALYSIS PLAN (SAP) 1. Administrative information 1.1. Title, registration, versions and revisions. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ProvidedDocs/24/NCT02912624/SAP_000.pdf (2018).
- van der Horst, I. C. C. Simple Observational Critical Care Studies - Full Text View - ClinicalTrials.gov. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ct2/show/NCT03553069 (2018).
- Ait-Oufella, H., et al. Alteration of skin perfusion in mottling area during septic shock. Annals of Intensive Care. 3 (1), 31(2013).
- Teasdale, G., Jennett, B. Assessment of Coma and Impaired Consciousness: A Practical Scale. The Lancet. 304 (7872), 81-84 (1974).
- Detsky, M. E., et al. Discriminative Accuracy of Physician and Nurse Predictions for Survival and Functional Outcomes 6 Months After an ICU Admission. JAMA. 317 (21), 2187(2017).
- Lipson, A. R., Miano, S. J., Daly, B. J., Douglas, S. L. The Accuracy of Nurses' Predictions for Clinical Outcomes in the Chronically Critically Ill. Research & reviews. Journal of nursing and health sciences. 3 (2), 35-38 (2017).
- Lichtenstein, D. A. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest. 147 (6), 1659-1670 (2015).
- Tang, W. H. W., Kitai, T. Intrarenal Venous Flow: A Window Into the Congestive Kidney Failure Phenotype of Heart Failure. JACC: Heart Failure. 4 (8), 683-686 (2016).
- Jeong, S. H., Jung, D. C., Kim, S. H., Kim, S. H. Renal venous doppler ultrasonography in normal subjects and patients with diabetic nephropathy: Value of venous impedance index measurements. Journal of Clinical Ultrasound. 39 (9), 512-518 (2011).
- Iida, N., et al. Clinical Implications of Intrarenal Hemodynamic Evaluation by Doppler Ultrasonography in Heart Failure. JACC: Heart Failure. 4 (8), 674-682 (2016).
- Lang, R. M., et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging. 16 (3), 233-271 (2015).
- Hiemstra, B., Eck, R. J., Keus, F., van der Horst, I. C. C. Clinical examination for diagnosing circulatory shock. Current opinion in critical care. 23 (4), 293-301 (2017).
- Vignon, P., et al. Basic critical care echocardiography: validation of a curriculum dedicated to noncardiologist residents. Critical care medicine. 39 (4), 636-642 (2011).
- Jensen, M. B., Sloth, E., Larsen, K. M., Schmidt, M. B. Transthoracic echocardiography for cardiopulmonary monitoring in intensive care. European journal of anaesthesiology. 21 (9), 700-707 (2004).
- Koster, G., van der Horst, I. C. C. Critical care ultrasonography in circulatory shock. Current opinion in critical care. 23 (4), 326-333 (2017).
- Haitsma Mulier, J. L. G., et al. Renal resistive index as an early predictor and discriminator of acute kidney injury in critically ill patients; A prospective observational cohort study. PloS one. 13 (6), 0197967(2018).
- Micek, S. T., et al. Fluid balance and cardiac function in septic shock as predictors of hospital mortality. Critical care. 17 (5), London, England. 246(2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten