Method Article
Protocollo di studio osservazionale per l'esame clinico ripetuto e l'ecografia in terapia intensiva all'interno di semplici studi di terapia intensiva
In questo articolo
Riepilogo
Sono necessari protocolli strutturati per fornire risposte alle domande di ricerca nei pazienti critici. I Simple Intensive Care Studies (SICS) forniscono un'infrastruttura per misurazioni ripetute in pazienti critici, tra cui esami clinici, analisi biochimiche ed ecografia. I progetti SICS hanno un focus specifico, ma la struttura è flessibile ad altre indagini.
Abstract
Le valutazioni longitudinali dei pazienti critici mediante combinazioni di esame clinico, analisi biochimica ed ecografia in terapia intensiva (CCUS) possono rilevare eventi avversi di interventi come il sovraccarico di liquidi in una fase precoce. Il Simple Intensive Care Studies (SICS) è una linea di ricerca che si concentra sul valore prognostico e diagnostico delle combinazioni di variabili cliniche.
La SICS-I si è concentrata in particolare sull'uso di variabili cliniche ottenute entro 24 ore dal ricovero acuto per la previsione della gittata cardiaca (CO) e della mortalità. Il suo seguito, SICS-II, si concentra su valutazioni ripetute durante il ricovero in terapia intensiva. Il primo esame clinico da parte di ricercatori qualificati viene eseguito entro 3 ore dal ricovero e consiste in esame fisico e congetture plausibili. Il secondo esame clinico viene eseguito entro 24 ore dal ricovero e comprende l'esame fisico e le ipotesi plausibili, l'analisi biochimica e le valutazioni CCUS di cuore, polmoni, vena cava inferiore (IVC) e rene. Questa valutazione viene ripetuta ai giorni 3 e 5 dopo il ricovero. Le immagini CCUS sono convalidate da un esperto indipendente e tutti i dati sono registrati in un database online protetto. Il follow-up a 90 giorni include la registrazione delle complicanze e dello stato di sopravvivenza secondo le cartelle cliniche del paziente e l'anagrafe comunale delle persone. L'obiettivo principale di SICS-II è l'associazione tra congestione venosa e disfunzione d'organo.
Lo scopo della pubblicazione di questo protocollo è quello di fornire dettagli sulla struttura e sui metodi di questo studio prospettico prospettico di coorte in corso, consentendo di rispondere a più domande di ricerca. Viene illustrato il disegno della raccolta dei dati dell'esame clinico combinato e delle valutazioni CCUS in pazienti critici. Il SICS-II è aperto alla partecipazione di altri centri ed è aperto ad altre domande di ricerca a cui è possibile rispondere con i nostri dati.
Introduzione
I pazienti ricoverati nell'Unità di Terapia Intensiva (ICU) sono i più critici con alti tassi di comorbilità e multimorbilità, indipendentemente dalla diagnosi di ricovero. Pertanto, l'unità di terapia intensiva è l'ambiente per studiare la comorbilità e la multimorbilità, il loro impatto negativo sugli esiti dei pazienti e il modo in cui la malattia critica può portare a complicanze che contribuiscono a ulteriori multimorbilità. Per ottenere informazioni su questo gruppo eterogeneo di pazienti, l'esame dettagliato di ogni singolo paziente è della massima importanza.
La linea di ricerca Simple Intensive Care Studies (SICS) è progettata con l'obiettivo di valutare il valore prognostico e diagnostico di una selezione completa di variabili cliniche, emodinamiche e biochimiche nei pazienti in terapia intensiva raccolte da un team dedicato di studenti-ricercatori coordinati da esperti medici. Uno degli obiettivi primari del SICS-I è quello di studiare la combinazione dei risultati dell'esame clinico meglio associati allo shock definito dalla gittata cardiaca (CO) misurata mediante ecografia in terapia intensiva (CCUS)1. Il SICS-II utilizza la struttura del SICS-I ma aggiunge l'esame clinico ripetuto, l'analisi biochimica e la CCUS. L'obiettivo principale di SICS-II è quello di quantificare la congestione venosa e identificare le variabili che possono contribuire al suo sviluppo. Le misurazioni ripetute forniscono informazioni dinamiche sul decorso della malattia di un paziente. Gli studi dimostrano che il sovraccarico di liquidi è presente nei pazienti critici e il sovraccarico di liquidi è associato a nuove morbilità. Ci concentriamo quindi sulla congestione venosa in questi pazienti. Inoltre, diversi studi hanno suggerito i possibili effetti negativi di un'eccessiva somministrazione di liquidi 2,3,4,5,6. Il sovraccarico di liquidi può essere percepito come congestione venosa o sovraccarico di liquidi venosi, che può essere osservato da un aumento della pressione venosa centrale (CVP) o da un edema periferico. Un'elevata pressione nel sistema venoso centrale può contribuire a ridurre la perfusione d'organo seguita da insufficienza d'organo, ma non esiste una definizione esatta di congestione venosa.
Studi precedenti che suggerivano effetti negativi associati a un'eccessiva somministrazione di liquidi utilizzavano singole misurazioni surrogate della congestione venosa come CVP, collassabilità IVC, bilancio dei liquidi e/o edema periferico 7,8,9,10. Per quanto ne sappiamo, il SICS-II è il primo studio a eseguire CCUS ripetute di più organi in combinazione con i risultati dell'esame clinico per valutare lo stato emodinamico dei pazienti in terapia intensiva. L'attenzione su questa tecnica di ecografia multiorgano è importante poiché l'insufficienza d'organo o la ridotta funzione d'organo influenzano sempre l'intero sistema emodinamico. Ci aspettiamo che i dati provenienti da esami ripetuti in SICS-II contribuiscano a svelare la fisiopatologia e le conseguenze della congestione venosa. Di conseguenza, ciò può aiutare a migliorare l'identificazione precoce dei pazienti critici a rischio di congestione venosa e guidare l'ottimizzazione della somministrazione di liquidi. Inoltre, è possibile esplorare l'associazione tra congestione venosa e insufficienza d'organo a breve e lungo termine. Infine, il successo dell'implementazione del protocollo SICS-II renderebbe evidente che lo svolgimento di un ampio studio prospettico con un team dedicato di studenti-ricercatori è fattibile e può produrre dati di qualità per indagare i problemi clinici.
Qui viene dimostrata la procedura per eseguire un esame clinico completo dei pazienti in terapia intensiva con l'obiettivo di misurare la congestione venosa. L'11 clinicaltrials.gov è stato pubblicato un breve protocollo del SICS-II. Dopo il primo esame clinico iniziale, vengono condotti al massimo tre ulteriori esami clinici, analisi biochimiche e CCUS. L'esame obiettivo comprende variabili che riflettono la perfusione/microcircolazione periferica come il tempo di riempimento capillare (CRT) o la screziatura, nonché variabili della macrocircolazione come la pressione sanguigna, la frequenza cardiaca e la produzione di urina. Inoltre, vengono registrati i valori di laboratorio delle cure standard (ad es. lattato, pH). Successivamente, viene eseguita la CCUS del cuore, dei polmoni, dell'IVC e del rene per ottenere informazioni sulla perfusione. Ulteriori metodi saranno elaborati all'interno del nostro piano di analisi statistica, come è stato fatto nel SICS-I12.
Sulla base di 138 pazienti inclusi tra il 14-05-2018 e il 15-08-2018, le misurazioni ripetute di un'ampia gamma di variabili cliniche all'interno di questa struttura sembrano fattibili. Dimostriamo anche che la convalida indipendente è fattibile. Il SICS-II esemplifica una metodologia preziosa per consentire ai ricercatori di registrare con precisione i cambiamenti nelle variabili di interesse e può quindi fungere da guida per condurre ricerche che riflettano la progressione della condizione dei pazienti osservata nella pratica quotidiana. Lo studio SICS-II è condotto quotidianamente da un team di 2-3 studenti-ricercatori in ogni momento, con un supervisore senior disponibile su chiamata. Questi studenti-ricercatori sono addestrati nell'esecuzione dell'esame fisico e della CCUS. Eseguono tutte le fasi del seguente protocollo e sono responsabili dell'inclusione dei pazienti sia durante l'orario di lavoro che nei fine settimana. Inoltre, un team di studenti di terapia intensiva più numeroso di circa 30 studenti partecipa a turni serali e notturni, per condurre l'esame clinico iniziale (entro 3 ore dal ricovero) dei nuovi pazienti. La Figura 1 presenta un riepilogo schematico del protocollo di studio e le Figure 2 e 3 mostrano i Form Report Forms (CRF) utilizzati per registrare i dati al momento della raccolta.
Protocollo
Questo studio è condotto secondo i principi della Dichiarazione di Helsinki (64a versione, Brasile 2013) e in conformità con la legge sulla ricerca medica che coinvolge soggetti umani (WMO), le linee guida di buona pratica clinica e il comitato di revisione istituzionale locale (Medisch Ethische Toetsingscommissie; M18.228393).
1. Ricovero del paziente in terapia intensiva e screening
NOTA: Per lo screening, un elenco digitale con i dati minimi del paziente viene aggiornato durante il giorno e vengono registrate le inclusioni e le esclusioni. L'elenco degli screening è memorizzato nel sistema elettronico sicuro dell'ospedale con accesso esclusivo per i ricercatori. Per proteggere la privacy dei pazienti, tutte le copie fisiche degli elenchi vengono distrutte alla fine della giornata. I criteri di inclusione sono: ricovero acuto e non programmato; e pazienti di età superiore ai 18 anni.
- Esamina il sistema di gestione dei pazienti per tutti i nuovi ricoveri e verifica se i pazienti soddisfano i criteri di inclusione.
- Escludere immediatamente le riammissioni, i ricoveri elettivi, i pazienti di età inferiore ai 18 anni e coloro che non saranno in grado di dare il consenso informato.
NOTA: Escludiamo anche i pazienti con un motivo di ricovero neurologico non traumatico poiché abbiamo stabilito più gruppi di pazienti in SICS-I, in cui questo gruppo era emodinamicamente stabile e il ricovero in terapia intensiva riguardava principalmente il trattamento neurologico1. - Aggiungi le possibili inclusioni a un elenco di pazienti continuamente aggiornato. Utilizza questo elenco per pianificare quotidianamente misurazioni nuove e ripetute in base al momento del ricovero/inclusione.
2. Esame clinico 1
NOTA: Il primo esame clinico viene condotto in tutti i pazienti che soddisfano i criteri di inclusione entro 3 ore dal ricovero. Questo esame viene eseguito dagli studenti-ricercatori se il paziente viene ricoverato durante il turno diurno. Per i pazienti ricoverati durante i turni serali o notturni, questo primo esame clinico viene condotto da un membro del team di studenti dell'ICU e i dati vengono elaborati e finalizzati il giorno successivo dagli studenti-ricercatori. Per una descrizione completa del protocollo del primo esame clinico, vedere clinicaltrials.gov13. Al letto del paziente, se possibile, ai pazienti viene chiesto se acconsentono all'esame clinico in quel momento. Il consenso informato scritto viene ottenuto in seguito: vedere il passaggio 1.2 per le istruzioni e il passaggio 7.
- Esame obiettivo
- Inizia garantendo le regole di sicurezza/isolamento richieste per il paziente: disinfettare mani e polsi seguendo le procedure ospedaliere standard con alcol al 70% e utilizzare guanti non sterili e un grembiule di plastica o precauzioni aggiuntive come un camice isolante durante il contatto con il paziente.
- Presentatevi e chiedete al paziente il permesso di condurre l'esame se non è sedato, cosciente e adeguato. Spiegare al paziente cosa si sta facendo.
NOTA: Il consenso informato formale viene richiesto in una fase successiva durante il ricovero in terapia intensiva o dopo la dimissione in reparto, sia dal paziente stesso che dai parenti più stretti se il paziente non è in grado di farlo. Questa operazione è descritta in modo più dettagliato nel passaggio 7. - Registra le variabili emodinamiche frequenza cardiaca, frequenza respiratoria, pressione arteriosa sistolica (SBP), pressione arteriosa diastolica (DBP), pressione arteriosa media (MAP) e pressione venosa centrale (CVP) dal monitor da posto letto.
- Registrare la saturazione di ossigeno (SpO2) e se il paziente riceve un supporto respiratorio non invasivo o è ventilato meccanicamente. In tal caso, registrare la pressione positiva di fine espirazione (PEEP) e la frazione di O2 inspirato (FiO2).
- Determinare la riperfusione del ginocchio e dello sterno premendo 10 secondi sulla pelle e lasciando andare, quindi contando il numero di secondi fino alla completa riperfusione.
- Determina la temperatura cutanea soggettiva palpando le estremità con le mani e stima se sono fredde o calde.
- Registrare la temperatura della vescica dal monitor, che mostra la temperatura misurata da un sensore collegato a un catetere urinario a permanenza.
- Determinare la temperatura cutanea sul dorso del piede posizionando un sensore di temperatura aggiuntivo al centro del dorso e collegandolo al monitor. Ricollegare il sensore di temperatura della vescica al monitor dopo questa misurazione.
- Segnare il grado di screziatura se osservabile utilizzando la scala del ginocchio Ait-Oufella14.
- Registrare se il paziente riceve sedazione e, in caso affermativo, quale farmaco, a quale velocità di pompaggio e in quale dosaggio.
- Determinare e registrare la scala del coma di Glasgow (GCS) del paziente15.
- Stimare la sopravvivenza del paziente in ospedale, la sopravvivenza a 6 mesi e la capacità di tornare alla residenza originale sulla base di un'ipotesi plausibile e dei risultati di questo esame clinico16,17. Chiedi anche all'infermiere e al medico le loro stime e registra tutte le stime sul CRF.
3. Esame clinico 2
NOTA: Il secondo esame clinico viene condotto entro 24 ore dal ricovero e include misurazioni della CCUS. Questo esame è sempre condotto da studenti-ricercatori formati in CCUS e non da membri del team di studenti dell'ICU. Inoltre, nei pazienti che soddisfano i criteri di inclusione e si sono sottoposti all'esame clinico 1, ma che in seguito hanno dimostrato di soffrire esclusivamente di una condizione neurologica (ad esempio, emorragia subaracnoidea non traumatica), non vengono eseguite misurazioni ripetute, inclusa la CCUS, e queste sono infine escluse.
- Ottenere il consenso informato.
NOTA: Ai sensi delle norme del Centro medico universitario di Groninga (UMCG) per le misurazioni osservazionali, a partire dal 1° gennaio 2016, le immagini ecografiche raccolte durante l'esame clinico possono essere utilizzate senza esplicito consenso. Tuttavia, la politica dello studio SICS-II è quella di cercare il consenso informato dei pazienti il prima possibile, sostenendo contemporaneamente i principi di ridurre al minimo lo "stress" per il paziente, aumentare il processo decisionale condiviso e dare al paziente abbastanza tempo per prendere in considerazione la partecipazione. Poiché la maggior parte dei pazienti non è in grado di fornire il consenso all'inizio della degenza in terapia intensiva, di solito si ottiene un consenso "ritardato". Se, al contrario, sono in grado di fornire o rifiutare il consenso prima o dopo gli esami, questi non verranno effettuati o tutti i dati già ottenuti saranno cancellati.- Prima di iniziare l'esame, determinare se il paziente è vigile/cosciente e in grado di interagire con gli studenti-ricercatori determinando il loro punteggio GCS. Fornire ai pazienti capaci una spiegazione in merito all'esame da condurre e lasciare una lettera scritta standardizzata che devono firmare.
- Nel caso in cui il paziente non sia in grado di essere consultato per il consenso (a causa di disturbi della coscienza, capacità mentali limitate, ecc.), monitorare quotidianamente il punteggio GCS e prendere in considerazione l'ottenimento del consenso della famiglia se i familiari sono raggiungibili (come descritto nel passaggio 7.1).
- Eseguire l'esame obiettivo seguendo i passaggi descritti per l'esame clinico 1.
- Eseguire la CCUS del cuore e dei polmoni.
NOTA: Questo protocollo è valido quando si utilizza un ecografo nel Tabella dei materiali, il trasduttore cardiaco per la vista parasternale dell'asse lungo (PLAX) e il trasduttore cardiaco phased array per le viste apicali a quattro e cinque camere (AP4CH, AP5CH). Per altri sistemi a ultrasuoni, gli utenti devono consultare i manuali operativi del proprio dispositivo specifico.- Accendere la macchina. Registra l'ID anonimo dello studio del paziente, avvia un nuovo esame e attendi che sullo schermo venga visualizzata la modalità di imaging 2D automatico.
- Se il paziente è vestito, sbottonare il camice per esporre il torace. Posiziona i nuovi adesivi per elettrocardiogramma (ECG) e collegali all'ecografo, se necessario.
- Collegare il cavo ECG dalla macchina al monitor al posto letto del paziente. Attendere che si stabilizzi e registrare la frequenza cardiaca misurata dall'ECG nel CRF.
- Quando possibile, posizionare il paziente leggermente ruotato sul lato sinistro. Ciò migliora la qualità dell'imaging cardiaco e renale.
NOTA: Considerazioni tecniche: prima di iniziare l'esame, fare clic sul pulsante Configura e impostare le impostazioni dell'immagine su cinque cicli cardiaci, una profondità di 10-15 cm, una larghezza dell'immagine di 65° e una frequenza di 1,7/3,4 MHz. Verificare se è selezionata la sonda corretta facendo clic sul pulsante Sonda . - Mettere una quantità sufficiente di gel per ultrasuoni sul trasduttore a ultrasuoni e posizionare il trasduttore sul lato sinistro dello sterno, tra il 3° e il 5° spazio intercostale, per ottenere la vista PLAX in modalità 2D. Regolare la profondità secondo necessità per registrare le immagini per le misurazioni del tratto di efflusso ventricolare sinistro e salvare l'immagine.
NOTA: La larghezza massima del ventricolo sinistro dovrebbe essere visibile con un'apertura massima della valvola mitrale. Nessun muscolo della valvola dovrebbe essere visibile. Prima di posizionare il trasduttore sul torace del paziente, avvertirlo che il gel è freddo e può dare fastidio e che sentirà una certa pressione (specialmente intorno allo sterno durante la registrazione di immagini per il tratto di efflusso ventricolare sinistro (LVOT). Prestare attenzione che nei pazienti che hanno fratture costali alcuni punti dovrebbero essere evitati in quanto ciò potrebbe essere scomodo per il paziente). - Nella modalità 2D, regolare la profondità a 15-20 cm e posizionare il trasduttore sopra l'apice del cuore, caudale all'areola sinistra. Si ottiene la vista AP4CH, con tutte e quattro le camere chiaramente visualizzate. Salva l'immagine.
- Ruotare la trackball in modo che il cursore si trovi sul confine tra la valvola tricuspide e la parete del ventricolo destro per ottenere l'escursione sistolica sul piano anulare tricuspide (TAPSE). Premere il pulsante M-Mode per ottenere l'immagine corretta e salvarla quando si vedono onde sinusoidali definite. Salva l'immagine.
- Posiziona il cursore sulla valvola tricuspide con la trackball. Diminuire la larghezza dell'immagine per aumentare il numero di fotogrammi al secondo, necessari per la qualità dell'RV S. Premere prima il pulsante TVI , quindi il pulsante PW , per ottenere l'immagine corretta per il RV S e salvarla.
- Dalla vista AP4CH, inclinare il trasduttore verso l'alto (cioè appiattirlo ) per ottenere la vista AP5CH e ottenere la radice aortica sullo schermo. Salva l'immagine.
- Posiziona il cursore proprio sopra la valvola aortica e premi il pulsante PW per ottenere il Doppler a onde pulsate LVOT. Posizionare il cursore esattamente nello stesso punto in cui è stato misurato il diametro LVOT. Salva l'immagine con la massima qualità (bordi d'onda Doppler nitidi, cavi all'interno e ben distinguibili dal flusso retrogrado o mitralico). Questi saranno successivamente utilizzati per calcolare l'integrale velocità-tempo (VTI) e successivamente il CO.
NOTA: Cercare sempre di ottenere almeno tre onde di flusso per ogni misurazione. In caso di ritmo irregolare, dovrebbero essere risparmiate almeno cinque onde. - Procedere all'ecografia polmonare utilizzando lo stesso trasduttore cardiaco phased array e modificando le impostazioni su una frequenza di 3,7 MHz, profondità a 15 cm e registrare le immagini solo durante 2 cicli cardiaci. Posizionare il trasduttore in 6 posizioni diverse, con la luce del trasduttore a ore 12, secondo il protocollo BLU18. Assicurati di ottenere sempre l'immagine nella stessa sequenza, per evitare confusione quando visualizzi le immagini in un secondo momento.
- Ottenere una vista superiore della clavicolare media anteriore dei polmoni posizionando il trasduttore sullo spazio intercostale della 2ae 3acostola su entrambi i lati. Salva le immagini per ogni lato.
- Ottenere una vista anteriore inferiore della clavicolare media dei polmoni posizionando il trasduttore da 2 a 3 costole più in basso. Salva le immagini per ogni lato.
- Ottenere una vista assiale centrale dei polmoni posizionando il trasduttore sotto le ascelle del paziente. Salva le immagini per ogni lato.
- Una volta completata l'imaging cardiaco e polmonare, rimuovere il gel in eccesso dal torace del paziente.
- Eseguire la CCUS dell'IVC e del rene.
- Fare clic sul pulsante Sonda e utilizzare la trackball per cambiare la sonda attiva con il trasduttore convesso/curvilineo (addominale) per l'IVC e l'esame renale. La luce del trasduttore, che può essere utilizzata per l'orientamento, deve essere a ore 12 per entrambe le misurazioni.
- Utilizzando la modalità 2D e con le impostazioni impostate su una profondità di 10-20 cm e una frequenza di 2,5/5,0 MHz, posizionare il trasduttore appena sotto il processo xifoideo e spostarlo di circa 2 cm alla destra del paziente. L'IVC dovrebbe diventare visibile. Salva l'immagine.
- Posiziona il cursore appena sopra la parete superiore dell'IVC e all'esterno del lume usando la trackball e premi il pulsante M-Mode . Salva l'immagine.
- Per l'ecografia renale, iniziare con la modalità 2D e regolare le impostazioni a una profondità di 10-15 cm e una frequenza di 2,2/4,4 MHz. Posizionare il trasduttore dorsale e caudale della gabbia toracica. Prendi il rene scelto al centro dell'immagine e salvalo.
NOTA: Assicurarsi di posizionare il trasduttore il più dorsale possibile per filtrare il tessuto epatico e le anse intestinali. Per misurazioni affidabili della lunghezza del rene, i bordi del rene dovrebbero essere chiaramente visibili e la distanza tra il complesso del seno centrale (il centro più ecogeno del rene) e la corteccia dovrebbe essere simile in tutta l'immagine. - Premere il pulsante Colore per ottenere un'immagine color Doppler del rene e determinare il flusso nel sistema vascolare renale. Posizionare il cursore su qualsiasi arteria in corrispondenza della giunzione corticommidollare al centro del rene dove il flusso Doppler è chiaramente visibile utilizzando la trackball.
- Regolare l'angolo del cursore e premere il pulsante PW . Se necessario, regolare l'ampiezza del segnale e il contrasto in modalità attiva . Salva l'immagine.
- Determinare se c'è anche un segnale venoso sufficiente (cioè un flusso visibile nella metà negativa dell'asse y), che è necessario per le misurazioni successive. In caso contrario, ripetere il passaggio 3.4.5 e posizionare il cursore su una vena in corrispondenza della giunzione corticommidollare al centro dove è visibile il flusso venoso. Salva l'immagine.
- Una volta completate tutte le imaging, scollegare tutti i cavi, rimuovere il gel in eccesso dal paziente e dal trasduttore, riparare o coprire il paziente e pulire il trasduttore con salviette disinfettanti approvate per gli ultrasuoni.
4. Esami clinici 3 e 4
NOTA: Il terzo e il quarto esame clinico vengono condotti nei giorni 3 e 5 dopo il ricovero se il paziente è ancora in terapia intensiva (cioè non è avvenuto alcun decesso o trasferimento in reparto).
- Esame obiettivo
- Condurre l'esame obiettivo seguendo i passaggi descritti per l'esame clinico 1.
- CCUS del cuore e dei polmoni
- Eseguire l'esame ecografico del cuore e dei polmoni secondo il passaggio 3.3. Ottenere LVOT solo una volta poiché si tratta di una misurazione statica e quindi non deve essere registrata negli esami clinici 3 e 4.
- CCUS dell'IVC e del rene
- Condurre l'esame ecografico dell'IVC e del rene secondo il passaggio 3.4. Ottenere la lunghezza del rene una sola volta poiché si tratta di una misurazione statica e quindi non deve essere registrata nell'esame clinico 3 e 4.
5. Misurazioni e analisi degli esami ecografici
NOTA: Le immagini salvate durante l'esame clinico vengono utilizzate dopo ogni esame per misurare le variabili desiderate. I valori misurati vengono registrati sulla CRF e trascritti in un sistema di gestione dei dati clinici dei pazienti online. Oltre alle immagini originali che verranno successivamente utilizzate per la convalida, devono essere salvate anche le immagini in cui vengono eseguite e visibili le misurazioni.
- Misurazione LVOT
- Fare clic sul pulsante Sonda per selezionare il trasduttore cardiaco e avviare le misurazioni.
- Utilizzando l'immagine salvata nel passaggio 3.3.5, mettere in pausa l'immagine quando le valvole sono completamente aperte.
- Fare clic sul pulsante Misura , quindi selezionare le opzioni Cardiac-Dimension-LVOT nel menu a destra per avviare la misurazione.
- Una volta visualizzato il cursore, scegli due punti alla base della valvola aortica, uno su ciascun lato del lume, dal bordo interno a quello interno, durante la telediastole. Salva l'immagine.
NOTA: La misurazione LVOT deve essere eseguita e salvata prima della misurazione del CO, in modo che questa possa essere determinata automaticamente dalla macchina.
- Misurazione di CO
- Utilizzando l'immagine salvata nel passaggio 3.3.10, tracciare l'output ventricolare sinistro. Regolare la scansione orizzontale a 100 cm/s.
- Seleziona tre onde cave ben sagomate con bordi chiari che si allineano con l'ECG. Fare clic sul pulsante Misura e utilizzare la trackball per selezionare le opzioni Traccia cardiaca-aortica-LVOT .
- Traccia la linea della forma d'onda, iniziando e finendo alla linea di base, e l'ecografo calcola automaticamente il CO. Ripeti l'operazione per tre onde e salva questa immagine.
NOTA: In caso di ritmo irregolare, registrare il valore medio di CO ottenuto per cinque onde.
- TAPSE
- Utilizzando l'immagine in modalità M salvata nel passaggio 3.3.7, fare clic sul pulsante Misura e utilizzare la trackball per selezionare le opzioni Cardiac-Dimension-TAPSE nel menu a destra.
- Posizionare il cursore prima sul punto più basso di un'onda sinusoidale ben definita e poi sul punto più alto. La differenza tra i due (il TAPSE) dovrebbe apparire nell'angolo in alto a sinistra dello schermo. Fallo in tre onde sinusoidali e fai la media delle tre misurazioni TAPSE. Salva l'immagine.
- Escursione sistolica ventricolare destra (RV S')
- Utilizzando l'immagine salvata nel passaggio 3.3.8, fare clic sul pulsante Calibro e posizionare il cursore sul picco più alto di una curva ben definita. Fallo in tre curve e fai la media. Salva l'immagine.
- Valutazione degli artefatti Kerley B-line
NOTA: Le linee A orizzontali che rappresentano una superficie polmonare normale possono essere utilizzate come riferimento per il rilevamento delle linee B. Questi derivano dalla pleura e sono iperecogeni rispetto alle linee A.- Regola il contrasto dell'immagine e/o il guadagno. Le linee B non sono sempre immediatamente visibili nelle immagini salvate.
- Determinare e registrare il numero di linee B di Kerley per ciascuna delle sei immagini ottenute. Poiché il numero di linee B non è memorizzato nella macchina, deve essere immediatamente registrato sul CRF (tra 0 e 5).
- Diametro IVC e pieghevolezza
- Fare clic sul pulsante Sonda per selezionare il trasduttore addominale e avviare le misurazioni.
- Utilizzando l'immagine 2D salvata nel passaggio 3.4.2, fare clic sul pulsante Calibro e misurare la distanza tra le due pareti dell'IVC a 2 cm dal punto in cui entra nell'atrio destro. Questo è il diametro IVC, salva questa immagine.
- Utilizzando l'immagine M-mode salvata nel passaggio 3.4.3, fare clic sul pulsante Calibro e misurare i diametri espiratori e inspiratori IVC. Salva questa immagine.
NOTA: I diametri espiratorio e inspiratorio dell'IVC sono rispettivamente i diametri massimo e minimo visti nell'immagine M-mode.
- Lunghezza dei reni e flusso sanguigno
- Utilizzando l'immagine 2D salvata nel passaggio 3.4.4, fare clic sul pulsante Calibro e tracciare la linea più lunga che va dalla caudale alle estremità craniche della corteccia renale. Questa è la lunghezza del rene in cm, registrare questo risultato nel CRF. Salva questa immagine.
- Utilizzando l'immagine Doppler salvata nel passaggio 3.4.6, analizzare la linea di flusso venoso vista al di sotto della linea di base come continua, monofasica o bifasica. Registrare i risultati nel CRF.
- Utilizzando l'immagine salvata nel passaggio 3.4.6, fare clic sul pulsante Misura e utilizzare la trackball per selezionare le opzioni Addominale-Renale-PS/ED/RI nel menu a destra.
- Posizionare il cursore sul picco e sul punto più basso dell'onda di flusso pulsatile nella metà positiva dell'asse y.
NOTA: La macchina G6 è in grado di calcolare automaticamente l'indice resistivo renale Doppler (RRI) se viene memorizzata un'onda a flusso pulsatile continuo, utilizzando la formula: RRI = (velocità sistolica di picco - velocità telediastolica)/velocità sistolica di picco. Salvare l'immagine con la misurazione dall'ecografo sullo schermo. - Utilizzando l'immagine salvata al punto 3.4.6 o 3.4.7, fare clic sul pulsante Calibro e posizionare il cursore, prima, sulla velocità massima del flusso di picco, quindi sulla velocità massima del flusso al nadir (cioè alla fine della diastolica)19. Salvare l'immagine dopo la misurazione.
NOTA: L'indice di impedenza venosa (VII) è calcolato da: VII = (velocità sistolica di picco - velocità telediastolica) / velocità sistolica di picco 20,21. Il VII non è registrato in caso di flusso monofasico, in quanto in tal caso è visibile un solo picco e non sono distinguibili fasi diastolica e sistolica.
6. Registrazione, archiviazione e convalida dei dati delle immagini ecografiche
NOTA: Come mostra la Figura 1 , la registrazione dei dati viene effettuata dopo ogni esame clinico. Di seguito, viene descritta la procedura di inserimento dei dati ottenuti dalle misurazioni, dall'esame clinico e dalle informazioni biochimiche (Tabella 2) recuperate dalla cartella clinica elettronica nel file online anonimo del soggetto dello studio.
- Accedi al sistema di gestione dei pazienti online sicuro e apri il dossier del paziente incluso di recente. Registrare i valori dell'emogasanalisi, le variabili sieriche generali, le variabili renali sieriche e l'analisi delle urine nelle 24 ore. L'elenco di tutte le variabili ottenute e le istruzioni per farlo sono presentate nella Tabella 2.
- Convalidare le immagini CCUS cardiache.
NOTA: Questa convalida viene eseguita da esperti indipendenti di un laboratorio di imaging cardiovascolare in conformità con le linee guida EACVI22. Viene valutata la qualità delle immagini ottenute dagli studenti-ricercatori e vengono ripetute le misure eseguite per garantire la qualità richiesta delle misure dimensionali e dei tracciati dei profili di velocità.- Eseguire le misurazioni LVOT alla fine della diastole, come si vede nel segnale ECG, appena sotto la valvola aortica.
- Tracciare il segnale PW prelevato dal LVOT in una vista AP5CH per ottenere il volume sistolico del ventricolo sinistro e il CO del ventricolo sinistro.
- Convalida tutte le immagini e le misurazioni dell'IVC e dei reni. Questo dovrebbe essere eseguito da un radiologo addominale indipendente ed esperto. In caso di problemi con l'ottenimento delle immagini desiderate durante l'esame clinico, il radiologo addominale indipendente può essere chiamato per eseguire la CCUS, nel qual caso non avviene alcuna ulteriore convalida.
7. Follow-up del paziente
- Registrazione del consenso informato
- Se il consenso del paziente o della famiglia viene ottenuto durante uno qualsiasi degli esami clinici o dopo che il protocollo degli esami clinici è terminato, ma il paziente è ancora ricoverato in ospedale, registrarlo nel sistema di gestione dei dati del paziente e caricare il modulo di consenso firmato a mano.
- Se il consenso è stato negato, registrarlo nel sistema di gestione dei dati del paziente insieme al motivo per cui non ha ottenuto il consenso e informare il coordinatore dello studio, che cancellerà tutti i dati del paziente.
- Dati sulla mortalità
- Per i pazienti deceduti durante il ricovero, registrare la mortalità direttamente dalla cartella clinica elettronica e la causa di morte associata.
- Per i pazienti senza mortalità intraospedaliera, ottenere i dati sulla mortalità dal registro municipale dei Paesi Bassi, che viene aggiornato ogni 90 giorni.
Risultati
Lo scopo di questi risultati rappresentativi è quello di illustrare la fattibilità del protocollo.
Pazienti
In totale, 663 pazienti sono stati ricoverati in terapia intensiva tra il 14-05-2018 e il 15-08-2018. Di questi, 208 pazienti erano idonei per l'inclusione (i motivi dell'esclusione sono mostrati nella Figura 4). Un numero di 49 pazienti è stato escluso in quanto non vi era la possibilità di eseguire la CCUS a causa degli sforzi di rianimazione in corso. Sette pazienti hanno rifiutato di partecipare (nessun consenso informato) e in quattro pazienti la CCUS è risultata impossibile, ad esempio a causa del posizionamento prono per la ventilazione meccanica o la chiusura assistita dal vuoto di grandi ferite, con il risultato che 138 pazienti inclusi avevano dati per l'analisi.
Convalida CCUS e qualità dell'immagine
È prevista un'ampia convalida dell'imaging cardiaco. È stata avviata la convalida dell'ecografia renale. Finora, sono state convalidate le immagini di 21 pazienti (15%). In 18 pazienti (86%) le immagini sono apparse di qualità sufficiente. Tutti i motivi di disapprovazione delle immagini sono stati elencati e restituiti per il feedback al ricercatore che ha eseguito l'ecografia. Il nome del ricercatore che ha eseguito l'ecografia viene registrato per poter valutare la variabilità inter- e intra-osservatore utilizzando il coefficiente di correlazione intraclasse (ICC). I metodi statistici esatti saranno descritti nel nostro piano di analisi statistica, come è stato fatto nel SICS-I12.
Caso esemplificativo: paziente X, femmina di mezza età
La paziente X è stata ricoverata dopo essere stata trovata con perdita di coscienza e pressione bassa. Tutte le misurazioni ottenute sono riportate nella Tabella 1. Tutte le variabili sono state ottenute entro il tempo richiesto senza dati mancanti, illustrando la possibile fattibilità di questo protocollo. Entro 3 ore dal ricovero è stato eseguito il primo esame clinico. Durante questo esame il paziente è stato sedato, intubato e ha avuto bisogno di un trattamento vasopressore. Il secondo esame clinico è stato eseguito dieci ore dopo e ha mostrato parametri vitali stabili dopo 700 ml di infusione di liquidi. I vasopressori sono stati ridotti. La CCUS e l'analisi biochimica hanno mostrato una funzionalità cardiaca, IVC e renale normale (Figura 5, Figura 6 e Figura 7). Al T3, due giorni dopo, i vasopressori sono stati interrotti, ma il bilancio cumulativo positivo dei liquidi era salito a 6 litri, accompagnato da un aumento del CO, un IVC più ampio e una diminuzione della perfusione e della funzione renale riflessa dall'aumento della creatinina sierica. Al T4, 5 giorni dopo il ricovero, l'equilibrio idrico e la creatinina sierica erano aumentati ulteriormente, dove il paziente ha sviluppato AKI allo stadio 3. Il paziente è deceduto 2 giorni dopo a causa di un'insufficienza multiorgano di origine non chiara, a 7 giorni dal ricovero.
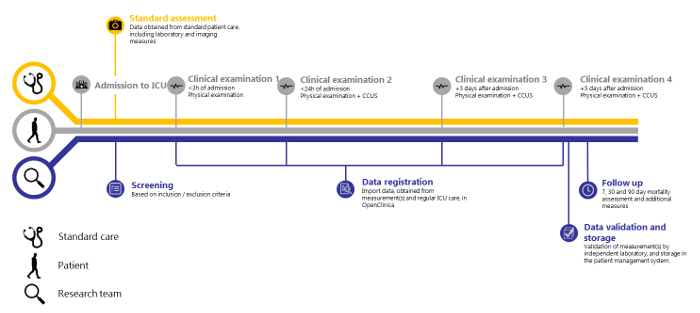
Figura 1: Panoramica dello studio SICS-II. Cronologia dello studio SICS-II dal ricovero del paziente in terapia intensiva alla fase finale della registrazione dei dati. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Modulo di segnalazione del caso (CRF) per l'esame clinico 1. CRF che deve essere compilato dagli studenti del team di terapia intensiva o dagli studenti-ricercatori durante lo svolgimento del primo esame clinico. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Modulo di segnalazione del caso (CRF) per gli esami clinici 2, 3 e 4. CRF che deve essere compilato dagli studenti del team di terapia intensiva o dagli studenti-ricercatori durante lo svolgimento del secondo, terzo e quarto esame clinico. Clicca qui per visualizzare una versione più grande di questa figura.
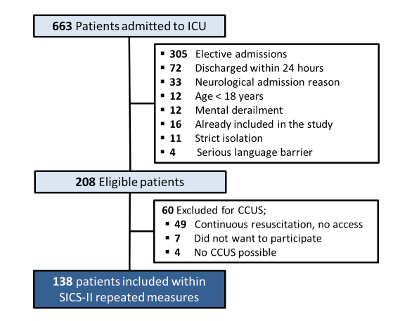
Figura 4: Tabella di inclusione ed esclusione dei pazienti SICS-II. Diagramma di flusso che descrive i criteri per l'inclusione e l'esclusione dei pazienti nello studio SICS-II fino al 15-08-2018. Clicca qui per visualizzare una versione più grande di questa figura.
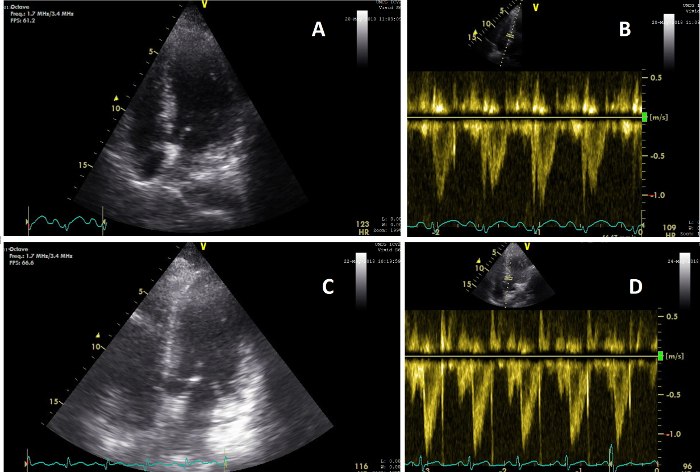
Figura 5: Viste apicali che mostrano il cambiamento nella funzione cardiaca. (A) Immagine del cuore su una vista AP4CH durante la CCUS condotta durante l'esame clinico 2 (T=2); (B) Immagine del segnale dell'onda pulsata cardiaca VTI su T=2, che mostra un CO di 5,6 L/min; (C) Immagine del cuore su una vista AP5CH durante la CCUS condotta durante l'esame clinico 3 (T=3); (D) Immagine del segnale dell'onda pulsata VTI cardiaca su T=3, che mostra un CO di 8,3 L/min. Fare clic qui per visualizzare una versione più grande di questa figura.
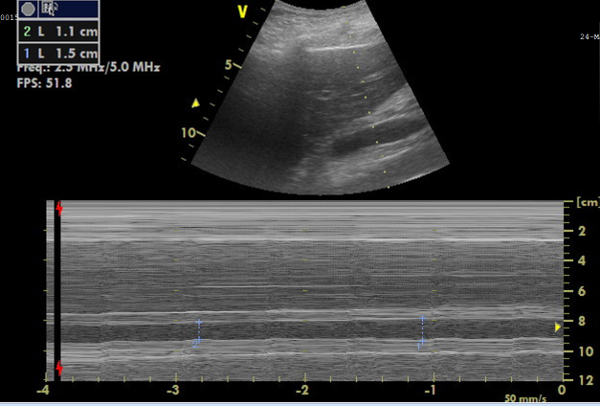
Figura 6: Immagine in modalità M della vena cava inferiore (IVC) per misure di diametro. Immagine che mostra, in alto, l'IVC in tempo reale e, in basso, l'immagine M-mode che rappresenta le variazioni di diametro dell'IVC, da cui è possibile calcolare la collassabilità. Clicca qui per visualizzare una versione più grande di questa figura.
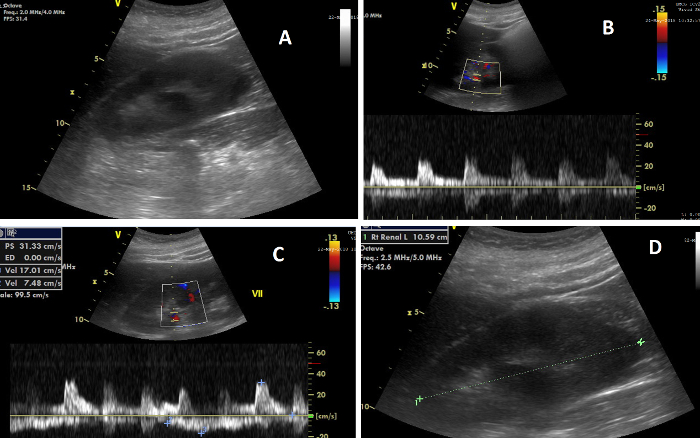
Figura 7: I vari elementi dell'ecografia renale. (A) Immagine del rene destro durante la CCUS; (B) Immagine che mostra, in alto, il flusso Doppler nelle arterie renali e, in basso, l'onda di flusso da cui viene calcolato l'indice resistivo renale; (C) Immagine che mostra, in alto, il flusso Doppler nelle vene renali e, in basso, l'onda di flusso da cui viene calcolato l'indice di impedenza venosa; (D) Immagine che illustra la misurazione della lunghezza renale. Clicca qui per visualizzare una versione più grande di questa figura.
| Variabile | T1 Giorno 1, alle 00:38 | T2 Giorno 1, alle 10:53 | T3 Giorno 3, alle 10:14 | T4 Giorno 5, ore 10:20 |
| Frequenza cardiaca (bpm) | 110 | 124 | 122 | 98 |
| Frequenza respiratoria (respiri al minuto) | 24 | 15 | 26 | 12 |
| Pressione arteriosa sistolica (mmhg) | 100 | 115 | 130 | 118 |
| Pressione arteriosa diastolica (mmhg) | 61 | 69 | 66 | 65 |
| Pressione arteriosa media (mmhg) | 73 | 80 | 84 | 81 |
| Bilancio cumulativo dei liquidi (mL) | 0 | 704 | 7272 | 12338 |
| Ventilazione artificiale | PEEP 5, FiO2 40% | PEEP 5, FiO2 40% | PEEP 5, FiO2 30% | PEEP 5, FiO2 30% |
| CRT sterno (secondi) | 1.5 | 2 | 4 | 3 |
| Temperatura centrale (◦ C) | 37.6 | 37.5 | 38.0 | 37.4 |
| Produzione urinaria nell'ora precedente (mL) | 117 | 60 | 0 | 10 |
| Agenti inotropi somministrati | Noradrenalina 0,1 mg/ml 3,0 ml/h | Noradrenalina 0,1 mg/ml 1,0 ml/h | nessuno | nessuno |
| Agenti sedativi somministrati | Propofol 20 mg/ml 5,0 ml/h | nessuno | nessuno | nessuno |
| Punteggio APACHE IV | 92 | 88 | 87 | 90 |
| Punteggio SOFA | 8 | 8 | 5 | 8 |
| LVOT (cm) | N.A. | 2.4 | 2.4 | 2.4 |
| Gittata cardiaca (L/min) | N.A. | 5.6 | 8.34 | 9.89 |
| MASCHIATURA (mm) | N.A. | 25 | 26 | 21 |
| RV S' (cm/s) | N.A. | 14 | 15 | 12 |
| Diametro inspiratorio IVC (cm) | N.A. | 1.14 | 1.24 | 1.10 |
| Diametro espiratorio IVC (cm) | N.A. | 1.27 | 1.38 | 1.50 |
| Linee Kerley B (totale) | N.A. | 6 | 2 | 4 |
| Lunghezza renale (cm) | N.A. | 10.59 | N.A. | N.A. |
| Andamento del flusso venoso intrarenale | N.A. | Continuo | Continuo | Continuo |
| RI renale Doppler | N.A. | 0.61 | 0.75 | 0.70 |
| VII | N.A. | 0.33 | 0.56 | 0.68 |
Tabella 1: Un paziente SICS-II casuale. La paziente X, donna di mezza età ricoverata in terapia intensiva dopo essere stata trovata con alterazione di coscienza. Abbreviazioni: bpm = battiti al minuto, CRT = tempo di riempimento capillare, LVOT = tratto di efflusso ventricolare sinistro, TAPSE = escursione sistolica del piano anulare tricuspide, RV S' = escursione sistolica del ventricolo destro, IVC = vena cava inferiore, RRI = indice resistivo renale, VII = indice di impedenza venosa, N.A. = non applicabile.
| Variabile | Unità | Fonte | Ottenuto presso |
| Lattato | mmol/L | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| Cloruro | mmol/L | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| ph | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 ho di differenza | |
| PCO2 | kPa | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| PaO2 | kPa | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| HCO3- | mmol/L | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| Emoglobina | mmol/L | Emogasanalisi arteriosa | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| Leucociti | 10 x 10-9/L | Analisi del siero | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| Trombociti | 10 x 10-9/L | Analisi del siero | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| HS Troponina | ng/L | Analisi del siero | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| ASAT | U/L | Analisi del siero | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| ALAT | U/L | Analisi del siero | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| Bilirubina totale | uoml/L | Analisi del siero | Dalle cure standard, il più vicino possibile ad ogni esame clinico, max 12 h di differenza |
| Creatinina | umol/L | Analisi del siero | Tutte le misurazioni dall'inizio del ricovero in terapia intensiva |
| Volume delle urine | Ml | Raccolta delle urine di 24 h | Tutte le misurazioni dall'inizio del ricovero in terapia intensiva |
| Creatinina | mmol/24 h | Analisi delle urine | Tutte le misurazioni dall'inizio del ricovero in terapia intensiva |
Tabella 2: Elenco delle variabili biochimiche ottenute. Tutte le variabili biochimiche dei pazienti raccolte durante lo studio sono elencate qui.
Discussione
Tutti gli esami devono essere eseguiti secondo il protocollo. L'esame obiettivo ha valore solo se eseguito secondo definizioni predefinite23. I valori di laboratorio devono essere raccolti secondo il protocollo per ottenere tutti i valori. Immagini CCUS chiare e interpretabili sono fondamentali per rispondere alla domanda di ricerca di questo studio, come descritto nel passaggio 3.3. Se si ottengono immagini di scarsa qualità, le misurazioni e le analisi descritte al punto 5 non possono essere eseguite e lo scopo delle misurazioni ripetute decade. Vengono prese tre importanti misure per ridurre al minimo il rischio di ottenere immagini di bassa qualità. In primo luogo, gli studenti-ricercatori che eseguono la CCUS nel nostro studio sono formati da un cardiologo-intensivista esperto. La letteratura mostra che un breve programma di formazione è adatto per ottenere la competenza di base in CCUS24. In secondo luogo, gli studenti ricercatori sono supervisionati da uno studente-ricercatore senior durante i primi 20 esami, in modo che possano ricevere un feedback pratico. Infine, tutte le immagini cardiache e renali acquisite saranno rivalutate e convalidate rispettivamente da un esperto indipendente di un laboratorio di imaging cardiaco e da un radiologo addominale esperto, per garantire che i dati siano affidabili.
Per garantire la qualità dell'immagine, i ricercatori devono prestare attenzione anche ad altri aspetti. A volte è necessario riapplicare il gel per ultrasuoni o riposizionare la sonda in modo che entri in contatto con la pelle del paziente per garantire una qualità dell'immagine ottimale. È anche importante prendersi il tempo necessario per acquisire l'immagine ottimale e se ci sono dubbi, un ricercatore senior, cioè un cardiologo-intensivista supervisore o un tecnico di laboratorio di base, dovrebbe essere consultato prima che l'esame clinico sia completato. La valutazione e la convalida continue di tutte le immagini ecografiche sono garantite dall'applicazione dei passaggi protocollati visualizzati nella Figura 1. Inoltre, studenti-ricercatori ed esperti si scambiano spesso feedback, facilitando l'implementazione rapida di modifiche al protocollo per aumentare ulteriormente la qualità delle immagini e delle misurazioni. Questa verifica frequente facilita l'individuazione degli errori sistematici, in modo che la formazione CCUS per i futuri studenti-ricercatori possa essere adattata di conseguenza. Inoltre, le riunioni mensili aperte a tutti i membri del team consentono una valutazione approfondita e (se necessario) modifiche del protocollo.
La disponibilità 24 ore su 24 per lo screening e l'inclusione dei pazienti è un altro elemento chiave per il successo dell'implementazione di questo studio. Questo obiettivo può essere raggiunto solo con un team dedicato di studenti-ricercatori, un grande team di studenti per fornire supporto e un buon coordinamento con gli operatori sanitari dell'unità di terapia intensiva. Questo coordinamento avviene attraverso un contatto regolare a basso rischio tra caregiver e ricercatori su possibili miglioramenti per ottimizzare la collaborazione con le cure standard.
Una limitazione di questo protocollo è che l'esecuzione di CCUS dipende dall'accessibilità delle posizioni pre-specificate in cui è posizionata la sonda. Durante la SICS-I, è già stato dimostrato che la CCUS cardiaca non può essere eseguita quando i pazienti richiedono drenaggi, garze o medicazioni per ferite che ostruiscono la finestra ecocardiograficateoricamente ottimale 1. Inoltre, la possibilità di ottenere un'adeguata finestra sottocostale tramite ecocardiografia transtoracica, necessaria per le misurazioni IVC, si è precedentemente dimostrata potenzialmente limitata in una popolazione generale in terapia intensiva25. Anche la disponibilità 24 ore su 24, 7 giorni su 7 richiesta da questo protocollo per effettuare i diversi esami in momenti diversi è una potenziale limitazione, in quanto alcuni centri potrebbero non essere in grado di farlo. Anche in un grande ospedale accademico come l'UMCG, garantire ciò ha portato a ritardi nell'inizio dello studio. Un'altra limitazione intrinseca alle misure ecografiche è la variabilità inter-osservatore delle misurazioni. Affinché l'inclusione dei pazienti sia garantita 24 ore su 24, 7 giorni su 7, è impossibile per un ricercatore condurre tutti gli esami clinici in tutti i pazienti inclusi. Questo studio mira a far eseguire allo stesso ricercatore tutte le misurazioni ecografiche in uno stesso paziente per ridurre al minimo la variabilità a livello individuale, ma per l'intera coorte, la variabilità inter-osservatore rimane un problema.
L'imaging ecografico di più organi può essere una struttura veloce, sicura ed efficace per visualizzare la perfusione e la funzione degli organi. Si tratta di uno strumento pratico che tutti i professionisti del settore medico dovrebbero essere in grado di utilizzare e per il quale poche misurazioni basate su un protocollo semplice e standardizzato dovrebbero generalmente fornire misurazioni affidabili.
Inoltre, la maggior parte degli studi osservazionali che valutano l'uso dell'ecografia, e in particolare dell'ecocardiografia, sono di natura retrospettiva o includono solo un piccolo numero di pazienti. 26 Questo protocollo consente uno screening strutturale 24/7 di una coorte non selezionata di pazienti critici, di cui possono essere definite le sottopopolazioni di interesse, consentendo così l'indagine simultanea di più domande di ricerca.
Inoltre, nonostante sia noto che le variabili cliniche in terapia intensiva sono altamente dinamiche e si influenzano reciprocamente, la maggior parte degli studi ha indagato solo il valore additivo delle singole misurazioni ecografiche di organi specifici27,28. Questo è il primo protocollo che si concentra su misure ripetute, ecografia di tutto il corpo e congestione venosa. Ci aspettiamo che il SICS-II fornisca una riflessione più accurata sullo stato emodinamico dei pazienti durante il ricovero in terapia intensiva.
L'attuale struttura utilizzata in SICS può essere applicata a un gran numero di contesti e l'aggiunta di altri elementi è attualmente allo studio. Il suo punto di forza risiede nella combinazione di una linea di ricerca di base e di una linea adattiva in cui nuove variabili possono essere facilmente aggiunte ai CRF in modo da poter indagare nuove domande di ricerca. Un esempio di questa adattabilità è l'aggiunta di un'ampia valutazione della parete ventricolare mediante imaging della deformazione, cioè sforzo a breve termine, al protocollo regolare in un sottogruppo specifico di pazienti.
Inoltre, l'inclusione dei pazienti avviene attualmente esclusivamente in terapia intensiva e parte della traiettoria di cura dei pazienti è ormai persa. I pazienti in terapia intensiva vengono spesso ricoverati per la prima volta al pronto soccorso e rimangono nel normale reparto ospedaliero dopo la dimissione dall'unità di terapia intensiva. Pertanto, il SICS mira a includere i pazienti in una fase precoce includendo i pazienti all'arrivo del PS e registrando gli interventi e la funzione emodinamica dal primo ricovero ospedaliero in poi. Inoltre, sono in corso piani per condurre la CCUS dopo la dimissione dall'unità di terapia intensiva nei reparti regolari, in modo che tutti i pazienti possano essere misurati in ogni momento di studio predefinito. Un altro aspetto importante è l'espandibilità del protocollo ad altri centri: la sua semplicità permette un facile adattamento da parte dei centri che possono avviare autonomamente l'inclusione.
Infine, lo sviluppo e l'implementazione di successo di un protocollo strutturato di CCUS possono anche avere ramificazioni cliniche. Nonostante sia utilizzato solo a scopo di ricerca, potrebbe essere implementato per la CCUS clinica dai medici dopo il breve periodo di formazione proposto. Sarebbe quindi interessante valutare se facilitare la formazione CCUS ai medici (inesperti) ridurrebbe ulteriori test diagnostici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare tutti i membri del gruppo di studio SICS che sono stati coinvolti all'interno del SICS-I e hanno partecipato a sessioni di brainstorming sul protocollo attuale. Vorremmo anche ringraziare l'ufficio di ricerca del nostro dipartimento di Terapia Intensiva e i suoi coordinatori per il loro supporto; il dott. W. Dieperink e M. Onrust. Inoltre, vorremmo ringraziare il team degli studenti di ICU e gli studenti-ricercatori che finora hanno incluso strutturalmente i pazienti in SICS-II; J. A. de Bruin, B. E. Keuning, dott. K. Selles.
Materiali
| Name | Company | Catalog Number | Comments |
| Ultrasound machine | GE Healthcare | 0144VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound machine | GE Healthcare | 3507VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound machine | GE Healthcare | 0630VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound gel | Parker | 01-08 | Aquasonic 100 ultrasound transmission gel |
| Temperature probe | DeRoyal | 81-010400EU | Skin Temperature Sensor |
Riferimenti
- Hiemstra, B., et al. Clinical examination, critical care ultrasonography and outcomes in the critically ill: cohort profile of the Simple Intensive Care Studies-I. BMJ open. 7 (9), 017170(2017).
- Lee, J., et al. Association between fluid balance and survival in critically ill patients. Journal of Internal Medicine. 277 (4), 468-477 (2015).
- Perner, A., et al. Fluid management in acute kidney injury. Intensive Care Medicine. 43 (6), 807-815 (2017).
- Balakumar, V., et al. Both Positive and Negative Fluid Balance May Be Associated With Reduced Long-Term Survival in the Critically Ill. Critical care medicine. 45 (8), 749-757 (2017).
- Hjortrup, P. B., et al. Restricting volumes of resuscitation fluid in adults with septic shock after initial management: the CLASSIC randomised, parallel-group, multicentre feasibility trial. Intensive Care Medicine. 42 (11), 1695-1705 (2016).
- Prowle, J. R., Kirwan, C. J., Bellomo, R. Fluid management for the prevention and attenuation of acute kidney injury. Nature reviews. Nephrology. 10 (1), 37-47 (2014).
- Gambardella, I., et al. Congestive kidney failure in cardiac surgery: the relationship between central venous pressure and acute kidney injury. Interactive CardioVascular and Thoracic Surgery. 23 (5), 800-805 (2016).
- Chen, K. P., et al. Peripheral Edema, Central Venous Pressure, and Risk of AKI in Critical Illness. Clinical journal of the American Society of Nephrology : CJASN. 11 (4), 602-608 (2016).
- Song, J., et al. Value of the combination of renal resistance index and central venous pressure in the early prediction of sepsis-induced acute kidney injury. Journal of critical care. 45, 204-208 (2018).
- Zhang, L., Chen, Z., Diao, Y., Yang, Y., Fu, P. Associations of fluid overload with mortality and kidney recovery in patients with acute kidney injury: A systematic review and meta-analysis. Journal of Critical Care. 30 (4), (2015).
- Simple Intensive Care Studies II - Full Text View. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ct2/show/NCT03577405? term=simple+intensive+care+studies (2018).
- Wetterslev, J. Statistical analysis plan Simple Intensive Care Studies-I DETAILED STATISTICAL ANALYSIS PLAN (SAP) 1. Administrative information 1.1. Title, registration, versions and revisions. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ProvidedDocs/24/NCT02912624/SAP_000.pdf (2018).
- van der Horst, I. C. C. Simple Observational Critical Care Studies - Full Text View - ClinicalTrials.gov. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ct2/show/NCT03553069 (2018).
- Ait-Oufella, H., et al. Alteration of skin perfusion in mottling area during septic shock. Annals of Intensive Care. 3 (1), 31(2013).
- Teasdale, G., Jennett, B. Assessment of Coma and Impaired Consciousness: A Practical Scale. The Lancet. 304 (7872), 81-84 (1974).
- Detsky, M. E., et al. Discriminative Accuracy of Physician and Nurse Predictions for Survival and Functional Outcomes 6 Months After an ICU Admission. JAMA. 317 (21), 2187(2017).
- Lipson, A. R., Miano, S. J., Daly, B. J., Douglas, S. L. The Accuracy of Nurses' Predictions for Clinical Outcomes in the Chronically Critically Ill. Research & reviews. Journal of nursing and health sciences. 3 (2), 35-38 (2017).
- Lichtenstein, D. A. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest. 147 (6), 1659-1670 (2015).
- Tang, W. H. W., Kitai, T. Intrarenal Venous Flow: A Window Into the Congestive Kidney Failure Phenotype of Heart Failure. JACC: Heart Failure. 4 (8), 683-686 (2016).
- Jeong, S. H., Jung, D. C., Kim, S. H., Kim, S. H. Renal venous doppler ultrasonography in normal subjects and patients with diabetic nephropathy: Value of venous impedance index measurements. Journal of Clinical Ultrasound. 39 (9), 512-518 (2011).
- Iida, N., et al. Clinical Implications of Intrarenal Hemodynamic Evaluation by Doppler Ultrasonography in Heart Failure. JACC: Heart Failure. 4 (8), 674-682 (2016).
- Lang, R. M., et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging. 16 (3), 233-271 (2015).
- Hiemstra, B., Eck, R. J., Keus, F., van der Horst, I. C. C. Clinical examination for diagnosing circulatory shock. Current opinion in critical care. 23 (4), 293-301 (2017).
- Vignon, P., et al. Basic critical care echocardiography: validation of a curriculum dedicated to noncardiologist residents. Critical care medicine. 39 (4), 636-642 (2011).
- Jensen, M. B., Sloth, E., Larsen, K. M., Schmidt, M. B. Transthoracic echocardiography for cardiopulmonary monitoring in intensive care. European journal of anaesthesiology. 21 (9), 700-707 (2004).
- Koster, G., van der Horst, I. C. C. Critical care ultrasonography in circulatory shock. Current opinion in critical care. 23 (4), 326-333 (2017).
- Haitsma Mulier, J. L. G., et al. Renal resistive index as an early predictor and discriminator of acute kidney injury in critically ill patients; A prospective observational cohort study. PloS one. 13 (6), 0197967(2018).
- Micek, S. T., et al. Fluid balance and cardiac function in septic shock as predictors of hospital mortality. Critical care. 17 (5), London, England. 246(2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon