Method Article
Protocole d’étude observationnelle pour l’examen clinique répété et l’échographie en soins intensifs dans le cadre des études simples en soins intensifs
Dans cet article
Résumé
Des protocoles structurés sont nécessaires pour fournir des réponses aux questions de recherche chez les patients gravement malades. Les études simples de soins intensifs (SICS) fournissent une infrastructure pour des mesures répétées chez les patients gravement malades, y compris l’examen clinique, l’analyse biochimique et l’échographie. Les projets SICS ont des objectifs spécifiques, mais la structure est souple pour d’autres enquêtes.
Résumé
Les évaluations longitudinales des patients gravement malades par combinaison d’examen clinique, d’analyse biochimique et d’échographie en soins intensifs (CUSC) peuvent détecter des effets indésirables d’interventions tels que la surcharge liquidienne à un stade précoce. Les études simples en soins intensifs (SICS) sont un axe de recherche qui se concentre sur la valeur pronostique et diagnostique de combinaisons de variables cliniques.
L’étude SICS-I s’est concentrée sur l’utilisation de variables cliniques obtenues dans les 24 heures suivant l’admission en phase aiguë pour la prédiction du débit cardiaque (CO) et de la mortalité. Sa suite, SICS-II, se concentre sur les évaluations répétées lors de l’admission en soins intensifs. Le premier examen clinique par des chercheurs formés est effectué dans les 3 heures suivant l’admission, consistant en un examen physique et une supposition éclairée. Le deuxième examen clinique est effectué dans les 24 heures suivant l’admission et comprend un examen physique et une supposition éclairée, une analyse biochimique et des évaluations CCUS du cœur, des poumons, de la veine cave inférieure (VCI) et des reins. Cette évaluation est répétée aux jours 3 et 5 après l’admission. Les images CCUS sont validées par un expert indépendant, et toutes les données sont enregistrées dans une base de données sécurisée en ligne. Le suivi à 90 jours comprend l’enregistrement des complications et de l’état de survie selon les dossiers médicaux du patient et le registre des personnes municipales. L’objectif principal de SICS-II est l’association entre la congestion veineuse et le dysfonctionnement des organes.
L’objectif de la publication de ce protocole est de fournir des détails sur la structure et les méthodes de cette étude de cohorte observationnelle prospective en cours, permettant de répondre à de multiples questions de recherche. La conception de la collecte de données de l’examen clinique combiné et des évaluations du CUSC chez les patients gravement malades est expliquée. Le SICS-II est ouvert à la participation d’autres centres et est ouvert à d’autres questions de recherche auxquelles on peut répondre avec nos données.
Introduction
Les patients admis à l’unité de soins intensifs (USI) sont les plus gravement malades avec des taux élevés de comorbidités et de multimorbidités, indépendamment de leur diagnostic d’admission. Par conséquent, l’unité de soins intensifs est le cadre idéal pour étudier la comorbidité et la multimorbidité, leur impact négatif sur les résultats pour les patients et la façon dont une maladie critique peut entraîner des complications qui contribuent à des multimorbidités supplémentaires. Pour mieux comprendre ce groupe de patients hétérogène, l’examen détaillé de chaque patient individuel est de la plus haute importance.
La ligne de recherche SICS (Simple Intensive Care Studies) est conçue dans le but d’évaluer la valeur pronostique et diagnostique d’une sélection complète de variables cliniques, hémodynamiques et biochimiques chez les patients en soins intensifs, collectées par une équipe dédiée d’étudiants-chercheurs coordonnée par des experts médicaux. L’un des principaux objectifs du SICS-I est d’étudier la combinaison des résultats d’examen clinique les mieux associés au choc défini par le débit cardiaque (CO) mesuré par échographie en soins intensifs (CUSC)1. Le SICS-II utilise la structure du SICS-I, mais y ajoute des examens cliniques répétés, des analyses biochimiques et des CUSC. L’objectif principal de SICS-II est de quantifier la congestion veineuse et d’identifier les variables qui peuvent contribuer à son développement. Des mesures répétées fournissent des informations dynamiques sur l’évolution de la maladie d’un patient. Des études montrent qu’une surcharge liquidienne est présente chez les patients gravement malades et qu’une surcharge liquidienne est associée à de nouvelles morbidités. Nous nous concentrons donc sur la congestion veineuse chez ces patients. De plus, plusieurs études ont suggéré les effets négatifs possibles d’une administration excessive de liquides2,3,4,5,6. La surcharge liquidienne peut être perçue comme une congestion veineuse ou une surcharge liquidienne veineuse, qui peut être observée par une augmentation de la pression veineuse centrale (PVC) ou un œdème périphérique. Une pression élevée dans le système veineux central peut contribuer à une réduction de la perfusion des organes suivie d’une défaillance des organes, mais il n’existe pas de définition exacte de la congestion veineuse.
Des études antérieures suggérant des effets négatifs associés à une administration excessive de liquide ont utilisé des mesures de substitution uniques de la congestion veineuse telles que la CVP, la collapsibilité de la VCI, l’équilibre hydrique et/ou l’œdème périphérique 7,8,9,10. À notre connaissance, le SICS-II est la première étude à effectuer des CCUS répétés de plusieurs organes combinés aux résultats de l’examen clinique pour évaluer l’état hémodynamique des patients en soins intensifs. Il est important de mettre l’accent sur cette technique d’échographie multiviscérale, car la défaillance d’un organe ou la diminution de la fonction d’un organe influence toujours l’ensemble du système hémodynamique. Nous nous attendons à ce que les données issues d’examens répétés dans le cadre de l’étude SICS-II aident à démêler la physiopathologie et les conséquences de la congestion veineuse. Par conséquent, cela peut aider à améliorer l’identification précoce des patients gravement malades à risque de congestion veineuse et guider l’optimisation de l’administration de liquides. De plus, l’association entre la congestion veineuse et l’insuffisance organique à court et à long terme peut être explorée. Enfin, la mise en œuvre réussie du protocole SICS-II mettrait en évidence la faisabilité de la réalisation d’une grande étude prospective avec une équipe dédiée d’étudiants-chercheurs et peut produire des données de qualité pour étudier des problèmes cliniques.
Ici, la procédure d’examen clinique complet des patients en soins intensifs dans le but de mesurer la congestion veineuse est démontrée. Un protocole concis de SICS-II a été publié le11 clinicaltrials.gov. Après le premier examen clinique initial, un maximum de trois examens cliniques supplémentaires, des analyses biochimiques et un CCUS sont effectués. L’examen physique comprend des variables qui reflètent la perfusion/microcirculation périphérique, telles que le temps de remplissage capillaire (CRT) ou les marbrures, ainsi que des variables de la macrocirculation telles que la pression artérielle, la fréquence cardiaque et le débit urinaire. De plus, les valeurs de laboratoire de soins standard sont enregistrées (par exemple, lactate, pH). Par la suite, un CCUS du cœur, des poumons, de la VCI et du rein est effectué pour obtenir des informations sur la perfusion. D’autres méthodes seront élaborées dans le cadre de notre plan d’analyse statistique, comme cela a été fait dans le SICS-I12.
Sur la base de 138 patients inclus entre le 14-05-2018 et le 15-08-2018, des mesures répétées d’un large éventail de variables cliniques au sein de cette structure semblent réalisables. Nous montrons également qu’une validation indépendante est possible. Le SICS-II illustre une méthodologie précieuse pour permettre aux chercheurs d’enregistrer avec précision les changements dans les variables d’intérêt et peut donc servir de guide pour mener des recherches qui reflètent la progression de l’état des patients telle qu’elle est observée dans la pratique quotidienne. L’étude SICS-II est réalisée quotidiennement par une équipe de 2-3 étudiants-chercheurs en tout temps, avec un superviseur senior disponible sur appel. Ces étudiants-chercheurs sont formés à la réalisation de l’examen physique et du CCUS. Ils exécutent toutes les étapes du protocole suivant et sont responsables de l’inclusion des patients tant pendant les heures de travail que les fins de semaine. De plus, une équipe plus importante d’environ 30 étudiants en soins intensifs participe à des quarts de soir et de nuit, pour effectuer l’examen clinique initial (dans les 3 heures suivant l’admission) des nouveaux patients. La figure 1 présente un résumé schématique du protocole de l’étude, et les figures 2 et 3 montrent les formulaires de rapport de cas (CRF) utilisés pour enregistrer les données lors de la collecte.
Protocole
Cette étude est menée conformément aux principes de la Déclaration d’Helsinki (64e version, Brésil 2013) et conformément à la loi sur la recherche médicale impliquant des sujets humains (OMM), aux lignes directrices de bonnes pratiques cliniques et au conseil d’examen institutionnel local (Medisch Ethische Toetsingscommissie ; M18.228393).
1. Admission d’un patient à l’unité de soins intensifs et dépistage
NOTE: Pour le dépistage, une liste numérique avec un minimum de données sur les patients est mise à jour tout au long de la journée, et les inclusions et exclusions sont enregistrées. La liste de dépistage est stockée dans le système électronique sécurisé de l’hôpital avec un accès exclusif pour les chercheurs. Pour protéger la vie privée des patients, toutes les copies physiques des listes sont détruites à la fin de la journée. Les critères d’inclusion sont les suivants : admission aiguë et non planifiée ; et les patients de plus de 18 ans.
- Examinez le système de gestion des patients pour toutes les nouvelles admissions et vérifiez si les patients répondent aux critères d’inclusion.
- Exclure immédiatement les réadmissions, les admissions électives, les patients de moins de 18 ans et ceux qui ne seront pas en mesure de donner un consentement éclairé.
NOTE: Nous excluons également les patients ayant une raison d’admission neurologique non traumatique, car nous avons établi plusieurs groupes de patients dans le SICS-I, dans lesquels ce groupe était hémodynamiquement stable et l’admission en soins intensifs concernait principalement le traitement neurologique1. - Ajoutez les inclusions possibles à une liste de patients continuellement mise à jour. Utilisez cette liste pour planifier quotidiennement des mesures nouvelles et répétées en fonction de l’heure d’admission ou d’inclusion.
2. Examen clinique 1
NOTE: Le premier examen clinique est effectué chez tous les patients qui remplissent les critères d’inclusion dans les 3 heures suivant l’admission. Cet examen est réalisé par les élèves-chercheurs si le patient est admis pendant le quart de jour. Pour les patients admis en équipe de soir ou de nuit, ce premier examen clinique est réalisé par un membre de l’équipe étudiante de l’unité de réanimation et les données sont traitées et finalisées le lendemain par les étudiants-chercheurs. Pour une description complète du protocole du premier examen clinique, voir clinicaltrials.gov13. Au chevet du patient, si possible, on demande aux patients s’ils consentent à l’examen clinique à ce moment-là. Le consentement éclairé écrit est obtenu ultérieurement : voir l’étape 1.2 pour les instructions et l’étape 7 .
- Examen physique
- Commencez par vous assurer que les règles de sécurité/d’isolement requises pour le patient sont respectées : désinfectez les mains et les poignets en suivant les procédures hospitalières standard avec de l’alcool à 70 % et utilisez des gants non stériles et un tablier en plastique ou des précautions supplémentaires telles qu’une blouse d’isolement lors du contact avec le patient.
- Présentez-vous et demandez au patient la permission de procéder à l’examen s’il n’est pas sous sédation, conscient et adéquat. Expliquez au patient ce qui est fait.
NOTE: Le consentement éclairé formel est demandé à un stade ultérieur lors de l’admission en soins intensifs ou après la sortie dans le service, soit de la part du patient lui-même, soit de la part de ses proches si le patient n’est pas en mesure de le faire. Ceci est décrit plus en détail à l’étape 7. - Enregistrez les variables hémodynamiques fréquence cardiaque, fréquence respiratoire, pression artérielle systolique (TAS), pression artérielle diastolique (PAD), pression artérielle moyenne (PAM) et pression veineuse centrale (PVC) à partir du moniteur de chevet.
- Enregistrez la saturation en oxygène (SpO2) et si le patient reçoit une assistance respiratoire non invasive ou une ventilation mécanique. Si c’est le cas, enregistrez la pression expiratoire positive (PEP) et la fraction de O2 inspiré (FiO2).
- Déterminez la reperfusion du genou et du sternum en appuyant 10 secondes sur la peau et en relâchant prise, puis en comptant le nombre de secondes jusqu’à la reperfusion complète.
- Déterminez la température subjective de la peau en palpant les extrémités avec les mains et estimez si elles sont froides ou chaudes.
- Enregistrez la température de la vessie à partir du moniteur, qui indique la température mesurée par un capteur fixé à une sonde urinaire à demeure.
- Déterminez la température de la peau sur le dos du pied en plaçant un capteur de température supplémentaire au milieu du dos et en le connectant au moniteur. Reconnectez le capteur de température de la vessie au moniteur après cette mesure.
- Notez le degré de marbrage s’il est observable à l’aide de l’échelle de genou d’Ait-Oufella14.
- Indiquez si le patient reçoit une sédation et, dans l’affirmative, quel médicament, à quelle vitesse de pompe et à quelle dose.
- Déterminer et enregistrer l’échelle de coma de Glasgow (GCS) du patient15.
- Estimez la survie du patient à l’hôpital, sa survie à 6 mois et sa capacité à retourner à son domicile d’origine sur la base d’une supposition éclairée et des résultats de cet examen clinique16,17. Demandez également à l’infirmière et au médecin leurs estimations et enregistrez toutes les estimations sur le CRF.
3. Examen clinique 2
NOTE: Le deuxième examen clinique est effectué dans les 24 heures suivant l’admission et comprend des mesures CCUS. Cet examen est toujours mené par des étudiants-chercheurs formés en CCUS, et non par des membres de l’équipe d’étudiants de l’ICU. De plus, chez les patients qui répondent aux critères d’inclusion et qui ont subi un examen clinique 1, mais qui s’avèrent par la suite souffrir exclusivement d’une affection neurologique (par exemple, une hémorragie sous-arachnoïdienne non traumatique), des mesures répétées, y compris le CUSC, ne sont pas effectuées, et celles-ci sont finalement exclues.
- Obtenir un consentement éclairé.
REMARQUE : En vertu de la réglementation du Centre médical universitaire de Groningue (UMCG) pour les mesures observationnelles, à partir du1er janvier 2016, les images échographiques collectées lors de l’examen clinique peuvent être utilisées sans consentement explicite. Cependant, la politique de l’étude SICS-II est d’obtenir le consentement éclairé des patients le plus tôt possible tout en respectant les principes de minimisation du « stress » pour le patient, d’augmentation de la prise de décision partagée et de donner au patient suffisamment de temps pour envisager de participer. Étant donné que la plupart des patients sont incapables de donner leur consentement au début de leur séjour aux soins intensifs, un consentement « différé » est généralement obtenu. Si, à l’inverse, ils sont en mesure de donner ou de refuser leur consentement avant ou après les examens, ceux-ci ne seront pas effectués ou toutes les données déjà obtenues seront supprimées, respectivement.- Avant de commencer l’examen, déterminez si le patient est alerte/conscient et capable de dialoguer avec les étudiants-chercheurs en déterminant leur score GCS. Fournir aux patients aptes une explication concernant l’examen à effectuer et laisser une lettre écrite normalisée qu’ils doivent signer.
- Si le patient ne peut pas être consulté pour obtenir son consentement (en raison d’une conscience altérée, d’une capacité mentale limitée, etc.), surveillez quotidiennement son score GCS et envisagez d’obtenir le consentement de la famille si les membres de la famille sont joignables (comme décrit à l’étape 7.1).
- Effectuez l’examen physique en suivant les étapes décrites pour l’examen clinique 1.
- Effectuer le CCUS du cœur et des poumons.
NOTE: Ce protocole est valable lors de l’utilisation d’un appareil à ultrasons dans le Table des matériaux, le transducteur cardiaque pour la vue parasternale grand axe (PLAX) et le transducteur cardiaque multiélément pour les vues apicales à quatre et cinq chambres (AP4CH, AP5CH). Pour les autres systèmes d’échographie, les utilisateurs doivent consulter les manuels d’utilisation de leur appareil spécifique.- Mettez l’appareil sous tension. Enregistrez l’identifiant d’étude anonyme du patient, démarrez un nouvel examen et attendez que le mode d’imagerie 2D automatique s’affiche à l’écran.
- Si le patient est habillé, déboutonnez sa blouse pour exposer la poitrine. Placez de nouveaux autocollants d’électrocardiogramme (ECG) et connectez-les à l’échographe si nécessaire.
- Connectez le câble ECG de l’appareil au moniteur de chevet du patient. Attendez qu’il se stabilise et enregistrez la fréquence cardiaque mesurée par ECG dans le CRF.
- Si possible, positionnez le patient en le tournant légèrement sur le côté gauche. Cela améliore la qualité de l’imagerie cardiaque et rénale.
NOTE: Considérations techniques : Avant de commencer l’examen, cliquez sur le bouton Configurer et réglez les paramètres d’image sur cinq cycles cardiaques, une profondeur de 10 à 15 cm, une largeur d’image de 65° et une fréquence de 1,7/3,4 MHz. Vérifiez si la bonne sonde est sélectionnée en cliquant sur le bouton Sonde . - Mettez une quantité suffisante de gel à ultrasons sur le transducteur à ultrasons et placez le transducteur sur le côté gauche du sternum, entre le 3ème et le 5ème espace intercostal, pour obtenir la vue PLAX en mode 2D. Ajustez la profondeur si nécessaire pour enregistrer des images pour les mesures de la voie d’éjection ventriculaire gauche et enregistrez l’image.
NOTE: La largeur maximale du ventricule gauche doit être visible avec une ouverture maximale de la valve mitrale. Aucun muscle de la valve ne doit être visible. Avant de placer le transducteur sur la poitrine du patient, avertissez-le que le gel est froid et peut être inconfortable, et qu’il ressentira une certaine pression (en particulier autour du sternum lors de l’enregistrement d’images pour la voie d’éjection ventriculaire gauche (LVOT). Sachez que chez les patients qui ont des fractures costales, certains endroits doivent être évités car cela peut être inconfortable pour le patient). - En mode 2D, ajustez la profondeur à 15-20 cm et placez le transducteur sur l’apex du cœur, caudale à l’aréole gauche. La vue AP4CH est obtenue, avec les quatre chambres clairement visualisées. Enregistrez l’image.
- Faites rouler la boule de commande de sorte que le curseur se trouve sur la limite entre la valve tricuspide et la paroi du ventricule droit pour obtenir l’excursion systolique du plan annulaire tricuspide (TAPSE). Appuyez sur le bouton M-Mode pour obtenir l’image correcte et l’enregistrer lorsque des ondes sinusales définies sont visibles. Enregistrez l’image.
- Placez le curseur sur la valve tricuspide avec la boule de commande. Diminuez la largeur de l’image pour augmenter le nombre d’images par seconde, nécessaire à la qualité du RV S. Appuyez d’abord sur le bouton TVI , puis sur le bouton PW , pour obtenir l’image correcte pour le RV S et l’enregistrer.
- À partir de la vue AP4CH, inclinez la sonde vers le haut (c’est-à-dire aplatissez-la) pour obtenir la vue AP5CH et obtenir la racine aortique à l’écran. Enregistrez l’image.
- Placez le curseur juste au-dessus de la valve aortique et appuyez sur le bouton PW pour obtenir le Doppler à ondes d’impulsion VLOT. Placez le curseur exactement au même endroit où le diamètre LVOT a été mesuré. Enregistrez l’image avec la plus haute qualité (limites d’ondes Doppler nettes, creuses à l’intérieur et bien distinguables du flux rétrograde ou mitral). Ceux-ci seront ensuite utilisés pour calculer l’intégrale vitesse-temps (VTI), et par la suite le CO.
NOTE: Essayez toujours d’obtenir au moins trois ondes de débit pour chaque mesure. En cas de rythme irrégulier, au moins cinq vagues doivent être enregistrées. - Passez à l’échographie pulmonaire à l’aide du même transducteur cardiaque à réseau phasé et en modifiant les paramètres à une fréquence de 3,7 MHz, une profondeur de 15 cm, et enregistrez les images uniquement pendant 2 cycles cardiaques. Placez le transducteur à 6 endroits différents, avec la lumière du transducteur à 12 heures, conformément au protocole BLUE18. Assurez-vous de toujours obtenir l’image dans le même ordre, afin d’éviter toute confusion lors de la visualisation ultérieure des images.
- Obtenez une vue mi-claviculaire antérieure supérieure des poumons en plaçant le transducteur sur l’espace intercostal des 2e et 3e côtes des deux côtés. Enregistrez les images de chaque côté.
- Obtenez une vue antérieure inférieure mi-claviculaire des poumons en plaçant le transducteur 2 à 3 côtes plus bas. Enregistrez les images de chaque côté.
- Obtenez une vue mi-axiale des poumons en plaçant le transducteur sous les aisselles du patient. Enregistrez les images de chaque côté.
- Une fois l’imagerie cardiaque et pulmonaire terminée, essuyez l’excès de gel sur la poitrine du patient.
- Effectuez le CCUS de la VCI et du rein.
- Cliquez sur le bouton Sonde et utilisez la boule de commande pour remplacer la sonde active par la sonde convexe/curviligne (abdominale) pour la VCI et l’examen rénal. La lumière du transducteur, qui peut être utilisé pour l’orientation, doit être à 12 heures pour les deux mesures.
- À l’aide du mode 2D et avec des paramètres réglés sur une profondeur de 10 à 20 cm et une fréquence de 2,5/5,0 MHz, placez la sonde juste en dessous de l’apophyse xiphoïde et déplacez-la d’environ 2 cm vers la droite du patient. L’IVC doit devenir visible. Enregistrez l’image.
- Placez le curseur juste au-dessus de la paroi supérieure de l’IVC et à l’extérieur de la lumière à l’aide de la boule de commande et appuyez sur le bouton M-Mode . Enregistrez l’image.
- Pour l’échographie rénale, commencez par le mode 2D et ajustez les paramètres à une profondeur de 10 à 15 cm et à une fréquence de 2,2/4,4 MHz. Placez le transducteur dorsal et caudal de la cage thoracique. Placez le rein central choisi dans l’image et enregistrez-le.
NOTE: Assurez-vous de placer la sonde aussi dorsale que possible pour filtrer le tissu hépatique et les boucles intestinales. Pour des mesures fiables de la longueur du rein, les bords du rein doivent être clairement visibles, et la distance entre le complexe sinusal central (le centre le plus échogène du rein) et le cortex doit être similaire tout au long de l’image. - Appuyez sur le bouton Couleur pour obtenir une image Doppler couleur du rein et déterminer le flux dans le système vasculaire rénal. Placez le curseur sur n’importe quelle artère au niveau de la jonction corticomédullaire au centre du rein où le flux Doppler est clairement visible à l’aide de la boule de commande.
- Ajustez l’angle du curseur et appuyez sur la touche PW . Ajustez l’amplitude du signal et le contraste en mode actif si nécessaire. Enregistrez l’image.
- Déterminez s’il y a également suffisamment de signal veineux (c’est-à-dire un écoulement visible dans la moitié négative de l’axe y), ce qui est nécessaire pour les mesures ultérieures. Si ce n’est pas le cas, répétez l’étape 3.4.5 et placez le curseur sur une veine au niveau de la jonction corticomédullaire au milieu où l’écoulement veineux est visible. Enregistrez l’image.
- Une fois l’imagerie terminée, débranchez tous les câbles, essuyez l’excès de gel du patient et de la sonde, redressez ou couvrez le patient et nettoyez la sonde avec des lingettes désinfectantes approuvées par échographie.
4. Examens cliniques 3 et 4
NOTE: Les troisième et quatrième examens cliniques sont effectués les jours 3 et 5 après l’admission si le patient est toujours en soins intensifs (c’est-à-dire qu’il n’y a pas eu de décès ou de transfert dans le service).
- Examen physique
- Effectuez l’examen physique en suivant les étapes décrites pour l’examen clinique 1.
- CUSC du cœur et des poumons
- Effectuer l’échographie du cœur et des poumons conformément à l’étape 3.3. N’obtenez le LVOT qu’une seule fois car il s’agit d’une mesure statique et n’a donc pas besoin d’être enregistrée dans les examens cliniques 3 et 4.
- CUSC de la VCI et du rein
- Effectuer l’examen échographique de la VCI et du rein conformément à l’étape 3.4. N’obtenez la longueur du rein qu’une seule fois, car il s’agit d’une mesure statique et n’a donc pas besoin d’être consignée dans les examens cliniques 3 et 4.
5. Mesures et analyse des examens échographiques
NOTE: Les images enregistrées lors de l’examen clinique sont utilisées après chaque examen pour mesurer les variables souhaitées. Les valeurs mesurées sont enregistrées sur le CRF et transcrites dans un système de gestion des données cliniques des patients en ligne. Les images dans lesquelles les mesures sont effectuées et visibles doivent également être enregistrées, en plus des images originales qui seront utilisées ultérieurement pour la validation.
- Mesure LVOT
- Cliquez sur le bouton Sonde pour sélectionner le transducteur cardiaque afin de démarrer les mesures.
- À l’aide de l’image enregistrée à l’étape 3.3.5, mettez l’image en pause lorsque les vannes sont complètement ouvertes.
- Cliquez sur le bouton Mesurer , puis sélectionnez les options Cardiac-Dimension-LVOT dans le menu de droite pour démarrer la mesure.
- Une fois que le curseur apparaît, choisissez deux points à la base de la valve aortique, un de chaque côté de la lumière, de l’intérieur vers l’intérieur du bord, lors de la diastole de fin. Enregistrez l’image.
REMARQUE : La mesure LVOT doit être effectuée et enregistrée avant la mesure du CO, afin qu’elle puisse être déterminée automatiquement par la machine.
- Mesure du CO
- À l’aide de l’image enregistrée à l’étape 3.3.10, tracez le débit ventriculaire gauche. Réglez le balayage horizontal à 100 cm/s.
- Sélectionnez trois ondes creuses bien formées avec des bords clairs qui s’alignent avec l’ECG. Cliquez sur le bouton Mesurer et utilisez la boule de commande pour sélectionner les options de trace Cardiac-Aortique-VLOT .
- Tracez la ligne de forme d’onde, commençant et se terminant à la ligne de base, et l’appareil à ultrasons calcule automatiquement le CO. Répétez cette opération pendant trois ondes et enregistrez cette image.
NOTE: En cas de rythme irrégulier, notez la valeur moyenne de CO obtenue pour cinq ondes.
- TAPSE
- À l’aide de l’image en mode M enregistrée à l’étape 3.3.7, cliquez sur le bouton Mesurer et utilisez la boule de commande pour sélectionner les options Cardiac-Dimension-TAPSE dans le menu de droite.
- Placez d’abord le curseur sur le point le plus bas d’une onde sinusale bien définie, puis sur le point le plus élevé. La différence entre les deux (le TAPSE) doit apparaître dans le coin supérieur gauche de l’écran. Faites-le en trois ondes sinusales et prenez la moyenne des trois mesures TAPSE. Enregistrez l’image.
- Excursion systolique ventriculaire droite (RV S)
- À l’aide de l’image enregistrée à l’étape 3.3.8, cliquez sur le bouton Pied à coulisse et placez le curseur sur le pic le plus élevé d’une courbe bien définie. Faites-le en trois courbes et prenez la moyenne. Enregistrez l’image.
- Évaluation de l’artefact de la ligne B de Kerley
REMARQUE : Les lignes A horizontales qui représentent une surface pulmonaire normale peuvent être utilisées comme référence pour la détection des lignes B. Ceux-ci proviennent de la plèvre et sont hyperéchogènes par rapport aux lignes A.- Ajustez le contraste de l’image et/ou le gain. Les lignes B ne sont pas toujours immédiatement visibles dans les images enregistrées.
- Déterminez et enregistrez le nombre de lignes B de Kerley pour chacune des six images obtenues. Étant donné que le nombre de lignes B n’est pas enregistré dans la machine, il doit être immédiatement enregistré sur le CRF (entre 0 et 5).
- Diamètre et repliabilité de l’IVC
- Cliquez sur le bouton Sonde pour sélectionner la sonde abdominale afin de commencer les mesures.
- À l’aide de l’image 2D enregistrée à l’étape 3.4.2, cliquez sur le bouton Pied à coulisse et mesurez la distance entre les deux parois de l’IVC à 2 cm de l’endroit où il pénètre dans l’oreillette droite. Il s’agit du diamètre de l’IVC, enregistrez cette image.
- À l’aide de l’image du mode M enregistrée à l’étape 3.4.3, cliquez sur le bouton Pied à coulisse et mesurez les diamètres expiratoire et inspiratoire de la VCI. Enregistrez cette image.
NOTE: Les diamètres expiratoire et inspiratoire de l’IVC sont les diamètres maximum et minimum observés sur l’image en mode M, respectivement.
- Longueur des reins et débit sanguin
- À l’aide de l’image 2D enregistrée à l’étape 3.4.4, cliquez sur le bouton Pied à coulisse et tracez la plus longue ligne allant de l’extrémité caudale à l’extrémité crânienne du cortex rénal. Il s’agit de la longueur du rein en cm, enregistrez cette constatation dans le CRF. Enregistrez cette image.
- À l’aide de l’image Doppler enregistrée à l’étape 3.4.6, analysez la ligne d’écoulement veineuse visible sous la ligne de base comme continue, monophasique ou biphasique. Enregistrer les résultats dans le FRC.
- À l’aide de l’image enregistrée à l’étape 3.4.6, cliquez sur le bouton Mesurer et utilisez la boule de commande pour sélectionner les options Abdominale-Renale-PS/ED/RI dans le menu de droite.
- Placez le curseur sur le pic et sur le point le plus bas de l’onde de flux pulsatile dans la moitié positive de l’axe y.
NOTE: La machine G6 peut calculer automatiquement l’indice résistif rénal (IRR) Doppler si une onde de flux pulsatile continu est stockée, à l’aide de la formule : RRI = (vitesse systolique maximale - vitesse diastolique finale)/vitesse systolique maximale. Enregistrez l’image avec la mesure de l’échographe à l’écran. - À l’aide de l’image enregistrée à l’étape 3.4.6 ou 3.4.7, cliquez sur le bouton Pied à coulisse et placez le curseur, d’abord, sur la vitesse d’écoulement maximale maximale, puis sur la vitesse d’écoulement maximale au nadir (c’est-à-dire la fin de la période diastolique)19. Enregistrez l’image après la mesure.
NOTE: L’indice d’impédance veineuse (VII) est calculé à partir de : VII = (vitesse systolique maximale - vitesse diastolique finale) / vitesse systolique maximale 20,21. Le VII n’est pas enregistré en cas d’écoulement monophasique, car alors un seul pic est visible et aucune phase diastolique et systolique n’est distinguable.
6. Enregistrement, stockage et validation des données des images échographiques
NOTE: Comme le montre la figure 1 , l’enregistrement des données se fait après chaque examen clinique. La procédure de saisie des données obtenues à partir des mesures, de l’examen clinique et des informations biochimiques (tableau 2) extraites du dossier de santé électronique dans le dossier en ligne anonyme du sujet de l’étude est décrite.
- Accédez au système de gestion des patients sécurisé en ligne et ouvrez le dossier du patient récemment inclus. Enregistrez les valeurs d’analyse des gaz du sang, les variables sériques générales, les variables rénales sériques et l’analyse d’urine sur 24 heures. La liste de toutes les variables obtenues et les instructions pour le faire sont présentées dans le tableau 2.
- Validez les images du CCUS cardiaque.
REMARQUE : Cette validation est effectuée par des experts indépendants d’un laboratoire central d’imagerie cardiovasculaire, conformément aux directives22 de l’EACVI. La qualité des images obtenues par les étudiants-chercheurs est évaluée et les mesures effectuées sont répétées afin d’assurer la qualité requise des mesures dimensionnelles et des tracés des profils de vitesse.- Effectuez les mesures LVOT à la fin de la diastole, comme on le voit sur le signal ECG, juste en dessous de la valve aortique.
- Tracez le signal PW tiré du LVOT dans une vue AP5CH pour obtenir le volume de la course ventriculaire gauche et le CO ventriculaire gauche.
- Valider toutes les images et mesures de la VCI et des reins. Cela doit être effectué par un radiologue abdominal indépendant et expérimenté. En cas de problèmes lors de l’obtention des images souhaitées lors de l’examen clinique, le radiologiste abdominal indépendant peut être appelé pour effectuer le CUSC, auquel cas aucune autre validation n’a lieu.
7. Suivi du patient
- Enregistrement du consentement éclairé
- Si le consentement du patient ou de la famille est obtenu lors de l’un des examens cliniques ou après la fin du protocole d’examens cliniques, mais que le patient est toujours admis à l’hôpital, enregistrez-le dans le système de gestion des données du patient et téléchargez le formulaire de consentement signé à la main.
- Si le consentement a été refusé, enregistrez-le dans le système de gestion des données du patient avec la raison pour laquelle vous n’avez pas obtenu le consentement, et informez-en le coordinateur de l’étude, qui supprimera toutes les données du patient.
- Données sur la mortalité
- Pour les patients qui décèdent lors de l’admission, enregistrez la mortalité directement à partir du dossier électronique du patient et la cause de décès associée.
- Pour les patients sans mortalité hospitalière, obtenir les données de mortalité du registre municipal des Pays-Bas, qui est mis à jour tous les 90 jours.
Résultats
L’objectif de ces résultats représentatifs est d’illustrer la faisabilité du protocole.
Patient
Au total, 663 patients ont été admis en réanimation entre le 14-05-2018 et le 15-08-2018. Parmi ceux-ci, 208 patients étaient éligibles à l’inclusion (les raisons de l’exclusion sont illustrées à la figure 4). Un certain nombre de 49 patients ont été exclus, car il n’était pas possible d’effectuer le CUSC en raison des efforts de réanimation en cours. Sept patients ont refusé de participer (pas de consentement éclairé) et chez quatre patients, le CUSC était impossible, par exemple en raison du positionnement ventral pour la ventilation mécanique ou la fermeture assistée par vide de grandes plaies, ce qui a donné lieu à 138 patients inclus avec des données pour l’analyse.
Validation CCUS et qualité d’image
Une validation approfondie de l’imagerie cardiaque est prévue. La validation de l’échographie rénale a commencé. Jusqu’à présent, les images de 21 patients (15 %) ont été validées. Chez 18 patients (86 %) les images semblaient de qualité suffisante. Toutes les raisons de désapprobation des images ont été énumérées et renvoyées pour rétroaction au chercheur qui a effectué l’échographie. Le nom du chercheur qui a effectué l’échographie est enregistré pour pouvoir évaluer la variabilité inter- et intra-observateur à l’aide du coefficient de corrélation intraclasse (ICC). Des méthodes statistiques exactes seront décrites dans notre plan d’analyse statistique, comme cela a été fait dans le SICS-I12.
Exemple de cas : Patiente X, femme d’âge moyen
La patiente X a été admise après qu’on a découvert qu’elle avait des troubles de la conscience et une pression artérielle basse. Toutes les mesures obtenues sont indiquées dans le tableau 1. Toutes les variables ont été obtenues dans le délai requis sans données manquantes, illustrant la faisabilité possible de ce protocole. Dans les 3 heures suivant l’admission, le premier examen clinique a été effectué. Au cours de cet examen, le patient a été sédatif, intubé et a eu besoin d’un traitement vasopresseur. Le deuxième examen clinique a été effectué dix heures plus tard et a montré des signes vitaux stables après 700 ml de perfusion de liquide. Les vasopresseurs ont été réduits. L’analyse du CUSC et de la biochimie a montré une fonction cardiaque, une VCI et une fonction rénale normales (Figure 5, Figure 6 et Figure 7). À T3, deux jours plus tard, les vasopresseurs ont été arrêtés mais le bilan hydrique positif cumulé était passé à 6 litres, accompagné d’une augmentation du CO, d’une VCI plus large et d’une diminution de la perfusion et de la fonction rénales reflétées par une augmentation de la créatinine sérique. À T4, 5 jours après l’admission, l’équilibre hydrique et la créatinine sérique avaient encore augmenté, où le patient a développé une IRA de stade 3. Le patient est décédé 2 jours plus tard des suites d’une défaillance multiviscérale dont l’origine n’est pas claire, 7 jours après son admission.
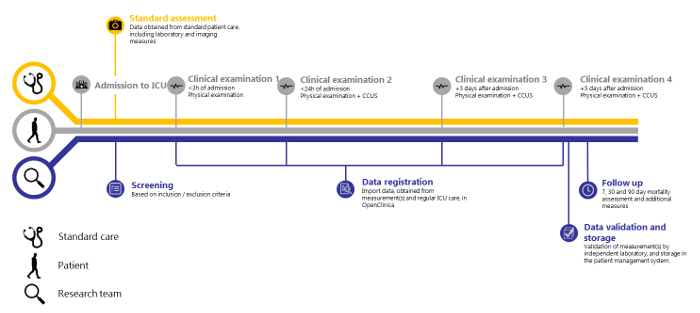
Figure 1 : Aperçu de l’étude SICS-II. Chronologie de l’étude SICS-II, de l’admission du patient aux soins intensifs à l’étape finale de l’enregistrement des données. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Formulaire de rapport de cas (CRF) pour l’examen clinique 1. CRF à remplir par les étudiants de l’équipe de l’USI ou les étudiants-chercheurs lors de la réalisation du premier examen clinique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Formulaire de rapport de cas (CRF) pour les examens cliniques 2, 3 et 4. CRF à remplir par les étudiants de l’équipe de l’USI ou les étudiants-chercheurs lors de la réalisation des deuxième, troisième et quatrième examens cliniques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
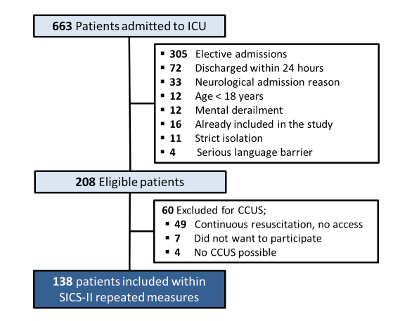
Figure 4 : Tableau d’inclusion et d’exclusion des patients SICS-II. Organigramme décrivant les critères d’inclusion et d’exclusion des patients dans l’étude SICS-II jusqu’au 15-08-2018. Veuillez cliquer ici pour voir une version agrandie de cette figure.
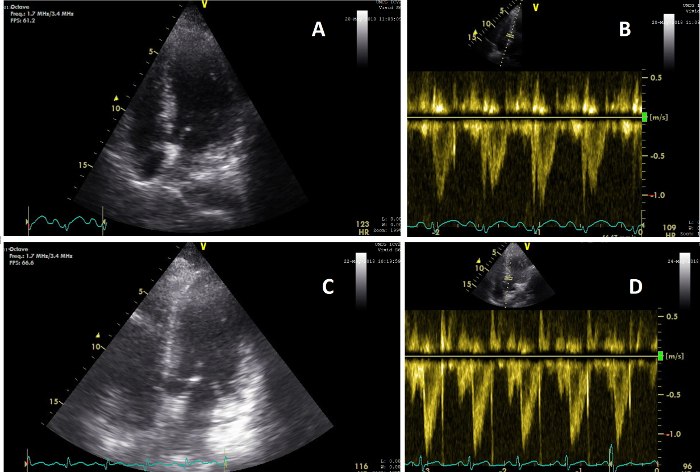
Figure 5 : Vues apicales montrant une modification de la fonction cardiaque. (A) Image du cœur sur une vue AP4CH pendant le CUSC réalisée lors de l’examen clinique 2 (T=2) ; (B) Image du signal d’onde de pouls VTI cardiaque à T=2, montrant un CO de 5,6 L/min ; (C) Image du cœur sur une vue AP5CH pendant le CUSC réalisée lors de l’examen clinique 3 (T=3) ; (D) Image du signal d’onde de pouls VTI cardiaque à T=3, montrant un CO de 8,3 L/min. Veuillez cliquer ici pour voir une version agrandie de cette figure.
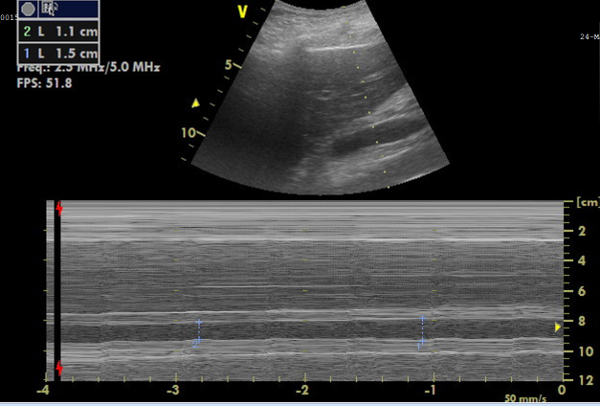
Figure 6 : Image en mode M de la veine cave inférieure (CVI) pour les mesures de diamètre. Image montrant, en haut, l’IVC en temps réel, et, en dessous, l’image en mode M représentant les changements de diamètre de l’IVC, à partir de laquelle la réductibilité peut être calculée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
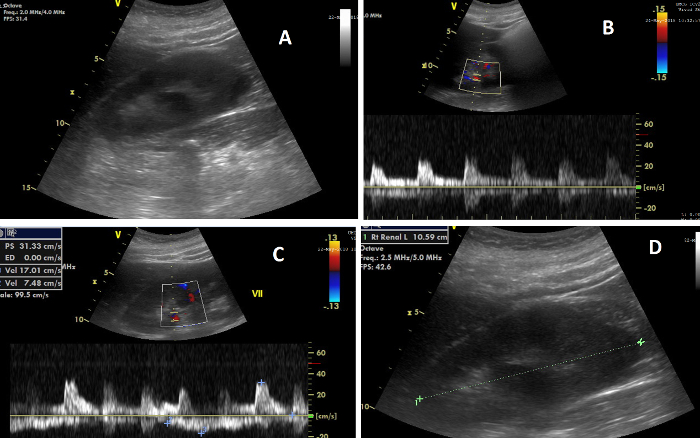
Figure 7 : Les différents éléments de l’échographie rénale. (A) Image du rein droit pendant le CUSC ; (B) Image montrant, en haut, le flux Doppler dans les artères rénales, et, en dessous, l’onde de flux à partir de laquelle l’indice résistif rénal est calculé ; (C) Image montrant, en haut, le flux Doppler dans les veines rénales, et, en bas, l’onde de débit à partir de laquelle l’indice d’impédance veineuse est calculé ; (D) Image illustrant la mesure de la longueur rénale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Variable | L1 Jour 1, à 00:38 | L2 Jour 1, à 10:53 | L3 Jour 3, à 10:14 | J4 Jour 5, à 10h20 |
| Fréquence cardiaque (bpm) | 110 | 124 | 122 | 98 |
| Fréquence respiratoire (respirations par minute) | 24 | 15 | 26 | 12 |
| Pression artérielle systolique (mmhg) | 100 | 115 | 130 | 118 |
| Pression artérielle diastolique (mmhg) | 61 | 69 | 66 | 65 |
| Pression artérielle moyenne (mmhg) | 73 | 80 | 84 | 81 |
| Bilan hydrique cumulé (mL) | 0 | 704 | 7272 | 12338 |
| Ventilation mécanique | PEP 5, FiO2 40 % | PEP 5, FiO2 40 % | PEP 5, FiO2 30 % | PEP 5, FiO2 30 % |
| Sternum CRT (secondes) | 1.5 | 2 | 4 | 3 |
| Température centrale (◦ C) | 37.6 | 37.5 | 38.0 | 37.4 |
| Débit urinaire de l’heure précédente (mL) | 117 | 60 | 0 | 10 |
| Agents inotropes administrés | Noradrénaline 0,1 mg/ml 3,0 ml/h | Noradrénaline 0,1 mg/ml 1,0 ml/h | aucun | aucun |
| Sédatifs administrés | Le propofol 20 mg/ml 5,0 ml/h | aucun | aucun | aucun |
| Score APACHE IV | 92 | 88 | 87 | 90 |
| Score SOFA | 8 | 8 | 5 | 8 |
| LVOT (cm) | N.A. | 2.4 | 2.4 | 2.4 |
| Débit cardiaque (L/min) | N.A. | 5.6 | 8.34 | 9.89 |
| TAPSE (mm) | N.A. | 25 | 26 | 21 |
| RV S'(cm/s) | N.A. | 14 | 15 | 12 |
| Diamètre inspiratoire IVC (cm) | N.A. | 1.14 | 1.24 | 1.10 |
| Diamètre expiratoire IVC (cm) | N.A. | 1.27 | 1.38 | 1.50 |
| Lignes Kerley B (total) | N.A. | 6 | 2 | 4 |
| Longueur rénale (cm) | N.A. | 10.59 | N.A. | N.A. |
| Schéma de flux veineux intrarénal | N.A. | Continu | Continu | Continu |
| IR rénal Doppler | N.A. | 0.61 | 0.75 | 0.70 |
| VII | N.A. | 0.33 | 0.56 | 0.68 |
Tableau 1 : Un patient SICS-II aléatoire. La patiente X, une femme d’âge moyen, a été admise à l’unité de soins intensifs après avoir été trouvée avec une conscience altérée. Abréviations : bpm = battements par minute, CRT = temps de remplissage capillaire, LVOT = voie d’éjection ventriculaire gauche, TAPSE = excursion systolique du plan annulaire tricuspide, RV S'= excursion systolique ventriculaire droite, IVC = veine cave inférieure, RRI = indice de résistance rénale, VII = indice d’impédance veineuse, N.A. = sans objet.
| Variable | Unité | Source | Obtenu à |
| Lactate | mmol/L | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| Chlorure | mmol/L | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| pH | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 ho de différence | |
| BCP2 | kPa | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| PaO2 | kPa | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| HCO3- | mmol/L | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| Hémoglobine | mmol/L | Analyse des gaz du sang artériel | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| Leucocytes | 10 x 10-9/L | Analyse sérique | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| Trombocytes | 10 x 10-9/L | Analyse sérique | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| HS Troponine | ng/L | Analyse sérique | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| ASAT | U/L | Analyse sérique | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| L’ALAT | U/L | Analyse sérique | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| Bilirubine totale | uoml/L | Analyse sérique | Des soins standards, au plus près de chaque examen clinique, max 12 h d’écart |
| Créatinine | umol/L | Analyse sérique | Toutes les mesures depuis le début de l’admission à l’unité de soins intensifs |
| Volume d’urine | Ml | Collecte d’urine de 24 h | Toutes les mesures depuis le début de l’admission à l’unité de soins intensifs |
| Créatinine | mmol/24 h | Analyse d’urine | Toutes les mesures depuis le début de l’admission à l’unité de soins intensifs |
Tableau 2 : Liste des variables biochimiques obtenues. Toutes les variables biochimiques recueillies par les patients au cours de l’étude sont répertoriées ici.
Discussion
Tous les examens doivent être effectués conformément au protocole. L’examen physique n’a de valeur que s’il est effectué conformément aux définitions prédéfinies23. Les valeurs de laboratoire doivent être recueillies conformément au protocole pour obtenir toutes les valeurs. Des images CCUS claires et interprétables sont essentielles pour répondre à la question de recherche de cette étude, comme décrit à l’étape 3.3. Si des images de mauvaise qualité sont obtenues, les mesures et les analyses décrites à l’étape 5 ne peuvent pas être effectuées, et l’objectif des mesures répétées expire. Trois mesures importantes sont prises pour minimiser le risque d’obtenir des images de mauvaise qualité. Tout d’abord, les étudiants-chercheurs qui pratiquent le CUSC dans notre étude sont formés par un cardiologue-intensiviste expérimenté. La littérature montre qu’un programme de formation court est bien adapté pour obtenir les compétences de base en CCUS24. Deuxièmement, les étudiants-chercheurs sont supervisés par un étudiant-chercheur senior lors de leurs 20 premiers examens afin qu’ils puissent recevoir une rétroaction pratique. Enfin, toutes les images cardiaques et rénales acquises seront réévaluées et validées par un expert indépendant d’un laboratoire central d’imagerie cardiaque et un radiologue abdominal expérimenté, respectivement, afin de garantir la fiabilité des données.
Pour garantir la qualité de l’image, les chercheurs doivent également prêter attention à d’autres aspects. Il est parfois nécessaire de réappliquer du gel à ultrasons ou de repositionner la sonde de manière à ce qu’elle ait un meilleur contact avec la peau du patient pour assurer une qualité d’image optimale. Il est également important de prendre suffisamment de temps pour acquérir l’image la plus optimale et, en cas de doute, un chercheur principal, c’est-à-dire un cardiologue-intensiviste superviseur ou un technicien de laboratoire principal, doit être consulté avant la fin de l’examen clinique. L’évaluation et la validation continues de toutes les images échographiques sont assurées par l’application des étapes protocolisées illustrées à la figure 1. De plus, les étudiants-chercheurs et les experts échangent fréquemment des commentaires, ce qui facilite la mise en œuvre rapide de modifications de protocole pour augmenter encore la qualité des images et des mesures. Cette vérification fréquente permet de détecter facilement les erreurs systématiques, de sorte que la formation CCUS des futurs étudiants-chercheurs peut être adaptée en conséquence. De plus, des réunions mensuelles ouvertes à tous les membres de l’équipe permettent une évaluation approfondie et (si nécessaire) des modifications du protocole.
La disponibilité permanente pour le dépistage et l’inclusion des patients est un autre élément clé de la réussite de la mise en œuvre de cette étude. Cela ne peut se faire qu’en disposant d’une équipe dédiée d’étudiants-chercheurs, d’une grande équipe d’étudiants pour apporter leur soutien et d’une bonne coordination avec les soignants de l’USI. Cette coordination se fait par un contact régulier à faible enjeu entre les soignants et les chercheurs sur les améliorations possibles pour optimiser la collaboration avec les soins standards.
L’une des limites de ce protocole est que la réussite du CCUS dépend de l’accessibilité des positions prédéfinies où la sonde est placée. Lors du SICS-I, il a déjà été démontré que le CCUS cardiaque ne peut pas être réalisé lorsque les patients ont besoin de drains, de gazes ou de pansements qui obstruent la fenêtre échocardiographique théoriquement optimale1. De plus, il a été démontré que la possibilité d’obtenir une fenêtre sous-costale appropriée par échocardiographie transthoracique, qui est nécessaire pour les mesures de la VCI, est potentiellement limitée dans une population générale de soins intensifs25. La disponibilité 24 heures sur 24 et 7 jours sur 7 requise par ce protocole pour effectuer les différents examens à différents moments est également une limitation potentielle, car certains centres peuvent ne pas avoir la capacité de le faire. Même dans un grand hôpital universitaire tel que l’UMCG, cela a entraîné des retards dans le démarrage de l’étude. Une autre limitation intrinsèque aux mesures ultrasonographiques est la variabilité inter-observateurs des mesures. Pour que l’inclusion des patients soit garantie 24 heures sur 24 et 7 jours sur 7, il est impossible pour un seul chercheur de réaliser tous les examens cliniques chez tous les patients inclus. Cette étude vise à ce que le même chercheur effectue toutes les mesures échographiques chez un même patient afin de minimiser la variabilité au niveau individuel, mais pour l’ensemble de la cohorte, la variabilité inter-observateurs reste un problème.
L’imagerie échographique de plusieurs organes peut être une structure rapide, sûre et efficace pour visualiser la perfusion et la fonction des organes. Il s’agit d’un outil pratique que tous les professionnels de la santé devraient pouvoir utiliser, et pour lequel peu de mesures basées sur un protocole simple et standardisé devraient généralement fournir des mesures fiables.
De plus, la plupart des études observationnelles évaluant l’utilisation de l’échographie, et en particulier de l’échocardiographie, sont de nature rétrospective ou n’incluent qu’un petit nombre de patients. 26 Ce protocole permet un dépistage structurel 24 heures sur 24, 7 jours sur 7, d’une cohorte non sélectionnée de patients gravement malades, dont les sous-populations d’intérêt peuvent être définies, permettant ainsi l’investigation simultanée de plusieurs questions de recherche.
De plus, bien que l’on sache que les variables cliniques en soins intensifs sont très dynamiques et s’influencent mutuellement, la plupart des études n’ont examiné que la valeur additive des mesures échographiques singulières d’organes spécifiques27,28. Il s’agit du premier protocole à mettre l’accent sur les mesures répétées, l’échographie corps entier et la congestion veineuse. Nous nous attendons à ce que le SICS-II fournisse un reflet plus précis de l’état hémodynamique des patients lors de leur admission en soins intensifs.
La structure actuelle utilisée dans SICS peut être appliquée à un grand nombre de paramètres, et l’ajout d’autres éléments est actuellement à l’étude. Sa force réside dans la combinaison d’une ligne de recherche fondamentale et d’une ligne adaptative dans laquelle de nouvelles variables peuvent facilement être ajoutées aux CRF afin d’étudier de nouvelles questions de recherche. Un exemple de cette adaptabilité est l’ajout au protocole habituel d’une évaluation approfondie de la paroi ventriculaire par imagerie de déformation, c’est-à-dire une contrainte à court terme, chez un sous-ensemble spécifique de patients.
De plus, l’inclusion des patients se fait actuellement exclusivement en réanimation et une partie de la trajectoire de soins des patients est désormais manquée. Les patients de l’unité de soins intensifs sont souvent admis d’abord au service des urgences et restent dans le service hospitalier ordinaire après leur sortie de l’unité de soins intensifs. Par conséquent, le SICS vise à inclure les patients à un stade plus précoce en incluant les patients à leur arrivée aux urgences et en enregistrant les interventions et la fonction hémodynamique dès l’admission initiale à l’hôpital. De plus, des plans visant à effectuer un CUSC après la sortie de l’unité de soins intensifs dans les services ordinaires sont également en cours afin que tous les patients puissent être mesurés à chaque moment d’étude prédéfini. Un autre aspect important est l’extensibilité du protocole à d’autres centres : sa simplicité permet une adaptation facile par les centres qui peuvent commencer à s’inclure eux-mêmes.
Enfin, l’élaboration et la mise en œuvre réussie d’un protocole structuré de CUSC peuvent également avoir des ramifications cliniques. Bien qu’il ne soit utilisé qu’à des fins de recherche, il pourrait être mis en œuvre pour le CUSC clinique par les médecins après la courte période de formation proposée. Il serait alors intéressant d’évaluer si le fait de faciliter la formation du CCUS aux médecins (inexpérimentés) réduirait les tests diagnostiques supplémentaires.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier tous les membres du groupe d’étude SICS-I qui ont été impliqués au sein du SICS-I et qui ont participé à des séances de remue-méninges sur le protocole actuel. Nous tenons également à remercier le bureau de recherche de notre département de soins intensifs et ses coordonnateurs pour leur soutien ; le docteur W. Dieperink et M. Onrust. De plus, nous tenons à remercier l’équipe d’étudiants de l’USI et les étudiants-chercheurs qui ont inclus structurellement des patients dans SICS-II jusqu’à présent ; J. A. de Bruin, B. E. Keuning, drs. K. Selles.
matériels
| Name | Company | Catalog Number | Comments |
| Ultrasound machine | GE Healthcare | 0144VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound machine | GE Healthcare | 3507VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound machine | GE Healthcare | 0630VS6 | Ultrasound machine, GE Vivid S6 |
| Ultrasound gel | Parker | 01-08 | Aquasonic 100 ultrasound transmission gel |
| Temperature probe | DeRoyal | 81-010400EU | Skin Temperature Sensor |
Références
- Hiemstra, B., et al. Clinical examination, critical care ultrasonography and outcomes in the critically ill: cohort profile of the Simple Intensive Care Studies-I. BMJ open. 7 (9), 017170(2017).
- Lee, J., et al. Association between fluid balance and survival in critically ill patients. Journal of Internal Medicine. 277 (4), 468-477 (2015).
- Perner, A., et al. Fluid management in acute kidney injury. Intensive Care Medicine. 43 (6), 807-815 (2017).
- Balakumar, V., et al. Both Positive and Negative Fluid Balance May Be Associated With Reduced Long-Term Survival in the Critically Ill. Critical care medicine. 45 (8), 749-757 (2017).
- Hjortrup, P. B., et al. Restricting volumes of resuscitation fluid in adults with septic shock after initial management: the CLASSIC randomised, parallel-group, multicentre feasibility trial. Intensive Care Medicine. 42 (11), 1695-1705 (2016).
- Prowle, J. R., Kirwan, C. J., Bellomo, R. Fluid management for the prevention and attenuation of acute kidney injury. Nature reviews. Nephrology. 10 (1), 37-47 (2014).
- Gambardella, I., et al. Congestive kidney failure in cardiac surgery: the relationship between central venous pressure and acute kidney injury. Interactive CardioVascular and Thoracic Surgery. 23 (5), 800-805 (2016).
- Chen, K. P., et al. Peripheral Edema, Central Venous Pressure, and Risk of AKI in Critical Illness. Clinical journal of the American Society of Nephrology : CJASN. 11 (4), 602-608 (2016).
- Song, J., et al. Value of the combination of renal resistance index and central venous pressure in the early prediction of sepsis-induced acute kidney injury. Journal of critical care. 45, 204-208 (2018).
- Zhang, L., Chen, Z., Diao, Y., Yang, Y., Fu, P. Associations of fluid overload with mortality and kidney recovery in patients with acute kidney injury: A systematic review and meta-analysis. Journal of Critical Care. 30 (4), (2015).
- Simple Intensive Care Studies II - Full Text View. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ct2/show/NCT03577405? term=simple+intensive+care+studies (2018).
- Wetterslev, J. Statistical analysis plan Simple Intensive Care Studies-I DETAILED STATISTICAL ANALYSIS PLAN (SAP) 1. Administrative information 1.1. Title, registration, versions and revisions. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ProvidedDocs/24/NCT02912624/SAP_000.pdf (2018).
- van der Horst, I. C. C. Simple Observational Critical Care Studies - Full Text View - ClinicalTrials.gov. ClinicalTrials.gov. , Available from: https://clinicaltrials.gov/ct2/show/NCT03553069 (2018).
- Ait-Oufella, H., et al. Alteration of skin perfusion in mottling area during septic shock. Annals of Intensive Care. 3 (1), 31(2013).
- Teasdale, G., Jennett, B. Assessment of Coma and Impaired Consciousness: A Practical Scale. The Lancet. 304 (7872), 81-84 (1974).
- Detsky, M. E., et al. Discriminative Accuracy of Physician and Nurse Predictions for Survival and Functional Outcomes 6 Months After an ICU Admission. JAMA. 317 (21), 2187(2017).
- Lipson, A. R., Miano, S. J., Daly, B. J., Douglas, S. L. The Accuracy of Nurses' Predictions for Clinical Outcomes in the Chronically Critically Ill. Research & reviews. Journal of nursing and health sciences. 3 (2), 35-38 (2017).
- Lichtenstein, D. A. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest. 147 (6), 1659-1670 (2015).
- Tang, W. H. W., Kitai, T. Intrarenal Venous Flow: A Window Into the Congestive Kidney Failure Phenotype of Heart Failure. JACC: Heart Failure. 4 (8), 683-686 (2016).
- Jeong, S. H., Jung, D. C., Kim, S. H., Kim, S. H. Renal venous doppler ultrasonography in normal subjects and patients with diabetic nephropathy: Value of venous impedance index measurements. Journal of Clinical Ultrasound. 39 (9), 512-518 (2011).
- Iida, N., et al. Clinical Implications of Intrarenal Hemodynamic Evaluation by Doppler Ultrasonography in Heart Failure. JACC: Heart Failure. 4 (8), 674-682 (2016).
- Lang, R. M., et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging. 16 (3), 233-271 (2015).
- Hiemstra, B., Eck, R. J., Keus, F., van der Horst, I. C. C. Clinical examination for diagnosing circulatory shock. Current opinion in critical care. 23 (4), 293-301 (2017).
- Vignon, P., et al. Basic critical care echocardiography: validation of a curriculum dedicated to noncardiologist residents. Critical care medicine. 39 (4), 636-642 (2011).
- Jensen, M. B., Sloth, E., Larsen, K. M., Schmidt, M. B. Transthoracic echocardiography for cardiopulmonary monitoring in intensive care. European journal of anaesthesiology. 21 (9), 700-707 (2004).
- Koster, G., van der Horst, I. C. C. Critical care ultrasonography in circulatory shock. Current opinion in critical care. 23 (4), 326-333 (2017).
- Haitsma Mulier, J. L. G., et al. Renal resistive index as an early predictor and discriminator of acute kidney injury in critically ill patients; A prospective observational cohort study. PloS one. 13 (6), 0197967(2018).
- Micek, S. T., et al. Fluid balance and cardiac function in septic shock as predictors of hospital mortality. Critical care. 17 (5), London, England. 246(2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon