Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vitro-Fluoreszenz Resonanz Energietransfer verwenden, um die Dynamik der Proteinkomplexe auf einer Millisekunde Zeitskala studieren
In diesem Artikel
Zusammenfassung
Protein-Protein-Interaktionen sind von entscheidender Bedeutung für biologische Systeme, und Studien der verbindliche Kinetik geben Einblicke in die Dynamik und Funktion von Proteinkomplexen. Wir beschreiben eine Methode, die die kinetischen Parameter von einem Proteinkomplex mit Fluoreszenz-Resonanz-Energie-Transfer und die gestoppt-Flow-Technik quantifiziert.
Zusammenfassung
Proteine sind die primären Betreiber von biologischen Systemen, und sie in der Regel interagieren mit anderen Makro oder kleine Moleküle, deren biologische Funktionen durchzuführen. Solche Interaktionen können sehr dynamisch, d. h. die interagierenden Untereinheiten sind ständig verbunden und getrennt zu bestimmten Preisen sein. Während Messen der Bindungsaffinität mit Techniken wie quantitative Pulldown-Menü zeigt die Stärke der Wechselwirkung, studieren die verbindliche Kinetik Einblicke darüber, wie schnell gibt die Interaktion erfolgt und wie lange jede Anlage bestehen kann. Darüber hinaus messen die Kinetik einer Interaktion in der Gegenwart ein zusätzlicher Faktor, wie ein Protein-Austausch-Faktor oder ein Medikament hilft den Mechanismus zu offenbaren, die Interaktion durch den anderen Faktor geregelt ist, wichtige Erkenntnisse für die Bereitstellung, der Förderung der biologischen und medizinischen Forschung. Hier beschreiben wir ein Protokoll zur Messung der verbindliche Kinetics von einem Proteinkomplex, das hat eine hohe intrinsische Verband und kann schnell durch ein anderes Protein getrennt werden. Die Methode verwendet Fluoreszenz Resonanz Energietransfer um zu melden, die Bildung von in-vitro-Protein-Komplex, und es ermöglicht die Überwachung der schnelle Assoziation und Dissoziation des Komplexes in Echtzeit auf einem gestoppt-Flow Fluorimeter. Mit diesem Test, werden die Assoziation und Dissoziation Geschwindigkeitskonstanten von dem Proteinkomplex quantifiziert.
Einleitung
Biologische Aktivitäten erfolgt letztlich durch Proteine, die meisten davon mit anderen für richtige biologische Funktionen interagieren. Mit einem rechnerischen Ansatz, der Gesamtbetrag der Protein-Protein-Interaktionen in der menschlichen wird voraussichtlich 650.000 ~1und Störung dieser Interaktionen oft führt zu Krankheiten2. Durch ihre entscheidende Rolle bei der Kontrolle der zellulärer und organismal Prozessen wurden zahlreiche Methoden entwickelt, um Protein-Protein-Wechselwirkungen, wie Hefe-zwei-Hybrid, bimolekulare Fluoreszenz Komplementierung, Split-Luciferase studieren Ergänzung und co-Immunopräzipitation Assay3. Während diese Methoden gut entdecken und Bestätigung von Protein-Protein-Interaktionen sind, sie sind in der Regel nicht-quantitative und somit bieten nur begrenzte Informationen über die Affinität zwischen den Interaktionspartnern Protein. Quantitative Pulldown-Menüs können zur Messung der Bindungsaffinität (z. B. die Dissoziationskonstante Kd), aber es misst nicht die Kinetik der Bindung, noch kann es angewendet werden, wenn die K-d sehr niedrig, da eine unzureichende ist Signal-Rausch-Verhältnis4. Surface Plasmon-Resonanz (SPR)-Spektroskopie quantifiziert die verbindliche Kinetik, aber es erfordert eine spezifische Oberfläche und Immobilisierung von einem Reaktionspartner auf der Oberfläche, die potenziell die Binding-Eigenschaft der Reaktanten5ändern können. Darüber hinaus ist es schwierig für SPR schnell Assoziation und Dissoziation Preise5messen, und es ist nicht angebracht, SPR verwenden, um die Charakterisierung der Veranstaltung zum Austausch von Protein-Untereinheiten in einem Proteinkomplex. Hier beschreiben wir eine Methode, die erlaubt Messraten von Protein komplexe Montage und Demontage auf einer Millisekunde Zeitskala. Diese Methode war wesentlich für die Bestimmung der Rolle von CUllin - Warnformate -Nedd8 -dIssociated Protein 1 (Cand1)als die F-Box Protein Austausch Faktor6,7.
Cand1 regelt die Dynamik der Skp1•Cul1•F-Box-Protein (SCF) E3 Ligases, die zu der großen Familie von Cullin-RING Ubiquitin Ligases gehören. SKSF bestehen aus den cullin, Cul1, die das RING Domain Protein Rbx1 bindet, und eine austauschbare F-Box Protein, das Rekruten Substrate und Cul1 durch den Adapter Protein Skp18bindet. Als eine E3-Ligase SCF katalysiert die Konjugation des Ubiquitin an seinem Substrat, und es ist aktiviert, wenn das Substrat durch die F-Box Protein rekrutiert und Cul1 des Proteins Ubiquitin-artigen Nedd89geändert wird. Cand1 bindet unmodifizierten Cul1 und bei der Bindung, stört es sowohl der Verband der Skp1•F-Box-Protein mit Cul1 und die Konjugation von Nedd8 bis Cul110,11,12,13. Infolgedessen Cand1 schien ein Inhibitor der SCF Aktivität in vitro, aber Cand1 Mangel in Organismen verursacht Mängel, die eine positive Rolle des Cand1 schlägt bei der Regulierung der SCF Aktivitäten in Vivo14,15,16 , 17. dieses Paradox erklärt sich schließlich durch eine quantitative Studie, die die dynamische Interaktionen zwischen Cul1, Cand1 und Skp1•F-Box-Protein enthüllt. Mit Fluoreszenz Resonanz Energie Transfer (FRET) Assays, die die Bildung der SCF und Cul1•Cand1 komplexe erkennen, der Assoziation und Dissoziation bewerten konstanten (kauf und kab, beziehungsweise) wurden einzeln gemessen. Die Messungen ergaben, dass Cand1 und Skp1•F-Box Protein Form extrem engen Komplex mit Cul1, aber die kaus der SCF durch Cand1 drastisch erhöht wird und die kaus der Cul1•Cand1 wird drastisch erhöht Skp1•F-Box Protein6,7. Diese Ergebnisse unterstützen die aus- und kritische Bestimmung der Rolle der Cand1 als ein Protein Austausch Faktor, der die Bildung von neuen SCF-komplexe durch recycling von Cul1 aus der alten SCF komplexe katalysiert.
Hier präsentieren wir Ihnen das Verfahren der Entwicklung und Verwendung der Bund-Assay, um die Dynamik der Cul1•Cand1 Komplex7zu studieren, und das gleiche Prinzip kann angewendet werden, um die Dynamik der verschiedenen Biomolekülen zu studieren. Bund tritt auf, wenn ein Spender freut sich mit der entsprechenden Wellenlänge, und ein Akzeptor mit Anregungsspektrums Überlappung der Spender Emissionsspektrum in einer Entfernung von 10-100 ist Å. Die angeregten Zustand wird in den Akzeptor, wodurch abnehmender Spender Intensität und Akzeptor Intensität18übertragen. Die Effizienz der Bund (E) hängt der Förster-Radius (R0) und der Abstand zwischen Donor und Akzeptor Fluorophore (R) und zeichnet sich durch: E = R06/ (R0 6 + R6). Der Förster-Radius (R0) hängt von einigen Faktoren, einschließlich der Dipol Winkelorientierung, die spektrale Überlappung der Donor-Akzeptor-paar und die Lösung verwendet,19. Um die Bund-Assay auf einem Fluorimeter gestoppt-Flow anwenden, die die Änderung der Spender Emission in Echtzeit überwacht und ermöglicht Messungen der schnelle kauf und kaus, ist es notwendig, effiziente Bund, Ergebnisse einer signifikanten Reduktion der Spender Emission. Daher gestalten effiziente Bund durch die Wahl der entsprechenden paar fluoreszierende Farbstoffe und Websites auf die Zielproteine um die Farbstoffe zu befestigen ist wichtig und in diesem Protokoll diskutiert werden.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Entwurf der Bund-Assay.
- Download der Strukturdatei der komplexen Cul1•Cand1 von der Protein Data Bank (Datei 1U6G).
- Zeigen Sie die Struktur des Komplexes in PyMOL Cul1•Cand1.
- Die Messfunktion unter Menü " Assistenten " von PyMOL verwenden, um den Abstand zwischen der ersten Aminosäure des Cand1 und die letzten Aminosäure des Cul1 zu schätzen (Abbildung 1).
- Laden Sie die Online-Spektren-Viewer (siehe Tabelle der Materialien) und Anregung und Emission-Spektren von 7-amino-4-Methylcumarin (AMC) und Blitz gleichzeitig anzeigen (Abbildung 2). Beachten Sie, dass AMC der Bund-Spender ist und Blitz die Bund-Akzeptor ist.
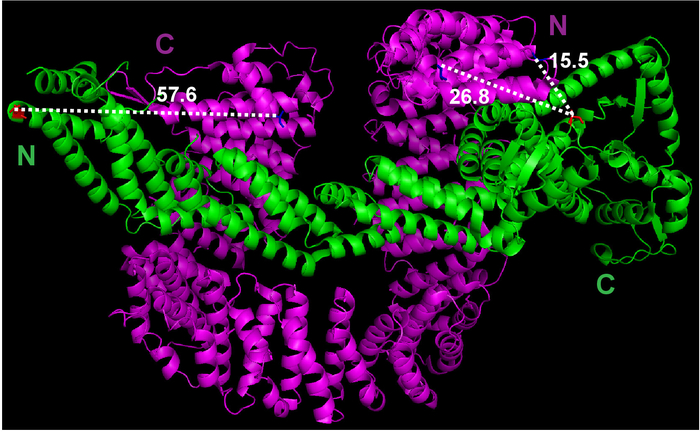
Abbildung 1: die Kristallstruktur des Cul1•Cand1 und Messung des Abstandes zwischen Potenzial Kennzeichnung Websites. Die Kristall-Struktur-Datei wurde heruntergeladen von Protein Data Bank (Datei 1U6G) und in PyMOL angesehen. Messungen zwischen ausgewählten Atome wurden von PyMOL ausgeführt. Bitte klicken Sie hier für eine größere Version dieser Figur.
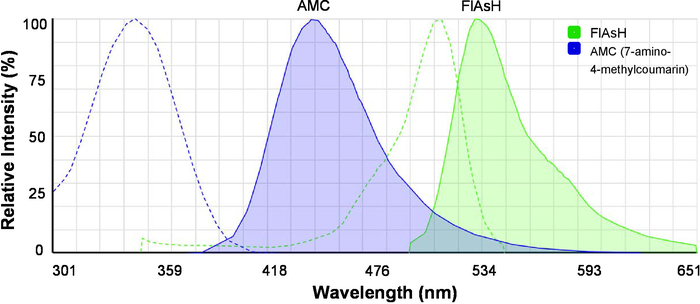
Abbildung 2: die Anregung und Emission-Spektren von Fluoreszenzfarbstoffen für Bund. Spektren von AMC (7-amino-4-Methylcumarin) und FlAsH werden angezeigt. Gestrichelte Linien zeigen Erregung Spektren, und durchgezogenen Linien zeigen Emissionsspektren. Das Bild wurde ursprünglich durch die Fluoreszenz-SpectraViewer generiert und für eine bessere Übersichtlichkeit geändert wurde. Bitte klicken Sie hier für eine größere Version dieser Figur.
2. Vorbereitung des Cul1AMC•Rbx1, FRET-Spender-Protein
- Plasmide für den Ausdruck von menschlichen Cul1Sortase•Rbx1 in E. Coli Zellen zu konstruieren. Beachten Sie, dass die beiden Plasmide Co Ausdruck menschlicher Cul1•Rbx1 in E. Coli Zellen in einem früheren Bericht20detailliert beschrieben sind.
- Hinzufügen einer DNA-Sequenz, die Codierung "LPETGGHHHHHH" (Sortase, seine6 Tag) bis zum 3' Ende des Cul1 kodierende Sequenz durch standard-PCR und Klonen Methoden21,22.
- Sequenz das neue Plasmid zu bestätigen, die gen-Einlage genau ist.
- Co Express Cul1Sortase•Rbx1 in E. Coli Zellen. Die Methode wird von einem vorherigen Bericht20abgeleitet.
- Mix 100 ng von zwei Plasmide mit BL21 (DE3) chemisch kompetente Zellen für Co-Transformation mit der Hitze Schock Methode23. Wachsen Sie Zellen auf LB-Agar-Platte mit 100 µg/mL Ampicillin und 34 µg/mL Chloramphenicol bei 37 ° C über Nacht.
- 50 mL LB-Kultur mit frisch transformierte Kolonien zu impfen und wachsen über Nacht bei 37 ° C mit 250 u/min schütteln. Dies gibt eine Starterkultur.
- 6 Flaschen, jeweils mit 1 L LB-Medium mit 5 mL Starterkultur jeder impfen und wachsen bei 37 ° C mit 250 u/min schütteln bis die OD600 ~ 1.0 ist. Die Kultur auf 16 ° C abkühlen und 0,4 mM Isopropyl-β-D-Thiogalactoside (IPTG) hinzufügen. Halten Sie die Kultur bei 16 ° C über Nacht mit 250 u/min schütteln.
- Ernten Sie die E. Coli -Zellen durch Zentrifugation bei 5.000 X g für 15 min zu und sammeln Sie Zelle Pellets in 50 mL konische Röhrchen.
Hinweis: Die Zelle-Pellets für Proteinreinigung verarbeitet werden können oder bei-80 ° C, bevor Sie fortfahren, die Protein-Reinigungsschritte eingefroren werden.
- Reinigung von Cul1Sortase•Rbx1 komplexe. Diese Methode wird von einem vorherigen Bericht20abgeleitet.
- Das Pellet von E. Coli Zellen mit dem Ausdruck Cul1Sortase•Rbx1 fügen Sie 50 mL Lyse-Puffer (30 mM Tris-HCl, 200 mM NaCl, 5 mM DVB-t, 10 % Glycerin 1 Tablette der Protease-Inhibitor cocktail, pH 7.6 hinzu).
- Lösen Sie die Zellen mit Beschallung bei 50 % Amplitude auf Eis. Wechseln Sie zwischen 1 Sekunde und 1 Sekunde aus und 3 min laufen lassen.
- Wiederholen Sie Schritt 2.3.2 2-3x.
- Übertragen der Zelle lysate in ein 50-mL-Zentrifugation Rohr und entfernen Sie die Zelle Verschmutzungen durch Zentrifugation bei 25.000 X g 45 min.
- Inkubieren Sie die klare Zelle lysate mit 5 mL Glutathion Perlen bei 4 ° C für 2 h.
- Zentrifugieren Sie die Perlen-lysate Mischung bei 1.500 X g für 2 min bei 4 ° C. Den Überstand zu entfernen.
- Waschen Sie die Perlen mit 5 mL Lyse-Puffer (mit keine Proteaseinhibitoren) und Entfernen des Überstands nach Zentrifugation bei 1.500 X g für 2 min bei 4 ° C.
- Wiederholen Sie Schritt 2.3.7 2 X.
- Die gewaschenen Perlen 3 mL Lyse Puffer hinzu und übertragen Sie die Perle Gülle in eine leere Spalte.
- 5 mL der Elution Buffer (50 mM Tris-HCl, 200 mM NaCl, 10 mM reduziert Glutathion, pH 8.0) in der Spalte hinzufügen. 10 min inkubieren und das Eluat zu sammeln.
- Wiederholen Sie Schritt 2.3.10 3-4 X.
- Fügen Sie 200 µL 5 mg/mL Thrombin (siehe Tabelle der Materialien), das Eluat von Glutathion-Perlen und über Nacht bei 4 ° c inkubieren
Hinweis: Das Protokoll kann hier angehalten werden. - Verdünnen Sie die Protein-Probe mit Puffer A (25 mM HEPES, 1 mM DVB-t, 5 % Glycerin, pH 6,5) verdreifacht.
- Equilibrate ein Kationenaustausch Chromatographiesäule (siehe Tabelle der Materialien) auf einem FPLC System mit Puffer A.
- Laden Sie die Protein-Probe zur äquilibriert Kationenaustausch-Chromatographie Spalte bei 0,5 mL/min Durchfluss.
- Eluieren Sie das Protein mit einer Steigung von NaCl in 40 mL Puffer A und 0 bis 50 % Puffer B (25 mM HEPES, 1 M NaCl, 1 mM DVB-t, 5 % Glycerin, pH 6,5) bei 1 mL/min Durchfluss.
- Überprüfen des eluierten Proteins in verschiedene Fraktionen mit SDS-PAGE24.
Hinweis: Das Protokoll kann hier angehalten werden. - Das Eluat Brüche mit Cul1Sortase•Rbx1 zu bündeln.
- Konzentrieren Sie die gepoolte Cul1Sortase•Rbx1 Probe 2,5 mL durch die Übergabe des Puffers durch eine Membran Ultrafiltration (30 kDa cutoff).
- Fügen Sie AMC an den C-Terminus des Cul1 durch Sortase-vermittelten Transpeptidation21,22.
- Ändern Sie den Puffer in der Cul1Sortase•Rbx1 Probe Sortase Puffer (50 mM Tris-HCl, 150 mM NaCl, 10 mM CaCl2, pH 7,5) eine Entsalzung Spalte verwenden (siehe Tabelle der Materialien).
- Equilibrate eine Entsalzung Spalte mit 25 mL Sortase Puffer.
- Laden Sie 2,5 mL Cul1Sortase•Rbx1 Probe in der Spalte. Entsorgen Sie den Durchfluss.
- Eluieren Sie die Probe mit 3,5 mL Sortase Puffer. Die Flow-through zu sammeln.
- Fügen Sie in 900 µL der Cul1Sortase•Rbx1 Lösung im Sortase Puffer 100 µL 600 µM gereinigt Sortase eine Lösung und 10 µL 25 mM GGGGAMC Peptid. Inkubieren Sie die Reaktionsmischung bei 30 ° C in der dunklen Nacht. Beachten Sie, dass dieser Schritt Cul1 generieren wirdAMC•Rbx1.
Achtung: Fluoreszierende Farbstoffe reagieren empfindlich auf Licht, also vermeiden sie Umgebungslicht während der Protein- und Probe Vorbereitung so weit wie möglich.
Hinweis: Das Protokoll kann hier angehalten werden. - Das Reaktionsgemisch 50 µL der Ni-NTA Agarose Korne hinzu und bei Zimmertemperatur 30 min inkubieren.
- Pellet-Ni-NTA-Agarose-Perlen durch Zentrifugation bei 5.000 X g für 2 min und den Überstand zu sammeln.
- Equilibrate eine Größe Ausgrenzung Chromatographiesäule (siehe Tabelle der Materialien) mit Puffer (30 mM Tris-HCl, 100 mM NaCl, 1 mM DVB-t, 10 % Glycerin) auf dem FPLC-System.
- Laden Sie die Cul1AMC•Rbx1 Probe auf die Ausgrenzung Chromatographie Spalte "Größe". Eluieren Sie mit 1,5 X Spalte Volumen des Puffers.
- Überprüfen Sie das Eluat Brüche durch SDS-PAGE24.
- Das Eluat Brüche mit Cul1 PoolAMC•Rbx1.
- Messen die Konzentration des Proteins mit der Absorption bei 280 nm mit einem Spektrophotometer.
- Aliquot der Proteinlösung und Store bei-80 ° C.
Hinweis: Das Protokoll kann hier angehalten werden.
- Ändern Sie den Puffer in der Cul1Sortase•Rbx1 Probe Sortase Puffer (50 mM Tris-HCl, 150 mM NaCl, 10 mM CaCl2, pH 7,5) eine Entsalzung Spalte verwenden (siehe Tabelle der Materialien).
3. Vorbereitung des Flash-Cand1, das Bund-Akzeptor-protein
Hinweis: Die meisten Schritte in diesem Teil sind identisch mit Schritt2. Bedingungen, die sich unterscheiden werden nachfolgend detailliert beschrieben.
- Das Plasmid für den Ausdruck von menschlichen TetraCysCand1 in E. Coli Zellen zu konstruieren.
- DNA-Sequenz, die Codierung "CCPGCCGSG" (Tetracysteine/TetraCys Tag) hinzufügen, bevor die 15th Aminosäure des Cand1 durch regelmäßige PCR25 (Primer-Sequenzen: TGCTGTCCGGGCTGCTGCGGCAGCGGCATGACATCCAGCGACAAGGACTTTAG; CTAACTAGTGTCCATTGATTCCAAG).
- Legen Sie das PCR-Produkt in ein pGEX-4 t-2-Vektor. Folge das Plasmid zu bestätigen, die gen-Einlage ist korrekt und im Rahmen.
- Drücken Sie TetraCysCand1in E. Coli Zellen in der gleichen Weise wie Schritt 2.2, aus, außer dass das Plasmid in Rosetta kompetente Zellen umgewandelt wird.
- Reinigung von TetraCysCand1 aus den E. Coli -Zellen.
- Lysiert die E. Coli Zelle Pellets und TetraCysCand1using Glutathion Perlen zu extrahieren. Diese Schritte sind identisch mit den Schritten 2.3.1–2.3.12.
- Verdünnen Sie das Protein Eluat von Glutathion-Perlen mit Puffer C (50 mM Tris-HCl, 1 mM DVB-t, 5 % Glycerin, pH 7,5) durch drei Falten. Equilibrate ein Anion Austausch Chromatographiesäule (siehe Tabelle der Materialien) auf dem FPLC System mit Puffer C und Last der verdünnten Protein-Probe bei 0,5 mL/min Durchfluss.
- Eluieren Sie das Protein mit einer Steigung von NaCl in 40 mL durch Mischen von Puffer C und 0 bis 50 % Puffer D (50 mM Tris-HCl, 1 M NaCl, 1 mM DVB-t, 5 % Glycerin, pH 7,5) bei 1 mL/min Durchfluss. Überprüfen Sie des eluierten Proteins in verschiedene Fraktionen mit SDS-PAGE24und bündeln Sie die Fraktionen mit TetraCysCand1. Beachten Sie, dass TetraCysCand1 einen größeren Retentionsvolumen als kostenlose GST.
- Konzentrieren Sie die gepoolte TetraCysCand1 Probe durch die Übergabe des Puffers durch eine Membran Ultrafiltration (30 kDa cutoff).
- Equilibrate der Größe Ausgrenzung Chromatographiesäule mit Kennzeichnung Puffer (20 mM Tris-HCl, 100 mM NaCl, 2 mM DÄMMUND, 1 mM EDTA, 5 % Glycerin) auf dem FPLC-System. Laden Sie TetraCysCand1 Probe (500 µL jedes Mal) und überprüfen Sie das Eluat Brüche durch SDS-PAGE24.
- Bündeln Sie die Fraktionen, die mit TetraCysCand1 und konzentrieren Sie das Protein zu ~ 40 µM durch Übergabe des Puffers durch eine Membran Ultrafiltration (30 kDa cutoff). Schätzen Sie die Konzentration des Proteins mit der Absorption bei 280 nm. Speichern Sie das Protein als 50 µL-Aliquots bei-80 ° C.
Hinweis: Das Protokoll kann hier angehalten werden.
- Erstellung von Flash-Cand1.
- Hinzufügen von Flash-Lösung 1 µL (siehe Tabelle der Materialien) zu 50 µL TetraCysCand1 Lösung.
- Gut mischen und die Mischung bei Raumtemperatur im Dunkeln für 1-2 h zu FlAsHCand1 inkubieren.
Hinweis: Das Protokoll kann hier angehalten werden.
4. Vorbereitung der Cand1, der Bund-Chase-protein
Hinweis: Das Protein-Vorbereitung-Protokoll ist ähnlich wie bei Schritt 3 mit den folgenden Änderungen.
- Legen Sie die kodierende Sequenz des abendfüllenden Cand1 in pGEX-4 t-2-Vektor.
- Ändern Sie den Puffer in Schritt 3.3.5 auf einen Puffer mit 30 mM Tris-HCl, 100 mM NaCl, 1 mM DVB-t, 10 % Glycerin verwendet.
- Beseitigen Sie Schritte 3.3.7 und 3.3.8.
5. Testen Sie und bestätigen Sie die Bund-assay
- Bereiten Sie den Bund-Puffer mit 30 mM Tris-HCl, 100 mM NaCl, 0,5 mM DVB-t, 1 mg/mL Ovalbumin, pH 7.6, und bei Raumtemperatur verwenden.
- Testen Sie den Bund zwischen Cul1AMC•Rbx1 und Flash-Cand1 auf einem Fluorimeter.
- In 300 µL Puffer FRET, fügen Cul1AMC•Rbx1 (Bund Spender), eine Endkonzentration von 70 nM. Übertragen Sie die Lösung in einer Küvette.
- Legen Sie die Küvette in den Probenhalter von einem Fluorimeter. Die Probe mit 350 nm Anregungslicht begeistern und scannen die Emission Signale von 400 nm bis 600 nm auf 1 nm-Schritten.
- Wiederholen Sie Schritt 5.2.1 aber Änderung Cul1AMC•Rbx1, Flash-Cand1 (Bund Akzeptor). Scannen Sie die Flash-Cand1-Probe mit der gleichen Methode wie in Schritt 5.2.2.
- (Optional) Die Flash-Cand1 mit 510 nm Anregungslicht begeistern, und scannen die Emission Signal von 500 nm bis 650 nm.
- In 300 µL Bund Puffer, fügen Sie beide Cul1AMC•Rbx1 und Flash-Cand1, eine Endkonzentration von 70 nM. Analysieren Sie die Probe auf die gleiche Weise wie in Schritt 5.2.2.
- Bestätigen Sie den Bund zwischen Cul1AMC•Rbx1 und Flash-Cand1 durch Zugabe von Chase (unbeschriftete Cand1) Protein (Abbildung 3).
- Fügen Sie in 300 µL Puffer FRET, 70 nM Cul1AMC•Rbx1 und 700 nM Cand1. Scannen Sie die Probe-Emission wie in Schritt 5.2.2.
- Fügen Sie in 300 µL Puffer FRET, 70 nM FlAsHCand1 und 700 nM Cand1. Scannen Sie die Probe-Emission wie in Schritt 5.2.2.
- Fügen Sie in 300 µL Puffer FRET, 70 nM Cul1AMC•Rbx1 und 70 nM FlAsHCand1 und der Probe bei 5 min bei Raumtemperatur inkubieren. Fügen Sie dann 700 nM Cand1, und Scannen Sie sofort nach der Zugabe die Probe-Emission wie in Schritt 5.2.2). Beachten Sie, dass dieser Schritt für Schritt 5.2.5 ähnelt.
- In 300 µL Bund Puffer, nacheinander hinzufügen 70 nM Cul1AMC•Rbx1, 700 nM Cand1 und 70 nM FlAsHCand1. Inkubieren Sie die Probe bei Raumtemperatur für 5 min, und Scannen Sie die Probe-Emission wie in Schritt 5.2.2. Beachten Sie, dass dies die Chase-Probe (grüne Linie in Abbildung 3).
6. Messen Sie die Vereinigung Geschwindigkeitskonstante (kauf) von Cul1•Cand1
Hinweis: Details für den Betrieb einer gestoppt-Flow Fluorimeter wurde in einem früheren Bericht26beschrieben.
- Messung der gestoppt-Flow Fluorimeter vorbereiten.
- Schalten Sie die gestoppt-Flow Fluorimeter nach Anweisungen des Herstellers.
- Legen Sie das Anregungslicht auf 350 nm und Verwendung ein Bandpass-Filter, der 450 nm Emission ermöglicht, Licht passieren und 500-650 nm Emission Licht blockiert.
- Halten Sie die Probe-Ventile an der Position zu füllen , und schließen Sie eine 3 mL Spritze mit Wasser gefüllt. Waschen Sie die zwei Probe-Spritzen (A und B) durch verschieben den Probe Spritze Antrieb nach oben und unten mehrmals mit Wasser. Entsorgen Sie das Wasser, die in diesem Schritt verwendet.
- Halten Sie die Probe-Ventile an der Position zu füllen , und schließen Sie eine 3 mL Spritze mit Bund Puffer gefüllt. Waschen Sie die zwei Probe-Spritzen mit dem Bund-Puffer durch verschieben den Probe Spritze Antrieb nach oben und unten mehrmals. Entsorgen Sie alle Bund-Puffers in diesem Schritt.
- Nehmen Sie eine Kontrollmessung (Abbildung 4).
- Schließen Sie eine 3 mL Spritze und laden Sie Spritze A mit 100 nM Cul1AMC-•Rbx1 im Bund Puffer zu. Drehen Sie das Ventil Probe fahren .
- Schließen Sie eine 3 mL Spritze und laden Sie Spritze B mit dem Bund-Puffer zu. Drehen Sie das Ventil Probe fahren .
- Mithilfe der Systemsteuerung unter erwerben in der Software zu fünf Schüsse (mischen gleiches Volumen an Proben aus Spritze A und B Spritze) auf die gestoppt-Flow Fluorimeter ohne Aufzeichnung der Ergebnisse.
- Öffnen Sie das Control Panel unter erwerben in der Software und die Emission von Cul1 aufnehmen programmierenAMC über 60 s. Dann nehmen Sie einen einzigen Schuss.
- Wiederholen Sie Schritt 6.2.4 2 X.
- Drehen Sie das Ventil Probe füllen . Spritze B entleeren und waschen mit dem Bund-Puffer.
- Maßnahme beobachtet Verband Geschwindigkeitskonstanten (kObs) des Cul1•Cand1 (Abbildung 4 b).
- Halten Sie die Probe in Spritze A das gleiche wie in Schritt 6.2.1.
- 3 mL Spritze zu verbinden und laden Sie Spritze B mit 100 nM FlAsHCand1 im Bund Puffer. Drehen Sie das Ventil Probe fahren .
- Verwenden Sie die Systemsteuerung unter erwerben in der Software, um fünf Schüsse zu nehmen, ohne die Ergebniserfassung.
- Öffnen Sie das Control Panel unter erwerben in der Software und die Emission von Cul1 aufnehmen programmierenAMC über 60 s. Dann nehmen Sie einen einzigen Schuss.
- Wiederholen Sie Schritt 6.3.4 2 X.
- Spritze B entleeren und waschen mit dem Bund-Puffer.
- Wiederholen Sie die Schritte 6.3.1–6.3.6 mehrmals mit steigenden Konzentrationen von FlAsHCand1 im Bund Puffer.
- Passen Sie die Änderung (Abnahme) in fluoreszierenden Signale gemessen im Laufe der Zeit aus jedem Schuss auf eine exponentielle Kurve. Dadurch erhalten kObsbei jeder Messung, und das Gerät ist s-1. Beachten Sie, dass die Grundlage dieser Berechnung auch in einem früheren Bericht27diskutiert worden ist.
- Berechnung der Mittelwert und die Standardabweichung der kObsfür jede Flash-Cand1-Konzentration verwendet. Plotten der durchschnittliche kObsgegen Cand1 Konzentration (Abbildung 4), und die Steigung der Linie repräsentiert das kauf der Cul1•Cand1, mit einer Einheit von M-1 s-1.
7. Messen Sie die Dissoziation Geschwindigkeitskonstante (koff) des Cul1•Cand1 in Gegenwart von Skp1•F-Box-Protein.
Hinweis: Dieser Schritt ist ähnlich wie bei Schritt 6 mit den folgenden Änderungen.
- In Spritze A, unter der Position zu füllen , laden, eine Lösung von 100 nM Cul1AMC•Rbx1 und 100 nM FlAsHCand1 im Bund Puffer. Drehen Sie das Beispiel der "DRIVE"-Position.
- Laden Sie in Spritze B unter der Position zu füllen , eine Lösung des Skp1•Skp2 (nach einem vorherigen Bericht20vorbereitet). Drehen Sie das Beispiel der "DRIVE"-Position.
- Öffnen Sie das Control Panel unter erwerben in der Software und die Emission von Cul1 aufnehmen programmierenAMC über 30 s. Dann nehmen Sie einen einzigen Schuss. Die fluoreszierende Signale erhöhen im Laufe der Zeit nach dem Mischen Lösungen A Spritze und Spritze B (Abbildung 5).
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Testen Sie den Bund zwischen Cul1AMC und FlAsHCand1 wir zunächst ermittelt die Emissionsintensität 70 nM Cul1AMC (Spender) und 70 nM FlAsHCand1 (Akzeptor), bzw. (Abb. 3A-C, blaue Linien). In jeder Analyse nur eine Emission Peak Gegenwart und die Emission von FlAsHCand1 war, war (Akzeptor) niedrig. Wenn 70 nM der Cul1AMC und FlAsHCand1 waren gemischt, um Bund zu gen...
Access restricted. Please log in or start a trial to view this content.
Diskussion
FRET ist ein physikalisches Phänomen, das von großem Interesse für Studium und das Verständnis biologischer Systeme19ist. Hier präsentieren wir Ihnen ein Protokoll für die Prüfung und Verwendung von Bund, um die verbindliche Kinetik der zwei interagierenden Proteine zu studieren. Beim Bund zu entwerfen, wir hielten drei Hauptfaktoren: die spektrale Überlappung zwischen Emission und Akzeptor Erregung Spender, der Abstand zwischen den zwei Fluorophore und die Dipol-Ausrichtung der Fluorophor...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Shu-Ou Shan (California Institute of Technology) für aufschlussreiche Diskussion über die Entwicklung des Bund-Assays. M.G., Y.Z und X.L. wurden durch Start-Fonds von der Purdue University, Y.Z finanziert und X.L.This Arbeit wurde teilweise durch einen Zuschuss der Samen von Purdue University Center für Pflanzenbiologie unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Anion exchange chromatography column | GE Healthcare | 17505301 | HiTrap Q FF anion exchange chromatography column |
| Benchtop refrigerated centrifuge | Eppendorf | 2231000511 | |
| BL21 (DE3) Competent Cells | ThermoFisher Scientific | C600003 | |
| Calcium Chloride | Fisher Scientific | C78-500 | |
| Cation exchange chromatography column | GE Healthcare | 17505401 | HiTrap SP Sepharose FF |
| Desalting Column | GE Healthcare | 17085101 | |
| Floor model centrifuge (high speed) | Beckman Coulter | J2-MC | |
| Floor model centrifuge (low speed) | Beckman Coulter | J6-MI | |
| Fluorescence SpectraViewer | ThermoFisher Scientific | https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html | |
| FluoroMax fluorimeter | HORIBA | FluoroMax-3 | |
| FPLC | GE Healthcare | 29018224 | |
| GGGGAMC peptide | New England Peptide | custom synthesis | |
| Glutathione beads | GE Healthcare | 17075605 | |
| Glycerol | Fisher Scientific | G33-500 | |
| HEPES | Fisher Scientific | BP310-100 | |
| Isopropyl-β-D-thiogalactoside (IPTG) | Fisher Scientific | 15-529-019 | |
| LB Broth | Fisher Scientific | BP1426-500 | |
| Ni-NTA agarose | Qiagen | 30210 | |
| Ovalbumin | MilliporeSigma | A2512 | |
| pGEX-4T-2 vector | GE Healthcare | 28954550 | |
| Protease inhibitor cocktail | MilliporeSigma | 4693132001 | |
| Reduced glutathione | Fisher Scientific | BP25211 | |
| Refrigerated shaker | Eppendorf | M1282-0004 | |
| Rosetta Competent Cells | MilliporeSigma | 70953-3 | |
| Size exclusion chromatography column | GE Healthcare | 28990944 | Superdex 200 10/300 GL column |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-500 | |
| Stopped-flow fluorimeter | Hi-Tech Scientific | SF-61 DX2 | |
| TCEP·HCl | Fisher Scientific | PI20490 | |
| Thrombin | MilliporeSigma | T4648 | |
| Tris Base | Fisher Scientific | BP152-500 | |
| Ultrafiltration membrane | MilliporeSigma | UFC903008 | Amicon Ultra-15 Centrifugal Filter Units, Ultra-15, 30,000 NMWL |
Referenzen
- Stumpf, M. P. H., et al. Estimating the size of the human interactome. Proceedings of the National Academy of Sciences of the United States of America. 105 (19), 6959-6964 (2008).
- Kuzmanov, U., Emili, A. Protein-protein interaction networks: probing disease mechanisms using model systems. Genome Medicine. 5 (4), 37(2013).
- Titeca, K., Lemmens, I., Tavernier, J., Eyckerman, S. Discovering cellular protein-protein interactions: Technological strategies and opportunities. Mass Spectrometry Reviews. , 1-33 (2018).
- Lapetina, S., Gil-Henn, H. A guide to simple, direct, and quantitative in vitro binding assays. Journal of Biological Methods. 4 (1), 62(2017).
- Zheng, X., Bi, C., Li, Z., Podariu, M., Hage, D. S. Analytical methods for kinetic studies of biological interactions: A review. Journal of Pharmaceutical and Biomedical Analysis. 113, 163-180 (2015).
- Pierce, N. W., et al. Cand1 promotes assembly of new SCF complexes through dynamic exchange of F box proteins. Cell. 153 (1), 206-215 (2013).
- Liu, X., Reitsma, J. M., Mamrosh, J. L., Zhang, Y., Straube, R., Deshaies, R. J. Cand1-Mediated Adaptive Exchange Mechanism Enables Variation in F-Box Protein Expression. Molecular Cell. 69 (5), 773-786 (2018).
- Zheng, N., et al. Structure of the Cul1-Rbx1-Skp1-F boxSkp2 SCF ubiquitin ligase complex. Nature. 416 (6882), 703-709 (2002).
- Kleiger, G., Deshaies, R. Tag Team Ubiquitin Ligases. Cell. 166 (5), 1080-1081 (2016).
- Zheng, J., et al. CAND1 binds to unneddylated CUL1 and regulates the formation of SCF ubiquitin E3 ligase complex. Molecular Cell. 10 (6), 1519-1526 (2002).
- Hwang, J. W., Min, K. W., Tamura, T. A., Yoon, J. B. TIP120A associates with unneddylated cullin 1 and regulates its neddylation. FEBS Letters. 541 (1-3), 102-108 (2003).
- Min, K. W., Hwang, J. W., Lee, J. S., Park, Y., Tamura, T., Yoon, J. B. TIP120A associates with cullins and modulates ubiquitin ligase activity. Journal of Biological Chemistry. 278 (18), 15905-15910 (2003).
- Goldenberg, S. J., et al. Structure of the Cand1-Cul1-Roc1 complex reveals regulatory mechanisms for the assembly of the multisubunit cullin-dependent ubiquitin ligases. Cell. 119 (4), 517-528 (2004).
- Chuang, H. W., Zhang, W., Gray, W. M. Arabidopsis ETA2, an apparent ortholog of the human cullin-interacting protein CAND1, is required for auxin responses mediated by the SCF(TIR1) ubiquitin ligase. Plant Cell. 16 (7), 1883-1897 (2004).
- Feng, S., et al. Arabidopsis CAND1, an Unmodified CUL1-Interacting Protein, Is Involved in Multiple Developmental Pathways Controlled by Ubiquitin/Proteasome-Mediated Protein Degradation. the Plant Cell Online. 16 (7), 1870-1882 (2004).
- Cheng, Y., Dai, X., Zhao, Y. AtCAND1, a HEAT-repeat protein that participates in auxin signaling in Arabidopsis. Plant Physiology. 135 (June), 1020-1026 (2004).
- Lo, S. -C., Hannink, M. CAND1-Mediated Substrate Adaptor Recycling Is Required for Efficient Repression of Nrf2 by Keap1. Molecular and Cellular Biology. 26 (4), 1235-1244 (2006).
- Okamoto, K., Sako, Y. Recent advances in FRET for the study of protein interactions and dynamics. Current Opinion in Structural Biology. 46, 16-23 (2017).
- Hussain, S. A. An introduction to fluorescence resonance energy transfer (FRET). arXiv preprint. , (2009).
- Li, T., Pavletich, N. P., Schulman, B. A., Zheng, N. High-level expression and purification of recombinant SCF ubiquitin ligases. Methods in Enzymology. 398 (1996), 125-142 (2005).
- Popp, M. W., Antos, J. M., Grotenbreg, G. M., Spooner, E., Ploegh, H. L. Sortagging: A versatile method for protein labeling. Nature Chemical Biology. 3 (11), 707-708 (2007).
- Antos, J. M., Ingram, J., Fang, T., Pishesha, N., Truttmann, M. C., Ploegh, H. L. Site-Specific Protein Labeling via Sortase-Mediated Transpeptidation. Current Protocols in Protein Science. 89, (2017).
- Froger, A., Hall, J. E. Transformation of Plasmid DNA into E. coli Using the Heat Shock Method. Journal of Visualized Experiments. , (2007).
- Simpson, R. J. SDS-PAGE of Proteins. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Kleiger, G., Saha, A., Lewis, S., Kuhlman, B., Deshaies, R. J. Rapid E2-E3 Assembly and Disassembly Enable Processive Ubiquitylation of Cullin-RING Ubiquitin Ligase Substrates. Cell. 139 (5), 957-968 (2009).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of Stopped-flow Kinetics Methods to Investigate the Mechanism of Action of a DNA Repair Protein. Journal of Visualized Experiments. (37), 2-8 (2010).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of Stopped-Flow Fluorescence and Labeled Nucleotides to Analyze the ATP Turnover Cycle of Kinesins. Journal of Visualized Experiments. (92), 1-6 (2014).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A guide to fluorescent protein FRET pairs. Sensors (Switzerland). 16 (9), 1-24 (2016).
- Chen, A. K., Cheng, Z., Behlke, M. A., Tsourkas, A. Assessing the sensitivity of commercially available fluorophores to the intracellular environment. Analytical Chemistry. 80 (19), 7437-7444 (2008).
- Lin, C. T., Rorabacher, D. B. Mathematical approach for stopped-flow kinetics of fast second-order reactions involving inhomogeneity in the reaction cell. Journal of Physical Chemistry. 78 (3), 305-308 (1974).
- Toseland, C. P., Geeves, M. A. Rapid Reaction Kinetic Techniques. Fluorescent Methods for Molecular Motors. , 49-65 (2014).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: Synthesis and biological applications. Journal of the American Chemical Society. 124 (21), 6063-6076 (2002).
- Lin, C. W., Ting, A. Y. Transglutaminase-catalyzed site-specific conjugation of small-molecule probes to proteins in vitro and on the surface of living cells. Journal of the American Chemical Society. 128 (14), 4542-4543 (2006).
- Yin, J., et al. Genetically encoded short peptide tag for versatile protein labeling by Sfp phosphopantetheinyl transferase. Proceedings of the National Academy of Sciences of the United States of America. 102 (44), 15815-15820 (2005).
- Diaspro, A., Chirico, G., Usai, C., Ramoino, P., Dobrucki, J. Photobleaching. Handbook Of Biological Confocal Microscopy. , 690-702 (2006).
- Aoki, K., Kamioka, Y., Matsuda, M. Fluorescence resonance energy transfer imaging of cell signaling from in vitro to in vivo: Basis of biosensor construction, live imaging, and image processing. Development, Growth & Differentiation. 55 (4), 515-522 (2013).
- Kilic, S., et al. Single-molecule FRET reveals multiscale chromatin dynamics modulated by HP1α. Nature Communications. 9 (1), (2018).
- Shen, K., Arslan, S., Akopian, D., Ha, T., Shan, S. O. Activated GTPase movement on an RNA scaffold drives co-translational protein targeting. Nature. 492 (7428), 271-275 (2012).
- Bajar, B. T., et al. Improving brightness and photostability of green and red fluorescent proteins for live cell imaging and FRET reporting. Scientific Reports. 6 (February), 1-12 (2016).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten