Method Article
Untersuchung der Auswirkungen der Temperatur auf die Keimbildung und das Wachstum von Nanopartikeln mittels Flüssigzell-Transmissionselektronenmikroskopie
In diesem Artikel
Zusammenfassung
Die Temperaturregelung während flüssigphasenelektronenmikroskopischer Experimente eröffnet neue Perspektiven für die Untersuchung der Dynamik von Nanopartikeln in flüssigen Umgebungen, die ihre Entstehungs- oder Anwendungsmedien nachahmen. Mit kürzlich entwickelten heizenden Flüssigkeitszellen beobachteten wir direkt den Einfluss der Temperatur auf die Keimbildungs- und Wachstumsprozesse von Goldnanopartikeln in Wasser.
Zusammenfassung
Die Temperaturregelung ist eine neuere Entwicklung, die einen zusätzlichen Freiheitsgrad bietet, um die Nanochemie durch Flüssigzelltransmissionselektronenmikroskopie zu untersuchen. In diesem Artikel beschreiben wir, wie ein In-situ-Heizexperiment vorbereitet wird, um den Einfluss der Temperatur auf die Bildung von Goldnanopartikeln zu untersuchen, die durch Radiolyse in Wasser angetrieben werden. Das Protokoll des Experiments ist ziemlich einfach mit einer speziellen Flüssigkeitszelle mit gleichmäßigen Heizfähigkeiten bis zu 100 °C, einem Flüssigkeitszellen-TEM-Halter mit Durchflussfähigkeiten und einer integrierten Schnittstelle zur Temperaturregelung. Wir zeigen, dass die Keimbildungs- und Wachstumsmechanismen von Goldnanopartikeln drastisch durch die Temperatur in flüssigen Zellen beeinflusst werden. Mittels STEM-Bildgebung und Nanodifferenzierung wird die Entwicklung der Dichte, Größe, Form und atomaren Struktur der wachsenden Nanopartikel in Echtzeit aufgedeckt. Automatisierte Bildverarbeitungsalgorithmen werden genutzt, um nützliche quantitative Daten aus Videosequenzen zu extrahieren, wie z.B. die Keimbildung und Wachstumsraten von Nanopartikeln. Dieser Ansatz liefert neue Inputs für das Verständnis der komplexen physikalisch-chemischen Prozesse, die bei der Flüssigphasensynthese von Nanomaterialien im Spiel sind.
Einleitung
Metall-Nanopartikel (NPs) haben vielversprechende physikalisch-chemische Eigenschaften, die in verschiedenen Bereichen wie optische Sensorik1,Medizin2 oder Energie3eingesetzt werden können. Die nasschemische Synthese ist eine sehr vielseitige Methode zur Herstellung von Metall-NPs mit genau definierter Größe und Form. In den letzten Jahrzehnten wurden viele Strategien entwickelt, um die Kontrolle über die NPs-Synthese zu erlangen: seed-vermitteltes Wachstum4, Gesichtsblockierungsmethode5, kinetisch kontrollierteSynthese 6, selektivesÄtzen 7 oder temperaturgesteuerteSynthese 8. Während die chemischen Reaktionen, die die Synthese antreiben, ziemlich einfach sind, sind es die Keimbildungs- und Wachstumsmechanismen nicht, da viele Parameter eine Rolle in den Entstehungsprozessen spielen und ihr individueller Einfluss aus Ex-situ-Momentaufnahmen der resultierenden Nanomaterialien, die zu bestimmten Zeitpunkten der Synthese aus ihrem Entstehungsmedium extrahiert wurden, schwer abzurufen sind. Um die Keimbildungs- und Wachstumsprozesse wirklich zu verstehen und Wege zu ihrer Kontrolle zu finden, müssen wir In-situ-Werkzeuge einsetzen, die ihre Echtzeitbeobachtung in fein kontrollierter flüssiger Umgebung ermöglichen.
In dieser Hinsicht war die Flüssigzell-Transmissionselektronenmikroskopie (LCTEM) eine sehr leistungsfähige Methode, um neues Licht auf die Synthese metallischer Nanopartikelzu wirften 9,10,11,12,13. Durch die Abbildung der Dynamik einzelner Nanostrukturen direkt in ihren flüssigen Bildungsmedien hat diese Technik ein tieferes Verständnis der Keimbildungs- und Wachstumsmechanismen ermöglicht, insbesondere der Rolle von Kristalldefekten, Samenmorphologie und organischen Liganden, die es ermöglichen, gerichtete Wachstums- oder Ätzprozesse voranzutreiben und Nanomaterialien mit spezifischen Formen (Nanostäbchen, Nanosterne, Nanoplatten, Nanoschalen) zu erhalten10,11,12,13,14,15,16,17,18,19. Wenn der Elektronenstrahl eines TEM mit Flüssigkeiten interagiert, erzeugen Radiolyseprozesse starke reduzierende und oxidierende Spezies, die die Lösungschemie im bestrahlten Bereich modifizieren und zur Förderung von Wachstums- oder Ätzprozessen verwendet werden können. Interessanterweise ist bekannt, dass die Konzentration von radiolytischen Produkten mit der Elektronendosisleistung zunimmt, ein Parameter, der in einem Elektronenmikroskop fein abgestimmt werden kann20. Daher wurde diese Dosis-Raten-Abhängigkeit der Radiolyse genutzt, um die Reaktionsgeschwindigkeit zu kontrollieren und kinetische Effekte auf die Bildungsprozesse und die endgültige Morphologie der Nanostrukturenaufzudecken 11,15,20.
Obwohl die Temperatur ein entscheidender Parameter in der Nanomaterialsynthese ist, wurden ihre Auswirkungen von LCTEM bisher nicht sorgfältig untersucht, da kommerzielle Flüssigzellen mit zuverlässiger Temperaturkontrolle erst kürzlich entwickelt wurden. Solche In-situ-Studien sind jedoch unerlässlich, um die komplexe Kinetik und die thermodynamischen Effekte zu entschlüsseln, die durch Temperaturänderungen induziert werden. Tatsächlich hat einerseits die Erhöhung der Temperatur drastische Auswirkungen auf die Facettenprozesse während des Wachstums, beschleunigt die atomare und molekulare Diffusion in Flüssigkeiten und verändert die Reaktionsgeschwindigkeiten. Andererseits ist das Nanophasendiagramm von Nanostrukturen auch sehr temperaturempfindlich. In diesem Artikel nutzen wir kürzlich entwickelte Erhitzungsflüssigkeitszellen, um das radiolytische Wachstum von Goldnanopartikeln in Wasser mit einer Temperaturregelung zwischen Raumtemperatur und 100 °C zu verfolgen. Diese Methodik, die STEM-Bildgebung und Beugung in einer Umgebung kombiniert, die sich den realen Synthesebedingungen immer mehr annähert, verringert die Lücke zwischen In-situ-TEM-Beobachtungen und Synthesen im Labormaßstab.
Protokoll
1. Richten Sie das Transmissionselektronenmikroskop für die STEM HAADF-Bildgebung aus
- Befolgen Sie die Anweisungen des Herstellers für die Ausrichtung des Mikroskops.
- Verwenden Sie eine herkömmliche getrocknete Probe, um das Mikroskop auszurichten. Verwenden Sie keine flüssige Probe.
- Um die Wachstumsgeschwindigkeit zu minimieren, minimieren Sie die Elektronendosisleistung (siehe Diskussionsabschnitt), was bedeutet, dass eine kleine Kondensatoröffnung und eine kleine Spotgröße verwendet werden, um den Strahlstrom zu reduzieren.
2. E-Chip-Handhabung
HINWEIS: Kommerzielle Flüssigkeitshalter passen auf fast alle TEM, verwenden aber den Halter, der speziell für die Mikroskopmarke und das Polstück entwickelt wurde. Eine Flüssigkeitszelle besteht aus zwei MEMS-basierten Siliziumchips, den sogenannten E-Chips, beides Siliziumsubstrate mit einem Fenster von 500 x 50 μm, das von einer 50 nm dicken amorphen Siliziumnitridfolie (SiN) bedeckt ist, die elektronentransparent ist(Abbildung 1A). Diese beiden E-Chips haben unterschiedliche Größen. Der kleine ist 2 x 2 mm mit Goldabstandshaltern, die den Abstand zwischen den beiden E-Chips (hier 150 nm) und die Flüssigkeitsdicke fixieren. Der große ist 4 x 6 mm groß und hat einen im Siliziumsubstrat eingebetteten Widerstand, der eine gleichmäßige Erwärmung der flüssigen Probe ermöglicht (Abbildung 1B). Aufgrund der Art und Weise, wie sie in Reinräumen hergestellt werden, haben die E-Chips zwei verschiedene Seiten: eine, wo das Fenster klein aussieht (hier die Vorderseite genannt) und die andere, wo das Fenster groß ist mit einer Waschbeckenform (hier nach der Rückseite genannt).
- Berühren Sie beim Umgang mit den E-Chips niemals das Fenster mit einer Pinzette und greifen Sie die Späne an den Seiten. Um Kratzer an der Oberfläche des Siliziumsubstrats zu vermeiden, verwenden Sie eine Pinzette mit Kohlenstoffspitze.
- Wenn Sie einen E-Chip auf einer Oberfläche platzieren, stellen Sie sicher, dass die Rückseite mit der Oberfläche in Kontakt kommt, da der SiN-Film zerbrechlich ist und sich auf der Vorderseite ablagert.
3. Reinigung des Flüssigkeitszellhalters (vor dem Experiment)
- Entfernen Sie den Deckel, der die Spitze des Halters bedeckt. Entfernen Sie die Dummy-Flüssigkeitszellen mit einer Pinzette. Entfernen Sie die Dichtung, die mit den Dummy-Flüssigkeitszellen verwendet wurde.
HINWEIS: Dummy-Flüssigkeitszellen sind Flüssigkeitszellen ohne SiN-Fenster und nur Silizium. Sie werden zur Aufbewahrung des Flüssigkeitszellenhalters in der Vakuumpumpe verwendet. Achten Sie auf den Zustand von Messingschrauben, da sie im Laufe der Zeit leicht zerbröckeln. Insbesondere wenn die Schraubenköpfe beschädigt sind, müssen die Schrauben gewechselt werden. Andernfalls kann es schwierig sein, sie nach dem Experiment abzuschrauben, und kleine Trümmer können auch die Probenbeladung stören. - 2 ml destilliertes Wasser manuell mit Spritzen und dem externen PEEK-Schlauch in den Halter injizieren, um ihn mit der Rückseite des Halters zu verbinden.
HINWEIS: Es gibt 3 mikrofluidische Tunnel im Inneren der Halterung. Alle drei müssen mit Wasser gereinigt werden. Achten Sie darauf, dass das Wasser vor dem Halter herauskommt: Wenn das Wasser aufgrund eines früheren Experiments gefärbt ist, legen Sie weiterhin Wasser in den Halter, bis die Flüssigkeit ungefärbt ist. - Wenn Sie während des Experiments eine Lösung in die Flüssigkeitszelle injizieren (in unserem Fall 1 mM HAuCl4 in Wasser), füllen Sie den Schlauch des Probenhalters mit dieser Lösung.
- Trocknen Sie die Spitze des Flüssigkeitszellenhalters mit einer Luftpistole aus.
4. Herstellung der Flüssigkeitszelle (E-Chips)
- Reinigung der Flüssigkeitszellen.
- Füllen Sie eine Glas Petrischale mit Aceton.
- Füllen Sie eine Glas Petrischale mit Methanol.
ACHTUNG: Aufgrund der Toxizität von Methanol muss die Petrischale mit Methanol unter einen Abzug gestellt werden. Methanol sollte mit der entsprechenden Schutzausrüstung (Handschuhe) behandelt werden. - Einen kleinen und einen großen E-Chip mit Aceton in die Petrischale geben und 2 Minuten warten.
HINWEIS: Die E-Chips sind mit einer Schutzschicht beschichtet, die vor dem Experiment entfernt werden muss. Aceton entfernt das Fotolack und reinigt die E-Chips von Trümmern. Um die Reinigung zu verbessern, kann die Lösung sanft gerührt werden. - Beide E-Chips mit Methanol in die Petrischale geben und 2 Minuten warten. Das Methanol reinigt die E-Chips vom Aceton und dem Rest der Trümmer.
ACHTUNG: Der Transfer der E-Chips zwischen dem Aceton und dem Methanol muss so schnell wie möglich erfolgen, damit die E-Chips nicht an der Luft austrocknen. - Trocknen Sie die Flüssigkeitszellen mit einer Luftpistole aus. Halten Sie den E-Chip mit einer Pinzette, während Sie die Luftpistole verwenden. Achten Sie darauf, nicht zu viel auf den Luftpistolenabzug zu drücken, da sonst der E-Chip aus der Pinzette fallen kann. Wenn sie ausfallen, starten Sie die Reinigung mit Aceton und Methanol neu.
- Überprüfen Sie die Integrität des Siliziumnitridfensters mit einer binokularen Lupe oder einem optischen Mikroskop (Abbildung 2).
HINWEIS: Stellen Sie sicher, dass die Fenster beider E-Chips sauber und nicht kaputt sind. Wenn die E-Chips nicht sauber erscheinen, versuchen Sie, sie wieder in Aceton und Methanol zu geben. Wenn der Schmutz noch am Fenster ist oder wenn das Fenster kaputt ist, müssen die E-Chips mit neuen gewechselt werden. - Plasma reinigen Sie die E-Chips mit einer Mischung aus Argon und Sauerstoffgas für 2 Minuten. Die Plasmareinigung der E-Chips ermöglicht es ihnen, hydrophil zu sein. Hier sind die Details der Plasmareinigung: Argongasstrom = 35 sccm, Sauerstoffgasstrom = 11,5 sccm, Gasflusstimeout = 20 s, Forward RF Target = 50 W, Forward RF Range = 5 W, Maximum reflected RF = 5 W.
- Laden der Flüssigkeitszellen in den TEM-Halter (Abbildung 3).
- Laden Sie die Dichtungs-O-Ringe in den Flüssigkeitszellenhalter (Abbildung 3B). Überprüfen Sie, ob die verwendete Dichtung sauber ist. Wenn nicht, reinigen Sie es schnell mit destilliertem Wasser. Trocknen Sie es mit einem sauberen Filterpapier ab. Um Ablagerungen und Fasern auf der Dichtung zu entfernen, drücken Sie sie mehrmals zwischen zwei Parafolien.
- Legen Sie den kleinen E-Chip in den Flüssigkeitszellenhalter (Abbildung 3C). Um die Neigung der SiN-Filme zum Vakuum des Mikroskops zu reduzieren, platzieren Sie die Fenster der Flüssigkeitszelle in einer gekreuzten Konfiguration. Daher muss das Fenster des kleinen E-Chips parallel zur Länge der Halterung und der Front nach oben verlaufen. Stellen Sie sicher, dass der kleine E-Chip gut in die Dichtung eingesetzt ist.
- Bereiten Sie die flüssige Probe vor (hier 1 mM HAuCl4 in Wasser).
- Geben Sie ≈2 μL der flüssigen Probe mit einer Mikropipette auf den kleinen E-Chip (Abbildung 3D). Wenn der kleine E-Chip ordnungsgemäß plasmagereinigt wurde, verteilt sich die wässrige flüssige Probe gleichmäßig über die Oberfläche des Chips.
- Entfernen Sie die zusätzliche Flüssigkeit mit einem Filterpapier. Reduzieren Sie mit einem scharf geschnittenen Stück Filterpapier die Dicke der Flüssigkeitsschicht auf dem kleinen E-Chip, bis sie eine flache Kuppel bildet.
- Setzen Sie den großen E-Chip in den Flüssigkeitszellenhalter ein (Abbildung 3E). Legen Sie den großen E-Chip mit der Vorderseite nach unten auf den kleinen (die Vorderseiten der beiden Chips müssen sich gegenüberstehen). Die Elektroden auf dem großen E-Chip müssen in Kontakt mit dem Elektrodenpad auf der Halterung sein.
- Schieben Sie den Deckel wieder auf den Flüssigkeitszellenhalter. Ziehen Sie nach und nach jede Schraube fest (Abbildung 3F).
- Trocknen Sie die eventuell aus den E-Chips kommende Flüssigkeit mit kleinem Ausschnittfilterpapier aus. Stellen Sie sicher, dass auf beiden Seiten der Flüssigkeitszellen keine Flüssigkeit austweht, indem Sie den Flüssigkeitszellhalter um seine Achse drehen.
- Testen Sie die Vakuumversiegelung der Flüssigkeitszelle in einer Pumpstation. Wenn das Vakuumniveau der Pumpe 5 x 10-2 Pa erreicht, fahren Sie mit dem Protokoll fort. Wenn nicht, überprüfen Sie die Integrität des Fensters (es ist höchstwahrscheinlich kaputt) und starten Sie das Protokoll von Anfang an mit einem neuen Satz von E-Chips.
- Überprüfen Sie ein letztes Mal die Integrität des Siliziumnitridfensters mit einer binokularen Lupe oder einem optischen Mikroskop. Manchmal kann die Flüssigkeitszelle das Vakuum der Pumpstation aufrechterhalten, auch wenn das Fenster zerbrochen ist. Dies liegt daran, dass, wenn das Fenster bricht und die Flüssigkeit austritt, es Salzaggregate auf dem zerbrochenen Teil des Fensters bilden kann und so das Loch bedeckt. Wenn es passiert, bereiten Sie einen neuen Satz E-Chips vor.
- Laden Sie den Flüssigkeitszellenhalter in das TEM und überprüfen Sie das Vakuumniveau. Selbst wenn die Flüssigkeitszelle das Vakuum der Pumpstation aufrechterhalten hat und es kein sichtbares Problem mit dem Fenster gibt, kann ein Mikroleck der Flüssigkeitszelle verhindern, dass das für den Betrieb des TEM erforderliche Vakuumniveau erreicht wird. Wenn das Mikroskop das für den Betrieb erforderliche Vakuumniveau (2-5 x 10-5 Pa) nicht erreichen kann, entfernen Sie den Probenhalter und bereiten Sie einen neuen Satz E-Chips vor.
5. Verwenden Sie den Flüssigkeitshalter im Flow-Modus
- Füllen Sie 2 Spritzen mit einigen Millilitern der zu injizierenden Lösung auf (in unserem Fall 1 mM HAuCl4 in Wasser).
- Schließen Sie 2 externe PEEK-Schläuche an die Spritzen an. Legen Sie die 2 Spritzen auf die Spritzenpumpen. Setzen Sie die externen PEEK-Röhrchen in die 2 Einträge des Flüssigkeitszellhalters ein. Legen Sie ein zusätzliches externes PEEK-Rohr für den Ausgang des Flüssigkeitszellenhalters ein.
- Injizieren Sie die Lösung mit einer Durchflussrate von 5 μL/min in jeden Einlass.
6. Erwärmung der flüssigen Umgebung
- Schließen Sie das Netzteil an die Halterung an. Schließen Sie das Netzteil an den Computer an, auf dem die Heizsoftware installiert ist.
- Schalten Sie den Computer ein und öffnen Sie die Heizungssoftware. Schalten Sie das Netzteil ein.
- Klicken Sie auf die Schaltfläche zur Geräteüberprüfung. Wenn die Software "bestanden" anzeigt, kann das Experiment fortgesetzt werden. Andernfalls könnte der große E-Chip ein Problem haben (falsches Laden des E-Chips, kaputte Elektroden...).
- Klicken Sie auf die Registerkarte Experiment. Klicken Sie auf Manuell, um den manuellen Heizmodus zu aktivieren.
- Wählen Sie die Zieltemperatur aus und ändern Sie entsprechend die Temperaturrate. Drücken Sie auf Apply, um die E-Chips auf die Zieltemperatur aufzuheizen (Abbildung 4).
HINWEIS: Die E-Chips können auf bis zu 100 °C erhitzt werden. Wenn für das Experiment eine wässrige Lösung verwendet wird (wie in unserem Fall), vermeiden Sie es, die E-Chips über 90 °C zu erhitzen. Andernfalls kann die flüssige Probe austrocknen. Beim Aufheizen der Flüssigkeit kann die Temperatur vorübergehend über die Solltemperatur ansteigen und dann auf die gewünschte Temperatur zurückfallen. Verwenden Sie eine niedrige Heizrate, um solche Überschreitungen zu minimieren (1 °C / s ist in Ordnung). - Klicken Sie auf Ambient, um zur Umgebungstemperatur (25 °C) zurückzukehren. Klicken Sie auf Stop, um die Heizung abrupt zu stoppen. Klicken Sie auf die Registerkarte Sitzung beenden, um den Heizversuch zu beenden.
7. STEM-Bildgebung des Wachstums von Nanopartikeln
- Verwenden Sie das Mikroskop im STEM-Modus mit dem HAADF-Detektor. Gehen Sie zu einem unberührten Bereich der Probe, in der Nähe einer Ecke des Beobachtungsfensters, wo die Flüssigkeitsdicke minimal ist. Erfassen Sie Videos des Nanopartikelwachstums für verschiedene Temperaturen der Flüssigkeit (Abbildung 5).
HINWEIS: Goldnanopartikel erscheinen sofort und wachsen im gescannten Bereich. Videoaufnahmen mit einer Bildrate von einem Bild pro Sekunde sind ein guter Kompromiss, um die Wachstumsprozesse mit gutem Signal-Rausch-Verhältnis und einer guten Zeitauflösung zu beobachten.
8. STEM-Nanodifferenzation einzelner Nanopartikel
- Erfassen Sie ein STEM-HAADF-Bild mehrerer Nanoobjekte. Erfassen Sie das Beugungsmuster einzelner Nanopartikel, die auf dem Bild ausgewählt wurden, mit der STEMx-Software (Abbildung 6).
HINWEIS: STEM-Nanodifferenzierung ist eine Technik, die es ermöglicht, das Beugungsmuster einzelner Nanopartikel in Flüssigkeit während Wachstumsexperimenten zu erfassen22. - Wählen Sie nach der Aufnahme eines STEM-HAADF-Bildes mehrere Nanoobjekte auf dem Bild aus und die STEMx-Software synchronisiert automatisch die Position der Sonde und der CCD-Kamera, um das Beugungsmuster an jeder Position der Sonde zu erfassen. Um die Überlappung der Beugungspunkte zu vermeiden, verwenden Sie einen kleinen Konvergenzwinkel der STEM-Sonde (7,4 mrad in unserem Fall) unter Verwendung einer kleinen Kondensatoröffnung (in unserem Fall 10 μm).
9. Reinigung des Flüssigkeitszellhalters (nach dem Experiment)
HINWEIS: Hier beschreiben wir ein Standard-Reinigungsverfahren für den Flüssigkeitszellhalter. Wenn diese Reinigung nicht effizient genug ist, ist es möglich, verdünnte Salpetersäure und Methanol zu verwenden, um die eventuellen Nanopartikelaggregate im flüssigen Zellhalter auszuspülen. Die chemische Verträglichkeitsdokumentation des Flüssigzellhalters sollte zuvor konsultiert werden. Beenden Sie die Reinigung in jedem Fall immer mit der Injektion von destilliertem Wasser.
- Entfernen Sie den Deckel. Entfernen Sie die gebrauchten E-Chips. Entfernen Sie die interne Dichtung.
HINWEIS: Die verwendeten E-Chips können in einer angepassten Box aufbewahrt werden. Es ist dann möglich, ex situ TEM- oder REM-Analysen der Nanoobjekte durchzuführen, die nach dem Entsiegeln der Flüssigkeitszelle an den SiN-Fenstern befestigt gebliebensind 15. Es ist nicht ratsam, die E-Chips für ein weiteres In-situ-Experiment wiederzuverwenden, aber es ist immer noch möglich, wenn der SiN-Film beim Entsiegeln der Flüssigkeitszelle nicht gebrochen wurde. Überwucherungsversuche in einem anderen Lösungsmittel können dann durchgeführt werden. 23 - Injizieren Sie 5 ml destilliertes Wasser in den Ein- und Auslassschlauch des Flüssigkeitszellhalters.
- Reinigen Sie die Spitze des Flüssigkeitszellhalters 20 Minuten lang mit einem Ultraschallbad. Die Kontaktunterlage kann in die Badewanne eingetaucht werden. Tauchen Sie nur den Teil ein, der mit dem Deckel bedeckt ist. Tauchen Sie die Entlüftungslöcher nicht in Flüssigkeit.
- Trocknen Sie den Flüssigkeitszellenhalter mit einer Luftpistole aus.
- Setzen Sie die mit den Dummy-Flüssigkeitszellen verwendete Dichtung wieder ein. Setzen Sie die Dummy-Flüssigkeitszellen und den Deckel zurück.
- Lagern Sie den Probenhalter in einer Vakuumstation.
10. Post-Experiment-Analyse mit Fidschi (ImageJ)
HINWEIS: Es wird empfohlen, jeden Frame des aufgenommenen Videos in einzelne Bilder aufzuteilen. Der Zweck dieses Analyseschritts nach dem Experiment besteht darin, die Originalvideos der Nanopartikel in binäre Videos umzuwandeln, die von Fidschi analysiert werden können. Ein Medianfilter wird verwendet, um den Kontrast der Nanopartikel auf dem Hintergrund zu verstärken (Abbildungen 7B & 7E). Dies ist wichtig, um die Binarisierung des Videos zu erleichtern.
- Öffnen Sie das Dateiverzeichnis mit den Bildern des Videos auf Fidschi, indem Sie auf Datei | | importieren Bildsequenz. Das Fenster mit den Sequenzoptionen wird angezeigt. Wählen Sie das entsprechende Startbild aus (wenn der Anfang des Videos verworfen werden soll). Geben Sie die Inkrementnummer für die Bildsequenz ein (sie entspricht der Anzahl der Frames, die der STEM-Scan benötigt, um den unteren Teil des Bildes zu erreichen). Aktivieren Sie das Kontrollkästchen In 8-Bit-Graustufen konvertieren. Speichern Sie die Bildsequenz im TIFF-Format.
- Schneiden Sie alle unerwünschten Artefakte aus dem Video aus (z. B. den Maßstabsbalken oder den Rand des Fensters der Flüssigkeitszelle).
- Klicken Sie auf | Filter | Median, um einen Medianfilter auf alle Bilder anzuwenden. Speichern Sie die verarbeitete Bildsequenz im TIFF-Format.
HINWEIS: Es wird ein Fenster angezeigt, in dem der für den Medianfilter verwendete Radius gefragt wird. Wir haben einen Radius von 2 Pixeln verwendet, aber fühlen Sie sich frei, verschiedene Parameter zu verwenden. In Fidschi sind auch andere Filter verfügbar, die zur Verbesserung der Bildverarbeitung verwendet werden könnten. Insbesondere kann der Subtrahierungsalgorithmus verwendet werden, um die Hintergrundintensität flach zu machen, wenn sie nicht gleichmäßig ist. Klicken Sie dazu auf Prozess | Substract Hintergrund. In unserem Fall entstehen bei diesem Verfahren kleine weiße Flecken im Hintergrund der ersten Bilder, die als falsche Nanopartikel interpretiert werden können. Daher haben wir dieses Verfahren nicht verwendet, aber es sollte an anderen Datensätzen ausprobiert werden, da die zunehmende Flüssigkeitsdicke von der Ecke bis zur Mitte der Flüssigkeitszelle normalerweise eine ungleichmäßige Hintergrundintensität auf LCTEM-Bildern mit geringer Vergrößerung induziert. - Klicken Sie auf Image | | anpassen Schwellenwert. Bewegen Sie sich manuell für eine bessere Genauigkeit der Schwelle der Binarisierung, bis nur noch die Nanopartikel rot gefärbt sind. Drücken Sie die Schaltfläche Übernehmen. Das Fenster Stack in Binärdatei konvertieren wird angezeigt. Deaktivieren Sie Schwellenwert für jedes Bild berechnen. Speichern Sie die binäre Bildsequenz im TIFF-Format (Abbildungen 7C & 7F).
HINWEIS: Es wird empfohlen, zu überprüfen, ob der Schwellenwert für jeden Frame des Videos erfüllt ist. - Führen Sie diesen Schritt nur aus, wenn während des Videos eine Kontrastinversion der Nanopartikel vorliegt. Klicken Sie auf | Binäre | Erweitern. Tun Sie es bei Bedarf noch einmal. Klicken Sie auf | Binäre | Löcher füllen (Abbildung 7G, siehe Diskussionsabschnitt).
- Klicken Sie auf | analysieren Partikel analysieren. Definieren Sie den Größenbereich der analysierten Nanopartikel, die während des Experiments beobachtet wurden. Aktivieren Sie Zusammenfassen.
HINWEIS: Es ist sehr wichtig, zumindest die Mindestgröße der beobachteten Nanopartikel zu definieren. Ohne sie werden die kleinen schwarzen Punkte (Rauschen), die in der binären Bildsequenz erscheinen, als Nanopartikel betrachtet. Wählen Sie als ersten Versuch die Größe der kleinsten Nanopartikel, die vom Auge identifiziert werden, aber dann ist ein Trial-and-Error-Prozess notwendig, um die Wirkung dieses Parameters zu verstehen und die automatisierte Datenanalyse zu optimieren (siehe Diskussionsabschnitt). Klicken Sie vor diesem Schritt auf Analysieren, um die Fläche der Nanopartikel abzurufen, | Legen Sie die Maße fest und aktivieren Sie Die Kontrollkästchen Fläche. Andere Messungen sind verfügbar. - Speichern Sie die Fenster Ergebnisse und Zusammenfassung. Die Anzahl der Nanopartikel für jeden Frame befindet sich im Fenster Zusammenfassungsdaten.
Ergebnisse
Abbildung 5 zeigt zwei STEM HAADF-Bildserien der Gold-Nanopartikelbildung, die über 80 Sekunden bei 25 °C und 85 °C aufgenommen wurden. In all diesen Experimenten wird die Keimbildung und das Wachstum von Nanopartikeln durch die Radiolyse von Wasser angetrieben. Unter den chemischen Spezies, die durch dieses elektronenstrahlinduzierte Phänomen erzeugt werden, können starke Reduktionsmittel (d. H. wässrige Elektronen und Wasserstoffradikale) die Tetrachloraurinsäure reduzieren, was zur Bildung von Goldnanokristall an der Grenzfläche zwischen den SiN-Fenstern und der Flüssigkeit führt. Diese beiden In-situ-Beobachtungen, die mit der gleichen Elektronendosisleistung durchgeführt wurden, bestätigen, dass die vorliegende Methode es ermöglicht, den drastischen Einfluss der Temperatur auf die Bildung von Nanopartikeln in flüssigen Medien zu visualisieren. Bei niedriger Temperatur beobachten wir das Wachstum einer sehr dichten Ansammlung kleiner Nanopartikel, während bei hoher Temperatur einige große und gut facettierte Nanostrukturen erhalten werden. Da der Kontrast von STEM HAADF-Bildern proportional zur Dicke der Goldnanopartikel ist, können wir sehen, dass während dieser Wachstumsexperimente zwei Populationen von Objekten gebildet werden: stark kontrastierte 3D-Nanopartikel und große 2D-Nanostrukturen mit dreieckiger oder sechseckiger Form und einem geringeren Kontrast (dargestellt durch rote Pfeile in Abbildung 5).
Die in diesem Protokoll beschriebene Videoanalysemethode ermöglicht die Quantifizierung der Keimbildungs- und Wachstumsprozesse, indem im Laufe der Zeit die Anzahl der Nanopartikel und ihre durchschnittliche Oberfläche im beobachteten Bereich gemessen werden. Wie in Abbildung 8zu sehen ist, werden bei niedriger Temperatur innerhalb weniger zehn Sekunden nach der Beobachtung mehr als 800 Nanopartikel gebildet, während bei hoher Temperatur nur 30 Nanopartikel gebildet werden. Bis auf zwei dreieckige und sechseckige Nanoplatten sind alle Nanopartikel bereits auf dem allerersten Bild der Hochtemperaturnachbereitung vorhanden. Abbildung 9 zeigt, dass die mittlere Oberfläche von Nanopartikeln bei 85 °C 40-mal schneller zunimmt als bei 25 °C.
Abbildung 6 stellt ein typisches STEM-Bild und das Beugungsmuster von zwei Goldnanopartikeln dar, die direkt auf dem Bild ausgewählt wurden (gekennzeichnet durch rote Pfeile in Abbildung 6A). Hier können wir die gesichtszentrierte kubische (FCC) Struktur von Gold identifizieren, die entlang der Zonenachsen [001] (Abbildung 6B) und [112] (Abbildung 6C) ausgerichtet ist.
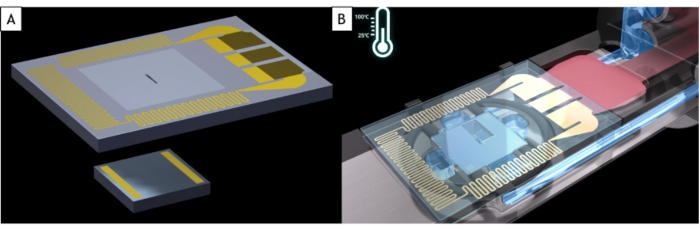
Abbildung 1: Schematische Darstellung der E-Chips und der Spitze des Flüssigkeitszellenhalters. (A) Der große E-Chip mit dem Widerstand, der zum Erwärmen der Flüssigkeitszelle (oben) und des kleinen E-Chips (unten) verwendet wird. (B) Beide E-Chips werden in den Flüssigkeitszellenhalter geladen. Die Elektroden des großen E-Chips stehen in Kontakt mit Elektrodenpads des Flüssigkeitszellhalters. Der Widerstand des großen E-Chips kann die Flüssigkeitszelle erwärmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Optische Mikroskopaufnahmen von E-Chips veranschaulichen: (A) Ein intaktes SiN-Fenster, das für das Experiment notwendig ist. (B) Ein beschädigter Siliziumwafer am Rand des E-Chips. Diese Art von E-Chips kann verwendet werden, wenn sich der beschädigte Bereich außerhalb des nassen Bereichs befindet, sobald die Flüssigkeitszelle versiegelt ist (d. H. Wenn der Schaden außerhalb des durch die O-Ringe definierten Bereichs liegt). (C) Rückstände auf der Oberfläche des E-Chips. Wenn solche Rückstände nach wiederholten Reinigungsvorgängen nicht zurücktreten (siehe Abschnitt 4.1), verwenden Sie den E-Chip nicht. (D bis F) Beschädigte SiN-Fenster (unbrauchbare E-Chips). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Fotos des schrittweisen Prozesses der Beladung der Flüssigkeitszelle in den TEM-Halter. (A) Probenhalter allein. (B) Setzen Sie den Dichtungs-O-Ring in den Hohlraum ein. (C) Setzen Sie den kleinen E-Chip in Dichtungs-O-Ringe ein. (D) Geben Sie einen Tropfen Lösung auf die kleinen E-Chips. (E) Legen Sie den großen E-Chip über den kleinen. (F) Versiegeln Sie die gesamte Flüssigkeitszelle durch Verschrauben des Deckels. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
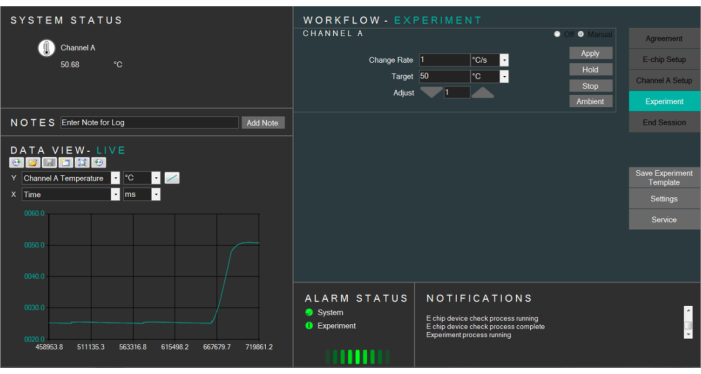
Abbildung 4: Screenshot der Heizsoftware, die die Temperatur der Flüssigkeitszelle steuert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: STEM HAADF-Bildserie mit geringer Vergrößerung des Wachstums von Goldnanopartikeln. a) bei 25 °C. (b) bei 85 °C. Die entsprechende Zeit wird in der unteren linken Ecke jedes Bildes angezeigt. Die 2D-Nanostrukturen sind durch rote Pfeile gekennzeichnet. Alle Bilder werden mit der gleichen Elektronendosisleistung von 3,4Elektronen·s -1·nm-2 aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: STEM-Nanodifferenzation einzelner Nanopartikel. (A) STEM-Bild zur Auswahl der beugenden Nanopartikel (die Positionen der Sonde während der Beugungsaufnahmen werden durch rote Pfeile angezeigt). (B,C) Beugungsmuster der beiden ausgewählten Nanopartikel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Datenverarbeitung und Analyse von STEM HAADF-Bildern mit Fidschi. Die Bilder wurden 40 Sekunden nach Beginn des Wachstums aufgenommen. (A bis C) Bild aufgenommen bei 25 °C. (D bis G) Bild aufgenommen bei 85 °C. (A,D) Raw STEM Bild. (B,E) Verarbeitetes Bild (Medianfilter). (C,F) Binäres Bild. (G) Eine Dilatation der Pixel wird zweimal angewendet und dann der Prozess "Löcher füllen" angewendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
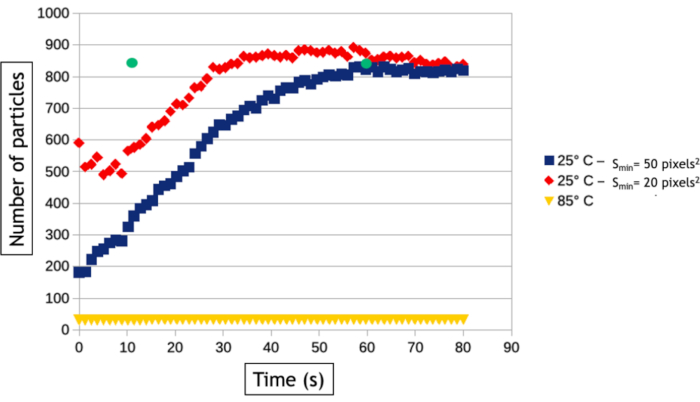
Abbildung 8: Grafik, die die Anzahl der Goldnanopartikel als Funktion der Zeit bei 25 °C und 85 °C darstellt. Die beiden Kurven bei 25°C werden automatisch mit einer minimalen Erfassungsgröße (Smin)von 20 (rot) und 50 (blau) Pixel2gemessen. Die grünen Punkte, die nach 12 und 60 Sekunden der Erfassung gemessen werden, stellen die Anzahl der Nanopartikel dar, die manuell auf dem bei 25 °C aufgenommenen Video gezählt werden.
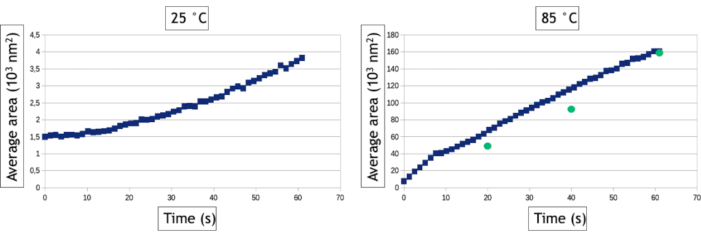
Abbildung 9: Diagramme, die die durchschnittliche Oberfläche von Goldnanopartikeln in Abhängigkeit von der Zeit für 25 °C und 85 °C darstellen. Die grünen Punkte stellen manuelle Messungen der durchschnittlichen Fläche von Nanopartikeln zu bestimmten Zeitpunkten des Videos dar, die bei 85 ° C aufgenommen wurden.

Abbildung 10: STEM HAADF-Bildserie mit hoher Vergrößerung des Wachstums einzelner Gold-Nanowürfel bei 85 °C. Diese Bildserie wurde mit einer Elektronendosisleistung von 83,6Elektronen-s -1.nm-2 aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das beschriebene Protokoll ermöglicht die Nachverfolgung der Keimbildung und des Wachstums von Goldnanopartikeln, die durch Radiolyse in einem temperaturkontrollierten flüssigen Medium angetrieben werden. In Kombination mit der automatisierten Videoverarbeitung ermöglicht es die Messung des Einflusses der Temperatur auf Schlüsselparameter der Nanopartikelsynthese wie Dichte, Größe, Form und atomare Struktur von Nanopartikeln. Diese wertvollen Inputs ermöglichen es, den Einfluss der Temperatur auf die Keimbildungs- und Wachstumsraten zu bewerten, mögliche Phasenübergänge zu erkennen und die Facettenprozesse zu visualisieren, die das Endergebnis kolloidaler Lösungen bestimmen. Zusammen mit der Möglichkeit, die Zusammensetzung der reaktiven Medien zu kontrollieren, ist temperaturgesteuertes Flüssigzell-TEM ein weiterer Schritt zur direkten Beobachtung der Keimbildungs- und Wachstumsprozesse verschiedener Nanostrukturen unter realistischen Synthesebedingungen. Die Interpretation der in diesem Artikel vorgestellten Ergebnisse und deren Vergleich mit Keimbildungs- und Wachstumsmodellen wird an anderer Stelle diskutiert. Hier wollen wir einige methodische Aspekte hervorheben, die berücksichtigt werden müssen, um relevante In-situ-TEM-Experimente durchzuführen.
Zunächst ist es entscheidend, die Elektronenstrahleffekte in den Reaktionsmedien zu identifizieren, da sie die Ergebnisse des Experiments drastisch beeinflussen können. Da die Wasserradiolyse die treibende Kraft der Nanopartikelbildung ist, steigt die Wachstumsgeschwindigkeit mit der Elektronendosisleistung schnell an, was sich auf die endgültige Form von Nanoobjektenauswirkt 11,15. Um die Auswirkungen der Temperatur auf die Keimbildung und das Wachstum von Nanopartikeln zu untersuchen, ist es daher notwendig, Wachstumsexperimente zu vergleichen, die mit der gleichen Elektronendosisleistung erworben wurden. Im STEM-Modus entspricht die Elektronendosisleistung dem Strahlstrom (in Elektron pro Sekunde) geteilt durch die Bildgröße (in nm2). Daher bedeutet eine konstante Elektronendosisleistung, dass der gleiche Strahlstrom (d. H. Gleiche Kondensatoröffnung und gleiche Spotgröße) und die gleiche Vergrößerung für jedes Experiment beibehalten wird. Die Quantifizierung des Strahlstroms der Bildgebungsbedingungen mit einer CCD-Kamera oder einem Faraday-Becher ist wichtig, um die Daten zu interpretieren und zu reproduzieren. Die Vergrößerung und die resultierende Dosisleistung sollten danach gewählt werden, ob man das Wachstum einer großen Ansammlung von Nanopartikeln visualisieren möchte, um statistisch relevante Ergebnisse zur Wachstumskinetik (Abbildung 5) oder die Wachstumsmechanismen auf der Einzelnanopartikelskala zu extrahieren, um die bevorzugten Adsorptionsstellen auf den Nanopartikeloberflächen zu identifizieren (Abbildung 10). Wenn die Keimbildungs- und Wachstumsprozesse zu schnell sind, insbesondere bei hoher Vergrößerung, sollten eine kleine Kondensatoröffnung und eine kleine Spotgröße gewählt werden, um die Dosisleistung zu minimieren. Die Keimbildung und das Wachstum von Nanopartikeln können sich auch verlangsamen, indem die Konzentration des Metallvorläufers in der analysierten Lösung reduziert wird, beachten Sie jedoch, dass die Konzentration von radiolytischen Produkten mit der Temperatur zunimmt. Generell ist es auch wichtig, die Elektronenbestrahlungsgeschichte der gesamten Probe zu berücksichtigen. Werden hier beispielsweise schnell mehrere Wachstumsexperimente in nahe beieinander liegenden Gebieten durchgeführt, nimmt die Dichte der Nanopartikel mit der Zeit ab, da die Konzentration der Goldvorläufer im untersuchten Gebiet abnimmt. Dieser Effekt kann minimiert werden, indem die Wachstumsexperimente sowohl in Raum als auch in Zeit getrennt werden und indem der Flüssigkeitshalter im Strömungsmodus verwendet wird.
Interface-Tracking-Algorithmen sind äußerst hilfreich, um die Analyse von Videos zu automatisieren und quantitative Ergebnisse über die Keimbildung und das Wachstum großer Nanopartikel-Baugruppen zu extrahieren. Es ist jedoch erwähnenswert, dass der Bildbinarisierungsschritt immer datenspezifisch ist, was bedeutet, dass die Filter und die Datenverarbeitung, die auf Bilder angewendet werden müssen, um die Detektion der Nanopartikel/Flüssigkeits-Schnittstelle zu optimieren, von Experiment zu Experiment variieren. Darüber hinaus ist es wichtig, die Ergebnisse dieser automatisierten Analysen mit manuellen Messungen an einigen wenigen Bildern zu vergleichen, um den Bildverarbeitungsworkflow zu optimieren und seine Grenzen zu kennen. Hier induzieren beispielsweise mehrere Streuereignisse in den bei hoher Temperatur gebildeten immer dicker werdenden 3D-Nanopartikeln nach 30 Sekunden Beobachtung eine Kontrastinversion ihres Kerns, da die Winkelverbreiterung der gestreuten Elektronen zu einer Abnahme des gesammelten Signals im Winkelbereich des ringförmigen Detektors führt. Um die wahre Oberfläche dieser Nanopartikel weiter zu messen, haben wir nach der Binarisierung des Bildes einen "Fill Holes" -Datenprozess verwendet, der den inneren Kreis der Ringformkontraste ausfüllt (Abbildung 7F, G). Wir mussten jedoch eine kleine Dilatation der Objekte verwenden, um sicherzustellen, dass diese Ringformkontraste immer vollständig miteinander verbunden sind. Letzterer Schritt führt zu einer leichten Überbewertung der mittleren Oberfläche von Nanopartikeln bei den automatisierten Messungen (Abbildung 9). In ähnlicher Weise müssen wir für den Nachweis von Nanopartikeln eine minimale Größe der detektierten Objekte (Smim)definieren, um die Erkennung des Rauschens zu vermeiden, aber dieser Parameter beeinflusst die gemessene Keimbildungsrate. Wie in Abbildung 8zu sehen ist, steigt die Anzahl der nachgewiesenen Nanopartikel zu Beginn des Experiments an, um ein Plateau zu erreichen. Wenn Smin groß ist (50 Pixel2 entsprechend 1543 nm2),wurden automatische und manuelle Messungen auf der Ebene dieses Plateaus vereinbart (835 Nanopartikel nach 60 Sekunden), aber der Nachweis von Nanopartikeln verzögert sich in der automatischen Analyse, da 835 Nanopartikel nach nur 12 s manuell gezählt, aber erst später automatisch detektiert werden. Diese verlängerte Nachweiszeit führt zu einer Unterbewertung der Keimbildungsrate. Die Reduzierung von Smin auf 20 Pixel2 (d.h. 617 nm2)reduziert den Fehler auf der Keimbildungszeit der Nanopartikelanordnung, führt aber insbesondere im Frühstadium der Experimente zu einer Überbewertung der Nanopartikeldichte (Abbildung 8), was sich auch auf die Keimbildungsrate auswirkt. Die Detektion und die Größen- und Formmessungen von Nanoobjekten mit einem sehr dynamischen Verhalten und einem niedrigen Signal-Rausch-Verhältnis ist eine häufige Herausforderung im Flüssigphasen-TEM, die mit anderen Segmentierungs- und Rauschunterdrückungsmethoden24 oder maschinellen Lernansätzen25weiter verbessert werden kann.
Nicht zuletzt muss die Vorbereitung der Flüssigkeitszelle und die Reinigung des Flüssigkeitshalters sehr sorgfältig durchgeführt werden, um Verunreinigungen der Reaktionsmedien zu vermeiden.
Im Allgemeinen bietet die Kontrolle der Temperatur der Probe während der LCTEM-Analysen die Möglichkeit, thermische Auswirkungen auf chemische Reaktionen zu untersuchen, die an der Grenzfläche zwischen Feststoffen und Flüssigkeiten auftreten. Daher hoffen wir, dass die vorliegende Methode den Weg zu anderen In-situ-TEM-Experimenten ebnet, die die Dynamik von harten, weichen oder biologischen Materialien in temperaturkontrollierten flüssigen Medien aufdecken sollen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken der Region Ile-de-France (Konvention SESAME E1845 für das an der Universität Paris installierte Elektronenmikroskop JEOL ARM 200 F), des Labex SEAM (GLOIRE Project) und des CNRS (Defi Nano Program). Wir danken Madeline Dukes und Daniel Franck für die Weitergabe der Schaltpläne und der optischen Bilder der Flüssigkeitszellen in den Abbildungen 1 und 2.
Materialien
| Name | Company | Catalog Number | Comments |
| 2100 Plus electron microscope | Jeol | ||
| Acetone | Merck | ||
| Air pistol | |||
| ARM 200F electron microscope | Jeol | ||
| Binoculars or optical microscope | |||
| Carbon tipped tweezers | |||
| Computer with heating software | Software by Protochips | ||
| Distlilled water | |||
| Dummy e-chips | Protochips | ||
| Gasket/O-rings | Protochips | ||
| Gold aqueous solution | Merck | 1 mM of HAuCl4 - Prepared beforehand | |
| Large liquid heating E-chip | Protochips | ||
| Methanol | Merck | ||
| One View camera | Gatan | ||
| Petri dish | Number : 2 | ||
| Plasma cleaner | Gatan | ||
| Poseidon Select | Protochips | Liquid cell holder | |
| Power supply Keithley 2450 | |||
| Protective gloves | |||
| Red PEEK tubing | Number : 3 | ||
| Screwdriver with torque | |||
| Small liquid E-chip | Protochips | 150 nm spacers | |
| STEM HAADF detector | Jeol | ||
| STEMx software | Gatan | ||
| Syringe | Number : 2 | ||
| Syringe pump | Harvard apparatus | Number : 2 | |
| Vacuum pump | Gatan |
Referenzen
- Willets, K. A., Van Duyne, R. P. Localized surface plasmon resonance spectroscopy and sensing. Annual Review of Physical Chemistry. 58 (1), 267-297 (2007).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chemical Society Review. 41, 2740-2779 (2012).
- You, H., Yang, S., Ding, B., Yang, H. Synthesis of colloidal metal and metal alloy nanoparticles for electrochemical energy applications. Chemical Society Review. 42, 2880-2904 (2013).
- Nikoobakht, B., El-Sayed, M. A. Preparation and growth mechanism of gold nanorods using seed-mediated growth method. Chemistry of Materials. 15, 1957-1962 (2003).
- Hubert, F., Testard, F., Spalla, O. Cetyltrimethylammonium bromid silver bromide complex as the capping agent of gold nanorods. Langmuir. 24, 9219-9222 (2008).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie International Edition. 48, 60-103 (2009).
- Zheng, Y., Zeng, J., Ruditskiy, A., Liu, M., Xia, Y. Oxidative etching and its role in manipulating the nucleation and growth of noble-metal nanocrystals. Chemistry of Materials. 26, 22-33 (2014).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12 (3), 1470-1474 (2012).
- Wu, J., et al. Growth of Auau on Pt icosahedral nanoparticles revealed by low-dose in situ TEM. Nano letters. 15, 2711-2715 (2015).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Exploring the formation of symmetric gold nanostars by liquid-cell transmission electron microscopy. Nano letters. 17, 4194-4201 (2017).
- Woehl, T. J., Evans, J. E., Arslan, I., Ristenpart, W. D., Browning, N. D. Direct in situ determination of the mechanisms controlling nanoparticle nucleation and growth. ACS Nano. 6, 8599-8610 (2012).
- Tan, S. F., et al. Intermediate structures of pt-ni nanoparticles during selective chemical and electrochemical etching. The Journal of Physical Chemistry Letters. 10, 6090-6096 (2019).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12, 1470-1474 (2012).
- Aliyah, K., et al. Real-time in situ observations reveal a double role for ascorbic acid in the anisotropic growth of silver on gold. The Journal of Physical Chemistry Letters. 11 (8), 2830-2837 (2020).
- Alloyeau, D., et al. Unravelling kinetic and thermodynamic effects on the growth of gold nanoplates by liquid transmission microscopy. Nano Letters. 15 (4), 2574-2581 (2015).
- Gao, W., et al. Direct in situ observation and analysis of the formation of palladium nanocrystals with high-index facets. Nano Letters. 18 (11), 7004-7013 (2018).
- Liao, H. -. G., et al. Facet development during platinum nanocube growth. Science. 345, 916-919 (2014).
- Tan, S. F., et al. Real-time imaging of the formation of Au-Ag core-shell nanoparticles. Journal of the American Chemical Society. 138 (16), 5190-5193 (2016).
- Khelfa, A. Selective shortening of gold nanorods: when surface functionalization dictates the reactivity of nanostructures. Nanoscale. 12, 22658-22667 (2020).
- Schneider, N. M., et al. Electron-water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118, 22373-22382 (2014).
- Ahmad, N., Le Bouar, Y., Ricolleau, C., Alloyeau, D. Growth of dendritic nanostructures by liquid-cell transmission electron microscopy: a reflection of the electron-irradiation history. Advanced Structural and Chemical Imaging. 2, 9 (2016).
- Khelfa, A., et al. Structural analysis of single nanoparticles in liquid by low-dose STEM nanodiffraction. Micron. 116, 30-35 (2019).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Driving Reversible Redox Reactions at Solid/Liquid Interfaces with the Electron Beam of a Transmission Electron Microscope. Journal of Microscopy. 269, 127-133 (2018).
- Schneider, N. M., Park, J. H., Norton, M. M., Ross, F. M., Bau, H. H. Automated analysis of evolving interfaces during in situ electron microscopy. Advanced Structural and Chemical Imaging. 2, (2016).
- Yao, L., Ou, Z., Luo, B., Xu, C., Chen, Q. Machine learning to reaveal nanoparticle dynamics from liquid-phase TEM videos. ACS Central Science. 6, 1421-1430 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten