Method Article
Studiare gli effetti della temperatura sulla nucleazione e la crescita delle nanoparticelle mediante microscopia elettronica a trasmissione a celle liquide
In questo articolo
Riepilogo
Il controllo della temperatura durante gli esperimenti di microscopia elettronica in fase liquida apre nuove prospettive di studio della dinamica delle nanoparticelle in ambienti liquidi imitandone la formazione o i mezzi applicativi. Utilizzando celle liquide riscaldanti di recente sviluppo, abbiamo osservato direttamente l'influenza della temperatura sui processi di nucleazione e crescita delle nanoparticelle d'oro nell'acqua.
Abstract
Il controllo della temperatura è uno sviluppo recente che fornisce un ulteriore grado di libertà di studio della nanochimica mediante microscopia elettronica a trasmissione a celle liquide. In questo articolo, descriviamo come preparare un esperimento di riscaldamento in situ per studiare l'effetto della temperatura sulla formazione di nanoparticelle d'oro guidate dalla radiolisi in acqua. Il protocollo dell'esperimento è abbastanza semplice che coinvolge una speciale cella liquida con capacità di riscaldamento uniformi fino a 100 °C, un supporto TEM a celle liquide con capacità di flusso e un'interfaccia integrata per il controllo della temperatura. Mostriamo che i meccanismi di nucleazione e crescita delle nanoparticelle d'oro sono drasticamente influenzati dalla temperatura nelle cellule liquide. Utilizzando l'imaging STEM e la nanodiffrazione, l'evoluzione della densità, delle dimensioni, della forma e della struttura atomica delle nanoparticelle in crescita viene rivelata in tempo reale. Gli algoritmi di elaborazione automatizzata delle immagini vengono sfruttati per estrarre dati quantitativi utili da sequenze video, come la nucleazione e i tassi di crescita delle nanoparticelle. Questo approccio fornisce nuovi input per comprendere i complessi processi fisico-chimici in gioco durante la sintesi in fase liquida dei nanomateriali.
Introduzione
Le nanoparticelle metalliche (NP) hanno proprietà fisico-chimiche promettenti che possono essere utilizzate in vari settori come il rilevamentoottico 1,lamedicina 2 o l'energia3. La sintesi chimico-umida è un metodo molto versatile per fabbricare NP metallici con dimensioni e forma ben definite. Negli ultimi decenni, sono state sviluppate molte strategie per ottenere il controllo sulla sintesi dei PNP: crescita mediata dal seme4,metodo di bloccofacciale 5,sintesi controllata cineticamente6,incisione selettiva7 o sintesi a temperaturacontrollata 8. Tuttavia, mentre le reazioni chimiche che guidano la sintesi sono abbastanza semplici, i meccanismi di nucleazione e crescita non lo sono, perché molti parametri svolgono un ruolo nei processi di formazione e la loro influenza individuale è difficile da recuperare dalle istantanee ex situ dei nanomateriali risultanti estratti dal loro mezzo di formazione in dati punti di tempo della sintesi. Per comprendere veramente i processi di nucleazione e crescita e stabilire modi per controllarli, dobbiamo impiegare strumenti in situ che consentano la loro osservazione in tempo reale in un ambiente liquido finemente controllato.
A questo proposito, la microscopia elettronica a trasmissione a celle liquide (LCTEM) è stato un metodo molto potente per gettare nuova luce sulla sintesi delle nanoparticelle metalliche9,10,11,12,13. Imaging della dinamica delle singole nanostrutture direttamente nei loro mezzi di formazione di liquidi, questa tecnica ha fornito una comprensione più profonda dei meccanismi di nucleazione e crescita, in particolare il ruolo dei difetti cristallini, della morfologia dei semi e dei ligandi organici che consentono di guidare processi di crescita direzionale o incisione e ottenere nanomateriali con forme specifiche (nanorodi, nanostelle, nanopiastrine, nanogusci)10,11,12,13,14,15,16,17,18,19. Quando il fascio di elettroni di un TEM interagisce con i liquidi, i processi di radiolisi producono forti specie riducenti e ossidanti che modificano la chimica della soluzione nell'area irradiata e possono essere utilizzati per guidare i processi di crescita o incisione. È interessante notare che la concentrazione di prodotti radiolitici è nota per aumentare con l'intensità di dose elettronica, un parametro che può essere finemente sintonizzato in un microscopioelettronico 20. Pertanto, questa dipendenza da dose-intensità di radiolisi è stata sfruttata per controllare la velocità di reazione e rivelare effetti cinetici sui processi di formazione e sulla morfologia finale delle nanostrutture11,15,20.
Sebbene la temperatura sia un parametro cruciale nella sintesi dei nanomateriali, i suoi effetti non sono stati finora attentamente studiati da LCTEM, perché le celle liquide commerciali con un controllo affidabile della temperatura sono state sviluppate solo di recente. Tuttavia, tali studi in situ sono indispensabili per svelare la cinetica complessa e gli effetti termodinamici inducono da variazioni di temperatura. Infatti, da un lato l'aumento della temperatura ha impatti drastici sui processi di sfaccettature durante la crescita, accelera la diffusione atomica e molecolare nel liquido e modifica i tassi di reazione. D'altra parte, il diagramma nanofase delle nanostrutture è anche molto sensibile alla temperatura. In questo articolo, sfruttiamo le celle liquide riscaldanti recentemente sviluppate per seguire la crescita radiolitica delle nanoparticelle d'oro in acqua con un controllo della temperatura tra la temperatura ambiente e i 100 °C. Questa metodologia che combina l'imaging STEM e la diffrazione in un ambiente sempre più vicino alle condizioni di sintesi reali riduce il divario tra osservazioni TEM in situ e sintesi su scala da banco.
Protocollo
1. Allineare il microscopio elettronico a trasmissione per l'imaging STEM HAADF
- Seguire le istruzioni del produttore per l'allineamento del microscopio.
- Utilizzare un campione essiccato convenzionale per allineare il microscopio. Non utilizzare un campione liquido.
- Per ridurre al minimo la velocità di crescita, ridurre al minimo l'intensità di dose elettronica (vedi sezione di discussione) che implica l'uso di una piccola apertura del condensatore e di piccole dimensioni dello spot per ridurre la corrente del fascio.
2. Gestione e-chip
NOTA: I porta liquidi commerciali si adattano a quasi tutti i TEM ma utilizzano il supporto specificamente progettato per il marchio del microscopio e il pezzo del palo. Una cella liquida è composta da due chip di silicio a base mems chiamati E-chips, entrambi substrati di silicio con una finestra di 500 x 50 μm coperta da un film di nitruro di silicio amorfo (SiN) spesso 50 nm che è trasparente elettronicamente (Figura 1A). Questi due e-chip hanno dimensioni diverse. Quello piccolo è 2 x 2 mm con distanziale in oro che fissano la distanza tra i due E-chip (150 nm qui) e lo spessore del liquido. Quello grande è di 4 x 6 mm e ha una resistenza incorporata all'interno del substrato di silicio che consente un riscaldamento uniforme del campione liquido(Figura 1B). A causa del modo in cui sono fabbricati in camere pulite, gli E-chips hanno due lati diversi: uno in cui la finestra sembra piccola (qui dopo chiamato il lato anteriore) e l'altro dove la finestra è grande con una forma a lavandino (qui dopo aver chiamato il lato posteriore).
- Quando si maneggiano gli E-chip, non toccare mai la finestra con una pinzetta e afferrare i trucioli ai lati. Per evitare di graffiare la superficie del substrato di silicio utilizzare pinzette con punta di carbonio.
- Se si posiziona un chip E su una superficie, assicurarsi che il lato posteriore sia a contatto con la superficie perché la pellicola SiN è fragile e si deposita sul lato anteriore.
3. Pulizia del supporto per celle liquide (prima dell'esperimento)
- Rimuovere il coperchio che copre la punta del supporto. Rimuovere le celle liquide fittizie usando una pinzetta. Rimuovere la guarnizione utilizzata con le celle liquide fittizie.
NOTA: Le cellule liquide fittizie sono celle liquide senza la finestra SiN e solo silicio. Vengono utilizzati per conservare il supporto a celle liquide nella pompa per vuoto. Prestare attenzione allo stato delle viti in ottone perché si sbriciolano facilmente nel tempo. In particolare, se le testine sono danneggiate, le viti devono essere cambiate. Altrimenti, potrebbe essere difficile svitarli dopo l'esperimento e piccoli detriti possono anche interrompere il caricamento del campione. - Iniettare manualmente 2 ml di acqua distillata all'interno del supporto utilizzando siringhe e i tubi PEEK esterni per collegarsi alla parte posteriore del supporto.
NOTA: Ci sono 3 tunnel microfluidici all'interno del supporto. Tutti e tre devono essere ripuliti con acqua. Prestare attenzione all'acqua che esce di fronte al supporto: se l'acqua è colorata a causa di un esperimento precedente, continuare a mettere l'acqua all'interno del supporto fino a quando il liquido non è colorato. - Se si inietta una soluzione nella cella liquida durante l'esperimento (1 mM di HAuCl4 in acqua nel nostro caso), riempire il tubo del portacampioni con questa soluzione.
- Asciugare la punta del supporto a celle liquide usando una pistola ad aria compressa.
4. Preparazione della cella liquida (E-chips)
- Pulizia delle celle liquide.
- Riempire una piastra di Petri di vetro con acetone.
- Riempire una piastra di Petri di vetro con metanolo.
ATTENZIONE: A causa della tossicità del metanolo, la piastra di Petri con metanolo deve essere messa sotto una cappa aspirante. Il metanolo deve essere maneggiato con l'attrezzatura protettiva adeguata (guanti). - Mettere un piccolo e uno grande E-chip nella piastra di Petri con acetone e attendere 2 minuti.
NOTA: Gli E-chip sono rivestiti con uno strato protettivo che deve essere rimosso prima dell'esperimento. Acetone rimuoverà il fotoresist e ripulirà gli E-chips di detriti. Per migliorare la pulizia, la soluzione può essere delicatamente agitata. - Mettere entrambi gli E-chips nella piastra di Petri con metanolo e attendere 2 minuti. Il metanolo pulirà gli E-chips dall'acetone e dal resto dei detriti.
ATTENZIONE: Il trasferimento degli E-chips tra l'acetone e il metanolo deve essere effettuato il più velocemente possibile per non lasciare asciugare gli E-chips nell'aria. - Asciugare le celle liquide usando una pistola ad aria compressa. Tenere l'E-chip usando una pinzetta mentre si utilizza la pistola ad aria compressa. Fare attenzione a non premere troppo sul grilletto della pistola ad aria compressa altrimenti l'E-chip può uscire dalle pinzette. Se cadono, riavviare la pulizia con acetone e metanolo.
- Verificare l'integrità della finestra del nitruro di silicio utilizzando una lente d'ingrandimento binoculare o un microscopio ottico (Figura 2).
NOTA: Assicurarsi che le finestre di entrambi gli E-chip siano pulite e non rotte. Se gli E-chips non sembrano puliti, prova a rimetterli in acetone e metanolo di nuovo. Se lo sporco è ancora sulla finestra o se la finestra è rotta, gli E-chip devono essere cambiati con quelli nuovi. - Il plasma pulisce gli E-chips con una miscela di argon e gas ossigeno per 2 minuti. La pulizia al plasma degli E-chips consente loro di essere idrofili. Ecco i dettagli della pulizia del plasma impostata: flusso di gas argon = 35 sccm, flusso di gas ossigeno = 11,5 sccm, timeout del flusso di gas = 20 s, obiettivo RF in avanti = 50 W, intervallo RF avanti = 5 W, RF massima riflessa = 5 W.
- Caricamento delle celle liquide nel supporto TEM(figura 3).
- Caricare gli O-ring della guarnizione all'interno del supporto della cella liquida( Figura 3B). Verificare che la guarnizione utilizzata sia pulita. In caso di no, pulirlo rapidamente con acqua distillata. Asciugarlo utilizzando una carta da filtro pulita. Per rimuovere detriti e fibre sulla guarnizione, premerlo più volte tra due fogli di parafilm.
- Mettere il piccolo chip elettronico all'interno del supporto a celle liquide( Figura 3C). Per ridurre l'inchino delle pellicole SiN verso il vuoto del microscopio, posizionare le finestre della cella liquida in una configurazione incrociata. Pertanto, la finestra del piccolo chip elettronico deve essere parallela alla lunghezza del supporto e alla faccia anteriore verso l'alto. Assicurarsi che il piccolo chip elettronico sia ben inserito all'interno della guarnizione.
- Preparare il campione liquido (qui, 1 mM di HAuCl4 in acqua).
- Eliminare ≈ 2 μL del campione liquido sul piccolo chip elettronico utilizzando una micropipetta (Figura 3D). Se il piccolo chip elettronico è stato correttamente pulito al plasma, il campione di liquido acquoso si diffonderà uniformemente sulla superficie del chip.
- Rimuovere il liquido extra con una carta da filtro. Con un pezzo di carta da filtro tagliato bruscamente, ridurre lo spessore dello strato liquido sul piccolo E-chip fino a 30 formei.
- Mettere il grande chip elettronico all'interno del supporto per celle liquide (Figura 3E). Posizionare il grande E-chip su quello piccolo con la faccia anteriore verso il basso (i lati anteriori dei due chip devono affrontarsi). Gli elettrodi sul grande chip elettronico devono essere a contatto con il pad dell'elettrodo sul supporto.
- Far scorrere di nuovo il coperchio sul supporto della cella liquida. Stringere gradualmente ogni vite(Figura 3F).
- Asciugare l'eventuale liquido che esce dai chip elettronici utilizzando una piccola carta da filtro ritagliata. Verificare che non vi sia liquido che esce su entrambi i lati delle celle liquide ruotando il supporto della cella liquida attorno al suo asse.
- Testare la sigillatura sottovuoto della cella liquida in una stazione di pompaggio. Se il livello di vuoto della pompa raggiunge 5 x 10-2 Pa, continuare il protocollo. In caso meno, controllare l'integrità della finestra (molto probabilmente è rotto) e avviare il protocollo dall'inizio con un nuovo set di E-chip.
- Verificare un'ultima volta l'integrità della finestra del nitruro di silicio utilizzando una lente d'ingrandimento binoculare o un microscopio ottico. A volte, la cella liquida sarà in grado di sostenere il vuoto della stazione di pompaggio anche se la finestra è rotta. Questo perché quando la finestra si rompe e il liquido si riversa, può formare aggregati di sale sulla parte rotta della finestra coprendo così il foro. Se succede, prepara un nuovo set di E-chip.
- Caricare il supporto della cella liquida nel TEM e controllare il livello di vuoto. Anche se la cella liquida ha sostenuto il vuoto della stazione di pompaggio e non vi è alcun problema visibile con la finestra, la micro-perdita della cella liquida può impedire di raggiungere il livello di vuoto necessario per far funzionare il TEM. Se il microscopio non è in grado di raggiungere il livello di vuoto richiesto per funzionare (2-5 x 10-5 Pa), rimuovere il portacampioni e preparare un nuovo set di chip elettronici.
5. Utilizzare il supporto liquido in modalità flusso
- Riempire 2 siringhe con alcuni millilitri della soluzione da iniettare (1 mM di HAuCl4 in acqua nel nostro caso).
- Collegare 2 tubi PEEK esterni alle siringhe. Posizionare le 2 siringhe sulle pompe della siringa. Inserire i tubi PEEK esterni nelle 2 voci del supporto a celle liquide. Inserire un ulteriore tubo PEEK esterno per l'uscita del supporto a celle liquide.
- Iniettare la soluzione con una portata di 5 μL/min in ogni ingresso.
6. Riscaldamento dell'ambiente liquido
- Collegare l'alimentatore al supporto. Collegare l'alimentatore al computer in cui è installato il software di riscaldamento.
- Alimentare il computer e aprire il software di riscaldamento. Alimentare l'alimentatore.
- Clicca sul pulsante di controllo del dispositivo. Se il software indica "passato", l'esperimento può continuare. In caso contrario, il grande chip elettronico potrebbe avere un problema (caricamento errato dell'E-chip, elettrodi rotti ...).
- Fare clic sulla scheda Esperimento. Clicca su Manuale per attivare la modalità manuale di riscaldamento.
- Selezionare la temperatura di destinazione e modificare di conseguenza la velocità di temperatura. Premere per riscaldare gli E-chip alla temperatura di destinazione (Figura 4).
NOTA: Gli E-chips possono essere riscaldati fino a 100 °C. Se per l'esperimento viene utilizzata una soluzione acquosa (come nel nostro caso), evitare di riscaldare gli E-chip superiori a 90 °C. Altrimenti, il campione liquido può asciugarsi. Quando si riscalda il liquido, la temperatura può temporaneamente salire al di sopra della temperatura mirata e quindi tornare alla temperatura desiderata. Utilizzare una bassa velocità di riscaldamento per ridurre al minimo tali sarti (1 °C/s va bene). - Clicca su Ambiente per tornare alla temperatura ambiente (25 °C). Clicca su Interrompi per interrompere bruscamente il riscaldamento. Fare clic sulla scheda Termina sessione per terminare l'esperimento di riscaldamento.
7. Imaging STEM della crescita delle nanoparticelle
- Utilizzare il microscopio in modalità STEM utilizzando il rilevatore HAADF. Vai in un'area incontaminata del campione, vicino a un angolo della finestra di osservazione in cui lo spessore del liquido è minimo. Acquisire video di crescita di nanoparticelle per diverse temperature del liquido (Figura 5).
NOTA: Le nanoparticelle d'oro appaiono immediatamente e crescono nell'area scansionata. La registrazione video con una frequenza fotogrammi di un'immagine al secondo è un buon compromesso per osservare i processi di crescita con un buon rapporto segnale/rumore e una buona risoluzione del tempo.
8. Nanodiffrazione STEM di singole nanoparticelle
- Acquisire un'immagine STEM HAADF di diversi nano-oggetti. Acquisire il modello di diffrazione delle singole nanoparticelle selezionate sull'immagine utilizzando il software STEMx (Figura 6).
NOTA: La nanodiffrazione STEM è una tecnica che consente di acquisire il modello di diffrazione di singole nanoparticelle in liquido durante gli esperimenti di crescita22. - Dopo l'acquisizione di un'immagine STEM HAADF, selezionare diversi nano-oggetti sull'immagine e il software STEMx sincronizza automaticamente la posizione della sonda e della telecamera CCD per acquisire il modello di diffrazione in ogni posizione della sonda. Per evitare la sovrapposizione delle macchie di diffrazione, utilizzare un piccolo angolo di convergenza della sonda STEM (7,4 mrad nel nostro caso) utilizzando una piccola apertura del condensatore (10 μm nel nostro caso).
9. Pulizia del supporto per celle liquide (dopo l'esperimento)
NOTA: Qui descriviamo una procedura di pulizia standard per il supporto a celle liquide. Se questa pulizia non è abbastanza efficiente, è possibile utilizzare acido nitrico diluito e metanolo per eliminare gli eventuali aggregati di nanoparticelle nel supporto della cella liquida. La documentazione relativa alla compatibilità chimica del detentore di celle liquide deve essere consultata in precedenza. In ogni caso, terminare sempre la pulizia con l'iniezione di acqua distillata.
- Rimuovere il coperchio. Rimuovere gli E-chip usati. Rimuovere la guarnizione interna.
NOTA: gli E-chip usati possono essere conservati in una scatola adattata. È quindi possibile eseguire analisi ex situ TEM o SEM dei nano-oggetti che sono rimasti attaccati alle finestre sin dopo aver sigillato la cella liquida15. Non è consigliabile riutilizzare gli E-chip per un altro esperimento in situ, ma è ancora possibile se la pellicola SiN non è stata rotta durante lo srotolamento della cella liquida. È quindi possibile eseguire esperimenti di crescita troppo in un solvente diverso. 23 di cui 23 - Iniettare 5 mL di acqua distillata nel tubo di ingresso e di uscita del supporto per celle liquide.
- Pulire la punta del supporto della cella liquida utilizzando un bagno ad ultrasuoni per 20 minuti. Il contact pad può essere immerso nella vasca da bagno. Immergere solo la parte coperta con il coperchio. Non immergere i fori di sfiato nel liquido.
- Asciugare il supporto della cella liquida usando una pistola ad aria compressa.
- Rimettere la guarnizione utilizzata con le celle liquide fittizie. Rimettere le cellule liquide fittizie e il coperchio.
- Conservare il portacampioni in una stazione di vuoto.
10. Analisi post-esperimento utilizzando Fiji (ImageJ)
NOTA: Si consiglia di dividere ogni fotogramma del video ripreso in singole immagini. Lo scopo di questo passaggio di analisi post-esperimento è quello di trasformare i video originali delle nanoparticelle in video binari che possono essere analizzati dalle Fiji. Un filtro mediano viene utilizzato per migliorare il contrasto delle nanoparticelle sullo sfondo (Figure 7B & 7E). Questo è essenziale per facilitare la binarizzazione del video.
- Aprire la directory dei file contenente le immagini del video sulle Fiji cliccando su File | Importa | Sequenza di immagini. Verrà visualizzata la finestra delle opzioni di sequenza. Selezionare l'immagine iniziale appropriata (se l'inizio del video deve essere scartato). Immettere il numero di incremento per la sequenza di immagini (corrisponde al numero di fotogrammi necessario affinché la scansione STEM raggiunga la parte inferiore dell'immagine). Selezionare la casella converti in scala di grigi a 8 bit. Salvare la sequenza di immagini in formato tiff.
- Ritaglia tutti gli artefatti indesiderati del video (ad esempio la barra di scala o il bordo della finestra della cella liquida).
- Clicca su Processo | Filtri | Mediana per applicare un filtro mediano su tutte le immagini. Salvare la sequenza di immagini elaborate in formato tiff.
NOTA: verrà visualizzata una finestra che chiede il raggio utilizzato per il filtro mediano. Abbiamo usato un raggio di 2 pixel ma non sentiti libero di usare parametri diversi. Altri filtri sono disponibili anche nelle Fiji che potrebbero essere utilizzati per migliorare l'elaborazione delle immagini. In particolare, l'algoritmo di sottrazione di sfondo può essere utilizzato per rendere piatta l'intensità dello sfondo se non è uniforme. Per questo, clicca su Processo | Sfondo sottostrato. Nel nostro caso, questo processo crea piccole macchie bianche sullo sfondo delle prime immagini che possono essere interpretate come false nanoparticelle. Pertanto, non abbiamo usato questo processo, ma dovrebbe essere provato su altri set di dati, perché l'aumento dello spessore del liquido dall'angolo al centro della cella liquida di solito induce un'intensità di fondo non uniforme su immagini LCTEM a basso ingrandimento. - Clicca su Immagine | Regola | Soglia. Muoversi manualmente per una migliore precisione della soglia della binarizzazione fino a quando solo le nanoparticelle sono colorate di rosso. Premere il pulsante Applica. Verrà visualizzata la finestra Converti stack in binario. Deselezionare Calcola soglia per ogni immagine. Salvare la sequenza di immagini binarie in formato tiff( Figure 7C & 7F).
NOTA: Si consiglia di verificare se la soglia è soddisfacente su ogni fotogramma del video. - Eseguire questo passaggio solo se c'è un'inversione di contrasto delle nanoparticelle durante il video. Clicca su Processo | Binario | Dilata. Fallo ancora una volta, se necessario. Clicca su Processo | Binario | Riempi fori (Figura 7G, vedere la sezione discussione).
- Clicca su Analizza | Analizza le particelle. Definire l'intervallo di dimensioni delle nanoparticelle analizzate osservate durante l'esperimento. Selezionare Riepiloga.
NOTA: È molto importante definire almeno la dimensione minima delle nanoparticelle osservate. Senza di essa, i piccoli punti neri (rumore) che appaiono nella sequenza di immagini binarie saranno considerati nanoparticelle. Come primo tentativo, scegli la dimensione delle nanoparticelle più piccole identificate dall'occhio, ma poi è necessario un processo di prova ed errore per comprendere l'effetto di questo parametro e ottimizzare l'analisi automatizzata dei dati (vedi sezione di discussione). Prima di questo passaggio, per recuperare l'area delle nanoparticelle, fare clic su Analizza | Impostare le misure e controllare Area. Sono disponibili altre misurazioni. - Salvare le finestre Risultati e Riepilogo. Il numero di nanoparticelle per ogni fotogramma si trova nella finestra dei dati di riepilogo.
Risultati
La figura 5 mostra due serie di immagini STEM HAADF di formazione di nanoparticelle d'oro acquisite in 80 secondi a 25 °C e 85 °C. In tutti questi esperimenti la nucleazione e la crescita delle nanoparticelle è guidata dalla radiolisi dell'acqua. Tra le specie chimiche generate da questo fenomeno indotto dal fascio di elettroni, forti agenti riducenti (cioè elettroni acquosi e radicali idrogeno) possono ridurre l'acido tetracloroaurico portando alla formazione di nanocristallo d'oro all'interfaccia tra le finestre del SiN e il liquido. Queste due osservazioni in situ eseguite con la stessa dose di elettroni confermano che il metodo attuale consente di visualizzare il drastico impatto della temperatura sulla formazione di nanoparticelle in mezzi liquidi. A bassa temperatura, osserviamo la crescita di un assemblaggio molto denso di piccole nanoparticelle, mentre ad alta temperatura si ottengono alcune nanostrutture grandi e ben sfaccettate. Poiché il contrasto delle immagini STEM HAADF è proporzionale allo spessore delle nanoparticelle d'oro, possiamo vedere che due popolazioni di oggetti si formano durante questi esperimenti di crescita: nanoparticelle 3D altamente contrastate e grandi nanostrutture 2D con forma triangolare o esagonale e un contrasto inferiore (indicato dalle frecce rosse nella Figura 5).
Il metodo di analisi video descritto in questo protocollo consente di quantificare i processi di nucleazione e crescita misurando nel tempo il numero di nanoparticelle e la loro superficie media nell'area osservata. Come si vede nella figura 8, a bassa temperatura si formano più di 800 nanoparticelle in poche decine di secondi di osservazione mentre solo 30 nanoparticelle si formano ad alta temperatura. A parte due nanopiastrine triangolari ed esagonali, tutte le nanoparticelle sono già presenti alla primissimo immagine del follow-up ad alta temperatura. La figura 9 mostra che la superficie media delle nanoparticelle aumenta 40 volte più velocemente a 85 °C rispetto a 25 °C.
La figura 6 rappresenta una tipica immagine STEM e il modello di diffrazione di due nanoparticelle d'oro che sono state selezionate direttamente sull'immagine (indicate dalle frecce rosse nella figura 6A). Qui possiamo identificare la struttura cubica (FCC) centrata sulla faccia dell'oro orientata lungo gli assi di zona [001] (Figura 6B) e [112] (Figura 6C).
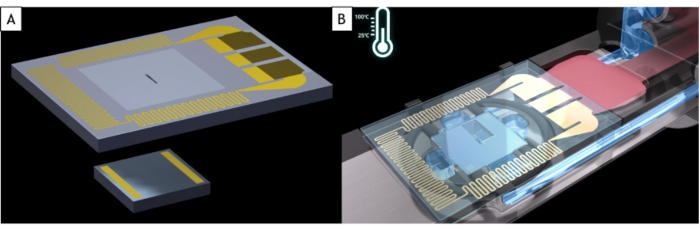
Figura 1: Schema degli E-chip e della punta del supporto per celle liquide. (A) Il grande chip elettronico con la resistenza utilizzata per riscaldare la cella liquida (in alto) e il piccolo chip elettronico (in basso). (B) Entrambi gli E-chip vengono caricati nel supporto per celle liquide. Gli elettrodi del grande chip elettronico sono a contatto con i cuscinetti degli elettrodi del supporto a celle liquide. La resistenza del grande chip elettronico può riscaldare la cella liquida. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini al microscopio ottico di chip elettronici che illustrano: (A) Una finestra SiN intatta necessaria per l'esperimento. (B) Un wafer di silicio danneggiato sul bordo dell'E-Chip. Questo tipo di chip elettronici può essere utilizzato se l'area danneggiata si trova al di fuori dell'area umida una volta sigillata la cella liquida (cioè, se il danno è al di fuori dell'area definita dagli O-ring). (C) Residui sulla superficie del chip elettronico. Se tali residui non se ne vanno dopo aver ripetuto i processi di pulizia (vedere sezione 4.1), non utilizzare l'E-chip. (Da D a F) Finestre SiN danneggiate (chip elettronici inutilizzabili). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Foto del processo passo-passo del caricamento della cella liquida nel supporto TEM. (A) Solo detentore del campione. (B) Mettere l'O-ring della guarnizione nella cavità. (C) Inserire il piccolo chip elettronico negli O-ring della guarnizione. (D) Mettere una goccia di soluzione sui piccoli chip elettronici. (E) Mettere il grande chip elettronico su quello piccolo. (F) Sigillare l'intera cella liquida avvitando il coperchio. Clicca qui per visualizzare una versione più grande di questa figura.
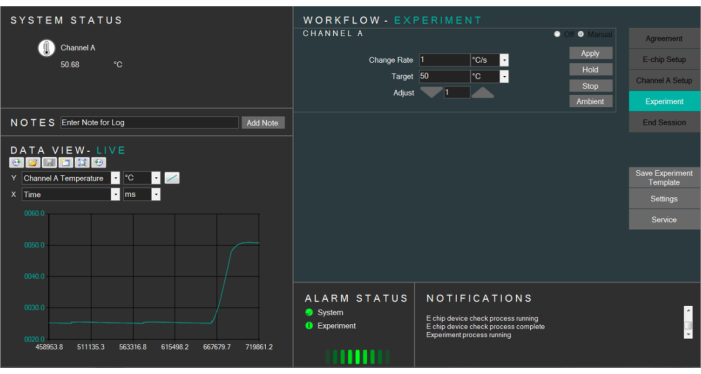
Figura 4: Screenshot del software di riscaldamento che controlla la temperatura della cella liquida. Fare clic qui per visualizzare una versione più ampia di questa figura.

Figura 5: Serie di immagini STEM HAADF a basso ingrandimento della crescita delle nanoparticelle d'oro. (a) a 25 °C. (b) a 85 °C. L'ora corrispondente è indicata nell'angolo in basso a sinistra di ogni immagine. Le nanostrutture 2D sono indicate da frecce rosse. Tutte le immagini sono acquisite con la stessa dose di elettroni di 3,4 elettroni-1·nm-2. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Nanodiffrazione STEM di singole nanoparticelle. (A) Immagine STEM utilizzata per selezionare le nanoparticelle diffrazione (le posizioni della sonda durante le acquisizioni di diffrazione sono indicate da frecce rosse). (B,C) Modello di diffrazione delle due nanoparticelle selezionate. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Elaborazione e analisi dei dati delle immagini STEM HAADF mediante Fiji. Le immagini sono state acquisite 40 secondi dopo l'inizio della crescita. (Da A a C) Immagine acquisita a 25 °C. (da D a G) Immagine acquisita a 85 °C. (A,D) Immagine STEM grezza. (B,E) Immagine elaborata (filtro mediano). (C,F) Immagine binaria. (G) Una dilatazione dei pixel viene applicata due volte e viene quindi applicato il processo "Riempi fori". Clicca qui per visualizzare una versione più grande di questa figura.
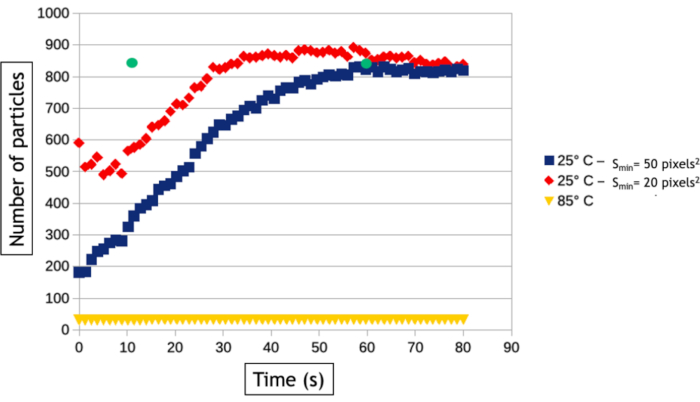
Figura 8: Grafico che rappresenta il numero di nanoparticelle d'oro in funzione del tempo a 25 °C e 85 °C. Le due curve a 25°C vengono misurate automaticamente con una dimensione minima di rilevamento (Smin)di 20 (rosso) e 50 (blu) pixel2. I punti verdi misurati dopo 12 e 60 secondi di acquisizione rappresentano il numero di nanoparticelle conteggiate manualmente sul video acquisito a 25 °C. Fare clic qui per visualizzare una versione più grande di questa figura.
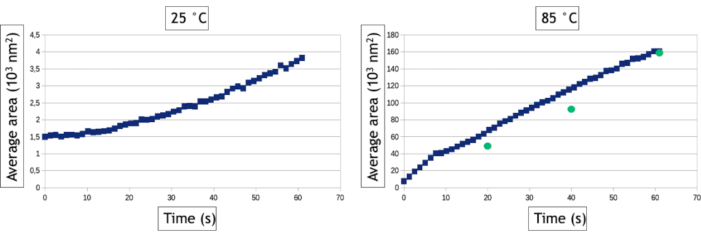
Figura 9: Grafici che rappresentano la superficie media delle nanoparticelle d'oro in funzione del tempo per 25 °C e 85 °C. I punti verdi rappresentano misurazioni manuali dell'area media delle nanoparticelle in dati punti di tempo del video acquisito a 85 °C. Fare clic qui per visualizzare una versione più ampia di questa figura.

Figura 10: Serie di immagini STEM HAADF ad alto ingrandimento della crescita del nanocubo d'oro singolo a 85 °C. Questa serie di immagini è stata acquisita con un'intensità di dose elettronica di 83,6 electron.s-1,nm-2. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo descritto consente di seguire la nucleazione e la crescita delle nanoparticelle d'oro guidate dalla radiolisi in un supporto liquido a temperatura controllata. Combinato con l'elaborazione video automatizzata, consente di misurare l'effetto della temperatura sui parametri chiave della sintesi delle nanoparticelle come la densità, le dimensioni, la forma e la struttura atomica delle nanoparticelle. Questi preziosi input consentono di valutare l'effetto della temperatura sui tassi di nucleazione e crescita, rilevando possibili transizioni di fase e visualizzando i processi di sfaccettature che dettano il risultato finale delle soluzioni colloidali. Insieme alla possibilità di controllare la composizione del supporto reattivo, il TEM a celle liquide a temperatura controllata è un altro passo verso l'osservazione diretta dei processi di nucleazione e crescita di varie nanostrutture in condizioni di sintesi realistiche. L'interpretazione dei risultati presentati in questo articolo e il loro confronto con i modelli di nucleazione e crescita saranno discussi altrove. A questo punto, vogliamo evidenziare diversi aspetti metodologici che devono essere considerati per condurre esperimenti TEM in situ pertinenti.
Prima di tutto, è fondamentale identificare gli effetti del fascio di elettroni nei mezzi di reazione perché possono influenzare drasticamente i risultati dell'esperimento. Qui, poiché la radiolisi dell'acqua è la forza trainante della formazione di nanoparticelle, la velocità di crescita aumenta rapidamente con l'intensità di dose elettronica che avrà un impatto sulla forma finale dei nano-oggetti11,15. Pertanto, per studiare gli effetti della temperatura sulla nucleazione e sulla crescita delle nanoparticelle, è necessario confrontare gli esperimenti di crescita acquisiti con la stessa dose di elettroni. In modalità STEM, l'intensità di dose elettronica corrisponde alla corrente del fascio (in elettrone al secondo) divisa per la dimensione dell'immagine (in nm2). Pertanto, un'intensità di dose elettronica costante implica di mantenere la stessa corrente del fascio (cioè la stessa apertura del condensatore e la stessa dimensione dello spot) e lo stesso ingrandimento per ogni esperimento. Quantificare la corrente del fascio delle condizioni di imaging utilizzando una telecamera CCD o una tazza Faraday è importante per interpretare e riprodurre i dati. L'ingrandimento e l'intensità di dose risultante devono essere selezionati a seconda che si desideri visualizzare la crescita di un grande assemblaggio di nanoparticelle per estrarre risultati statisticamente rilevanti sulla cinetica della crescita (Figura 5) o sui meccanismi di crescita su scala di nanoparticelle singola per identificare i siti di adsorbimento preferenziali sulle superfici delle nanoparticelle(figura 10). Se i processi di nucleazione e crescita sono troppo rapidi, in particolare ad alto ingrandimento, è necessario selezionare una piccola apertura del condensatore e piccole dimensioni dello spot per ridurre al minimo l'intensità di dose. La nucleazione e la crescita delle nanoparticelle possono anche rallentare riducendo la concentrazione di precursore metallico nella soluzione analizzata, ma si noti che la concentrazione di prodotti radiolitici aumenterà con la temperatura. In generale, è anche importante tenere conto della storia dell'irradiazione elettronica dell'intero campione. Qui, ad esempio, se diversi esperimenti di crescita vengono rapidamente eseguiti in aree vicine l'una all'altra, la densità delle nanoparticelle diminuirà nel tempo perché la concentrazione di precursori dell'oro nell'area studiata diminuisce. Questo effetto può essere ridotto al minimo separando gli esperimenti di crescita sia nello spazio che nel tempo e utilizzando il porta liquidi in modalità flusso.
Gli algoritmi di tracciamento dell'interfaccia sono estremamente utili per automatizzare l'analisi dei video ed estrarre risultati quantitativi sulla nucleazione e la crescita di grandi assiemi di nanoparticelle. Tuttavia, vale la pena notare che il passaggio di binarizzazione dell'immagine è sempre specifico dei dati, il che significa che i filtri e l'elaborazione dei dati che devono essere applicati sulle immagini per ottimizzare il rilevamento dell'interfaccia nanoparticella / liquido varieranno da un esperimento all'altro. Inoltre, è essenziale confrontare i risultati di queste analisi automatizzate con misurazioni manuali eseguite su alcune immagini per ottimizzare il flusso di lavoro di elaborazione delle immagini e conoscerne i limiti. Qui, ad esempio, eventi di scattering multipli nelle nanoparticelle 3D sempre più spesse formate ad alta temperatura inducono un'inversione di contrasto del loro nucleo dopo 30 secondi di osservazione perché l'allargamento angolare degli elettroni sparsi si traduce in una diminuzione del segnale raccolto nell'intervallo angolare del rivelatore anulare. Per continuare a misurare la vera superficie di queste nanoparticelle, abbiamo utilizzato un processo di dati "riempimenti" dopo la binarizzazione dell'immagine che riempie il cerchio interno dei contrasti della forma dell'anello (Figura 7F, G). Tuttavia, abbiamo dovuto usare una piccola dilatazione degli oggetti per assicurarci che questi contrasti della forma dell'anello siano sempre completamente connessi. Quest'ultimo passaggio porta ad una leggera sopravvalutazione della superficie media delle nanoparticelle nelle misurazioni automatizzate (figura 9). Allo stesso modo, per il rilevamento di nanoparticelle, dobbiamo definire una dimensione minima di oggetti rilevati (Smim) per evitare di rilevare il rumore, ma questo parametro influisce sulla velocità di nucleazione misurata. Come si vede nella figura 8, il numero di nanoparticelle rilevate aumenta all'inizio dell'esperimento per raggiungere un altopiano. Quando Smin è grande (50 pixel2 corrispondenti a 1543 nm2), le misurazioni automatiche e manuali concordate sul livello di questo plateau (835 nanoparticelle dopo 60 secondi) ma il rilevamento delle nanoparticelle viene ritardato nell'analisi automatica poiché 835 nanoparticelle vengono conteggiate manualmente dopo solo 12 s, ma non vengono rilevate automaticamente fino a dopo. Questo tempo di rilevazione prolungato porta ad una sottovalutazione del tasso di nucleazione. Ridurre Smin fino a 20 pixel2 (cioè 617 nm2) riduce l'errore sul tempo di nucleazione dell'assemblaggio della nanoparticella, ma porta ad una sopravvalutazione della densità delle nanoparticelle in particolare nella fase iniziale degli esperimenti (Figura 8) che influisce anche sulla velocità di nucleazione. Il rilevamento e le misure di dimensioni e forma di nano-oggetti con un comportamento molto dinamico e un basso rapporto segnale/rumore è una sfida comune nel TEM in fase liquida che può essere ulteriormente migliorato utilizzando altri metodi di segmentazione e denoising24 o approcci di machine learning25.
Ultimo ma non meno importante, la preparazione della cella liquida e la pulizia del supporto liquido devono essere eseguite con molta attenzione per evitare contaminazioni dei mezzi di reazione.
In generale, il controllo della temperatura del campione durante le analisi LCTEM offre l'opportunità di studiare gli effetti termici sulle reazioni chimiche che si verificano all'interfaccia tra solidi e liquidi. Pertanto, speriamo che il metodo attuale apra la strada ad altri esperimenti TEM in situ progettati per rivelare la dinamica dei materiali duri, morbidi o biologici nei mezzi liquidi a temperatura controllata.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Riconosciamo con gratitudine il sostegno finanziario della Regione Ile-de-France (convenzione SESAME E1845 per il microscopio elettronico JEOL ARM 200 F installato presso l'Università di Parigi), il Labex SEAM (Progetto GLOIRE) e il CNRS (Defi Nano Program). Ringraziamo Madeline Dukes e Daniel Franck per aver condiviso gli schemi e le immagini ottiche delle celle liquide viste nelle figure 1 e 2.
Materiali
| Name | Company | Catalog Number | Comments |
| 2100 Plus electron microscope | Jeol | ||
| Acetone | Merck | ||
| Air pistol | |||
| ARM 200F electron microscope | Jeol | ||
| Binoculars or optical microscope | |||
| Carbon tipped tweezers | |||
| Computer with heating software | Software by Protochips | ||
| Distlilled water | |||
| Dummy e-chips | Protochips | ||
| Gasket/O-rings | Protochips | ||
| Gold aqueous solution | Merck | 1 mM of HAuCl4 - Prepared beforehand | |
| Large liquid heating E-chip | Protochips | ||
| Methanol | Merck | ||
| One View camera | Gatan | ||
| Petri dish | Number : 2 | ||
| Plasma cleaner | Gatan | ||
| Poseidon Select | Protochips | Liquid cell holder | |
| Power supply Keithley 2450 | |||
| Protective gloves | |||
| Red PEEK tubing | Number : 3 | ||
| Screwdriver with torque | |||
| Small liquid E-chip | Protochips | 150 nm spacers | |
| STEM HAADF detector | Jeol | ||
| STEMx software | Gatan | ||
| Syringe | Number : 2 | ||
| Syringe pump | Harvard apparatus | Number : 2 | |
| Vacuum pump | Gatan |
Riferimenti
- Willets, K. A., Van Duyne, R. P. Localized surface plasmon resonance spectroscopy and sensing. Annual Review of Physical Chemistry. 58 (1), 267-297 (2007).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chemical Society Review. 41, 2740-2779 (2012).
- You, H., Yang, S., Ding, B., Yang, H. Synthesis of colloidal metal and metal alloy nanoparticles for electrochemical energy applications. Chemical Society Review. 42, 2880-2904 (2013).
- Nikoobakht, B., El-Sayed, M. A. Preparation and growth mechanism of gold nanorods using seed-mediated growth method. Chemistry of Materials. 15, 1957-1962 (2003).
- Hubert, F., Testard, F., Spalla, O. Cetyltrimethylammonium bromid silver bromide complex as the capping agent of gold nanorods. Langmuir. 24, 9219-9222 (2008).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie International Edition. 48, 60-103 (2009).
- Zheng, Y., Zeng, J., Ruditskiy, A., Liu, M., Xia, Y. Oxidative etching and its role in manipulating the nucleation and growth of noble-metal nanocrystals. Chemistry of Materials. 26, 22-33 (2014).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12 (3), 1470-1474 (2012).
- Wu, J., et al. Growth of Auau on Pt icosahedral nanoparticles revealed by low-dose in situ TEM. Nano letters. 15, 2711-2715 (2015).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Exploring the formation of symmetric gold nanostars by liquid-cell transmission electron microscopy. Nano letters. 17, 4194-4201 (2017).
- Woehl, T. J., Evans, J. E., Arslan, I., Ristenpart, W. D., Browning, N. D. Direct in situ determination of the mechanisms controlling nanoparticle nucleation and growth. ACS Nano. 6, 8599-8610 (2012).
- Tan, S. F., et al. Intermediate structures of pt-ni nanoparticles during selective chemical and electrochemical etching. The Journal of Physical Chemistry Letters. 10, 6090-6096 (2019).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12, 1470-1474 (2012).
- Aliyah, K., et al. Real-time in situ observations reveal a double role for ascorbic acid in the anisotropic growth of silver on gold. The Journal of Physical Chemistry Letters. 11 (8), 2830-2837 (2020).
- Alloyeau, D., et al. Unravelling kinetic and thermodynamic effects on the growth of gold nanoplates by liquid transmission microscopy. Nano Letters. 15 (4), 2574-2581 (2015).
- Gao, W., et al. Direct in situ observation and analysis of the formation of palladium nanocrystals with high-index facets. Nano Letters. 18 (11), 7004-7013 (2018).
- Liao, H. -. G., et al. Facet development during platinum nanocube growth. Science. 345, 916-919 (2014).
- Tan, S. F., et al. Real-time imaging of the formation of Au-Ag core-shell nanoparticles. Journal of the American Chemical Society. 138 (16), 5190-5193 (2016).
- Khelfa, A. Selective shortening of gold nanorods: when surface functionalization dictates the reactivity of nanostructures. Nanoscale. 12, 22658-22667 (2020).
- Schneider, N. M., et al. Electron-water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118, 22373-22382 (2014).
- Ahmad, N., Le Bouar, Y., Ricolleau, C., Alloyeau, D. Growth of dendritic nanostructures by liquid-cell transmission electron microscopy: a reflection of the electron-irradiation history. Advanced Structural and Chemical Imaging. 2, 9 (2016).
- Khelfa, A., et al. Structural analysis of single nanoparticles in liquid by low-dose STEM nanodiffraction. Micron. 116, 30-35 (2019).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Driving Reversible Redox Reactions at Solid/Liquid Interfaces with the Electron Beam of a Transmission Electron Microscope. Journal of Microscopy. 269, 127-133 (2018).
- Schneider, N. M., Park, J. H., Norton, M. M., Ross, F. M., Bau, H. H. Automated analysis of evolving interfaces during in situ electron microscopy. Advanced Structural and Chemical Imaging. 2, (2016).
- Yao, L., Ou, Z., Luo, B., Xu, C., Chen, Q. Machine learning to reaveal nanoparticle dynamics from liquid-phase TEM videos. ACS Central Science. 6, 1421-1430 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon