Method Article
Изучение влияния температуры на зародыша и рост наночастиц с помощью просвечивающей электронной микроскопии жидкостных клеток
В этой статье
Резюме
Контроль температуры в ходе экспериментов по жидкофазной электронной микроскопии открывает новые перспективы изучения динамики наночастиц в жидких средах, имитирующих их образование или применение средой. Используя недавно разработанные нагревательные жидкие клетки, мы непосредственно наблюдали влияние температуры на процессы зародыша и роста наночастиц золота в воде.
Аннотация
Контроль температуры является недавней разработкой, которая обеспечивает дополнительную степень свободы для изучения нанохимии с помощью электронной микроскопии с передачей жидких клеток. В данной работе описано, как подготовить эксперимент по нагреву in situ для изучения влияния температуры на образование наночастиц золота, обусловленных радиолизом в воде. Протокол эксперимента достаточно прост с использованием специальной жидкостной ячейки с равномерным нагревом до 100 °C, держателя TEM жидкостной ячейки с возможностями потока и интегрированного интерфейса для контроля температуры. Мы показываем, что на механизмы нуклеации и роста наночастиц золота резко влияет температура в жидкой клетке. С помощью STEM-визуализации и нанодиффракции эволюция плотности, размера, формы и атомной структуры растущих наночастиц раскрывается в режиме реального времени. Автоматизированные алгоритмы обработки изображений используются для извлечения полезных количественных данных из видеопоследовательностей, таких как зародышеобразование и скорость роста наночастиц. Этот подход обеспечивает новые входные данные для понимания сложных физико-химических процессов, происходящих во время жидкофазного синтеза наноматериалов.
Введение
Наночастицы металлов (НП) обладают многообещающими физико-химическими свойствами, которые могут быть использованы в различных областях, таких как оптическое зондирование1,лекарство2 или энергия3. Мокрый химический синтез является очень универсальным методом изготовления металлических НП с четко определенным размером и формой. За последние десятилетия было разработано много стратегий для получения контроля над синтезом НП: посевной опосредованный рост4,метод блокировки лица5,кинетически контролируемый синтез6,селективное травление7 или синтез с контролируемой температурой8. Однако, хотя химические реакции, управляющие синтезом, довольно просты, механизмы зерождения и роста — нет, поскольку многие параметры играют определенную роль в процессах формирования, и их индивидуальное влияние трудно извлечь из снимков ex situ полученных наноматериалов, извлеченных из их пластовой среды в заданные моменты времени синтеза. Чтобы по-настоящему понять процессы нуклеации и роста и установить способы их контроля, мы должны использовать инструменты in situ, которые позволяют наблюдать их в режиме реального времени в тонко контролируемой жидкой среде.
В этом отношении просвечивающая электронная микроскопия жидкостных клеток (LCTEM) была очень мощным методом для пролития нового света на синтез металлических наночастиц9,10,11,12,13. Благодаря визуализации динамики отдельных наноструктур непосредственно в их жидких пластовых средах этот метод обеспечил более глубокое понимание механизмов нуклеации и роста, в частности роли дефектов кристаллов, морфологии семян и органических лигандов, которые позволяют управлять процессами направленного роста или травления и получать наноматериалы с определенными формами (наностержни, нанозвезды, нанопластины, нанооболочки, нанооболочки)10,11,12,13,14,15,16,17,18,19. Когда электронный пучок ТЭМ взаимодействует с жидкостями, процессы радиолиза производят сильные восстановительные и окисляющие виды, которые изменяют химический состав раствора в облученной области и могут быть использованы для стимулирования процессов роста или травления. Интересно, что концентрация радиолитических продуктов, как известно, увеличивается с мощностью дозы электронов, параметр, который может быть точно настроен в электронном микроскопе20. Поэтому эта зависимость дозы и мощности радиолиза была использована для управления скоростью реакции и выявления кинетических эффектов на процессы образования и конечную морфологию наноструктур11,15,20.
Хотя температура является важнейшим параметром в синтезе наноматериалов, ее эффекты до сих пор не были тщательно исследованы LCTEM, потому что коммерческие жидкостные ячейки с надежным контролем температуры были разработаны только недавно. Тем не менее, такие исследования in situ необходимы для разгадки сложной кинетики и термодинамических эффектов, вызванных изменениями температуры. Действительно, с одной стороны, повышение температуры оказывает резкое влияние на процессы огранки во время роста, ускоряет атомную и молекулярную диффузию в жидкости и изменяет скорость реакции. С другой стороны, нанофазная диаграмма наноструктур также очень чувствительна к температуре. В этой статье мы используем недавно разработанные нагревательные жидкие ячейки для отслеживания радиолитического роста наночастиц золота в воде с контролем температуры между комнатной температурой и 100 ° C. Эта методология, сочетающая в себе визуализацию STEM и дифракцию в среде, которая становится все ближе и ближе к реальным условиям синтеза, сокращает разрыв между наблюдениями ТЕА in situ и синтезами стендового масштаба.
протокол
1. Выровнять просвечиваю электронный микроскоп для визуализации STEM HAADF
- Следуйте инструкциям производителя для выравнивания микроскопа.
- Используйте обычный высушенный образец, чтобы выровнять микроскоп. Не используйте жидкий образец.
- Чтобы свести к минимуму скорость роста, минимизируйте мощность дозы электронов (см. раздел обсуждения), что подразумевает использование небольшой апертуры конденсатора и небольшого размера пятна для уменьшения тока пучка.
2. Обработка электронных чипов
ПРИМЕЧАНИЕ: Коммерческие держатели жидкостей подходят почти на все TEM, но используют держатель, который специально разработан для марки микроскопа и полюса. Жидкая ячейка изготовлена из двух кремниевых чипов на основе MEMS, называемых E-чипами, оба из которых представляют собой кремниевые подложки с окном размером 500 x 50 мкм, покрытым пленкой аморфного нитрида кремния (SiN) толщиной 50 нм, которая является электронно-прозрачной(рисунок 1A). Эти два электронных чипа имеют разные размеры. Маленький - 2 х 2 мм с золотыми прокладками, которые фиксируют расстояние между двумя E-чипами (здесь 150 нм) и толщину жидкости. Большой из них составляет 4 х 6 мм и имеет сопротивление, встроенное внутрь кремниевой подложки, что позволяет равномерно нагревать жидкий образец(рисунок 1B). Из-за того, как они изготавливаются в чистых помещениях, электронные чипы имеют две разные стороны: одну, где окно выглядит маленьким (здесь после этого называется передней стороной), а другая, где окно большое с формой раковины (здесь после называется задней стороной).
- При обращении с электронными чипами никогда не прикасайтесь пинцета к окну и не хватайте чипы по бокам. Чтобы избежать царапин на поверхности кремниевой подложки, используйте пинцет с углеродным наконечником.
- При размещении E-чипа на поверхности убедитесь, что задняя сторона находится в контакте с поверхностью, потому что пленка SiN хрупкая и она нанесена на лицевую сторону.
3. Очистка держателя жидкой ячейки (перед экспериментом)
- Снимите крышку, закрывающую кончик держателя. Удалите фиктивные жидкие клетки с помощью пинцете. Снимите прокладку, используемую с фиктивными жидкими ячейками.
ПРИМЕЧАНИЕ: Фиктивные жидкие ячейки - это жидкие ячейки без окна SiN и только кремния. Они используются для хранения держателя жидкостной ячейки в вакуумном насосе. Обратите внимание на состояние латунных винтов, потому что они легко крошатся с течением времени. В частности, если головки винтов повреждены, винты должны быть заменены. В противном случае может быть трудно открутить их после эксперимента, и мелкий мусор также может нарушить загрузку образца. - Вручную впрыскивайте 2 мл дистиллированной воды внутрь держателя с помощью шприцев и внешней трубки PEEK для подключения к задней части держателя.
ПРИМЕЧАНИЕ: Внутри держателя есть 3 микрофлюидных туннеля. Все три должны быть очищены водой. Обратите внимание на воду, вытекав из передней части держателя: если вода окрашена из-за предыдущего эксперимента, продолжайте класть воду внутрь держателя, пока жидкость не покрасится. - При введении раствора в жидкую ячейку во время эксперимента (1 мМ HAuCl4 в воде в нашем случае), заполните этим раствором трубку держателя образца.
- Высушите наконечник держателя жидкостных ячеек с помощью пневматического пистолета.
4. Подготовка жидкой ячейки (Е-чипы)
- Очистка жидких клеток.
- Наполните стеклянную чашку Петри ацетоном.
- Наполните стеклянную чашку Петри метанолом.
ВНИМАНИЕ: Из-за токсичности метанола чашку Петри с метанолом необходимо поместить под вытяжной капюшон. Метанол следует обрабатывать с помощью соответствующего защитного снаряжения (перчаток). - Положите один маленький и один большой Е-чипс в чашку Петри с ацетоном и подождите 2 минуты.
ПРИМЕЧАНИЕ: Е-чипы покрыты защитным слоем, который необходимо удалить перед экспериментом. Ацетон удалит фоторезист и очистит Е-чипы от мусора. Для усиления очистки раствор можно осторожно перемешивать. - Положите оба Е-чипса в чашку Петри с метанолом и подождите 2 минуты. Метанол очистит Е-чипы от ацетона и остального мусора.
ВНИМАНИЕ: Перенос E-чипсов между ацетоном и метанолом должен осуществляться как можно быстрее, чтобы не дать E-чипсам высохнуть на воздухе. - Высушите жидкие ячейки с помощью пневматического пистолета. Удерживайте электронный чип пинцетем во время использования пневматического пистолета. Будьте осторожны, чтобы не нажимать слишком сильно на спусковой крючок пневматического пистолета, иначе E-чип может выпасть из пинцета. Если они выпадают, возобновите очистку ацетоном и метанолом.
- Проверьте целостность окна нитрида кремния с помощью бинокулярной лупы или оптического микроскопа(рисунок 2).
ПРИМЕЧАНИЕ: Убедитесь, что окна обоих электронных чипов чистые и не разбиты. Если Е-чипы не кажутся чистыми, попробуйте снова поместить их обратно в ацетон и метанол. Если грязь все еще находится на окне или если окно разбито, электронные фишки должны быть заменены на новые. - Плазменно очищают Е-чипы смесью аргона и газообразного кислорода в течение 2 минут. Плазменная очистка Е-чипов позволяет им быть гидрофильными. Вот детали настройки плазменной очистки: расход газа аргона = 35 sccm, поток кислородного газа = 11,5 sccm, время ожидания потока газа = 20 с, передовая цель RF = 50 Вт, прямой диапазон ВЧ = 5 Вт, максимальный отраженный RF = 5 Вт.
- Загрузка жидких ячеек в держатель TEM(рисунок 3).
- Загрузите уплотнительным кольцами прокладки внутрь держателя жидкостной ячейки(рисунок 3B). Убедитесь, что используемая прокладка чистая. Если нет, быстро очистите его дистиллированной водой. Высушите его с помощью чистой фильтровальной бумаги. Чтобы удалить мусор и волокна на прокладке, прижмите ее между двумя листами парапленки несколько раз.
- Поместите маленький E-чип внутрь держателя жидкостной ячейки(рисунок 3C). Чтобы уменьшить изгиб пленок SiN к вакууму микроскопа, поместите окна жидкой ячейки в скрещенные конфигурации. Поэтому окно небольшого Е-чипа должно быть параллельно длине держателя и передней грани вверх. Убедитесь, что маленький электронный чип хорошо вставлен внутрь прокладки.
- Подготовьте жидкий образец (здесь 1 мМ HAuCl4 в воде).
- Опустите ≈2 мкл жидкого образца на небольшую электронную микросхему с помощью микропипетки(рисунок 3D). Если небольшой электронный чип был должным образом очищен плазмой, образец водной жидкости будет равномерно распределен по поверхности чипа.
- Удалите лишнюю жидкость фильтровальной бумагой. С помощью резко разрезанной части фильтровальной бумаги уменьшите толщину жидкого слоя на небольшом Е-чипе, пока он не образует плоский купол.
- Поместите большой E-чип внутрь держателя жидкостной ячейки(рисунок 3E). Поместите большой E-чип на маленький, его передней стороной вниз (лицевая сторона двух фишек должна быть обращена друг к другу). Электроды на большом E-чипе должны соприкасаться с электродной прокладкой на держателе.
- Сдвиньте крышку обратно на держатель жидкостной ячейки. Постепенно затягивайте каждый винт(рисунок 3F).
- Высушите возможную жидкость, вытекав из Е-чипов, используя небольшую фильтровальную бумагу. Убедитесь, что жидкость не выходит с обеих сторон жидких ячеек, вращая держатель жидких ячеек вокруг своей оси.
- Проверьте вакуумное уплотнение жидкостной ячейки на насосной станции. Если уровень вакуума насоса достигает 5 х 10-2 Па, то продолжайте протокол. Если нет, проверьте целостность окна (оно, скорее всего, сломано) и запустите протокол с самого начала с нового набора E-chips.
- Проверьте целостность окна нитрида кремния в последний раз с помощью бинокулярной лупы или оптического микроскопа. Иногда жидкая ячейка сможет поддерживать вакуум насосной станции, даже если окно разбито. Это связано с тем, что когда окно разбивается и жидкость выплескивается наружу, она может образовывать агрегаты соли на разбитой части окна, тем самым закрывая отверстие. Если это произойдет, подготовьте новый набор электронных чипов.
- Загрузите держатель ячейки жидкости в TEM и проверьте уровень вакуума. Даже если жидкая ячейка поддерживала вакуум насосной станции и нет видимых проблем с окном, микропротечка жидкостной ячейки может помешать достичь уровня вакуума, необходимого для работы ТЭМ. Если микроскоп не может достичь требуемого уровня вакуума для работы (2-5 х 10-5 Па), извлеките держатель образца и подготовьте новый набор электронных чипов.
5. Используйте держатель жидкости в режиме потока
- Заполните 2 шприца несколькими миллилитрами раствора для инъекции (1 мМ HAuCl4 в воде в нашем случае).
- Подключите 2 внешние трубки PEEK к шприцам. Поместите 2 шприца на шприцевые насосы. Вставьте внешние трубки PEEK в 2 записи держателя жидкой ячейки. Вставьте одну дополнительную внешнюю трубку PEEK для вывода держателя жидкостной ячейки.
- Вводят раствор со скоростью потока 5 мкл/мин в каждое входное отверстие.
6. Нагрев жидкой среды
- Подключите блок питания к держателю. Подключите блок питания к компьютеру, на котором установлено программное обеспечение для отопления.
- Включайте компьютер и откройте программное обеспечение Heating. Подключить блок питания.
- Нажмите на кнопку проверки устройства. Если программное обеспечение указывает «пройдено», то эксперимент может продолжаться. В противном случае у большого E-чипа могут возникнуть проблемы (неправильная загрузка E-чипа, сломанные электроды ...).
- Перейдите на вкладку Эксперимент. Нажмите на Вручную, чтобы активировать ручной режим нагрева.
- Выберите целевую температуру и измените ее соответствующим образом. Нажмите, чтобы нагреть E-чипы до целевой температуры(рисунок 4).
ПРИМЕЧАНИЕ: Электронные чипы могут нагреваться до 100 °C. Если для эксперимента используется водный раствор (как в нашем случае), избегайте нагревания Е-чипов выше 90 °C. В противном случае жидкий образец может высохнуть. При нагревании жидкости температура может временно подняться выше целевой температуры, а затем упасть обратно до желаемой температуры. Используйте низкую скорость нагрева, чтобы свести к минимуму такие превышения (1 ° C / с - это нормально). - Нажмите «Окружающая среда», чтобы вернуться к температуре окружающей среды (25 °C). Нажмите «Стоп», чтобы резко остановить нагрев. Перейдите на вкладку Завершение сеанса, чтобы завершить эксперимент с нагревом.
7. STEM визуализация роста наночастиц
- Используйте микроскоп в режиме STEM с помощью детектора HAADF. Пройдите в нетронутую область образца, рядом с углом окна наблюдения, где толщина жидкости минимальна. Получение видео роста наночастиц при разных температурах жидкости(рисунок 5).
ПРИМЕЧАНИЕ: Наночастицы золота сразу же появляются и растут в сканируемой области. Запись видео с частотой кадров одно изображение в секунду является хорошим компромиссом для наблюдения за процессами роста с хорошим соотношением сигнал/шум и хорошим временным разрешением.
8. STEM нанодифракция одиночных наночастиц
- Получите STEM HAADF изображение нескольких нанообъедий. Получить дифракционную картину отдельных наночастиц, выбранных на изображении, с помощью программного обеспечения STEMx(рисунок 6).
ПРИМЕЧАНИЕ: Нанодифракция STEM - это метод, который позволяет получить дифракционную картину отдельных наночастиц в жидкости во время экспериментов роста22. - После получения изображения STEM HAADF выберите несколько нанообъектов на изображении, и программное обеспечение STEMx автоматически синхронизирует положение зонда и ПЗС-камеры для получения дифракционной картины в каждом положении зонда. Чтобы избежать перекрытия дифракционных пятен, используйте небольшой угол сходимости зонда STEM (7,4 мрад в нашем случае) с помощью небольшой конденсаторной апертуры (10 мкм в нашем случае).
9. Очистка держателя жидкой ячейки (после эксперимента)
ПРИМЕЧАНИЕ: Здесь мы описываем стандартную процедуру очистки держателя жидкой ячейки. Если эта очистка недостаточно эффективна, можно использовать разбавленные азотную кислоту и метанол для промывки возможных агрегатов наночастиц в жидком держателе ячейки. Перед тем, как ознакомиться с документацией по химической совместимости держателя жидкостной ячейки, следует ознакомиться. В любом случае, всегда заканчивайте уборку инъекцией дистиллированной воды.
- Снимите крышку. Удалите использованные электронные чипы. Снимите внутреннюю прокладку.
ПРИМЕЧАНИЕ: Использованные электронные чипы могут храниться в адаптированной коробке. Затем можно выполнить анализ ex situ TEM или SEM нанообъектов, которые остались прикрепленными к окнам SiN после вскрытия жидкой ячейки15. Не рекомендуется повторно использовать E-чипы для другого эксперимента in situ, но это все еще возможно, если пленка SiN не была разорвана во время расклеивания жидкой ячейки. Затем могут быть проведены эксперименты по разрастанию в другом растворителе. 23 23 - Впрыскивайте 5 мл дистиллированной воды во впускную и выходную трубку держателя жидкой ячейки.
- Очистите кончик держателя жидкостной ячейки с помощью ультразвуковой ванны в течение 20 минут. Контактную площадку можно погружать в ванну. Погружайте только ту часть, которая покрыта крышкой. Не погружайте вентиляционные отверстия в жидкость.
- Высушите держатель жидкой ячейки с помощью пневматического пистолета.
- Положите обратно прокладку, используемую с фиктивными жидкими ячейками. Верните фиктивные жидкие клетки и крышку.
- Храните держатель образца на вакуумной станции.
10. Поэкспериментальный анализ с использованием Фиджи (ImageJ)
ПРИМЕЧАНИЕ: Рекомендуется разделить каждый кадр видео, снятого на отдельные изображения. Целью этого этапа анализа после эксперимента является преобразование оригинальных видео наночастиц в двоичные видео, которые могут быть проанализированы Фиджи. Срединный фильтр используется для того, чтобы усилить контраст наночастиц на фоне(рисунки 7B и 7E). Это необходимо для облегчения бинаризации видео.
- Откройте каталог файлов, содержащий изображения видео на Фиджи, нажав на Файл | Импорт | Последовательность изображений. Появится окно параметров последовательности. Выберите подходящее начальное изображение (если начало видео должно быть отброшено). Введите номер приращения для последовательности изображения (он соответствует количеству кадров, необходимому для того, чтобы сканирование STEM достигло нижней части изображения). Установите флажок Преобразовать в 8-битные оттенки серого. Сохраните последовательность изображений в формате tiff.
- Обрежьте все нежелательные артефакты из видео (например, шкалу масштаба или край окна жидкой ячейки).
- Нажмите на | процесса Фильтры | Медиана, чтобы применить медианный фильтр ко всем изображениям. Сохраните обработанную последовательность изображений в формате tiff.
ПРИМЕЧАНИЕ: Появится окно с запросом радиуса, используемого для медианного фильтра. Мы использовали радиус 2 пикселя, но не стесняйтесь использовать разные параметры. На Фиджи также доступны другие фильтры, которые могут быть использованы для улучшения обработки изображений. В частности, алгоритм вычитания фона может быть использован для того, чтобы сделать интенсивность фона плоской, если она неоднородна. Для этого нажмите на | процесса Субстрактный фон. В нашем случае этот процесс создает небольшие белые пятна на фоне первых изображений, которые можно интерпретировать как ложные наночастицы. Таким образом, мы не использовали этот процесс, но его следует опробовать на других наборах данных, потому что увеличение толщины жидкости от угла до центра жидкой ячейки обычно вызывает неравномерную интенсивность фона на изображениях LCTEM с низким увеличением. - Нажмите на | изображений Отрегулируйте | Порог. Перемещайтесь вручную для большей точности порога бинаризации, пока только наночастицы не будут окрашены в красный цвет. Нажмите кнопку применить. Появится окно Преобразовать стек в двоичный файл. Снимите флажок Вычислять пороговое значение для каждого изображения. Сохраните двоичную последовательность изображений в формате tiff(рисунки 7C & 7F).
ПРИМЕЧАНИЕ: Рекомендуется проверить, удовлетворяет ли порог на каждом кадре видео. - Делайте этот шаг только в том случае, если во время видео происходит контрастная инверсия наночастиц. Нажмите на | процесса Двоичные | Расширение. Сделайте это еще раз, если это необходимо. Нажмите на | процесса Двоичные | Заполните отверстия (рисунок 7G,см. раздел обсуждения).
- Нажмите на Анализ | Анализируйте частицы. Определите диапазон размеров анализируемых наночастиц, наблюдаемых в ходе эксперимента. Установите флажок Суммировать.
ПРИМЕЧАНИЕ: Очень важно, по крайней мере, определить минимальный размер наблюдаемых наночастиц. Без него маленькие черные точки (шумы), которые появляются в последовательности двоичного изображения, будут рассматриваться как наночастицы. В качестве первой попытки выберите размер мельчайших наночастиц, идентифицированных глазом, но затем необходим процесс проб и ошибок, чтобы понять эффект этого параметра и оптимизировать автоматизированный анализ данных (см. раздел обсуждения). Перед этим шагом, чтобы извлечь область наночастиц, нажмите «Анализировать | Установите измерения и проверьте Площадь. Доступны и другие измерения. - Сохраните окна Результаты и Сводка. Количество наночастиц для каждого кадра находится в окне Сводные данные.
Результаты
На рисунке 5 показаны две серии изображений STEM HAADF формирования наночастиц золота, полученных в течение 80 секунд при 25 °C и 85 °C. Во всех этих экспериментах зародыша и рост наночастиц обусловлены радиолизом воды. Среди химических веществ, генерируемых этими электронно-лучевыми индуцированными явлениями, сильные восстановители (т.е. водные электроны и водородные радикалы) могут восстанавливать тетрахлорауровую кислоту, что приводит к образованию нанокристалла золота на границе раздела между окнами SiN и жидкостью. Эти два наблюдения in situ, выполненные с одинаковой мощностью дозы электронов, подтверждают, что настоящий метод позволяет визуализировать резкое влияние температуры на образование наночастиц в жидких средах. При низкой температуре мы наблюдаем рост очень плотной сборки мелких наночастиц, в то время как при высокой температуре получается несколько крупных и хорошо ограненных наноструктур. Поскольку контраст изображений STEM HAADF пропорционален толщине наночастиц золота, мы можем видеть, что в ходе этих экспериментов по росту формируются две популяции объектов: высококонтрастные 3D-наночастицы и большие 2D-наноструктуры с треугольной или гексагональной формой и более низкой контрастностью (обозначены красными стрелками на рисунке 5).
Метод видеоанализа, описанный в этом протоколе, позволяет количественно оценить процессы нуклеации и роста путем измерения с течением времени количества наночастиц и их средней площади поверхности в наблюдаемой области. Как видно на рисунке 8,при низкой температуре за несколько десятков секунд наблюдения образуется более 800 наночастиц, в то время как при высокой температуре образуется только 30 наночастиц. Помимо двух треугольных и гексагональных нанопластин, все наночастицы уже присутствуют на самом первом изображении наблюдения за высокой температурой. На рисунке 9 показано, что средняя площадь поверхности наночастиц увеличивается в 40 раз быстрее при 85 °C, чем при 25 °C.
Рисунок 6 представляет собой типичное ИЗОБРАЖЕНИЕ STEM и дифракционную картину двух наночастиц золота, которые были выбраны непосредственно на изображении (обозначены красными стрелками на рисунке 6A). Здесь мы можем идентифицировать гранецентрированную кубическую (FCC) структуру золота, ориентированную вдоль осей зоны [001](рисунок 6B)и [112](рисунок 6C).
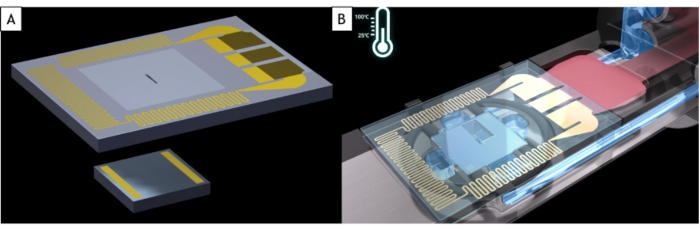
Рисунок 1:Схема электронных чипов и наконечник держателя жидкостной ячейки. (A) Большой электронный чип с сопротивлением, используемым для нагрева жидкой ячейки (вверху) и маленький E-чип (снизу). (B) Обе электронные микросхемы загружаются в держатель жидкостного элемента. Электроды большого E-чипа находятся в контакте с электродными прокладками держателя жидкой ячейки. Сопротивление большого E-чипа может нагревать жидкую ячейку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Изображения электронных микросхем в оптических микроскопах, иллюстрирующие: (A) Неповрежденный SiN-окно, необходимое для эксперимента. (B) Поврежденная кремниевая пластина на краю E-Chip. Этот тип электронных чипов может быть использован, если поврежденная область находится за пределами влажной области после герметизации жидкой ячейки (т. Е. Если повреждение находится за пределами области, определенной уплотнительными кольцами). (C) Остатки на поверхности Е-чипа. Если такие остатки не оставляются после повторения процессов очистки (см. раздел 4.1), не используйте E-чип. (D-F) Повреждены окна SiN (непригодные для использования электронные чипы). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:Фотографии пошагового процесса загрузки жидкостной ячейки в держатель ТЭМ. (A) Только держатель образца. (B) Поместите уплотнительное кольцо прокладки в полость. (C) Вставьте маленькую Е-микросхему в уплотнительным кольцам прокладки. (D) Нанести каплю раствора на небольшие электронные чипы. (E) Поместите большой E-чип поверх маленького. (F) Запечатайте всю жидкую ячейку путем завинчивания крышки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
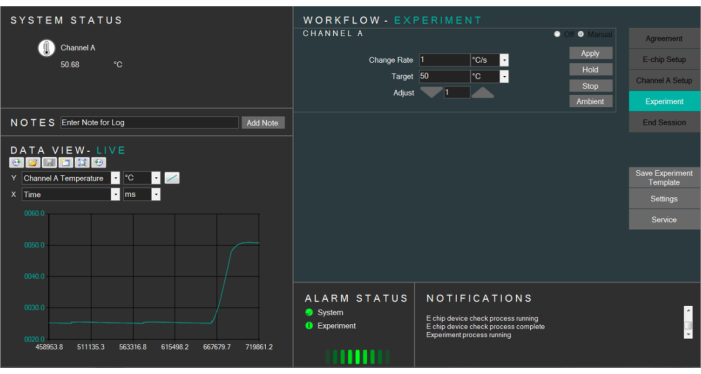
Рисунок 4:Скриншот нагревательного программного обеспечения, контролирующего температуру жидкой ячейки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Низкоувелищная серия изображений STEM HAADF роста наночастиц золота. а) при 25°С. в) при 85°С. Соответствующее время указывается в левом нижнем углу каждого изображения. 2D-наноструктуры обозначены красными стрелками. Все изображения получены с одинаковой мощностью электронной дозы 3,4 электрон·с-1·нм-2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6:STEM нанодифракция отдельных наночастиц. (A) STEM-изображение, используемое для выбора дифрагрующих наночастиц (положения зонда во время дифракционных захватов обозначены красными стрелками). (В,С) Дифракционная картина двух выбранных наночастиц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7:Обработка данных и анализ изображений STEM HAADF с использованием Фиджи. Снимки были получены через 40 секунд после начала роста. (от А до С) Изображение получено при 25 °C. (D до G) Изображение получено при 85 °C. (A,D) Необработанное изображение STEM. (В,Э) Обработанное изображение (медианный фильтр). (С,Ф) Двоичное изображение. (G) Дважды применяется дилатация пикселей, а затем применяется процесс "Заполнение отверстий". Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
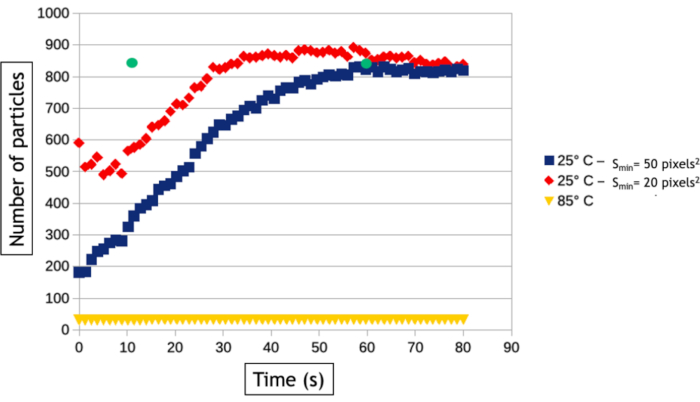
Рисунок 8:График, представляющий количество наночастиц золота в зависимости от времени при 25 °C и 85 °C. Две кривые при 25°C автоматически измеряются с минимальным размером обнаружения (Sмин)20 (красный) и 50 (синий) пикселей2. Зеленые точки, измеренные после 12 и 60 секунд сбора, представляют собой количество наночастиц, подсчитанных вручную на видео, полученном при 25 °C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
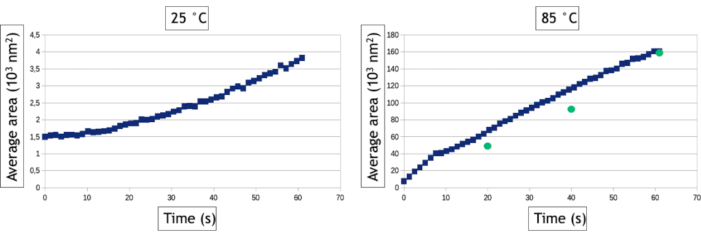
Рисунок 9:Графики, представляющие среднюю площадь поверхности наночастиц золота в зависимости от времени для 25 °C и 85 °C. Зеленые точки представляют собой ручные измерения средней площади наночастиц в заданные моменты времени видео, полученного при 85 ° C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10:Серия изображений с высоким увеличением STEM HAADF роста одного нанокуба золота при 85 °C. Эта серия изображений была получена с мощностью дозы электронов 83,6 электрон.с -1.нм-2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Описанный протокол позволяет следить за зародышем и ростом наночастиц золота, обусловленных радиолизом в жидкой среде с контролируемой температурой. В сочетании с автоматизированной обработкой видео он позволяет измерять влияние температуры на ключевые параметры синтеза наночастиц, такие как плотность, размер, форма и атомная структура наночастиц. Эти ценные входные данные позволяют оценить влияние температуры на скорость нуклеации и роста, обнаружить возможные фазовые переходы и визуализировать процессы огранки, которые диктуют конечный результат коллоидных растворов. Вместе с возможностью управления составом реакционноспособных сред, терморегулируемая жидкая ячейка ТЭМ является еще одним шагом к непосредственному наблюдению за процессами нуклеации и роста различных наноструктур в реалистичных условиях синтеза. Интерпретация результатов, представленных в данной статье, и их сравнение с моделями кудровения и роста будут обсуждаться в другом месте. Здесь мы хотим выделить несколько методологических аспектов, которые необходимо учитывать при проведении соответствующих экспериментов ПО ТЕА in situ.
Прежде всего, крайне важно идентифицировать эффекты электронного пучка в реакционной среде, потому что они могут резко повлиять на результаты эксперимента. Здесь, поскольку радиолиз воды является движущей силой образования наночастиц, скорость роста быстро увеличивается с мощностью дозы электронов, что повлияет на окончательную форму нанообъездов11,15. Поэтому для изучения влияния температуры на зародыша и рост наночастиц необходимо сравнить эксперименты роста, полученные с той же мощностью дозы электронов. В режиме STEM мощность дозы электронов соответствует току пучка (в электроне в секунду), деленный на размер изображения (в нм2). Следовательно, постоянная мощность дозы электронов подразумевает поддержание одного и того же тока пучка (т. е. той же апертуры конденсатора и того же размера пятна) и одинакового увеличения для каждого эксперимента. Количественная оценка тока луча условий изображения с помощью ПЗС-камеры или чашки Фарадея важна для интерпретации и воспроизведения данных. Увеличение и результирующая мощность дозы должны быть выбраны в зависимости от того, хотите ли вы визуализировать рост большой сборки наночастиц для извлечения статистически значимых результатов по кинетике роста(рисунок 5)или механизмов роста в масштабе одной наночастицы для идентификации предпочтительных адсорбционных участков на поверхностях наночастиц(рисунок 10). Если процессы зародыша и роста слишком быстры, особенно при высоком увеличении, следует выбрать небольшую апертуру конденсатора и небольшой размер пятна, чтобы свести к минимуму мощность дозы. Зародышеобразование и рост наночастиц также могут замедляться за счет снижения концентрации предшественника металла в анализируемом растворе, но отмечают, что концентрация радиолитических продуктов будет увеличиваться с температурой. В общем, также важно учитывать историю электронного облучения всего образца. Здесь, например, если в районах, близких друг к другу, быстро проводить несколько экспериментов по росту, плотность наночастиц со временем будет уменьшаться, поскольку концентрация предшественников золота в исследуемой области уменьшается. Этот эффект можно свести к минимуму, разделив эксперименты роста как в пространстве, так и во времени и используя держатель жидкости в режиме потока.
Алгоритмы отслеживания интерфейса чрезвычайно полезны для автоматизации анализа видео и извлечения количественных результатов о зародышах и росте крупных сборок наночастиц. Тем не менее, стоит отметить, что этап бинаризации изображения всегда зависит от данных, а это означает, что фильтры и обработка данных, которые должны быть применены к изображениям для оптимизации обнаружения интерфейса наночастицы / жидкости, будут варьироваться от эксперимента к другому. Кроме того, важно сравнить результаты этих автоматизированных анализов с ручными измерениями, выполненными на нескольких изображениях, чтобы оптимизировать рабочий процесс обработки изображений и узнать его ограничения. Здесь, например, множественные события рассеяния во все более толстых 3D-наночастицах, образующихся при высокой температуре, вызывают контрастную инверсию их ядра после 30 секунд наблюдения, поскольку угловое расширение рассеянных электронов приводит к уменьшению собранного сигнала в угловом диапазоне кольцевого детектора. Чтобы продолжать измерять истинную площадь поверхности этих наночастиц, мы использовали процесс данных «заполнения отверстий» после бинаризации изображения, который заполняет внутренний круг контрастов формы кольца(рисунок 7F,G). Тем не менее, нам пришлось использовать небольшую дилатацию объектов, чтобы убедиться, что эти контрасты формы кольца всегда полностью связаны. Этот последний этап приводит к небольшому завышению средней площади поверхности наночастиц в автоматизированных измерениях(рисунок 9). Аналогично, для обнаружения наночастиц мы должны определить минимальный размер обнаруженных объектов (Smim),чтобы избежать обнаружения шума, но этот параметр влияет на измеренную скорость нуклеации. Как видно на рисунке 8,количество обнаруженных наночастиц увеличивается в начале эксперимента, чтобы достичь плато. Когда Smin велик (50 пикселей2, что соответствует 1543 нм2),автоматические и ручные измерения согласовываются на уровне этого плато (835 наночастиц через 60 секунд), но обнаружение наночастиц задерживается при автоматическом анализе, поскольку 835 наночастиц вручную подсчитываются только через 12 с, но не обнаруживаются автоматически до более позднего времени. Это увеличенное время обнаружения приводит к недооценки скорости нуклеации. Уменьшение Smin до 20 пикселей2 (т.е. 617 нм2)уменьшает погрешность по времени нуклеации сборки наночастиц, но приводит к переоценке плотности наночастиц, особенно на ранней стадии экспериментов(рисунок 8),что также влияет на скорость нуклеации. Обнаружение и измерения размера и формы нанообъектов с очень динамичным поведением и низким отношением сигнал/шум является общей проблемой в жидкофазной ТЭМ, которая может быть дополнительно улучшена с использованием других методов сегментации и шумоподавления24 или подходов25машинного обучения.
И последнее, но не менее важное: подготовка жидкой ячейки и очистка держателя жидкости должны выполняться очень тщательно, чтобы избежать загрязнения реакционной среды.
В целом, контроль температуры образца во время анализа LCTEM дает возможность исследовать тепловое воздействие на химические реакции, которые происходят на границе раздела между твердыми телами и жидкостями. Поэтому мы надеемся, что настоящий метод проложит путь к другим экспериментам ТЕА in situ, направленным на выявление динамики твердых, мягких или биологических материалов в жидких средах с контролируемой температурой.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы с благодарностью признаем финансовую поддержку Региона Иль-де-Франс (конвенция SESAME E1845 для электронного микроскопа JEOL ARM 200 F, установленного в Парижском университете), Labex SEAM (проект GLOIRE) и CNRS (Программа Defi Nano). Мы благодарим Мадлен Дьюкс и Даниэля Франка за то, что они поделились схемами и оптическими изображениями жидких ячеек, которые видны на рисунках 1 и 2.
Материалы
| Name | Company | Catalog Number | Comments |
| 2100 Plus electron microscope | Jeol | ||
| Acetone | Merck | ||
| Air pistol | |||
| ARM 200F electron microscope | Jeol | ||
| Binoculars or optical microscope | |||
| Carbon tipped tweezers | |||
| Computer with heating software | Software by Protochips | ||
| Distlilled water | |||
| Dummy e-chips | Protochips | ||
| Gasket/O-rings | Protochips | ||
| Gold aqueous solution | Merck | 1 mM of HAuCl4 - Prepared beforehand | |
| Large liquid heating E-chip | Protochips | ||
| Methanol | Merck | ||
| One View camera | Gatan | ||
| Petri dish | Number : 2 | ||
| Plasma cleaner | Gatan | ||
| Poseidon Select | Protochips | Liquid cell holder | |
| Power supply Keithley 2450 | |||
| Protective gloves | |||
| Red PEEK tubing | Number : 3 | ||
| Screwdriver with torque | |||
| Small liquid E-chip | Protochips | 150 nm spacers | |
| STEM HAADF detector | Jeol | ||
| STEMx software | Gatan | ||
| Syringe | Number : 2 | ||
| Syringe pump | Harvard apparatus | Number : 2 | |
| Vacuum pump | Gatan |
Ссылки
- Willets, K. A., Van Duyne, R. P. Localized surface plasmon resonance spectroscopy and sensing. Annual Review of Physical Chemistry. 58 (1), 267-297 (2007).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chemical Society Review. 41, 2740-2779 (2012).
- You, H., Yang, S., Ding, B., Yang, H. Synthesis of colloidal metal and metal alloy nanoparticles for electrochemical energy applications. Chemical Society Review. 42, 2880-2904 (2013).
- Nikoobakht, B., El-Sayed, M. A. Preparation and growth mechanism of gold nanorods using seed-mediated growth method. Chemistry of Materials. 15, 1957-1962 (2003).
- Hubert, F., Testard, F., Spalla, O. Cetyltrimethylammonium bromid silver bromide complex as the capping agent of gold nanorods. Langmuir. 24, 9219-9222 (2008).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie International Edition. 48, 60-103 (2009).
- Zheng, Y., Zeng, J., Ruditskiy, A., Liu, M., Xia, Y. Oxidative etching and its role in manipulating the nucleation and growth of noble-metal nanocrystals. Chemistry of Materials. 26, 22-33 (2014).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12 (3), 1470-1474 (2012).
- Wu, J., et al. Growth of Auau on Pt icosahedral nanoparticles revealed by low-dose in situ TEM. Nano letters. 15, 2711-2715 (2015).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Exploring the formation of symmetric gold nanostars by liquid-cell transmission electron microscopy. Nano letters. 17, 4194-4201 (2017).
- Woehl, T. J., Evans, J. E., Arslan, I., Ristenpart, W. D., Browning, N. D. Direct in situ determination of the mechanisms controlling nanoparticle nucleation and growth. ACS Nano. 6, 8599-8610 (2012).
- Tan, S. F., et al. Intermediate structures of pt-ni nanoparticles during selective chemical and electrochemical etching. The Journal of Physical Chemistry Letters. 10, 6090-6096 (2019).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12, 1470-1474 (2012).
- Aliyah, K., et al. Real-time in situ observations reveal a double role for ascorbic acid in the anisotropic growth of silver on gold. The Journal of Physical Chemistry Letters. 11 (8), 2830-2837 (2020).
- Alloyeau, D., et al. Unravelling kinetic and thermodynamic effects on the growth of gold nanoplates by liquid transmission microscopy. Nano Letters. 15 (4), 2574-2581 (2015).
- Gao, W., et al. Direct in situ observation and analysis of the formation of palladium nanocrystals with high-index facets. Nano Letters. 18 (11), 7004-7013 (2018).
- Liao, H. -. G., et al. Facet development during platinum nanocube growth. Science. 345, 916-919 (2014).
- Tan, S. F., et al. Real-time imaging of the formation of Au-Ag core-shell nanoparticles. Journal of the American Chemical Society. 138 (16), 5190-5193 (2016).
- Khelfa, A. Selective shortening of gold nanorods: when surface functionalization dictates the reactivity of nanostructures. Nanoscale. 12, 22658-22667 (2020).
- Schneider, N. M., et al. Electron-water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118, 22373-22382 (2014).
- Ahmad, N., Le Bouar, Y., Ricolleau, C., Alloyeau, D. Growth of dendritic nanostructures by liquid-cell transmission electron microscopy: a reflection of the electron-irradiation history. Advanced Structural and Chemical Imaging. 2, 9 (2016).
- Khelfa, A., et al. Structural analysis of single nanoparticles in liquid by low-dose STEM nanodiffraction. Micron. 116, 30-35 (2019).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Driving Reversible Redox Reactions at Solid/Liquid Interfaces with the Electron Beam of a Transmission Electron Microscope. Journal of Microscopy. 269, 127-133 (2018).
- Schneider, N. M., Park, J. H., Norton, M. M., Ross, F. M., Bau, H. H. Automated analysis of evolving interfaces during in situ electron microscopy. Advanced Structural and Chemical Imaging. 2, (2016).
- Yao, L., Ou, Z., Luo, B., Xu, C., Chen, Q. Machine learning to reaveal nanoparticle dynamics from liquid-phase TEM videos. ACS Central Science. 6, 1421-1430 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены