Method Article
Estudando os efeitos da temperatura na nucleação e crescimento de nanopartículas por microscopia eletrônica de transmissão de células líquidas
Neste Artigo
Resumo
O controle de temperatura durante experimentos de microscopia eletrônica em fase líquida abre novas perspectivas de estudar a dinâmica das nanopartículas em ambientes líquidos imitando sua formação ou mídia de aplicação. Usando células líquidas de aquecimento recentemente desenvolvidas, observamos diretamente a influência da temperatura nos processos de nucleação e crescimento de nanopartículas de ouro na água.
Resumo
O controle de temperatura é um desenvolvimento recente que fornece um grau adicional de liberdade para estudar a nanoquímica por microscopia eletrônica de transmissão de células líquidas. Neste artigo, descrevemos como preparar um experimento de aquecimento in situ para estudar o efeito da temperatura na formação de nanopartículas de ouro impulsionadas por radiolise na água. O protocolo do experimento é bastante simples envolvendo uma célula líquida especial com capacidades uniformes de aquecimento até 100 °C, um suporte TEM de célula líquida com capacidades de fluxo e uma interface integrada para controlar a temperatura. Mostramos que os mecanismos de nucleação e crescimento das nanopartículas de ouro são drasticamente impactados pela temperatura em células líquidas. Usando imagem STEM e nanodiffraction, a evolução da densidade, tamanho, forma e estrutura atômica das nanopartículas em crescimento são reveladas em tempo real. Algoritmos automatizados de processamento de imagens são explorados para extrair dados quantitativos úteis de sequências de vídeo, como as taxas de nucleação e crescimento de nanopartículas. Esta abordagem fornece novos insumos para a compreensão dos complexos processos físico-químicos em jogo durante a síntese de fase líquida de nanomateriais.
Introdução
As nanopartículas metálicas (NPs) têm propriedades físico-químicas promissoras que podem ser usadas em vários domínios, como sensoriamento óptico1,medicina2 ou energia3. A síntese de produtos químicos molhados é um método muito versátil para fabricar NPs metálicos com tamanho e forma bem definidos. Ao longo das últimas décadas, muitas estratégias foram desenvolvidas para obter controle sobre a síntese de NPs: crescimento mediado por sementes4, método de bloqueio facial5,síntese controlada cineticamente6,gravura seletiva7 ou síntese controlada pela temperatura8. No entanto, embora as reações químicas que conduzem a síntese sejam bastante simples, os mecanismos de nucleação e crescimento não são, pois muitos parâmetros desempenham um papel nos processos de formação e sua influência individual são difíceis de recuperar dos instantâneos ex situ dos nanomateriais resultantes extraídos de seu meio de formação em determinados pontos de tempo da síntese. Para realmente entender os processos de nucleação e crescimento e estabelecer formas de controlá-los, devemos empregar ferramentas in situ que permitam sua observação em tempo real em ambiente líquido finamente controlado.
Nesse sentido, a Microscopia eletrônica de Transmissão de Células Líquidas (LCTEM) tem sido um método muito poderoso para lançar uma nova luz sobre a síntese de nanopartículas metálicas9,10,11,12,13. Ao imaginar a dinâmica das nanoestruturas individuais diretamente em suas mídias de formação líquida, essa técnica forneceu uma compreensão mais profunda dos mecanismos de nucleação e crescimento, notavelmente o papel de defeitos cristalinos, morfologia de sementes e ligantes orgânicos que permitem conduzir o crescimento direcional ou processos de gravura e a obtenção de nanomateriais com formas específicas (nanorods, nanostars, nanoplacas, nanoshells)10,11,12,13,14,15,16,17,18,19. Quando o feixe de elétrons de um TEM interage com líquidos, os processos de radiolise produzem espécies fortemente redutoras e oxidantes que modificam a química da solução na área irradiada e podem ser usadas para impulsionar o crescimento ou processos de gravação. Curiosamente, a concentração de produtos radiolíticos é conhecida por aumentar com a taxa de dose de elétrons, um parâmetro que pode ser finamente sintonizado em um microscópio eletrônico20. Portanto, essa dependência de taxa de dose de radiolise tem sido explorada para controlar a velocidade de reação e revelar efeitos cinéticos nos processos de formação e morfologia final das nanoestruturas11,15,20.
Embora a temperatura seja um parâmetro crucial na síntese de nanomateriais, seus efeitos até agora não foram cuidadosamente investigados pela LCTEM, porque células líquidas comerciais com controle de temperatura confiável só foram desenvolvidas recentemente. No entanto, tais estudos in situ são indispensáveis para desvendar a cinética complexa e os efeitos termodinâmicos induzem pelas mudanças de temperatura. De fato, por um lado o aumento da temperatura tem impactos drásticos nos processos de faceting durante o crescimento, acelera a difusão atômica e molecular em líquido e modifica as taxas de reação. Por outro lado, o diagrama nano-fase das nanoestruturas também é muito sensível à temperatura. Neste artigo, exploramos células líquidas de aquecimento recentemente desenvolvidas para acompanhar o crescimento radiolítico de nanopartículas de ouro na água com um controle de temperatura entre temperatura ambiente e 100 °C. Essa metodologia que combina imagem STEM e difração em um ambiente cada vez mais próximo das condições reais de síntese reduz a distância entre observações in situ TEM e sínteses em escala de bancada.
Protocolo
1. Alinhe o microscópio eletrônico de transmissão para imagens STEM HAADF
- Siga as instruções do fabricante para o alinhamento do microscópio.
- Use uma amostra seca convencional para alinhar o microscópio. Não utilize uma amostra líquida.
- Para minimizar a velocidade de crescimento, minimize a taxa de dose de elétrons (ver seção de discussão) que implica o uso de pequena abertura de condensador e tamanho de pequena mancha para reduzir a corrente do feixe.
2. Manuseio de e-chip
NOTA: Os detentores de líquidos comerciais se encaixam em quase todos os TEM, mas usam o suporte que é especificamente projetado para a marca de microscópio e a peça do polo. Uma célula líquida é feita de dois chips de silício baseados em MEMS chamados E-chips, ambos substratos de silício com uma janela de 500 x 50 μm coberta por um filme de nitreto de silício amorfo (SiN) de 50 nm de espessura que é transparente em elétrons(Figura 1A). Estes dois e-chips têm tamanhos diferentes. O pequeno é 2 x 2 mm com espaçadores dourados que fixam a distância entre os dois E-chips (150 nm aqui) e a espessura líquida. O grande é de 4 x 6 mm e tem uma resistência embutida dentro do substrato de silício que permite um aquecimento uniforme da amostra líquida(Figura 1B). Por causa da maneira como eles são fabricados em salas limpas, os E-chips têm dois lados diferentes: um onde a janela parece pequena (aqui depois chamada de parte da frente) e a outra onde a janela é grande com uma forma de pia (aqui depois chamada de parte de trás).
- Ao manusear os e-chips, nunca toque na janela com pinças e segure as lascas pelos lados. Para evitar arranhar a superfície do substrato de silício use pinças com ponta de carbono.
- Se colocar um E-chip em uma superfície, certifique-se de que a parte traseira esteja em contato com a superfície porque o filme SiN é frágil e é depositado na parte frontal.
3. Limpeza do suporte de célula líquida (antes do experimento)
- Retire a tampa que cobre a ponta do suporte. Remova as células líquidas falsas usando pinças. Remova a junta usada com as células líquidas falsas.
NOTA: As células líquidas falsas são células líquidas sem a janela SiN e apenas silício. São usados para armazenar o suporte de células líquidas na bomba de vácuo. Preste atenção ao estado dos parafusos de latão porque eles desmoronam facilmente com o tempo. Particularmente, se as cabeças do parafuso estiverem danificadas, os parafusos devem ser trocados. Caso contrário, pode ser difícil desaparafusá-los após o experimento e pequenos detritos também podem interromper o carregamento de amostras. - Injete manualmente 2 mL de água destilada dentro do suporte usando seringas e a tubulação peek externa para conectar-se à parte de trás do suporte.
NOTA: Há 3 túneis microfluidos dentro do suporte. Todos os três devem ser limpos com água. Preste atenção à água que sai da frente do suporte: se a água estiver colorida por causa de um experimento anterior, continue a colocar água dentro do suporte até que o líquido não esteja colorido. - Se injetar uma solução na célula líquida durante o experimento (1 mM de HAuCl4 em água em nosso estojo), encha o tubo do suporte da amostra com esta solução.
- Seque a ponta do suporte de célula líquida usando uma pistola de ar.
4. Preparação da célula líquida (E-chips)
- Limpeza das células líquidas.
- Encha uma placa de vidro de Petri com acetona.
- Encha uma placa de vidro de Petri com metanol.
ATENÇÃO: Devido à toxicidade do metanol, a placa de Petri com metanol deve ser colocada sob um capô de fumaça. O metanol deve ser manuseado com o equipamento de proteção adequado (luvas). - Coloque um pequeno e um e-chip grande na placa de Petri com acetona e espere por 2 minutos.
NOTA: Os e-chips são revestidos com uma camada protetora que precisa ser removida antes do experimento. Acetona removerá o fotoresistista e limpará os e-chips de detritos. Para melhorar a limpeza, a solução pode ser suavemente agitada. - Coloque os dois e-chips na placa de Petri com metanol e espere por 2 minutos. O metanol limpará os e-chips da acetona e o resto dos detritos.
ATENÇÃO: A transferência dos e-chips entre a acetona e o metanol deve ser feita o mais rápido possível para não deixar os E-chips secarem no ar. - Seque as células líquidas usando uma pistola de ar. Segure o e-chip usando pinças enquanto usa a pistola de ar. Tenha cuidado para não pressionar muito no gatilho da pistola de ar caso contrário, o E-chip pode cair das pinças. Se eles desistirem, reinicie a limpeza com acetona e metanol.
- Verifique a integridade da janela de nitreto de silício usando uma lupa binóculo ou um microscópio óptico(Figura 2).
NOTA: Certifique-se de que as janelas de ambos os e-chips estão limpas e não quebradas. Se os E-chips não parecem limpos, tente colocá-los de volta em acetona e metanol novamente. Se a sujeira ainda estiver na janela ou se a janela estiver quebrada, os E-chips devem ser trocados com os novos. - Limpe o plasma dos e-chips com uma mistura de argônio e gás oxigênio por 2 minutos. A limpeza plasmática dos e-chips permite que sejam hidrofílicos. Aqui estão os detalhes da limpeza plasmática configurada: fluxo de gás argônio = 35 sccm, fluxo de gás de oxigênio = 11,5 sccm, tempo limite de fluxo de gás = 20 s, alvo de RF dianteiro = 50 W, Alcance RF dianteiro = 5 W, RF refletido máximo = 5 W.
- Carregando as células líquidas no suporte TEM(Figura 3).
- Carregue os anéis O da junta dentro do suporte da célula líquida(Figura 3B). Verifique se a junta usada está limpa. Se não, limpe-o rapidamente com água destilada. Seque-o usando um papel filtro limpo. Para remover detritos e fibras na junta, pressione-o entre duas folhas de parafilm várias vezes.
- Coloque o pequeno E-chip dentro do suporte de células líquidas(Figura 3C). Para reduzir o arco dos filmes sin em direção ao vácuo do microscópio, coloque as janelas da célula líquida em uma configuração cruzada. Portanto, a janela do pequeno E-chip deve ser paralela ao comprimento do suporte e da face dianteira para cima. Certifique-se de que o pequeno E-chip está bem inserido dentro da junta.
- Prepare a amostra líquida (aqui, 1 mM de HAuCl4 na água).
- Solte ≈2 μL da amostra líquida no pequeno E-chip usando uma micropipette (Figura 3D). Se o pequeno e-chip tiver sido devidamente limpo plasmá plasma, a amostra líquida aquosa se espalhará uniformemente pela superfície do chip.
- Remova o líquido extra com um papel filtro. Com um pedaço de papel filtro bem cortado, reduza a espessura da camada líquida no pequeno E-chip até formar uma cúpula plana.
- Coloque o grande E-chip dentro do suporte de célula líquida(Figura 3E). Coloque o e-chip grande no pequeno com a frente para baixo (os lados dianteiros das duas fichas devem se enfrentar). Os eletrodos do grande E-chip devem estar em contato com o bloco de eletrodos no suporte.
- Deslize a tampa de volta no suporte da célula líquida. Aperte gradualmente cada parafuso(Figura 3F).
- Seque o líquido eventual que sai dos e-chips usando papel filtro de recorte pequeno. Verifique se não há líquido saindo em ambos os lados das células líquidas girando o suporte de células líquidas ao redor de seu eixo.
- Teste a vedação a vácuo da célula líquida em uma estação de bombeamento. Se o nível de vácuo da bomba atingir 5 x 10-2 Pa, continue o protocolo. Caso não, verifique a integridade da janela (provavelmente está quebrada) e inicie o protocolo desde o início com um novo conjunto de E-chips.
- Verifique uma última vez a integridade da janela de nitreto de silício usando uma lupa binóculo ou um microscópio óptico. Às vezes, a célula líquida será capaz de sustentar o vácuo da estação de bombeamento mesmo que a janela esteja quebrada. Isso porque quando a janela quebra e o líquido derrama, ele pode formar agregados de sal na parte quebrada da janela, cobrindo assim o buraco. Se isso acontecer, prepare um novo conjunto de E-chips.
- Carregue o suporte de célula líquida no TEM e verifique o nível de vácuo. Mesmo que a célula líquida tenha sustentado o vácuo da estação de bombeamento e não haja nenhum problema visível com a janela, o micro-vazamento da célula líquida pode evitar atingir o nível de vácuo necessário para operar o TEM. Se o microscópio não conseguir atingir o nível de vácuo necessário para operar (2-5 x 10-5 Pa), remova o suporte de amostra e prepare um novo conjunto de e-chips.
5. Use o suporte líquido no modo de fluxo
- Encha 2 seringas com alguns mililitros da solução a ser injetada (1 mM de HAuCl4 em água no nosso caso).
- Conecte 2 tubos peek externos às seringas. Coloque as 2 seringas nas bombas de seringa. Insira os tubos peek externos nas 2 entradas do suporte de célula líquida. Insira um tubo peek externo adicional para a saída do suporte da célula líquida.
- Injete a solução com uma taxa de fluxo de 5 μL/min em cada entrada.
6. Aquecimento do ambiente líquido
- Conecte a fonte de alimentação ao suporte. Conecte a fonte de alimentação ao computador no qual o software de aquecimento está instalado.
- Ligue o computador e abra o software de aquecimento. Ligue a fonte de alimentação.
- Clique no botão de verificação do dispositivo. Se o software indicar "passado", o experimento pode continuar. Caso contrário, o grande E-chip pode ter um problema (carregamento incorreto do E-chip, eletrodos quebrados...).
- Clique na guia Experimentar. Clique em Manual para ativar o modo manual de aquecimento.
- Selecione a temperatura alvo e altere de acordo a taxa de temperatura. Pressione aplicar para aquecer os e-chips à temperatura-alvo(Figura 4).
NOTA: Os e-chips podem ser aquecidos até 100 °C. Se uma solução aquosa for usada para o experimento (como no nosso caso), evite aquecer os e-chips acima de 90 °C. Caso contrário, a amostra líquida pode secar. Ao aquecer o líquido, a temperatura pode subir temporariamente acima da temperatura-alvo e, em seguida, cair de volta para a temperatura desejada. Use baixa taxa de aquecimento para minimizar tais ultrapassagens (1 °C/s está bem). - Clique em Ambiente para voltar à temperatura ambiente (25 °C). Clique em Parar para parar o aquecimento abruptamente. Clique na guia Sessão Fim para finalizar o experimento de aquecimento.
7. Imagem STEM do crescimento de nanopartículas
- Use o microscópio no modo STEM usando o detector HAADF. Vá para uma área intocada da amostra, perto de um canto da janela de observação onde a espessura do líquido é mínima. Adquira vídeos de crescimento de nanopartículas para diferentes temperaturas do líquido(Figura 5).
NOTA: As nanopartículas de ouro aparecem imediatamente e crescem na área digitalizada. A gravação de vídeo com uma taxa de quadros de uma imagem por segundo é um bom compromisso para observar os processos de crescimento com boa relação sinal-ruído e uma boa resolução de tempo.
8. Nanodiffraction STEM de nanopartículas simples
- Adquira uma imagem STEM HAADF de vários nano-objetos. Adquirir o padrão de difração de nanopartículas individuais selecionadas na imagem usando o software STEMx (Figura 6).
NOTA: A nanodiffração STEM é uma técnica que permite a aquisição do padrão de difração de nanopartículas únicas em líquido durante os experimentos de crescimento22. - Após a aquisição de uma imagem STEM HAADF, selecione vários nano-objetos na imagem e o software STEMx sincroniza automaticamente a posição da sonda e da câmera CCD para adquirir o padrão de difração em cada posição da sonda. Para evitar a sobreposição dos pontos de difração, use um pequeno ângulo de convergência da sonda STEM (7,4 mrad em nosso caso) usando pequena abertura condensadora (10 μm em nosso caso).
9. Limpeza do suporte de célula líquida (após o experimento)
NOTA: Aqui descrevemos um procedimento padrão de limpeza para o suporte de célula líquida. Se esta limpeza não for eficiente o suficiente, é possível usar ácido nítrico diluído e metanol para eliminar os eventuais agregados de nanopartículas no suporte de células líquidas. A documentação de compatibilidade química do suporte de células líquidas deve ser consultada antes. Em todo caso, sempre termine a limpeza com a injeção de água destilada.
- Retire a tampa. Remova os e-chips usados. Remova a junta interna.
NOTA: Os e-chips usados podem ser armazenados em uma caixa adaptada. Em seguida, é possível realizar análises ex situ TEM ou SEM dos nano-objetos que permaneceram ligados às janelas do SiN após o deslatado da célula líquida15. Não é aconselhável reutilizar os E-chips para outro experimento in situ, mas ainda é possível se o filme SiN não tiver sido quebrado durante o desvelamento da célula líquida. Experimentos de crescimento excessivo em um solvente diferente podem então ser realizados. 23 - Injete 5 mL de água destilada na entrada e tubo de saída do suporte da célula líquida.
- Limpe a ponta do suporte de célula líquida usando um banho ultrassônico por 20 minutos. A almofada de contato pode ser imersa no banho. Apenas mergulhe a parte que está coberta com a tampa. Não mergulhe os orifícios de ventilação em líquido.
- Seque o suporte da célula líquida usando uma pistola de ar.
- Coloque de volta a junta usada com as células líquidas falsas. Coloque de volta as células líquidas falsas e a tampa.
- Armazene o suporte da amostra em uma estação de vácuo.
10. Análise pós-experimento usando Fiji (ImageJ)
NOTA: Recomenda-se dividir cada quadro do vídeo levado em imagens únicas. O objetivo desta etapa de análise pós-experimento é transformar os vídeos originais das nanopartículas em vídeos binários que podem ser analisados por Fiji. Um filtro mediano é usado para melhorar o contraste das nanopartículas no fundo (Figuras 7B & 7E). Isso é essencial para facilitar a binarização do vídeo.
- Abra o diretório de arquivos contendo as imagens do vídeo em Fiji clicando em Arquivo | | de importação Sequência de imagem. A janela de opções de sequência aparecerá. Selecione a imagem inicial apropriada (se o início do vídeo for descartado). Digite o número de incremento para a sequência de imagem (corresponde ao número de quadros necessários para que a varredura STEM chegue à parte inferior da imagem). Verifique a caixa para Converter em escala de cinza de 8 bits. Salve a sequência de imagem em formato de disputa.
- Corte todos os artefatos indesejados do vídeo (por exemplo, a barra de escala ou a borda da janela da célula líquida).
- Clique em Process | Filtros | Mediana para aplicar um filtro mediano em todas as imagens. Salve a sequência de imagem processada em formato de tiff.
NOTA: Uma janela aparecerá perguntando o raio usado para o filtro mediano. Usamos um raio de 2 pixels, mas nos sentimos livres para usar parâmetros diferentes. Outros filtros também estão disponíveis em Fiji que poderiam ser usados para melhorar o processamento da imagem. Particularmente, o algoritmo de fundo subtraído pode ser usado para tornar a intensidade de fundo plana se não for uniforme. Para isso, clique em Process | Fundo de substrato. No nosso caso, esse processo cria pequenas manchas brancas no fundo das primeiras imagens que podem ser interpretadas como falsas nanopartículas. Assim, não utilizamos esse processo, mas deve ser experimentado em outros conjuntos de dados, pois o aumento da espessura líquida do canto para o centro da célula líquida geralmente induz a intensidade de fundo não uniforme em imagens LCTEM de baixa ampliação. - Clique em Imagem | Ajuste | Limiar. Mova-se manualmente para uma melhor precisão do limiar da binarização até que apenas as nanopartículas sejam coloridas em vermelho. Pressione o botão de aplicação. A pilha Converter para janela binária aparecerá. Desmarcar calcular limiar para cada imagem. Salve a sequência de imagem binária no formato tiff (Figuras 7C & 7F).
NOTA: Recomenda-se verificar se o limiar está satisfatório em cada quadro do vídeo. - Faça este passo somente se houver uma inversão de contraste das nanopartículas durante o vídeo. Clique em Process | | binário Dilatação. Faça mais uma vez, se necessário. Clique em Process | | binário Preenchimento de furos (Figura 7G,consulte a seção de discussão).
- Clique em Analisar | Analise partículas. Defina a faixa de tamanho das nanopartículas analisadas observadas durante o experimento. Confira resumo.
NOTA: É muito importante pelo menos definir o tamanho mínimo das nanopartículas observadas. Sem ele, os pequenos pontos pretos (ruído) que aparecem na sequência de imagem binária serão considerados como nanopartículas. Como uma primeira tentativa, escolha o tamanho das menores nanopartículas identificadas pelo olho, mas então um processo de tentativa e erro é necessário para entender o efeito desse parâmetro e otimizar a análise automatizada de dados (ver seção de discussão). Antes desta etapa, para recuperar a área das nanopartículas, clique em Analisar | Definir medidas e verificar área. Outras medidas estão disponíveis. - Salve as janelas resultados e resumos. O número de nanopartículas para cada quadro está na janela de dados Resumo.
Resultados
A Figura 5 mostra duas séries de imagens STEM HAADF de formação de nanopartículas de ouro adquiridas ao longo de 80 segundos a 25 °C e 85 °C. Em todos esses experimentos, a nucleação e o crescimento das nanopartículas é impulsionado pela radiolise da água. Entre as espécies químicas geradas por este fenômeno induzido pelo feixe de elétrons, agentes redutores fortes (ou seja, elétrons aquosos e radicais de hidrogênio) podem reduzir o ácido tetracloroautérico levando à formação de nanocristais de ouro na interface entre as janelas sin e o líquido. Estas duas observações in situ realizadas com a mesma taxa de dose de elétrons confirmam que o presente método permite visualizar o impacto drástico da temperatura na formação de nanopartículas em mídia líquida. A baixa temperatura, observamos o crescimento de uma montagem muito densa de pequenas nanopartículas, enquanto em alta temperatura são obtidas algumas grandes e bem facetted nanoestruturas. Como o contraste das imagens STEM HAADF é proporcional à espessura das nanopartículas de ouro, podemos ver que duas populações de objetos são formadas durante esses experimentos de crescimento: nanopartículas 3D altamente contrastadas e grandes nanoestruturas 2D com forma triangular ou hexagonal e um contraste inferior (indicado por setas vermelhas na Figura 5).
O método de análise de vídeo descrito neste protocolo permite quantificar os processos de nucleação e crescimento medindo ao longo do tempo o número de nanopartículas e sua área média de superfície na área observada. Como visto na Figura 8,a baixa temperatura mais de 800 nanopartículas são formadas dentro de algumas dezenas de segundos de observação, enquanto apenas 30 nanopartículas são formadas a alta temperatura. Além de dois nanoplatos triangulares e hexagonais, todas as nanopartículas já estão presentes na primeira imagem do seguimento de alta temperatura. A Figura 9 mostra que a área média da superfície das nanopartículas aumenta 40 vezes mais rápido a 85 °C do que a 25 °C.
A Figura 6 representa uma imagem típica de STEM e o padrão de difração de duas nanopartículas de ouro que foram selecionadas diretamente na imagem (indicadas por setas vermelhas na Figura 6A). Aqui, podemos identificar a estrutura cúbica centrada no rosto (FCC) de ouro orientada ao longo dos eixos de zona [001] (Figura 6B) e [112](Figura 6C).
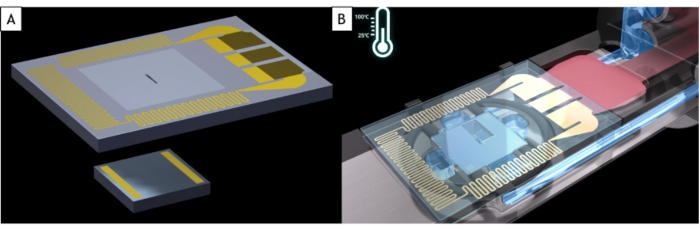
Figura 1: Esquema dos e-chips e da ponta do suporte de célula líquida. (A) O grande e-chip com a resistência usada para aquecer a célula líquida (superior) e o pequeno E-chip (inferior). (B) Ambos os e-chips são carregados no suporte de célula líquida. Os eletrodos do grande E-chip estão em contato com almofadas de eletrodos do suporte de células líquidas. A resistência do grande E-chip pode aquecer a célula líquida. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens de microscópio óptico de e-chips ilustrando: (A) Uma janela SiN intacta necessária para o experimento. (B) Um wafer de silício danificado na borda do E-Chip. Este tipo de e-chips pode ser usado se a área danificada estiver fora da área úmida uma vez que a célula líquida esteja selada (ou seja, se o dano estiver fora da área definida pelos anéis O). (C) Resíduos na superfície do chip E. Se esses resíduos não saírem após a repetição dos processos de limpeza (ver seção 4.1), não utilize o e-chip. (D a F) Janelas SiN danificadas (e-chips não imusáveis). Clique aqui para ver uma versão maior desta figura.

Figura 3: Fotos do processo passo a passo do carregamento da célula líquida no suporte TEM. (A) Somente o titular da amostra. (B) Coloque a junta O-ring na cavidade. (C) Insira o pequeno e-chip em anéis O de junta. (D) Coloque uma gota de solução nos pequenos E-chips. (E) Coloque o e-chip grande sobre o pequeno. (F) Selar toda a célula líquida aparafusando a tampa. Clique aqui para ver uma versão maior desta figura.
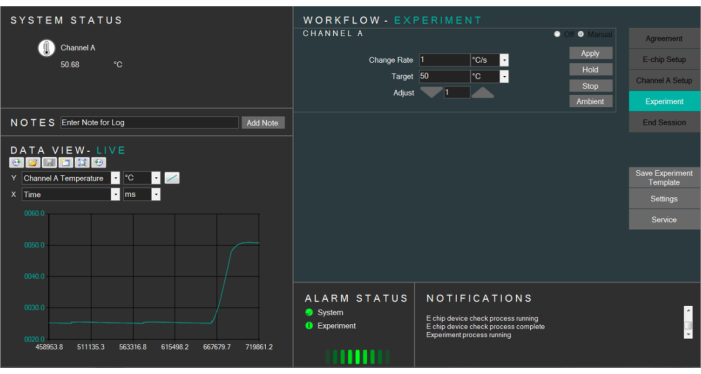
Figura 4: Captura de tela do software de aquecimento que controla a temperatura da célula líquida. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5: Série de imagens STEM HAADF de baixa ampliação do crescimento de nanopartículas de ouro. (A) A 25 °C. (B) A 85 °C. O tempo correspondente é indicado no canto inferior esquerdo de cada imagem. As nanoestruturas 2D são indicadas por setas vermelhas. Todas as imagens são adquiridas com a mesma taxa de dose eletrônica de 3,4elétrons·s -1·nm-2. Clique aqui para ver uma versão maior desta figura.

Figura 6: Nanodiffraction STEM de nanopartículas únicas. (A) Imagem STEM usada para selecionar as nanopartículas difracionárias (as posições da sonda durante as aquisições de difração são indicadas por setas vermelhas). (B,C) Padrão de difração das duas nanopartículas selecionadas. Clique aqui para ver uma versão maior desta figura.

Figura 7: Processamento de dados e análise de imagens STEM HAADF usando Fiji. As imagens foram adquiridas 40 segundos após o início do crescimento. (A a C) Imagem adquirida a 25 °C. (D a G) Imagem adquirida a 85 °C. (A,D) Imagem STEM bruta. (B,E) Imagem processada (filtro mediano). (C,F) Imagem binária. (G) Uma dilatação dos pixels é aplicada duas vezes e o processo "Preencher buracos" é então aplicado. Clique aqui para ver uma versão maior desta figura.
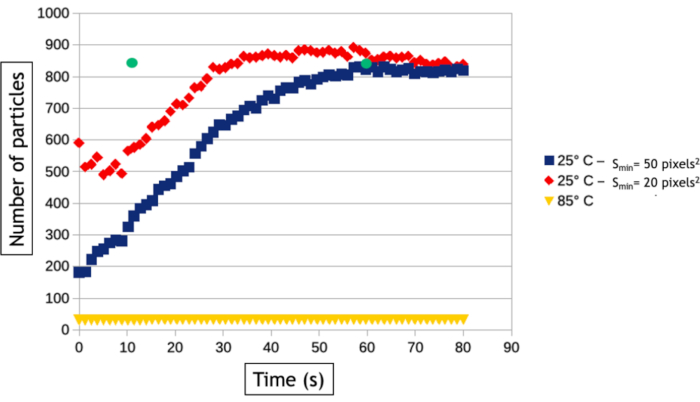
Figura 8: Gráfico representando o número de nanopartículas de ouro em função do tempo a 25 °C e 85 °C. As duas curvas a 25°C são automaticamente medidas com um tamanho mínimo de detecção (Smin)de 20 (vermelho) e 50 (azul) pixels2. Os pontos verdes medidos após 12 e 60 segundos de aquisição representam o número de nanopartículas contadas manualmente no vídeo adquirido a 25 °C. Clique aqui para ver uma versão maior desta figura.
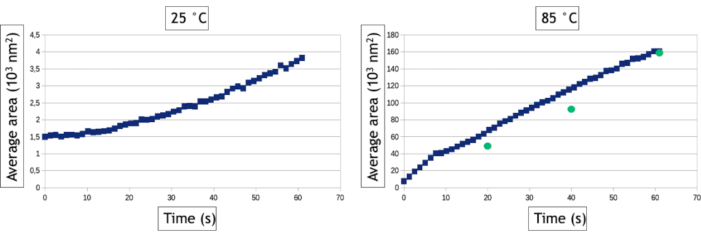
Figura 9: Gráficos representando a área média da superfície das nanopartículas de ouro em função do tempo para 25 °C e 85 °C. Os pontos verdes representam medições manuais da área média de nanopartículas em determinados pontos de tempo do vídeo adquiridos a 85° C. Clique aqui para ver uma versão maior desta figura.

Figura 10: Série de imagens STEM HAADF de alta ampliação do crescimento de nanocubo de ouro único a 85 °C. Esta série de imagens foi adquirida com uma taxa de dose eletrônica de 83,6 elétrons.s-1.nm-2. Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo descrito permite acompanhar a nucleação e o crescimento de nanopartículas de ouro impulsionadas por radiolise em uma mídia líquida controlada pela temperatura. Combinado com o processamento automatizado de vídeo, permite medir o efeito da temperatura sobre parâmetros-chave da síntese de nanopartículas, como a densidade, o tamanho, a forma e a estrutura atômica das nanopartículas. Esses valiosos insumos permitem avaliar o efeito da temperatura sobre as taxas de nucleação e crescimento, detectar possíveis transições de fase e visualizar os processos de facetação que ditam o resultado final das soluções coloidais. Juntamente com a possibilidade de controlar a composição dos meios reativos, a célula líquida controlada pela temperatura TEM é mais um passo para a observação direta dos processos de nucleação e crescimento de várias nanoestruturas em condições realistas de síntese. A interpretação dos resultados apresentados neste artigo e sua comparação com os modelos de nucleação e crescimento serão discutidas em outros lugares. Aqui, queremos destacar vários aspectos metodológicos que devem ser considerados relevantes em experimentos TEM in situ.
Em primeiro lugar, é crucial identificar os efeitos do feixe de elétrons na mídia de reação porque eles podem influenciar drasticamente os resultados do experimento. Aqui, como a radiolise hídrica é a força motriz da formação de nanopartículas, a velocidade de crescimento aumenta rapidamente com a taxa de dose de elétrons que impactará a forma final de nanoí objetos11,15. Portanto, para estudar os efeitos da temperatura na nucleação e crescimento de nanopartículas, é necessário comparar experimentos de crescimento adquiridos com a mesma taxa de dose de elétrons. No modo STEM, a taxa de dose de elétrons corresponde à corrente do feixe (em elétron por segundo) dividida pelo tamanho da imagem (em nm2). Portanto, uma taxa constante de dose de elétrons implica manter a mesma corrente de feixe (ou seja, a mesma abertura condensadora e o mesmo tamanho da mancha) e a mesma ampliação para cada experimento. Quantificar a corrente de feixe das condições de imagem usando uma câmera CCD ou um copo Faraday é importante para interpretar e reproduzir os dados. A ampliação e a taxa de dose resultante devem ser selecionadas de acordo com se desejamos visualizar o crescimento de um grande conjunto de nanopartículas para extrair resultados estatisticamente relevantes sobre a cinética de crescimento(Figura 5) ou os mecanismos de crescimento na escala de nanopartículas únicas para identificar os locais de adsorção preferencial nas superfícies das nanopartículas(Figura 10). Se os processos de nucleação e crescimento forem muito rápidos, particularmente na alta ampliação, uma pequena abertura de condensador e o pequeno tamanho das manchas devem ser selecionados para minimizar a taxa de dose. A nucleação e o crescimento de nanopartículas também podem desacelerar reduzindo a concentração de precursor de metal na solução analisada, mas note que a concentração de produtos radiolíticos aumentará com a temperatura. De uma forma geral, também é importante levar em conta a história de irradiação eletrônica de toda a amostra. Aqui, por exemplo, se vários experimentos de crescimento forem rapidamente realizados em áreas próximas umas das outras, a densidade de nanopartículas diminuirá com o tempo porque a concentração de precursores de ouro na área estudada diminui. Esse efeito pode ser minimizado separando os experimentos de crescimento tanto no espaço quanto no tempo e usando o suporte líquido no modo de fluxo.
Algoritmos de rastreamento de interface são extremamente úteis para automatizar a análise de vídeos e extrair resultados quantitativos sobre a nucleação e crescimento de grandes conjuntos de nanopartículas. No entanto, vale ressaltar que a etapa de binarização de imagem é sempre específica dos dados, o que significa que os filtros e o processamento de dados que devem ser aplicados em imagens para otimizar a detecção da interface nanopartícula/líquida variam de um experimento para outro. Além disso, é essencial comparar os resultados dessas análises automatizadas com medições manuais realizadas em poucas imagens para otimizar o fluxo de trabalho de processamento de imagem e conhecer suas limitações. Aqui, por exemplo, múltiplos eventos de dispersão nas nanopartículas 3D cada vez mais espessas formadas a alta temperatura induz uma inversão de contraste de seu núcleo após 30 segundos de observação porque a ampliação angular de elétrons dispersos resulta em uma diminuição do sinal coletado na faixa angular do detector anular. Para continuar medindo a verdadeira área superficial dessas nanopartículas, utilizamos um processo de dados de "preenchimento" após a binarização da imagem que preenche o círculo interno dos contrastes de forma de anel(Figura 7F,G). No entanto, tivemos que usar uma pequena dilatação dos objetos para garantir que esses contrastes de forma de anel estejam sempre totalmente conectados. Este último passo leva a uma leve supervalorização da área média da superfície das nanopartículas nas medidas automatizadas(Figura 9). Da mesma forma, para a detecção de nanopartículas, temos que definir um tamanho mínimo de objetos detectados (Smim) para evitar detectar o ruído, mas este parâmetro afeta a taxa de nucleação medida. Como visto na Figura 8,o número de nanopartículas detectadas aumenta no início do experimento para chegar a um platô. Quando smin é grande (50 pixels2 correspondente a 1543 nm2), medições automáticas e manuais acordadas no nível deste planalto (835 nanopartículas após 60 segundos), mas a detecção de nanopartículas é retardada na análise automática, uma vez que 835 nanopartículas são contadas manualmente após apenas 12 s, mas não automaticamente detectadas até mais tarde. Esse tempo de detecção estendido leva a uma desvalorização da taxa de nucleação. Reduzir Smin até 20pixels 2 (ou seja, 617 nm2) reduz o erro no tempo de nucleação do conjunto de nanopartículas, mas leva a uma supervalorização da densidade de nanopartículas particularmente no estágio inicial dos experimentos(Figura 8) que também afeta a taxa de nucleação. A detecção e as medidas de tamanho e forma de nanoítos com um comportamento muito dinâmico e uma baixa relação sinal/ruído é um desafio comum no TEM de fase líquida que pode ser melhorado usando outros métodos de segmentação e desnoização24 ou machine learning se aproxima25.
Por último, mas não menos importante, a preparação da célula líquida e a limpeza do suporte líquido devem ser realizadas com muito cuidado para evitar contaminações dos meios de reação.
Em geral, controlar a temperatura da amostra durante as análises da LCTEM proporciona a oportunidade de investigar efeitos térmicos sobre reações químicas que ocorrem na interface entre sólidos e líquidos. Portanto, esperamos que o presente método abra caminho para outros experimentos IN SITU TEM projetados para revelar a dinâmica de materiais duros, macios ou biológicos em meios líquidos controlados pela temperatura.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos o apoio financeiro da Região Ile-de-France (convenção SESAME E1845 para o microscópio eletrônico JEOL ARM 200 F instalado na Universidade de Paris), o Labex SEAM (Projeto GLOIRE) e o CNRS (Programa Defi Nano). Agradecemos a Madeline Dukes e Daniel Franck por compartilharem os esquemas e as imagens ópticas das células líquidas vistas nas figuras 1 e 2.
Materiais
| Name | Company | Catalog Number | Comments |
| 2100 Plus electron microscope | Jeol | ||
| Acetone | Merck | ||
| Air pistol | |||
| ARM 200F electron microscope | Jeol | ||
| Binoculars or optical microscope | |||
| Carbon tipped tweezers | |||
| Computer with heating software | Software by Protochips | ||
| Distlilled water | |||
| Dummy e-chips | Protochips | ||
| Gasket/O-rings | Protochips | ||
| Gold aqueous solution | Merck | 1 mM of HAuCl4 - Prepared beforehand | |
| Large liquid heating E-chip | Protochips | ||
| Methanol | Merck | ||
| One View camera | Gatan | ||
| Petri dish | Number : 2 | ||
| Plasma cleaner | Gatan | ||
| Poseidon Select | Protochips | Liquid cell holder | |
| Power supply Keithley 2450 | |||
| Protective gloves | |||
| Red PEEK tubing | Number : 3 | ||
| Screwdriver with torque | |||
| Small liquid E-chip | Protochips | 150 nm spacers | |
| STEM HAADF detector | Jeol | ||
| STEMx software | Gatan | ||
| Syringe | Number : 2 | ||
| Syringe pump | Harvard apparatus | Number : 2 | |
| Vacuum pump | Gatan |
Referências
- Willets, K. A., Van Duyne, R. P. Localized surface plasmon resonance spectroscopy and sensing. Annual Review of Physical Chemistry. 58 (1), 267-297 (2007).
- Dreaden, E. C., Alkilany, A. M., Huang, X., Murphy, C. J., El-Sayed, M. A. The golden age: gold nanoparticles for biomedicine. Chemical Society Review. 41, 2740-2779 (2012).
- You, H., Yang, S., Ding, B., Yang, H. Synthesis of colloidal metal and metal alloy nanoparticles for electrochemical energy applications. Chemical Society Review. 42, 2880-2904 (2013).
- Nikoobakht, B., El-Sayed, M. A. Preparation and growth mechanism of gold nanorods using seed-mediated growth method. Chemistry of Materials. 15, 1957-1962 (2003).
- Hubert, F., Testard, F., Spalla, O. Cetyltrimethylammonium bromid silver bromide complex as the capping agent of gold nanorods. Langmuir. 24, 9219-9222 (2008).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie International Edition. 48, 60-103 (2009).
- Zheng, Y., Zeng, J., Ruditskiy, A., Liu, M., Xia, Y. Oxidative etching and its role in manipulating the nucleation and growth of noble-metal nanocrystals. Chemistry of Materials. 26, 22-33 (2014).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12 (3), 1470-1474 (2012).
- Wu, J., et al. Growth of Auau on Pt icosahedral nanoparticles revealed by low-dose in situ TEM. Nano letters. 15, 2711-2715 (2015).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Exploring the formation of symmetric gold nanostars by liquid-cell transmission electron microscopy. Nano letters. 17, 4194-4201 (2017).
- Woehl, T. J., Evans, J. E., Arslan, I., Ristenpart, W. D., Browning, N. D. Direct in situ determination of the mechanisms controlling nanoparticle nucleation and growth. ACS Nano. 6, 8599-8610 (2012).
- Tan, S. F., et al. Intermediate structures of pt-ni nanoparticles during selective chemical and electrochemical etching. The Journal of Physical Chemistry Letters. 10, 6090-6096 (2019).
- Xin, H. L., Zheng, H. In situ observation of oscillatory growth of bismuth nanoparticles. Nano Letters. 12, 1470-1474 (2012).
- Aliyah, K., et al. Real-time in situ observations reveal a double role for ascorbic acid in the anisotropic growth of silver on gold. The Journal of Physical Chemistry Letters. 11 (8), 2830-2837 (2020).
- Alloyeau, D., et al. Unravelling kinetic and thermodynamic effects on the growth of gold nanoplates by liquid transmission microscopy. Nano Letters. 15 (4), 2574-2581 (2015).
- Gao, W., et al. Direct in situ observation and analysis of the formation of palladium nanocrystals with high-index facets. Nano Letters. 18 (11), 7004-7013 (2018).
- Liao, H. -. G., et al. Facet development during platinum nanocube growth. Science. 345, 916-919 (2014).
- Tan, S. F., et al. Real-time imaging of the formation of Au-Ag core-shell nanoparticles. Journal of the American Chemical Society. 138 (16), 5190-5193 (2016).
- Khelfa, A. Selective shortening of gold nanorods: when surface functionalization dictates the reactivity of nanostructures. Nanoscale. 12, 22658-22667 (2020).
- Schneider, N. M., et al. Electron-water interactions and implications for liquid cell electron microscopy. Journal of Physical Chemistry C. 118, 22373-22382 (2014).
- Ahmad, N., Le Bouar, Y., Ricolleau, C., Alloyeau, D. Growth of dendritic nanostructures by liquid-cell transmission electron microscopy: a reflection of the electron-irradiation history. Advanced Structural and Chemical Imaging. 2, 9 (2016).
- Khelfa, A., et al. Structural analysis of single nanoparticles in liquid by low-dose STEM nanodiffraction. Micron. 116, 30-35 (2019).
- Ahmad, N., Wang, G., Nelayah, J., Ricolleau, C., Alloyeau, D. Driving Reversible Redox Reactions at Solid/Liquid Interfaces with the Electron Beam of a Transmission Electron Microscope. Journal of Microscopy. 269, 127-133 (2018).
- Schneider, N. M., Park, J. H., Norton, M. M., Ross, F. M., Bau, H. H. Automated analysis of evolving interfaces during in situ electron microscopy. Advanced Structural and Chemical Imaging. 2, (2016).
- Yao, L., Ou, Z., Luo, B., Xu, C., Chen, Q. Machine learning to reaveal nanoparticle dynamics from liquid-phase TEM videos. ACS Central Science. 6, 1421-1430 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados