Method Article
Multi-Timescale-Mikroskopie-Methoden zur Charakterisierung fluoreszenzmarkierter Mikroblasen für die ultraschallgesteuerte Wirkstofffreisetzung
In diesem Artikel
Zusammenfassung
Die vorgestellten Protokolle können verwendet werden, um die Reaktion von fluoreszenzmarkierten Mikrobläschen zu charakterisieren, die für ultraschallgesteuerte Arzneimittelabgabeanwendungen entwickelt wurden, einschließlich ihrer Aktivierungsmechanismen sowie ihrer Bioeffekte. Dieser Artikel behandelt eine Reihe von In-vitro- und In-vivo-Mikroskopietechniken , die durchgeführt werden, um die relevanten Längen- und Zeitskalen zu erfassen.
Zusammenfassung
Mikroblasen-Kontrastmittel sind vielversprechend für Anwendungen zur Arzneimittelabgabe mit Ultraschall. Die Verkapselung von Arzneimitteln in Nanopartikeln reduziert die systemische Toxizität und erhöht die Zirkulationszeit der Arzneimittel. In einem neuartigen Ansatz zur mikroblasengestützten Wirkstoffabgabe werden Nanopartikel in oder auf Mikrobläschenschalen eingebaut, was eine lokale und ausgelöste Freisetzung der Nanopartikelnutzlast mit Ultraschall ermöglicht. Ein gründliches Verständnis der Freisetzungsmechanismen innerhalb des riesigen Ultraschallparameterraums ist entscheidend für eine effiziente und kontrollierte Freisetzung. Dieser Satz der vorgestellten Protokolle ist auf Mikrobläschen mit einer Hülle anwendbar, die eine fluoreszierende Markierung enthält. Hier liegt der Fokus auf Mikrobläschen, die mit Polymer-Nanopartikeln aus Poly(2-ethyl-butylcyanoacrylat) beladen sind, die mit einem modifizierten Nilrotfarbstoff dotiert sind. Die Partikel werden in einer denaturierten Kaseinhülle fixiert. Die Mikrobläschen werden durch kräftiges Rühren hergestellt und bilden in der flüssigen Phase eine Dispersion von Perfluorpropangas, die Casein und Nanopartikel enthält, wonach sich die Mikroblasenhülle selbst zusammensetzt. Eine Vielzahl von Mikroskopietechniken ist erforderlich, um die nanopartikelstabilisierten Mikrobläschen auf allen relevanten Zeitskalen des Nanopartikel-Freisetzungsprozesses zu charakterisieren. Die Fluoreszenz der Nanopartikel ermöglicht die konfokale Abbildung einzelner Mikrobläschen und deckt die Partikelverteilung innerhalb der Schale auf. Die In-vitro-Ultrahochgeschwindigkeitsbildgebung mittels Hellfeldmikroskopie bei 10 Millionen Bildern pro Sekunde liefert Einblicke in die Blasendynamik als Reaktion auf Ultraschallinsonation. Schließlich wird die Freisetzung von Nanopartikeln aus der Blasenhülle am besten mittels Fluoreszenzmikroskopie sichtbar gemacht, die mit 500.000 Bildern pro Sekunde durchgeführt wird. Um die Wirkstoffabgabe in vivo zu charakterisieren, wird die ausgelöste Freisetzung von Nanopartikeln innerhalb des Gefäßsystems und ihre Extravasation über die Endothelschicht hinaus mittels intravitaler Mikroskopie bei Tumoren, die in dorsale Hautfaltenfensterkammern implantiert wurden, über einen Zeitraum von mehreren Minuten untersucht. Die Kombination dieser komplementären Charakterisierungstechniken bietet einen einzigartigen Einblick in das Verhalten von Mikrobläschen und ihre Nutzlastfreisetzung auf einer Reihe von Zeit- und Längenskalen, sowohl in vitro als auch in vivo.
Einleitung
Ultraschall ist die am weitesten verbreitete medizinische Bildgebungstechnik. Es ist nicht-invasiv, schnell, sicher, kostengünstig und tragbar1,2,3. Blut ist jedoch ein schlechter Ultraschallstreuer, und der Kontrast des Blutpools kann durch eine intravenöse Injektion von Ultraschallkontrastmitteln verbessert werden3. Dieser verbesserte Blutpoolkontrast ermöglicht die Quantifizierung der Organperfusion für diagnostische Zwecke, z. B. beim Nachweis der koronaren Herzkrankheit4 und der metastasierenden Lebererkrankung5. Tatsächlich erwies sich das Tumorgefäßsystem als wichtiger prognostischer Faktor6. Eine große Forschungsanstrengung richtet sich nun auf mikroblasengestützte, zielgerichtete molekulare Bildgebung und maßgeschneiderte Kontrastmittel für den therapeutischen Einsatz.
Handelsübliche Ultraschallkontrastmittel bestehen typischerweise aus einer Suspension beschichteter Mikrobläschen7,8 mit Durchmessern von 1 μm bis 10 μm9. Da Ultraschall-Kontrastmittel-Mikrobläschen etwas kleiner sind als rote Blutkörperchen7, können die Mikroblasen selbst die kleinsten Kapillaren sicher erreichen, ohne einen Verschluss zu erzeugen3. Mikroblasen haben aufgrund ihres kompressiblen Gaskerns11 einen dramatisch erhöhten Ultraschall-Rückstreukoeffizienten im Vergleich zu Gewebe10. Darüber hinaus ist das Mikroblasenecho hochgradig nichtlinear, d.h. sein Spektrum enthält Oberschwingungen und Subharmonika der Fahrfrequenz. Darüber hinaus ist die Echostärke stark von der Resonanzreaktion der Blase12 abhängig. Während Gewebe nur linear streut, reicht eine geringe Anzahl von Mikrobläschen aus, um eine hohe Nachweisempfindlichkeit in der harmonischen Bildgebung zu erreichen13,14. Diese nichtlineare Kontrasterzeugung kann sogar stark genug sein, um einzelne Blasen im Körper zu verfolgen15.
Die Hülle des Ultraschallkontrastmittels stabilisiert die Blasen gegen Auflösung und Koaleszenz und erhöht dadurch ihre Durchblutungszeit im Blutpool16. Die Hülle kann aus Lipiden, Polymeren oder denaturierten Proteinen bestehen3,8. Es verringert die Grenzflächenspannung, begrenzt dadurch die Wirkung der druckgetriebenen Laplace-Auflösung17 und bildet eine Widerstandsbarriere gegen Gasdiffusion18. Um die Stabilität weiter zu erhöhen, werden die Kontrastmikrobläschen typischerweise mit einem hochmolekularen Gas mit geringer Löslichkeit im Blut gefüllt11. Die Mikroblasenschale verändert dramatisch die Reaktion der Mikroblasen auf Ultraschallinsonation11. Unbeschichtete Gasblasen haben eine charakteristische Resonanzfrequenz, die umgekehrt proportional zu ihrer Größe ist, und die Zugabe einer Lipidbeschichtung erhöht die Resonanzfrequenz gegenüber der eines unbeschichteten Bubles aufgrund der intrinsischen Steifigkeit der Schale3. Darüber hinaus leitet die Schale Energie durch dilatative Viskosität ab, die die dominierende Dämpfungsquelle für beschichtete Blasen darstellt3. Die stabilisierende Schale hat den zusätzlichen Vorteil, dass sie funktionalisiert werden kann, z.B. indem Zielliganden an die Oberfläche von Mikroblasen gebunden werden. Dieses Targeting ermöglicht viele Anwendungen für diese Blasen und insbesondere die molekulare Bildgebung mit Ultraschall14,19.
Mikroblasen-Kontrastmittel sind vielversprechend für Anwendungen zur Arzneimittelabgabe mit Ultraschall. Mikroblasen, die im Einschluss eines Blutgefäßes oszillieren, können Microstreaming sowie lokale Normal- und Scherspannungen an der Kapillarwand verursachen3. Bei hohen Schalldrücken können große Amplitudenoszillationen zu einem Mikroblasenkollaps in einem heftigen Prozess führen, der als Trägheitskavitation bezeichnet wird, was wiederum zu einem Bruch oder einer Invagination des Blutgefäßes führen kann20. Diese heftigen Phänomene können Bioeffekte wie die Sonopermeation21 induzieren, wodurch die Extravasation therapeutischer Arzneimittel in das Interstitium über die Endothelwand entweder parazellulär oder transzellulär verstärkt wird. Es kann auch die Penetration von Therapeutika durch die extrazelluläre Matrix von stromareichen Tumoren21,22 und Biofilmen23,24 verbessern, obwohl dieser Mechanismus noch wenig verstanden ist26.
Die ultraschallvermittelte Wirkstoffabgabe hat sowohl präklinisch27,28 als auch in klinischen Studien vielversprechende Ergebnisse gezeigt22. Darüber hinaus wurde berichtet, dass Mikrobläschen bei Verwendung mit relativ niederfrequentem Ultraschall (~ 1 MHz) die Durchlässigkeit der Blut-Hirn-Schranke lokal und vorübergehend erhöhen, wodurch Medikamente sowohl in präklinischen als auch in klinischen Studien in das Hirnparenchym gelangen können29,30,31,32,33,34.
Es gibt im Allgemeinen zwei Ansätze für die ultraschallvermittelte Arzneimittelabgabe: Das therapeutische Material kann zusammen mit den Blasen verabreicht werden, oder es kann an der Blasenhülle befestigt oder in sie geladen werden28,35,36. Der zweite Ansatz hat sich in Bezug auf die Arzneimittelabgabe als effizienter erwiesen37. Mikrobläschen können mit Medikamenten oder genetischem Material beladen sein, das in Nanopartikeln (Liposomen oder polymeren Nanokonstruktionen) eingekapselt ist, die an der Schale befestigt oder direkt in die Mikrobläschenschale eingearbeitet sind35,36. Nanopartikelbeladene Mikrobläschen können durch (fokussierten) Ultraschall aktiviert werden, um die Nanopartikel-Nutzlast lokal freizusetzen28,33,38,39,40. Wenn eine solche Mikrobläsche in direktem Kontakt mit einer Zelle steht, hat sich in vitro gezeigt, dass die Nutzlast sogar in einem Sogenannten Sonoprinting34,35 auf der zytoplasmatischen Zellmembran abgeschieden werden kann.
Der Ultraschallparameterraum für die Mikroblaseninsonation ist umfangreich, und die biologischen In-vivo-Bedingungen erhöhen die Komplexität weiter. Daher stellt die Kombination von fokussiertem Ultraschall und nanopartikelbeladenen Mikroblasen eine Herausforderung im Bereich der zielgerichteten Therapeutika dar.
Ziel dieser Arbeit ist es, Protokolle bereitzustellen, die verwendet werden können, um die Reaktion von Mikrobläschen in Abhängigkeit von den Ultraschallparametern detailliert abzubilden und die Mechanismen zu untersuchen, die zum Bruch der Schale und zur anschließenden Freisetzung des fluoreszierend markierten Schalenmaterials führen. Dieser Satz von Protokollen ist auf Mikrobläschen mit Schalen anwendbar, die einen Fluoreszenzfarbstoff enthalten. Abbildung 1 zeigt eine schematische Darstellung der polymer-nanopartikel- und proteinstabilisierten Mikroblasen, die am SINTEF (Trondheim, Norwegen) entwickelt wurden. Diese Blasen sind mit Perfluorpropangas (C3F8) gefüllt und die Nanopartikel, die die Schale stabilisieren, enthalten NR668, ein lipophiles Derivat des Nilrot-Fluoreszenzfarbstoffs38,43. Die Nanopartikel bestehen aus Poly(2-ethyl-butylcyanoacrylat) (PEBCA) und sind PEGyliert. Die Funktionalisierung mit Polyethylenglykol (PEG) reduziert die Opsonisierung und Phagozytose durch das mononukleäre Phagozytsystem und verlängert dadurch die Zirkulationszeit14,44. Infolgedessen erhöht die PEGylierung die Menge an Nanopartikeln, die die Zielstelle erreichen, wodurch die Wirksamkeit der Behandlung verbessert wird16. Abbildung 2 zeigt, wie der Einsatz von vier Mikroskopiemethoden es den Forschern ermöglicht, alle relevanten Zeit- und Längenskalen abzudecken. Es ist zu beachten, dass die in der optischen Mikroskopie erreichbare räumliche Auflösung durch die Beugungsgrenze bestimmt wird, die von der Wellenlänge des Lichts und der numerischen Apertur (NA) des Objektivs und der Objektbeleuchtungsquelle45 abhängt. Für die vorliegenden Systeme liegt die optische Auflösungsgrenze typischerweise bei 200 nm. Zusätzlich kann die intravitale Mikroskopie zur Bildgebung auf subzellulärer Ebene verwendet werden46. Für die in dieser Arbeit verwendeten nanopartikel- und proteinstabilisierten Mikrobläschen ist die für die intravitale Mikroskopie relevante Mindestlängenskala die Größe kleiner Kapillaren (≥10 μm). In-vitro-Hochgeschwindigkeitsexperimente der optischen Hochgeschwindigkeitsbildgebung (10 Millionen Bilder pro Sekunde) und der Hochgeschwindigkeitsfluoreszenzbildgebung (500.000 Bilder pro Sekunde) werden für einzelne Mikrobläschen beschrieben. Hochgeschwindigkeits-Hellfeldbildgebung auf Nanosekunden-Zeitskalen ist geeignet, die zeitaufgelöste radiale Dynamik der vibrierenden Blasen zu untersuchen. Im Gegensatz dazu ermöglicht die Hochgeschwindigkeits-Fluoreszenzmikroskopie eine direkte Visualisierung der Freisetzung der fluoreszenzmarkierten Nanopartikel. Darüber hinaus kann die Struktur der Mikrobläschenschale mit Hilfe der Z-Stack-dreidimensionalen (3D) konfokalen Mikroskopie und der Rasterelektronenmikroskopie (das Protokoll für letztere ist in der aktuellen Arbeit nicht enthalten) untersucht werden. Die intravitale Mikroskopie besteht darin, mit Hilfe der Multiphotonenmikroskopie Tumore abzubilden, die in dorsalen Fensterkammern wachsen, um Echtzeitinformationen über den lokalen Blutfluss und den Verbleib fluoreszierend markierter Nanopartikel in vivo47 bereitzustellen. Die Kombination dieser Mikroskopiemethoden liefert letztendlich einen detaillierten Einblick in das Verhalten therapeutischer Mikrobläschenmittel als Reaktion auf Ultraschall, sowohl in vitro als auch in vivo.
Protokoll
HINWEIS: Alle Versuchsverfahren wurden von den norwegischen Tierversuchsbehörden genehmigt. Details zu Materialien, die im Protokoll verwendet wurden, finden Sie in der Tabelle der Materialien.
1. Herstellung von Mikrobläschen
HINWEIS: In dieser Arbeit sind die interessierenden Mikrobläschen protein- und nanopartikelstabilisierte Mikrobläschen, für die das Produktionsprotokoll zuvor beschrieben wurde28,33,48. Daher wurde das Herstellungsprotokoll hier kurz zusammengefasst.
- Mischen Sie zunächst mit einer Pipette Reinstwasser mit 0,5 Gew.-% Casein in phosphatgepufferter Kochsalzlösung (PBS) und 1 Gew.-% der Nanopartikel, die mit 0,21 Gew.-% des Fluoreszenzfarbstoffs NR668 (modifiziertes Nilrot) markiert sind, in einem sterilen Glascrimp-Top-Fläschchen (10 ml, Durchmesser 2 cm). Die polymeren Nanopartikel werden unter Verwendung des Mini-Emulsionspolymerisationsverfahrens hergestellt, wie von Mørch et al. beschrieben. 38. Auflage.
HINWEIS: Hier fungiert der Farbstoff als Modellmedikament, um die Visualisierung der Freisetzung von Nanopartikeln zu ermöglichen. Wenn Sie mit der Nanopartikellösung arbeiten, tragen Sie einen Laborkittel, eine Schutzbrille und Handschuhe. Wischen Sie verschüttet die Nanopartikellösung sofort mit 100% Aceton ab. - Schließen Sie die Durchstechflasche mit der Gummikappe ab, mischen Sie leicht und legen Sie die Durchstechflasche für 10 minuten bei Raumtemperatur in ein Ultraschallbad, um mögliche Aggregate zu eliminieren. Legen Sie ein Dispersionswerkzeug mit der Spitze des Rührers ~ 0,5 cm vom Boden der Glasfläschchen entfernt. Geben Sie mit einer Glaspipette, die mit dem Gasbehälter verbunden ist, das Perfluorpropangas in den Kopfraum der Durchstechflasche, die die Lösung enthält, bis die Lösung leicht zu sprudeln beginnt.
HINWEIS: Wickeln Sie selbstversiegelnde Folie um die Basis des Dispersionswerkzeugs, um ein Verrutschen der Glasfläschchen während des Rührens zu verhindern. - Die Lösung bei 1935 × g (24.000 U/min bei einem Drehradius von 3 mm) 4 min mit dem Dispergierwerkzeug kräftig umrühren. Schließen Sie die Durchstechflasche mit der Gummikappe und verschließen Sie die Durchstechflasche für die weitere Verwendung.
HINWEIS: Das Rühren fängt das Gas in der Flüssigkeit ein. Die Mikroblasenschale baut sich anschließend selbst zusammen, ohne dass ein aktiver Schritt erforderlich ist. - Lagern Sie die überschüssige Kasein- und Nanopartikellösung bei 4 °C und reinigen Sie das Dispersionswerkzeug mit 100% Aceton.
2. Abbildung einzelner Blasen
- Konfokale Mikroskopie
- Probenvorbereitung
- Verdünnen Sie die Blasenlösung, um einzelne Mikrobläschen wie folgt abzubilden. Eine Entlüftungsnadel (19 G-21 G) wird in eine Durchstechflasche mit Glascrimpverschluss gegeben, die die nach dem in Abschnitt 1 beschriebenen Verfahren erzeugten Mikrobläschen enthält. Drehen Sie die Durchstechflasche auf den Kopf, damit sich große Blasen von der Versiegelung der Durchstechflasche entfernen können.
- Führen Sie eine weitere Nadelspitze (19 G) einer kleinen (~1 ml) Spritze in die Durchstechflasche ein, während die Durchstechflasche noch auf dem Kopf steht. Entfernen Sie eine kleine Menge der Blasensuspension und übertragen Sie den Inhalt der Spritze in ein kleines Röhrchen, um das Pipettieren im nächsten Schritt zu erleichtern.
HINWEIS: Das Volumen der zu extrahierenden Suspension hängt direkt von der Art und Konzentration der Blasensuspension ab. In diesem Fall wurden 0,2 ml extrahiert. - Verdünnen Sie die Mikrobläschensuspension (aus Abschnitt 1) mit einer Pipette in gefiltertem PBS, um eine Konzentration von etwa 2 × 105 bis 6 × 105 Mikrobläschen/ml zu erreichen, um eine Einzelblasenbildgebung zu ermöglichen.
HINWEIS: Je nach Blasentyp wird empfohlen, die Blasensuspension zu waschen, um freien Fluoreszenzfarbstoff zu entfernen. Dies ist besonders wichtig bei Blasen, bei denen der Fluoreszenzfarbstoff in die Schale infundiert wird. Um Blasen zu waschen, verdünnen Sie die Blasensuspension (z. B. durch Entnahme von 100 μL der Blasenlösung in 10 ml PBS) und zentrifugieren Sie sie (typischerweise bei Geschwindigkeiten in der Größenordnung von 100 × g). Entfernen Sie schließlich den Überstand, der die Mikrobläschen enthält, mit einer Pipette zur weiteren Analyse. Die verbleibende Lösung enthält die freien fluoreszierenden Partikel und kann verworfen werden. Der Waschschritt sollte bei Bedarf wiederholt werden. - Fügen Sie der Mischung Glycerin hinzu, um die Viskosität des Mediums zu erhöhen und die durch die Brownsche Bewegung induzierte Bewegung zu eliminieren, die sonst die eher langsame konfokale Z-Stack-Bildgebung stören würde.
HINWEIS: Die Menge an Glycerin hängt von der Art der Blase ab, die abgebildet ist (hier ~ 50%). Bei einigen Arten von Blasen kann Glycerin die Stabilität beeinträchtigen49. Unter konfokaler Bildgebung wurde jedoch keine merkliche Veränderung in den Blasen über ca. 30 min beobachtet. Darüber hinaus kann Glycerin die akustische Reaktion von Mikrobläschen verändern und kann daher nur mit bildgebenden Verfahren verwendet werden, bei denen die Mikrobläschen nicht insonifiziert sind. - Legen Sie die Mikroblasensuspension in eine Kammer mit dünnen Wänden für eine optimale Bildgebung, z. B. einen Kanalschieber.
- Imaging-Protokoll
- Schalten Sie das konfokale Mikroskop ein und wählen Sie ein geeignetes Objektiv und den gewünschten Laser und Scanner aus, der während der konfokalen Mikroskopie verwendet werden soll.
HINWEIS: Verwenden Sie hier ein 60-faches Wasserimmersionsobjektiv für eine Auflösung von 0,08 μm/Pixel und bilden Je nach Blasengröße einen Bereich von 256 x 256 Pixeln oder 128 x 128 Pixeln ab. Verwenden Sie in diesen spezifischen Experimenten einen 488-nm-Laser und einen Galvano-Scanner. Die Emissionswellenlänge hängt vom Fluoreszenzfarbstoff ab und ist typischerweise breitbandig. - Finden Sie eine Mikrobläsche im Hellfeld und wechseln Sie zur konfokalen Mikroskopie. Stellen Sie die gewünschte obere und untere Ebene ein, zwischen denen das konfokale Mikroskop scannen wird. Erwerben Sie einen Z-Stack, um die 3D-Struktur zu beobachten. verwenden Sie eine Schrittweite von 100 nm in Z-Richtung.
- Schalten Sie das konfokale Mikroskop ein und wählen Sie ein geeignetes Objektiv und den gewünschten Laser und Scanner aus, der während der konfokalen Mikroskopie verwendet werden soll.
- Probenvorbereitung
- Hellfeldmikroskopie
- Montage des optischen Systems
HINWEIS: Eine schematische Darstellung des Aufbaus der Hellfeldmikroskopie ist in Abbildung 3A dargestellt. Um eine ungestörte Ultraschallausbreitung zu gewährleisten, enthält das Wasserbad zwei Öffnungen: eine für eine Lichtquelle und eine für einen Ultraschallwandler. Das optische System besteht aus einem (modularen) Mikroskop, einer Hochgeschwindigkeitskamera und einer passenden Optik. Da die Periode der Mikroblasenoszillationen typischerweise in der Größenordnung von 1 μs liegt (unter Verwendung von 1 MHz Ultraschall), sollte die Kamera so eingestellt sein, dass sie mit einer Bildrate von mindestens 5 Millionen Bildern pro Sekunde aufzeichnet. Hier soll die Kamera auf 10 Millionen Bilder pro Sekunde (256 x 400 Pixel) für 256 Bilder (25,6 μs) eingestellt werden, um alle Details der Blasendynamik einschließlich höherer Oberschwingungen zu erfassen.- Befestigen Sie ein Wasserimmersionsobjektiv mit entsprechender Vergrößerung, Arbeitsabstand und NA am Mikroskop.
HINWEIS: Ein Wasserimmersionsobjektiv wurde verwendet, um trotz allmählicher Verdunstung des Wassers einen stabilen Arbeitsabstand zu gewährleisten. Hier wurde ein Wasserimmersionsobjektiv mit einer 60-fachen Vergrößerung, einem Arbeitsabstand von 2 mm und einem NA von 1 ausgewählt. - Verwenden Sie ein Stroboskoplicht mit einer Spitzenleistung von mindestens 1 kW für die Beleuchtung und eine Tubuslinse zwischen Mikroskop und Kamera, um sicherzustellen, dass möglichst wenig Umgebungslicht den Sensor der Hochgeschwindigkeitskamera erreicht.
- Verwenden Sie eine dimmbare Halogenlichtquelle für die Fokussierung auf einzelne Mikroblasen und die Ausrichtung des optischen und akustischen Systems für die Echtzeitbildgebung.
- Befestigen Sie ein Wasserimmersionsobjektiv mit entsprechender Vergrößerung, Arbeitsabstand und NA am Mikroskop.
- Montage des Akustiksystems
- Verwenden Sie einen programmierbaren Arbiträrsignalgenerator und einen Leistungsverstärker (56 dB Verstärkung), um den Wandler mit einer glatten Umhüllung und Wellenform anzutreiben. Schließen Sie ein Oszilloskop an den Arbiträrsignalgenerator an, um das Signal zu überprüfen. Schließen Sie einen PC an den Arbiträrsignalgenerator an, um die eingehende akustische Druckwelle mit einem intern geschriebenen Skript zu programmieren.
- Verwenden Sie einen Impuls-/Verzögerungsgenerator als Master-Trigger, um die optischen und akustischen Systeme zu synchronisieren. Stellen Sie die Triggerverzögerungen am Puls-/Verzögerungsgenerator und der Kamerasoftware so ein, dass die Aufzeichnung nach der Ultraschallübertragung 16 μs beginnt, damit die Ultraschallwelle die Blasen erreichen kann. Lösen Sie die Lichtquelle 1,5 μs vor Beginn der Aufzeichnung aus, um eine ordnungsgemäße Beleuchtung während der Blasenschwingungen zu gewährleisten (siehe Abbildung 3B für das Timing-Diagramm).
- Wählen Sie einen geeigneten Schallkopf mit einer geeigneten Mittenfrequenz. Legen Sie es in eine Öffnung des Wasserbades, so dass es sich in einem Winkel zur optischen Achse befindet, um Reflexionen von den Probenhaltermembranen zu minimieren und die Bildung stehender Wellen zu reduzieren.
HINWEIS: Hier wurde ein einelementfokussierter Tauchwandler mit einer Mittenfrequenz von 2,25 MHz, einem Brennabstand von 1" und einem Elementdurchmesser von 0,75" in einem Winkel von 35° zur optischen Achse platziert. Die Kalibrierung der Übertragungsfunktion muss mit dem gleichen Verstärker durchgeführt werden, der auch im akustischen System verwendet wird. Kalibrieren Sie die Übertragungsfunktion von der Spannungsamplitude bis zur Druckamplitude des Wandlers unter Verwendung eines faseroptischen Hydrophons als Funktion der Ultraschallübertragungsfrequenz.
- Auswahl des Probenhalters
- Verwenden Sie einen Probenhalter mit optisch und akustisch transparenten Membranen und einem Volumen, das groß genug ist, um die Abbildung mehrerer einzelner Mikroblasen innerhalb derselben Probe zu ermöglichen.
HINWEIS: Hier wurde eine Zellkulturkassette mit einem Volumen von 10 ml, Membranflächen von 25 cm2 und einer Membrandicke von 175 μm verwendet. Aufgrund akustischer Reflexionen auf der unteren Membran und Interferenzen durch Wellen, die vom Mikroskopobjektiv und der oberen Membran reflektiert werden, kann der in situ Schalldruck von dem auf dem Arbiträrsignalgenerator programmierten abweichen. Die Platzierung des Wandlers in einem Winkel in Bezug auf die Probenhaltermembranen reduziert die Bildung stehender Wellen, kann aber die Reflexionen von den Membranen erhöhen. - Stellen Sie sicher, dass die Probe vollständig eingetaucht und in den Fokus sowohl des Aufnehmers als auch des Mikroskopobjektivs gebracht werden kann. Verwenden Sie eine Aluminiumstütze, die an einer 3D-Mikropositionierstufe befestigt ist, um den Probenhalter unabhängig voneinander zu bewegen.
- Verwenden Sie einen Probenhalter mit optisch und akustisch transparenten Membranen und einem Volumen, das groß genug ist, um die Abbildung mehrerer einzelner Mikroblasen innerhalb derselben Probe zu ermöglichen.
- Ausrichtung der optischen und akustischen Systeme
- Damit die 3D-Übersetzung den Aufbau ausrichtet, befestigen Sie das Wasserbad an einer XY-Translationsstufe und befestigen Sie die Stufe an einem optischen Tisch, um sicherzustellen, dass sie sich während der Experimente nicht bewegt. Füllen Sie dann das Wasserbad mit Wasser und schalten Sie die dimmbare Halogenlichtquelle ein. Bewegen Sie das Mikroskopobjektiv während der Ausrichtung zur Seite, um Ultraschallreflexionen zu vermeiden.
- Befestigen Sie ein Nadelhydrophon (0,2 mm) am Probenhalterarm und legen Sie das Nadelhydrophon in das Wasserbad, wobei sich die Spitze im Sichtfeld des Objektivs befindet. Schalten Sie den Verstärker und den Arbiträrsignalgenerator ein. Verwenden Sie Einzelimpulse von 5 bis 10 Ultraschallzyklen und eine Pulswiederholfrequenz von 15 Hz. Stellen Sie sicher, dass die Hydrophonspitze zentriert und fokussiert auf dem Mikroskopbild ist. Bewegen Sie den Tank in XY-Richtung und die Nadel in Z-Richtung, bis die maximale Druckamplitude erreicht ist.
- Stellen Sie den Fokus des Mikroskops so ein, dass er sich wieder auf die Spitze des Hydrophons konzentriert.
HINWEIS: Dieses Protokoll stellt die Ausrichtung zwischen dem Mikroskopfokus und dem Wandlerfokus sicher. Ändern Sie nicht die Position des Mikroskops und des Schallkopfes nach der Ausrichtung.
- Probenvorbereitung
- Wiederholen Sie die Schritte 2.1.1.1 bis 2.1.1.3, um die Probenlösung vorzubereiten. Verdünnen Sie die Blasenlösung, um eine Einzelblasenbildgebung zu ermöglichen und akustische Wechselwirkungen benachbarter Blasen auszuschließen.
- Öffnen Sie den Auslass des Probenhalters. Mit einer Spritze wird die Probenlösung in die andere Öffnung des Probenhalters injiziert, bis sie vollständig gefüllt ist. Stellen Sie sicher, dass sich keine Luftblasen im Probenhalter befinden, um unerwünschte Wechselwirkungen mit dem Ultraschallfeld zu vermeiden.
- Schließen Sie beide Ventile des Probenhalters und platzieren Sie den Probenhalter senkrecht zur optischen Achse.
HINWEIS: Halten Sie den gefüllten Probenhalter waagerecht, um ein Verschieben der Blasen auf eine Seite des Probenhalters während des Bewegens zu verhindern.
- Imaging-Protokoll
- Programmieren Sie die gewünschte Ultraschall-Fahrfrequenz und den Schalldruck im Arbiträrsignalgenerator durch das bereits erwähnte inhouse geschriebene Skript.
HINWEIS: Hier war die akustische Druckwelle ein einzelner Burst von 40 Zyklen mit einem 8-stufigen Gauß-konischen Impuls. Die in diesen Experimenten verwendeten Ultraschallfrequenzen waren 1 MHz, 2 MHz oder 3 MHz mit akustischen Druckamplituden von 81 kPa bis 1200 kPa. - Bewegen Sie den Probenhalter mit der Probenlösung mit dem XYZ-Tisch, um einzelne Mikroblasen im Fokus des Mikroskops zu lokalisieren. Beginnen Sie mit einem Sichtfeld in einer Ecke des Probenhalters und stellen Sie sicher, dass der Rand der Mikroblasen deutlich sichtbar und scharf ist (eine ideale Kameraansicht finden Sie in Abbildung 3C ).
- Befestigen Sie das Ende einer optischen Faser, die zuvor mit dem Halogenlicht verbunden war, an ein Stroboskoplicht, so dass das andere Ende noch mit dem Wasserbad verbunden ist. Lösen Sie die Aufnahme aus.
- Wiederholen Sie die Schritte 2.2.6.2 bis 2.2.6.3 so oft wie gewünscht pro Ultraschalleinstellung (Frequenz und Schalldruck) und bewegen Sie die Zellkulturkassette mit den Mikrobläschen mindestens 2 mm (in der Brennebene) von der vorherigen Position, um sicherzustellen, dass die Mikrobläschen im Sichtfeld in früheren Experimenten nicht insonifiziert werden.
HINWEIS: Hier wurde jedes Experiment ~ 20 Mal wiederholt. Wenn der gesamte Probenhalter insonifiziert ist, leeren Sie den Probenhalter und füllen Sie ihn für nachfolgende Experimente mit frischer Probenlösung auf.
- Programmieren Sie die gewünschte Ultraschall-Fahrfrequenz und den Schalldruck im Arbiträrsignalgenerator durch das bereits erwähnte inhouse geschriebene Skript.
- Datenanalyse
- Nehmen Sie eine Programmierumgebung an, um eine Datenanalyse gemäß der Forschungsfrage durchzuführen, und führen Sie nach der Verarbeitung der Bilder eine Kantenerkennung durch. Mit einer Funktion, die die Eigenschaften von Bildbereichen misst, finden Sie den Schwerpunkt einer Blase und die Ableitung des Intensitätsprofils um jede Blase, um die Kontur der Blase (und damit den Blasenradius R) zu erkennen. Extrahieren Sie relevante Parameter aus dem Radius im Laufe der Zeit für einzelne Mikrobläschen.
HINWEIS: In der vorliegenden Studie wurde eine Programmierumgebung für die Bildverarbeitung verwendet, um Aufnahmen einzelner Mikroblasen zu binarisieren und zu filtern. Ein internes Skript wurde verwendet, um die Ableitung des Intensitätsprofils um jede Blase zu finden.
- Nehmen Sie eine Programmierumgebung an, um eine Datenanalyse gemäß der Forschungsfrage durchzuführen, und führen Sie nach der Verarbeitung der Bilder eine Kantenerkennung durch. Mit einer Funktion, die die Eigenschaften von Bildbereichen misst, finden Sie den Schwerpunkt einer Blase und die Ableitung des Intensitätsprofils um jede Blase, um die Kontur der Blase (und damit den Blasenradius R) zu erkennen. Extrahieren Sie relevante Parameter aus dem Radius im Laufe der Zeit für einzelne Mikrobläschen.
- Montage des optischen Systems
- Fluoreszenzmikroskopie
- Montage des optischen Systems
- Erstellen Sie den Aufbau für die Fluoreszenzmikroskopie (Abbildung 4A) mit der gleichen Basis, die in der in Abschnitt 2.2 beschriebenen Hellfeldmikroskopie verwendet wird.
HINWEIS: Der in Abschnitt 2.3 beschriebene Aufbau kann mit dem in Abschnitt 2.2 beschriebenen Aufbau für die Hellfeldmikroskopie kombiniert werden. Die Kombination von Fluoreszenzmikroskopie und Hellfeldmikroskopie ermöglicht die Visualisierung des Mikroblasengaskerns bei gleichzeitiger Abbildung der Freisetzung von Nanopartikeln. - Stellen Sie die Hochgeschwindigkeitskamera so ein, dass sie mit 500.000 Bildern pro Sekunde (400 x 250 Pixel) für 128 Bilder (256 μs) aufzeichnet.
HINWEIS: Die Bildgebungszeit ist länger als in den Hellfeldexperimenten, da die Lichtintensität in der Fluoreszenz begrenzt ist und weil die Zeitskala, über die die Teilchenabgabe erfolgt, länger ist als die der Blasendynamik. - Wählen Sie einen Laser mit einer Leistung, die hoch genug ist, um ausreichend Licht zu liefern, und der eine geeignete Anregungswellenlänge hat, und stellen Sie sicher, dass er mit einem akusto-optischen Modulator gekoppelt ist, um ein Bleichen der Probe zu vermeiden.
HINWEIS: In dieser Studie wurde ein 5-W-Dauerstrichlaser mit einer Anregungswellenlänge von 532 nm verwendet, um die Fluoreszenz der Nanopartikel anzuregen. - Platzieren Sie einen Strahlteiler, einen dichroitischen Spiegel und einen Kerbfilter zwischen dem Laser und dem Mikroskopobjektiv, um das Anregungslicht auf die Probe zu richten, während die Fluoreszenzemission die Kamera erreichen kann.
- Erstellen Sie den Aufbau für die Fluoreszenzmikroskopie (Abbildung 4A) mit der gleichen Basis, die in der in Abschnitt 2.2 beschriebenen Hellfeldmikroskopie verwendet wird.
- Montage des Akustiksystems
- Um die Mikrobläschen zu insonifizieren, verwenden Sie den gleichen akustischen Aufbau wie in Abschnitt 2.2.2. Ändern Sie den Wandler in diesen spezifischen Experimenten in einen fokussierten Tauchwandler mit einem Element mit einer Mittenfrequenz von 2,25 MHz, einer Brennweite von 1,88 Zoll und einem Elementdurchmesser von 1 ". Platzieren Sie es in einem Winkel von 35° in Bezug auf die optische Achse, um Reflexionen von den Probenhaltermembranen zu minimieren und stehende Wellenbildungen zu reduzieren.
- Ausrichtung der optischen und akustischen Systeme
- Wiederholen Sie die in Abschnitt 2.2.4 beschriebenen Schritte.
- Probenvorbereitung
- Bereiten Sie die Probenlösung wie in Abschnitt 2.2.5 beschrieben vor.
- Imaging-Protokoll
- Stellen Sie die gewünschte Ultraschall-Fahrfrequenz und die akustische Druckamplitude am Arbiträrsignalgenerator durch das oben erwähnte inhouse geschriebene Skript ein.
HINWEIS: Hier wurde die akustische Druckwelle so programmiert, dass sie ein einzelner Ultraschallstoß von 140 Zyklen mit einem 10-stufigen Gauß-konischen Impuls ist. Längere Pulsdauern sind im Allgemeinen erforderlich, um Bioeffekte zu induzieren, verglichen mit denen, die zur Untersuchung der Blasendynamik erforderlich sind. Die in diesen Experimenten verwendeten Ultraschallfrequenzen waren 1 MHz, 2 MHz oder 3 MHz mit akustischen Druckamplituden von 81 kPa bis 1200 kPa. - Stellen Sie auf dem Puls-/Verzögerungsgenerator die Triggerverzögerung für den Laser zur Fluoreszenzanregung der Nanopartikel aus den Mikroblasen während der Aufnahme ein.
HINWEIS: Für diese spezifischen Experimente lag die Triggerverzögerung zwischen 20 μs und 170 μs für eine Gesamtdauer von 150 μs. Das Zeitdiagramm ist in Abbildung 4B dargestellt. - Bewegen Sie den Probenhalter mit der Probenlösung mit dem XYZ-Tisch, um einzelne Mikroblasen im Fokus des Mikroskops zu lokalisieren. Beginnen Sie mit einem Sichtfeld einer Ecke des Probenhalters. Siehe Abbildung 4C für eine ideale Kameraansicht, in der die Schnittstelle der Mikroblasen deutlich sichtbar und scharf ist. Lösen Sie die Aufnahme aus.
- Wiederholen Sie Schritt 2.3.5.3 so oft wie gewünscht pro Ultraschalleinstellung (Frequenz und Schalldruck) und bewegen Sie die Zellkulturkassette mit den Mikrobläschen mindestens 2 mm (in der optischen Ebene) von der vorherigen Position, um sicherzustellen, dass Mikroblasen im Sichtfeld in früheren Experimenten nicht beschallt werden.
HINWEIS: In dieser Studie wurde jedes Experiment ~ 10-20x wiederholt. Wenn der gesamte Probenhalter insonifiziert ist, leeren Sie den Probenhalter und füllen Sie ihn für nachfolgende Experimente mit frischer Probenlösung auf. Welcher Abstand der Probenhalter zwischen den Experimenten bewegt werden soll, hängt von der akustischen Strahlgröße ab.
- Stellen Sie die gewünschte Ultraschall-Fahrfrequenz und die akustische Druckamplitude am Arbiträrsignalgenerator durch das oben erwähnte inhouse geschriebene Skript ein.
- Datenanalyse
- Analysieren Sie die Fluoreszenzmikroskopie-Aufnahmen entsprechend der Forschungsfrage. Bestimmen Sie für jede Mikrobläsche visuell, ob die Lieferung der Nanopartikel in den Fluoreszenzmikroskopieexperimenten stattgefunden hat. Wenn das Ablösen und Abscheiden der Nanopartikel vom Gaskern auf die Probenhaltermembran für eine einzelne Mikrobläsche beobachtet wird, geben Sie diese Lieferung manuell in die Programmierumgebung ein.
- Montage des optischen Systems
3. Intravitale Mikroskopie
- Dorsale Hautfalten-Fensterkammerchirurgie (beschrieben zuvor26,47,50)
- Akklimatisieren Sie die Tiere für eine Woche, bevor Sie die Fensterkammern platzieren. Obwohl sowohl weibliche als auch männliche Mäuse verwendet werden können und das Alter unwichtig ist, stellen Sie sicher, dass das Gewicht der Mäuse mindestens 22-24 g beträgt, damit die Haut ausreichend flexibel ist.
- Führen Sie die Operation unter Vollnarkose mit intraoperativer und postoperativer analgetischer Behandlung durch. Anästhesie des Tieres durch subkutane Injektion von Fentanyl (0,05 mg/kg)/Medetomidin (0,5 mg/kg)/Midazolam (5 mg/kg)/Wasser (2:1:2:5) in einer Dosis von 0,1 ml pro 10 g Gewicht. Verwenden Sie ein Heizkissen oder eine Heizlampe, um die Körpertemperatur des Tieres aufrechtzuerhalten.
- Ziehen Sie sanft an der doppelten Hautschicht auf dem Rücken des Tieres, so dass die Haut zwischen zwei symmetrischen Polyoxymethylenrahmen der Fensterkammer eingeklemmt ist. Befestigen Sie die Kammer, indem Sie zwei Schrauben platzieren, die sich durch die doppelschalige Schicht erstrecken und entlang des oberen Randes der Kammer nähen.
- Entfernen Sie die Haut innerhalb des kreisförmigen Rahmens der Kammer auf einer Seite der Hautfalte. Legen Sie ein Deckglas mit einem Durchmesser von 11,8 mm in den Rahmen, in dem die Haut entfernt wird, um ein Fenster in das Gewebe zu bilden.
- Verwenden Sie eine subkutane Injektion von Atipemazol (2,5 mg/kg), Flumazenil (0,5 mg/kg) und Wasser (1:1:8) in einer Dosis von 0,1 ml pro 10 g als Gegenmittel, um die Anästhesie zu beenden. Legen Sie das Tier über Nacht in ein beheiztes Aufwachgestell. Ergänzen Sie das Wasser für die Tiere mit 25 mg / ml Enrofloxacin, um eine Infektion an der Operationsstelle zu verhindern.
- Erstellung von Tumormodellen
- Halten Sie Krebszellen bei 37 °C und in einer 5% igen CO2-Atmosphäre in geeignetem Kulturmedium, ergänzt mit 10% fetalem Rinderserum und 100 U/ml Penicillin und 100 mg/ml Streptomycin.
HINWEIS: Die humane Osteosarkom (OHS) -Zelllinie wurde in diesem Protokoll verwendet, aber auch andere Zelllinien können verwendet werden. - Am Tag nach Schritt 3.1.5 wird das Tier für einige Minuten mit Isofluran betäubt (5% während der Induktion und 1-2% während der Wartung). Entfernen Sie das Deckglas, tragen Sie 5 × 106 Krebszellen in 30 μL Zellkulturmedium auf und ersetzen Sie das Deckglas.
- Lassen Sie die Tumore vor der Bildgebung 2 Wochen lang wachsen und überwachen Sie das Gewicht und den Gesundheitszustand der Tiere mindestens 3 Mal pro Woche während dieses Zeitraums.
- Halten Sie Krebszellen bei 37 °C und in einer 5% igen CO2-Atmosphäre in geeignetem Kulturmedium, ergänzt mit 10% fetalem Rinderserum und 100 U/ml Penicillin und 100 mg/ml Streptomycin.
- Montage des optischen Systems
- Führen Sie während der Ultraschallbehandlung (wie in früheren Arbeiten26 beschrieben) intravitale Bildgebung mit einem geeigneten Mikroskop und Objektiv durch, abhängig von der Forschungsfrage. Siehe Abbildung 5A für eine schematische Darstellung des Versuchsaufbaus.
HINWEIS: Für dieses spezielle Experiment wurde ein Multiphotonenmikroskop verwendet, das mit einem 20-fachen Wassertauchobjektiv (NA von 1,0 und Arbeitsabstand von 2 mm) und einem gepulsten Laser ausgestattet ist. Die Bilder wurden im Resonant-Scanning-Modus mit 31 Bildern pro Sekunde (512 x 512 Pixel) mit einem Sichtfeld von 400 x 400 μm2 aufgenommen. Die Anregungswellenlänge betrug 790 nm. Die Filter vor den beiden Galliumarsenid-Phosphid-Detektoren waren Long-Pass 590 nm und Bandpass 525/50 nm für den Nachweis von Fluoreszenz.
- Führen Sie während der Ultraschallbehandlung (wie in früheren Arbeiten26 beschrieben) intravitale Bildgebung mit einem geeigneten Mikroskop und Objektiv durch, abhängig von der Forschungsfrage. Siehe Abbildung 5A für eine schematische Darstellung des Versuchsaufbaus.
- Montage des Akustiksystems
- Montieren Sie einen geeigneten Ultraschallwandler in einem Hohlleiter (Sonderanfertigung), der unter dem Objektiv in einem Winkel von 45° in Bezug auf die optische Achse positioniert ist, um Reflexionen vom Deckglas der dorsalen Hautfaltenfensterkammer zu minimieren und stehende Wellenbildungen zu reduzieren. Füllen Sie den Hohlleiter mit destilliertem und entgastem Wasser. Tragen Sie Ultraschall-Kopplungsgel auf den Hohlleiter auf.
- Ausrichtung der optischen und akustischen Systeme
- Richten Sie die optische Achse mit dem Fokus des Ultraschalls aus. Positionieren Sie ein faseroptisches Hydrophon im Fokus des Objektivs. Schalten Sie dann den Verstärker und den Arbiträrsignalgenerator ein, um den Wandler mit kurzen Bursts (5-10 Zyklen) mit einer Pulswiederholfrequenz von 100 Hz anzuregen, und bewegen Sie den Ultraschallwandler an die Position, an der der höchste Druck mit dem Hydrophonsignal auf dem Oszilloskop detektiert wird.
HINWEIS: Ändern Sie die Position des Messumformers nach der Ausrichtung nicht.
- Richten Sie die optische Achse mit dem Fokus des Ultraschalls aus. Positionieren Sie ein faseroptisches Hydrophon im Fokus des Objektivs. Schalten Sie dann den Verstärker und den Arbiträrsignalgenerator ein, um den Wandler mit kurzen Bursts (5-10 Zyklen) mit einer Pulswiederholfrequenz von 100 Hz anzuregen, und bewegen Sie den Ultraschallwandler an die Position, an der der höchste Druck mit dem Hydrophonsignal auf dem Oszilloskop detektiert wird.
- Imaging-Protokoll
- Positionieren Sie den beheizten Tierhalter (sondergefertigt), der mit einer XY-Positionierungsstufe zwischen dem Hohlleiter und dem Objektiv verbunden ist, und fügen Sie weiteres Kopplungsgel hinzu. Betäuben Sie das Tier und legen Sie einen Schwanzvenenkatheter. Legen Sie die Maus in die beheizte Halterung und befestigen Sie die Fensterkammer in der Halterung. Fügen Sie einen Wassertropfen auf den Abdeckungsslip in der Fensterkammer hinzu und bewegen Sie das Objektiv an Ort und Stelle, um das Tumorgewebe abzubilden.
-
Abbildung 5B zeigt das Zeitdiagramm der Experimente, das die Reihenfolge der Ereignisse darstellt. Injizieren Sie fluoreszierend markiertes 2 MDa Dextran intravenös (30 μL, 4 mg/ml in Kochsalzlösung verdünnt), um das Gefäßsystem zu visualisieren, und bewegen Sie die Maus mit dem XY-Translationsstadium, um eine Position mit geeigneten Blutgefäßen zu finden. Zeichnen Sie vor der Ultraschallbehandlung Ausgangsbilder auf. Passen Sie die Bildrate, das Sichtfeld und die Länge der Aufnahme abhängig von der Forschungsfrage und den Besonderheiten des Mikroskops und der farbstofffarbenen Farbstoffe an.
HINWEIS: In diesen Experimenten wurden 31 Bilder pro Sekunde mit einem Sichtfeld von 400 x 400 μm2 aufgezeichnet, und die Bildgebung wurde kontinuierlich für 5 minuten durchgeführt. - Stellen Sie die gewünschte Ultraschall-Fahrfrequenz, die Pulslänge und die akustische Druckamplitude am Arbiträrsignalgenerator ein.
ANMERKUNG: Für diese Experimente wurde eine Frequenz von 1 MHz mit einer Pulslänge von 10 ms und Spitzenunterdruckamplituden zwischen 0,2 MPa und 0,8 MPa verwendet. Eine Pulswiederholfrequenz von 0,5 Hz oder 0,1 Hz wurde verwendet, damit neue Mikrobläschen in den behandelten Bereich zwischen Den Ultraschallimpulsen eindringen konnten. - 50 μL Mikrobläschen (2 × 108 bis 5 × 108 Mikrobläschen/ml) intravenös injizieren und Ultraschall während der Bildgebung anwenden, wie in26 beschrieben.
- Datenanalyse
- Analysieren Sie je nach Forschungsfrage Bilder mit (Open Source) Bildverarbeitungssoftware und einer Programmierumgebung, wie in26 beschrieben, um Blutgefäßparameter (Durchmesser, Verzweigung, Fließgeschwindigkeit und -richtung), die Akkumulation von Nanopartikeln in den Gefäßen sowie die Kinetik und Eindringtiefe der Extravasation von Dextran und Nanopartikeln in Tumorgewebe zu bestimmen.
Ergebnisse
Die Mikroblasen, die wie im Protokoll beschrieben hergestellt wurden, wurden mit verschiedenen Mikroskopiemethoden und auf verschiedenen Zeitskalen analysiert.
Die Fluoreszenz der Nanopartikel in der konfokalen Mikroskopie (Abbildung 6A) zeigt an, dass die Schale eine ungleichmäßige Partikelverteilung aufweist. Andere Mikroskopiemethoden können zur Blasencharakterisierung verwendet werden. Abbildung 6B zeigt beispielsweise die Gesamtstruktur der Mikrobläsche unter Verwendung der Rasterelektronenmikroskopie, wie sie in früheren Arbeiten34 dargestellt wurde.
Radialdynamik und phänomenologisches Blasenverhalten können mit der beschriebenen in vitro Hellfeldmikroskopiemethode untersucht werden, bei der Mikrobläschen mit 10 Millionen Bildern pro Sekunde abgebildet wurden. Der Radius einzelner Mikroblasen wurde im Laufe der Zeit mit einem intern geschriebenen Skript extrahiert. Ein Beispiel für eine solche radiale Reaktion ist in Abbildung 7 dargestellt.
Eine Bildsequenz der typischen erfolgreichen Nanopartikelabgabe, wie in Abschnitt 2.3.6 beschrieben, ist in Abbildung 8A dargestellt. Die in die Mikroblasenhülle eingebetteten Nanopartikel leuchten aufgrund von Fluoreszenz auf, wenn das Laserlicht die Blase erreicht. Angetrieben durch Ultraschallinsonation lösen sich die fluoreszierenden Nanopartikel vom Gaskern der Mikrobläschen und werden auf der Membran des Probenhalters abgeschieden. Schließlich wird der Laser ausgeschaltet und die fluoreszierenden Nanopartikel werden nicht mehr angeregt. Die erfolglose Abgabe der fluoreszenzmarkierten Nutzlast der Mikrobläschen sieht typischerweise wie die in Abbildung 8B gezeigte Bildsequenz aus, in der die fluoreszierenden Nanopartikel auf der Hülle der Mikrobläsche aufleuchten, die während der Ultraschallbelichtung intakt bleibt.
Die intravitale Multiphotonenmikroskopie in Echtzeit während des Ultraschalls wurde verwendet, um die Auswirkungen von Ultraschall und Mikroblasen auf das Verhalten von Nanopartikeln im Blut, die Verbesserung der Permeabilität von Tumorblutgefäßen und die Verbesserung der Abgabe von Nanopartikeln zu untersuchen. Das Ausmaß und die Kinetik des Eindringens in die extrazelluläre Matrix als Funktion von Schalldruck, Frequenz und Pulslängen können charakterisiert werden. Die Wirkung der Ultraschallbehandlung kann in Bezug auf die Größe und Morphologie der Gefäße und die daraus resultierende Einschließung der Blase variieren. Wie sich die Ultraschallbehandlung auf den Blutfluss und die Richtung auswirkt, kann bestimmt werden. Ein Beispielexperiment, das die Extravasation von Nanopartikeln im Laufe der Zeit zeigt, ist in Abbildung 9 bei einem mechanischen Index (MI) von 0,826 dargestellt. Die Ergebnisse der intravitalen Multiphotonenmikroskopie verdeutlichen die räumliche und zeitliche Extravasation von Nanopartikeln während der Ultraschallexposition, was für das vollständige Verständnis der Mechanismen, die der ultraschallvermittelten Abgabe von Nanopartikeln zugrunde liegen, und für die Optimierung solcher Technologien von großem Nutzen ist26.
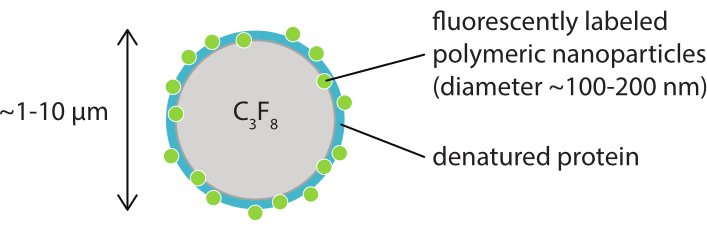
Abbildung 1: Schematische Darstellung einer Mikrobläsche mit einer Hülle aus fluoreszierend markierten polymeren Nanopartikeln in denaturiertem Casein. Die Mikrobläschen haben typischerweise einen Durchmesser zwischen 1 μm und 10 μm. Die Nanopartikel haben einen Durchmesser meist zwischen 100 nm und 200 nm38. Abkürzung: C3F8 = Perfluorpropangas. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
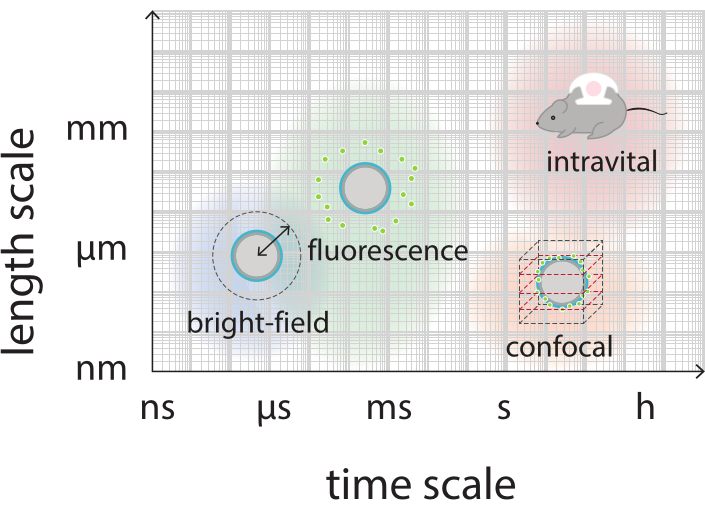
Abbildung 2: Schematische Übersicht mit den relevanten Zeit- und Längenskalen für die Hellfeld-, Fluoreszenz-, Konfokal- und Intravitalmikroskopie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
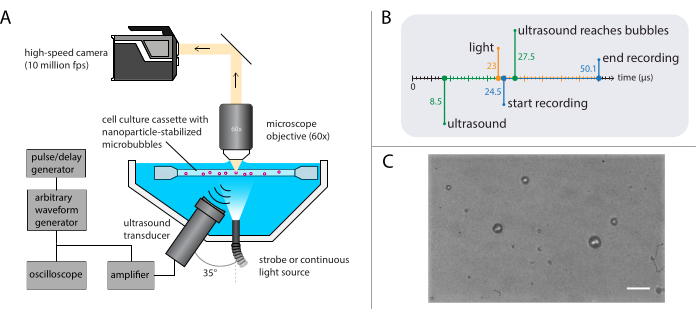
Abbildung 3: Schematische Darstellung von Hellfeldmikroskopie-Experimenten. (A) Versuchsaufbau, (B) das Timing-Diagramm und (C) ein typischer aufgezeichneter Rahmen. Maßstabsleiste in (C) = 10 μm. Abkürzung: fps = Bilder pro Sekunde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
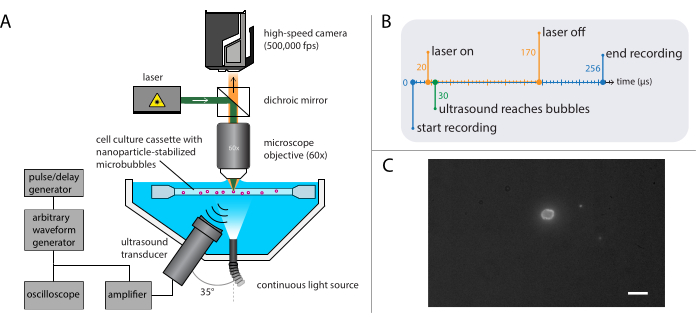
Abbildung 4: Schematische Darstellung von Fluoreszenzmikroskopie-Experimenten. (A) Versuchsaufbau, (B) das Timing-Diagramm und (C) ein typischer aufgezeichneter Frame. Maßstabsleiste in (C) = 10 μm. Abkürzung: fps = Bilder pro Sekunde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
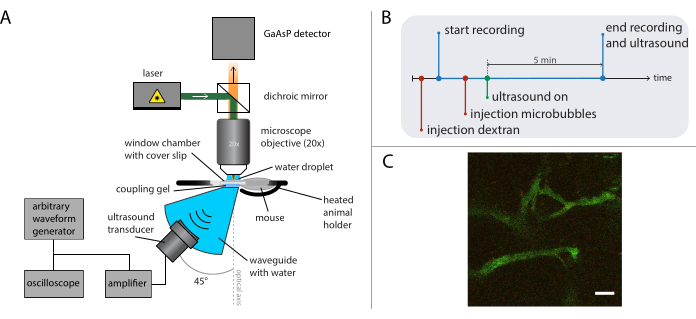
Abbildung 5: Schematische Darstellung intravitaler Mikroskopieexperimente. (A) Versuchsaufbau, (B) das Zeitdiagramm und (C) ein typischer aufgezeichneter Rahmen. Maßstabsleiste in (C) = 50 μm. Grün entspricht Dextran-FITC und Rot Nanopartikeln. Abkürzung: GaAsP = Galliumarsenidphosphid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
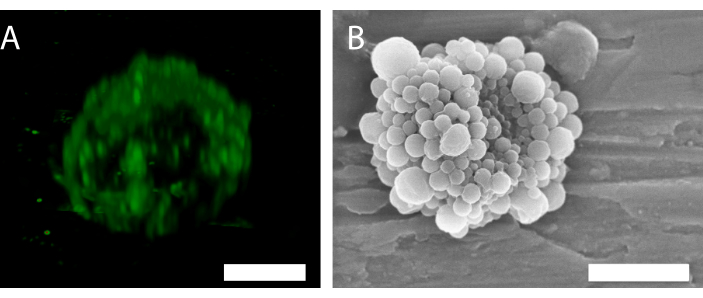
Abbildung 6: 3D-Struktur einer einzelnen nanopartikel- und proteinstabilisierten Mikrobläsche. (A) Verwendung der konfokalen Mikroskopie zur Darstellung der Nanopartikel und (B) Verwendung eines Rasterelektronenmikroskops zur Darstellung der 3D-Struktur. (B) mit Genehmigung von 34 reproduziert wurde. Maßstabsleiste in (A) = 5 μm; Maßstabsleiste in (B) = 2 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
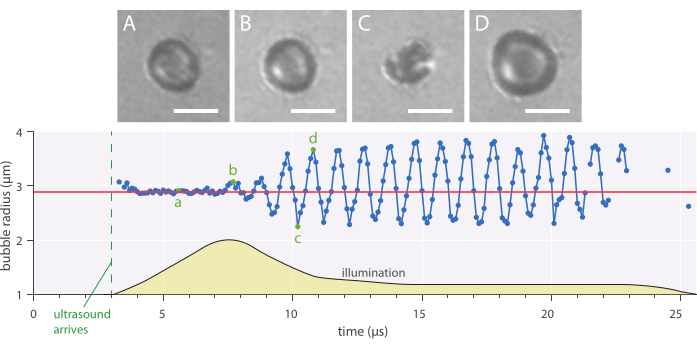
Abbildung 7: Typische sphärische Schwingungen einer nanopartikel- und proteinstabilisierten Mikrobläsche mit einem Radius von 2,89 μm, insonifiziert bei einer Ultraschallfrequenz von 1 MHz und einer akustischen Druckamplitude von 142 kPa. (A-D) Bilder aus der Hochgeschwindigkeitsaufzeichnung und dem entsprechenden Blasenradius über die Zeitkurve (unten). Maßstabsbalken = 5 μm, und die rote Linie zeigt den Anfangsradius an. Das Beleuchtungsprofil (beliebige Einheiten) ist gelb gekennzeichnet. Die Vergrößerung beträgt das 120-fache. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
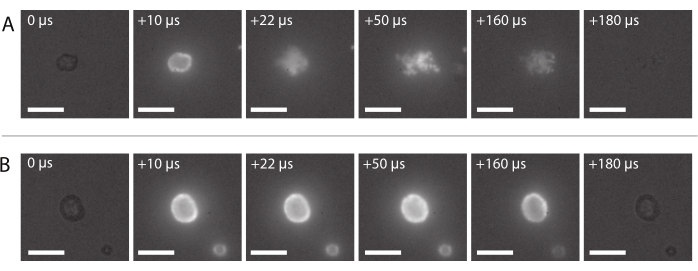
Abbildung 8: Bildsequenz aus der Hochgeschwindigkeitsfluoreszenzmikroskopie. (A) Erfolgreiche Abgabe fluoreszenzmarkierter Nanopartikel einer nanopartikel- und proteinstabilisierten Mikrobläsche, die bei einer Ultraschallfrequenz von 2 MHz und einer akustischen Druckamplitude von 600 kPa insonifiziert ist. (B) Erfolglose Abgabe fluoreszenzmarkierter Nanopartikel einer nanopartikel- und proteinstabilisierten Mikrobläsche, die bei einer Ultraschallfrequenz von 2 MHz und einer akustischen Druckamplitude von 210 kPa insonifiziert ist. Maßstabsbalken = 10 μm. Die Vergrößerung beträgt das 120-fache. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
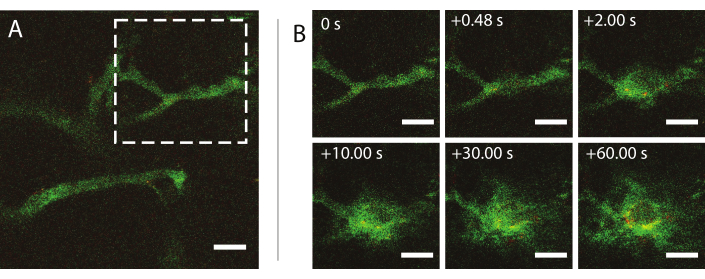
Abbildung 9: Intravitale Mikroskopie nach Insonation von Nanopartikel- und Protein-stabilisierten Mikrobläschen bei einer Ultraschallfrequenz von 1 MHz und einer akustischen Druckamplitude von 800 kPa. (A) Nanopartikel im Gefäß und (B) eine Bildsequenz des Bereichs, der durch das weiß gestrichelte Quadrat in (A) angezeigt wird und die Extravasation von Dextran (grün) und Nanopartikeln (rot) darstellt. Maßstabsbalken = 50 μm. Die Vergrößerung beträgt das 20-fache. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Verschiedene optische Mikroskopiemethoden wurden kombiniert, um Informationen über die verschiedenen Schritte bei der Abgabe von Nanopartikeln von der Oberfläche von Mikrobläschen an das umgebende Medium zu erhalten. Es wurde eine Bildgebung der Blasenoszillationen sowie eine Bildgebung der Freisetzung der Nanopartikel aus der Blasenhülle, der Extravasation und des Eindringens von Tumoren durch die extrazelluläre Matrix von Tumoren in vivo durchgeführt. Die In-vitro-Bildgebung ermöglicht das Screening vieler Ultraschallparameter im Vergleich zu komplexeren In-vivo-Setups . Der Vorteil der Kombination dieser Reihe von Bildgebungsmodalitäten ist die komplementäre Information, die auf verschiedenen Zeitskalen erhalten werden kann - ein Merkmal, das entscheidend ist, um die Mikroblasen für eine erfolgreiche Verabreichung zu charakterisieren und zu optimieren und therapeutische Wirksamkeit zu erzielen. Dieser Ansatz ist nützlich, um die Abgabemechanismen für alle Mikrobläschen gleichermaßen zu verstehen, einschließlich Konstrukte mit fluoreszenzmarkierten Nanopartikeln und Medikamenten.
Die kritischsten Schritte in den Mikroskopiemethoden, die zur Untersuchung einzelner Mikroblasen verwendet werden, sind wie folgt. Für die Fluoreszenzmikroskopie sollten die Nanopartikel fluoreszierend markiert sein, um die Visualisierung der Partikelfreisetzung zu ermöglichen. Darüber hinaus sollte die Probenlösung ausreichend verdünnt werden, um einzelne Mikrobläschen für die Analyse in konfokalen, Hellfeld- und Fluoreszenzmikroskopiemethoden zu isolieren. Darüber hinaus ist es wichtig, eine Ultraschall-Fahrfrequenz und einen Schalldruck zu wählen, um die Blasen am effizientesten anzuregen, nämlich bei ihrer Resonanz. Betrifft die Forschungsfrage die Abgabe der Nanopartikel-Nutzlast, sollten die entsprechenden Ultraschallparameter Teil der Untersuchung sein. Neben der Resonanz sollten diese Blasen auch an oder über ihre Schwelle für die Freisetzung von Nanopartikeln getrieben werden, typischerweise bei relativ hohen akustischen Druckamplituden (MI > 0,3)51. Für die Hellfeldmikroskopie-Bildgebung ist es wichtig, eine Hochgeschwindigkeitskamera mit einer ausreichend hohen Bildrate zu wählen, um Bewegungsunschärfe zu minimieren und Aliasing zu vermeiden.
Die Hellfeldmikroskopie ist hauptsächlich durch die bildgebende Bildrate und Intensität der verfügbaren Lichtquellen begrenzt, da eine höhere Bildrate einen detaillierteren zeitaufgelösten Einblick in die Blasendynamik geben würde, aber aufgrund kürzerer Belichtungszeiten eine intensivere Beleuchtung erfordert. Um die Partikelfreisetzung genauer zu untersuchen, kann die Framerate für die Fluoreszenzbildgebung prinzipiell durch Erhöhung der Intensität des Laserlichts erhöht werden. Die Absorption des hochintensiven Laserlichts durch die fluoreszenzmarkierten Mikrobläschen erzeugt jedoch Wärme, selbst bei Farbstoffen mit hoher Quantenausbeute. Diese Wärme kann die anstehenden Experimente stören und im Extremfall eine photothermische Kavitation induzieren52. In der Praxis gibt es also eine Grenze für die angewandte Laserfluenz. Intensive Laserbeleuchtung kann aber auch gezielt eingesetzt werden, um die Partikelfreisetzung aus Liposomen zu induzieren53. Die Temperatur beeinflusst die Blasendynamik und die Ultraschallreaktion, abhängig vom Blasentyp54. Wenn also In-vitro- und intravitale Methoden objektiv verglichen werden sollen, sollten die im Prüfplan erörterten In-vitro-Methoden bei 37 °C durchgeführt werden. Eine weitere Einschränkung der in der aktuellen Arbeit diskutierten In-vitro-Methoden besteht darin, dass sich die Blasen nicht in einer Freifeldumgebung befinden, da Mikrobläschen unter der Probenhaltermembran schweben. Darüber hinaus gibt es eine Selektionsverzerrung bei der Abbildung einzelner Mikroblasen. Die Durchführung wiederholter Experimente an einzelnen Blasen ermöglicht jedoch die Untersuchung des Einflusses der Größe und der Entfernung des Störfaktors - der Größenverteilung. Wenn die Blasenreaktion als Funktion der Größe verstanden werden kann, während die Konzentration nicht zu hoch ist, um Blasen-Blasen-Wechselwirkungen zu verhindern, kann die Reaktion jeder beliebigen Blasenpopulation berechnet werden. Schließlich bieten sowohl Hellfeld- als auch Fluoreszenzmikroskopie-Methoden Einblicke in Mikroblasen, die in einem zweidimensionalen (2D) Bild verschachtelt sind. Wenn die Forschungsfrage mehr als 2D-Bildgebung erfordert, kann das 3D-Verhalten der Blasen aufgelöst werden, indem das im Protokoll beschriebene Setup mit einem Sideview-Setup für multiplane imaging55 kombiniert wird.
Eine alternative Methode zur Untersuchung von Mikroblasen ist die akustische Charakterisierung56. Die Messung des Echos einer einzelnen Mikrobläsche erfordert jedoch die Lokalisierung und Isolierung einer einzelnen Mikrobläsche innerhalb des Ultraschallstrahls56, was eine Herausforderung darstellt, die typischerweise durch die Verwendung eines schmalen Tubus oder einer optischen oder akustischen Pinzette bewältigt wird57,58. Um Blasen akustisch zu dimensionieren, können die Mikroblasen im geometrischen Streuregime bei Frequenzen insonifiziert werden, die viel höher sind als ihre Resonanzfrequenz, was keine volumetrischen Mikroblasenschwingungen induziert59. Die Verwendung einer "akustischen Kamera" ist eine solche Methode, um die radiale Dynamik einzelner Mikroblasen als Reaktion auf Ultraschall abzubilden, wobei eine Hochfrequenz-Ultraschallsonde verwendet wird, um die radiale Reaktion der Blase auf eine niederfrequente Antriebswelle zu bestimmen60. Der Nachteil dieser Methode ist, dass sie nur verwendet werden kann, um die relative Änderung des Mikroblasenradius zu bestimmen; Daher wird eine andere Methode benötigt, um den absoluten Blasenradius zu bestimmen, z. B. durch optische Bildgebung61,62. Der Nachteil von Verfahren, bei denen Mikrobläschen Ultraschall bei Frequenzen ausgesetzt werden, die höher als ihre Resonanzfrequenz sind, besteht darin, dass bei solch hohen Frequenzen die Eindringtiefe verringert wird59, was die Verwendbarkeit für In-vivo-Anwendungen einschränkt. Andere Formen der Mikroskopie können auch verwendet werden, um Mikroblasen wie Rasterelektronenmikroskopie, Rasterkraftmikroskopie und Transmissionselektronenmikroskopie zu untersuchen63. Die erreichbare räumlich-zeitliche Auflösung dieser alternativen Mikroskopietechniken ist jedoch im Allgemeinen begrenzter, und diese Techniken haben den Nachteil, dass die Bildgebung entweder vor oder nach der Ultraschallexposition durch Offline-Analyse durchgeführt wird und typischerweise einen geringen Durchsatz aufweist63. Eine weitere Alternative ist die Verwendung einer Lichtstreumethode, mit der die radiale Dynamik einzelner Mikroblasen in Echtzeit untersucht werden kann, die jedoch im Vergleich zu akustischen Streumethoden ein niedriges Signal-Rausch-Verhältnis aufweist64.
Die intravitale Echtzeitmikroskopie während der Ultraschallexposition ist eine leistungsstarke Methode, um während der Ultraschallexposition neue Erkenntnisse über das Gefäßsystem, das Verhalten von Mikrobläschen, Nanopartikeln oder anderen Molekülen (in diesem Fall Dextran) zu gewinnen. Eine allgemeine Einschränkung bei der Durchführung der Intravitalmikroskopie in Echtzeit besteht darin, dass nur ein kleiner Bereich des Gewebes abgebildet wird und die Eindringtiefe des Lichts in das Gewebe begrenzt ist. Wenn die abgebildeten Gefäße nur sehr wenige Mikrobläschen und/oder Nanopartikel im Sichtfeld enthalten, können nur wenige oder keine Informationen über das Verhalten und die Extravasation von Nanopartikeln erhalten werden. Darüber hinaus ist aufgrund des begrenzten Sichtfeldes eine richtige Ausrichtung zwischen den Licht- und Ultraschallpfaden entscheidend. Wenn der Ultraschalldruck hoch genug ist, um eine Blasenzerstörung zu induzieren, ist es auch wichtig, eine Pulswiederholfrequenz zu wählen, die es ermöglicht, dass frische Blasen in das Sichtfeld zwischen Ultraschallimpulsen zurückkehren. Da der Ultraschall vom Deckglas in der Fensterkammer und dem Objektiv reflektiert wird, ist es außerdem wichtig, den Wandler in einem Winkel zu platzieren, um Reflexionen zu reduzieren und die Bildung von stehenden Wellen zu verhindern, die das kalibrierte Druckfeld verzerren. Ein weiteres praktisches Problem ist, dass das Setup genügend Platz haben muss, um den Ultraschallwandler und den Wellenleiter über oder unter dem Objektiv im Mikroskopaufbau zu montieren. Die Tumoren in der dorsalen Fensterkammer haben aufgrund der einschließenden Kammer und des Abdeckungsschlupfes eine begrenzte Dicke; bei Bedarf könnten jedoch auch andere Modelle verwendet werden. Beispiele sind Hautfaltentumoren, zum Beispiel im Brustfettpolster65 oder die abdominale intravitale Bildgebung von Tumoren in den verschiedenen Organen66. Solche Tumoren können in der entsprechenden Mikroumgebung orthotop gezüchtet werden und stellen daher einen klinisch relevanteren Fall dar.
Die in dieser Arbeit beschriebenen Methoden beleuchten das Potenzial fluoreszierend markierter Mikroblasen, um die Grundlagen von Arzneimittelabgabeanwendungen mit Blasen und Ultraschall zu untersuchen. Diese Kombination von Mikroskopiemethoden liefert wertvolle Einblicke in die Mikroblasenreaktion auf Ultraschallinsonation und den damit verbundenen akustischen Parameterraum und bietet eine klare Sicht auf das Mikroblasen- und Nutzlastverhalten über einen relevanten Bereich von Zeit- und Längenskalen.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
Referenzen
- Szabo, T. L. . Diagnostic ultrasound imaging: inside out. , (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197 (2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E., Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). , 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. . Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8 (2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -. N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103 (2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, &. #. 2. 2. 1. ;., et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876 (2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. . Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115 (2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103 (2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911 (2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501 (2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten