Method Article
Métodos de microscopia em escala de tempo para a caracterização de microbolhas fluorescentes para liberação de medicamentos acionados por ultrassom
Neste Artigo
Resumo
Os protocolos apresentados podem ser usados para caracterizar a resposta de microbolhas fluorescentes rotuladas projetadas para aplicações de entrega de medicamentos acionados por ultrassom, incluindo seus mecanismos de ativação, bem como seus efeitos biológicos. Este artigo abrange uma gama de técnicas de microscopia in vitro e in vivo realizadas para capturar o comprimento e escalas de tempo relevantes.
Resumo
Os agentes de contraste de microbolhas têm grande promessa para aplicações de entrega de medicamentos com ultrassom. Encapsular drogas em nanopartículas reduz a toxicidade sistêmica e aumenta o tempo de circulação das drogas. Em uma nova abordagem para a entrega de medicamentos assistidos por microbolhas, as nanopartículas são incorporadas em ou em conchas de microbolhas, permitindo a liberação local e desencadeada da carga de nanopartículas com ultrassom. Uma compreensão completa dos mecanismos de liberação dentro do vasto espaço de parâmetros de ultrassom é crucial para uma liberação eficiente e controlada. Este conjunto de protocolos apresentados é aplicável a microbolhas com uma concha contendo um rótulo fluorescente. Aqui, o foco está em microbolhas carregadas com nanopartículas poli (2-2-ethyl-butil cyanoacrilato), dopadas com um corante vermelho do Nilo modificado. As partículas são fixadas dentro de uma concha desnaturada. As microbolhas são produzidas por agitação vigorosa, formando uma dispersão de gás perfluoropropano na fase líquida contendo caseína e nanopartículas, após a qual a concha de microbolhas se auto-monta. Uma variedade de técnicas de microscopia são necessárias para caracterizar os microbolhas estabilizados por nanopartículas em todas as escalas de tempo relevantes do processo de liberação de nanopartículas. A fluorescência das nanopartículas permite imagens confocal de microbolhas únicas, revelando a distribuição de partículas dentro da concha. Imagens in vitro de ultra-alta velocidade usando microscopia de campo brilhante a 10 milhões de quadros por segundo fornecem insights sobre a dinâmica da bolha em resposta à inssonação do ultrassom. Finalmente, a liberação de nanopartículas da casca de bolha é melhor visualizada por meio de microscopia de fluorescência, realizada a 500.000 quadros por segundo. Para caracterizar a entrega de medicamentos in vivo, a liberação desencadeada de nanopartículas dentro da vasculatura e sua extravasação além da camada endotelial é estudada utilizando microscopia intravital em tumores implantados em câmaras de janelas de dobra dorsal, ao longo de uma escala de tempo de vários minutos. A combinação dessas técnicas complementares de caracterização fornece uma visão única sobre o comportamento dos microbolhas e sua liberação de carga em uma variedade de escalas de tempo e comprimento, tanto in vitro quanto in vivo.
Introdução
O ultrassom é a técnica de imagem médica mais utilizada. É não invasivo, rápido, seguro, econômico e portátil1,2,3. No entanto, o sangue é um dispersão de ultrassom ruim, e o contraste da poça sanguínea pode ser aumentado por uma injeção intravenosa de agentes de contraste de ultrassom3. Esse contraste aprimorado da poça sanguínea permite a quantificação da perfusão de órgãos para fins diagnósticos, por exemplo, na detecção de doença arterial coronariana4 e doença hepática metastática5. De fato, a vasculatura tumoral foi provada como um importante fator prognóstico6. Um grande esforço de pesquisa agora é direcionado para microbolhas assistidas, imagens moleculares direcionadas e agentes de contraste de alfaiataria para uso terapêutico.
Os agentes de contraste de ultrassom disponíveis comercialmente normalmente consistem em uma suspensão de microbolhas revestidas7,8 com diâmetros que variam de 1 μm a 10 μm9. Uma vez que os microbolhas do agente de contraste de ultrassom são ligeiramente menores que os glóbulos vermelhos7, os microbolhas podem atingir com segurança até mesmo os menores capilares sem criar uma oclusão3. Os microbolhas têm um coeficiente de backscattering de ultrassom dramaticamente aumentado em comparação com o tecido10, devido ao seu núcleo de gás compressível11. Além disso, o eco de microbolhas é altamente não linear, ou seja, seu espectro contém harmônicos e subharmônicos da frequência de condução. Além disso, a força do eco depende fortemente da resposta ressonante da bolha12. Enquanto o tecido se dispersa apenas linearmente, um pequeno número de microbolhas é suficiente para alcançar uma alta sensibilidade de detecção em imagens harmônicas13,14. Esta geração de contraste não linear pode até ser forte o suficiente para rastrear bolhas únicas no corpo15.
A concha do agente de contraste do ultrassom estabiliza as bolhas contra a dissolução e a coalescência, aumentando assim seu tempo de circulação na poça sanguínea16. A casca pode consistir de lipídios, polímeros ou proteínas desnaturadas3,8. Diminui a tensão interfacial, limitando assim o efeito da dissolução movida a pressão de Laplace17 e cria uma barreira resistiva contra a difusão de gás18. Para aumentar ainda mais a estabilidade, os microbolhas de contraste são tipicamente preenchidos com um gás de alto peso molecular com baixa solubilidade no sangue11. A concha de microbolhas altera drasticamente a resposta dos microbolhas à inseção de ultrassom11. Bolhas de gás não revestidas têm uma frequência de ressonância característica que é inversamente proporcional ao seu tamanho e a adição de um revestimento lipídico aumenta a frequência de ressonância em relação à de um buble não revestido devido à rigidez intrínseca da casca3. Além disso, a casca dissipa energia através da viscosidade dilatacional, que constitui a fonte dominante de amortecimento para bolhas revestidas3. A concha estabilizadora tem a vantagem adicional de que pode ser funcionalizada, por exemplo, ligando ligantes de destino à superfície de microbolhas. Esse direcionamento permite muitas aplicações para essas bolhas e, em particular, imagens moleculares com ultrassom14,19.
Os agentes de contraste de microbolhas têm grande promessa para aplicações de entrega de medicamentos com ultrassom. Microbolhas oscilando no confinamento de um vaso sanguíneo podem causar microstreaming, bem como tensões normais e de tesoura locais na parede capilar3. Em altas pressões acústicas, grandes oscilações de amplitude podem levar ao colapso de microbolhas em um processo violento chamado cavitação inercial, que, por sua vez, pode levar à ruptura ou invaginação do vaso sanguíneo20. Esses fenômenos violentos podem induzir efeitos bioefálicos como a sonopermeação21, aumentando a extravasão de drogas terapêuticas no interstício através da parede endotelial, seja paracelularmente ou transcelularmente. Também pode melhorar a penetração de agentes terapêuticos através da matriz extracelular de tumores ricos em estroma21,22 e biofilmes23,24, embora esse mecanismo ainda seja mal compreendido26.
O fornecimento de medicamentos mediados por ultrassom tem mostrado resultados promissores tanto pré-clínicos27,28 quanto em ensaios clínicos22. Além disso, quando usados com ultrassom relativamente de baixa frequência (~1 MHz), microbolhas têm sido relatadas localmente e transitoriamente aumentam a permeabilidade da barreira hematoencefálica, permitindo assim que as drogas entrem no parenchyma cerebral, tanto em estudos pré-clínicos quanto clínicos29,30,31,32,33,34.
Geralmente há duas abordagens para o fornecimento de medicamentos mediados por ultrassom: o material terapêutico pode ser coadministrado com as bolhas, ou pode ser anexado ou carregado na bolha shell28,35,36. A segunda abordagem mostrou-se mais eficiente em termos de entrega de drogas37. Microbolhas podem ser carregadas com drogas ou material genético encapsulados em nanopartículas (lipossomos ou nanoconstróis poliméricas) anexadas à casca ou incorporadas diretamente na concha de microbolhas35,36. Microbolhas carregadas de nanopartículas podem ser ativadas por ultrassom (focado) para liberar localmente a carga de nanopartículas28,33,38,39,40. Se tal microbolhas estiver em contato direto com uma célula, foi demonstrado in vitro que a carga pode até ser depositada na membrana citoplasmática celular em um processo chamado sonoimplos34,35.
O espaço do parâmetro de ultrassom para insonação de microbolhas é extenso, e as condições biológicas in vivo adicionam ainda mais complexidade. Assim, a combinação de ultrassom focado e microbolhas carregadas de nanopartículas representa um desafio no campo da terapêutica direcionada.
O objetivo deste trabalho é fornecer protocolos que possam ser utilizados para a imagem, em detalhes, a resposta de microbolhas em função dos parâmetros de ultrassom e estudar os mecanismos que levam à ruptura da concha e posterior liberação do material de concha fluorescente. Este conjunto de protocolos é aplicável a microbolhas com conchas que contêm um corante fluorescente. A Figura 1 mostra uma representação esquemática dos microbolhas polimórica-nanopartículas e proteínas estabilizadas desenvolvidas no SINTEF (Trondheim, Noruega). Estas bolhas são preenchidas com gás perfluoropropano (C3F8) e as nanopartículas que estabilizam a casca contêm NR668, que é um derivado lipofílico de corante fluorescente vermelho do Nilo38,43. As nanopartículas consistem em poli (2-ethyl-butyl cyanoacrylate) (PEBCA) e são PEGylated. A funcionalização com polietileno glicol (PEG) reduz a opsonização e a fagocitose pelo sistema de fagocite mononuclear, ampliando assim o tempo de circulação14,44. Como resultado, a PEGylation aumenta a quantidade de nanopartículas atingindo o local alvo, melhorando assim a eficácia do tratamento16. A Figura 2 ilustra como o uso de quatro métodos de microscopia permite que os pesquisadores cubram todas as escalas de tempo e comprimento relevantes. Deve-se notar que a resolução espacial alcançável na microscopia óptica é determinada pelo limite de difração, que depende do comprimento de onda da luz e abertura numérica (NA) do objetivo e da fonte de iluminação do objeto45. Para os sistemas em mãos, o limite de resolução óptica é tipicamente de 200 nm. Além disso, a microscopia intravital pode ser usada para imagem no nível subcelular46. Para os microbolhas estabilizados por nanopartículas e proteínas utilizados neste trabalho, a escala mínima de comprimento relevante para a microscopia intravital é do tamanho de pequenos capilares (≥ 10 μm). Imagens ópticas in vitro de alta velocidade (10 milhões de quadros por segundo) e experimentos de imagens de fluorescência de alta velocidade (500.000 quadros por segundo) são descritos para microbolhas únicas. Imagens de campo brilhante de alta velocidade em escalas de tempo nanossegundos são adequadas para estudar a dinâmica radial resolvida pelo tempo das bolhas vibratórias. Em contraste, a microscopia de fluorescência de alta velocidade permite a visualização direta da liberação das nanopartículas fluorescentes. Além disso, a estrutura da cápsula de microbolhas pode ser investigada usando microscopia confocal tridimensional (3D) de Z-stack (3D) e microscopia eletrônica de varredura (o protocolo para este último não está incluído no trabalho atual). A microscopia intravital consiste em usar microscopia multifotícula para tumores de imagem crescendo em câmaras de janelas dorsais para fornecer informações em tempo real sobre o fluxo sanguíneo local e sobre o destino de nanopartículas fluorescentes rotuladas em vivo47. A combinação desses métodos de microscopia, em última análise, fornece uma visão detalhada do comportamento dos agentes de microbolhas terapêuticas em resposta ao ultrassom, tanto in vitro quanto in vivo.
Protocolo
NOTA: Todos os procedimentos experimentais foram aprovados pelas Autoridades Norueguesas de Pesquisa Animal. Detalhes dos materiais utilizados no protocolo podem ser encontrados na Tabela de Materiais.
1. Produção de microbolhas
NOTA: Neste trabalho, as microbolhas de interesse são microbolhas estabilizadas por proteínas e nanopartículas, para as quais o protocolo de produção foi descrito anteriormente28,33,48. Portanto, o protocolo de fabricação foi brevemente resumido aqui.
- Primeiro, utilizando uma pipeta, misture água ultrauso com 0,5 wt% de caixa em soro fisiológico tamponado de fosfato (PBS) e 1 wt% das nanopartículas rotuladas com 0,21 wt% do corante fluorescente, NR668 (vermelho nilo modificado), em um frasco superior de vidro estéril (10 mL, diâmetro de 2 cm). As nanopartículas poliméricas são preparadas usando o método de polimerização mini-emulsão, conforme descrito por Mørch et al. 38.
NOTA: Aqui, o corante funciona como uma droga modelo para permitir a visualização da liberação de nanopartículas. Ao trabalhar com a solução de nanopartículas, use um jaleco, óculos e luvas. Limpe qualquer derramamento da solução de nanopartículas imediatamente com 100% de acetona. - Tampe o frasco com a tampa de borracha, misture ligeiramente e coloque o frasco em um banho ultrassônico por 10 minutos à temperatura ambiente para eliminar possíveis agregados. Coloque uma ferramenta de dispersão com a ponta do agitador ~0,5 cm da parte inferior do frasco de vidro. Usando uma pipeta de vidro conectada ao recipiente de gás, adicione o gás perfluoropropano ao espaço da cabeça do frasco contendo a solução até que a solução comece a borbulhar ligeiramente.
NOTA: Enrole a auto-vedação ao redor da base da ferramenta de dispersão para evitar escorregar do frasco de vidro durante a agitação. - Mexa a solução vigorosamente a 1935 × g (24.000 rpm com um raio de rotação de 3 mm) por 4 min usando a ferramenta de dispersão. Feche o frasco com a tampa de borracha e sele o frasco para uso posterior.
NOTA: A agitação prende o gás no líquido. A microbolhas-shell subsequentemente se auto-monta sem exigir qualquer passo ativo. - Armazene a solução de caixa e nanopartículas em excesso a 4 °C e limpe a ferramenta de dispersão com 100% de acetona.
2. Imagens de bolhas únicas
- Microscopia confocal
- Preparação da amostra
- Diluir a solução de bolha para image single microbubbles da seguinte forma. Coloque uma agulha de ventilação (19 G-21 G) em um frasco superior de vidro contendo as microbolhas produzidas seguindo o procedimento descrito na seção 1. Vire o frasco de cabeça para baixo para permitir que grandes bolhas se afastem do selo do frasco.
- Insira outra ponta de agulha (19 G) de uma pequena (~1 mL) de seringa no frasco, enquanto o frasco ainda está de cabeça para baixo. Remova uma pequena quantidade da suspensão da bolha e transfira o conteúdo da seringa para um tubo pequeno para facilitar a tubulação na próxima etapa.
NOTA: O volume da suspensão para extrair depende diretamente do tipo e concentração da suspensão da bolha. Neste caso, foi extraído 0,2 mL. - Usando uma pipeta, dilui a suspensão de microbolhas (da seção 1) em PBS filtrada para obter uma concentração de aproximadamente 2 × 105 a 6 × 105 microbolhas/mL para permitir imagens de bolha única.
NOTA: Dependendo do tipo de bolha, recomenda-se lavar a suspensão da bolha para remover o corante fluorescente livre. Isso é particularmente importante com bolhas para as quais o corante fluorescente é infundido na casca. Para lavar bolhas, dilui a suspensão da bolha (por exemplo, tomando 100 μL da solução de bolha em 10 mL de PBS) e centrífuga -a (tipicamente em velocidades da ordem de 100 × g). Por fim, remova o sobrenatante contendo as microbolhas com uma pipeta para análise posterior. A solução restante contém as partículas fluorescentes livres e pode ser descartada. A etapa de lavagem deve ser repetida conforme necessário. - Adicione glicerol à mistura para aumentar a viscosidade do meio e eliminar o movimento induzido pelo movimento browniano que de outra forma interferiria com a imagem de pilha Z bastante lenta.
NOTA: A quantidade de glicerol depende do tipo de bolha que é imageda (aqui, ~50%). Para alguns tipos de bolhas, o glicerol pode ter um efeito adverso na estabilidade49. No entanto, nenhuma alteração perceptível foi observada nas bolhas ao longo de aproximadamente 30 minutos sob imagens confocal. Além disso, o glicerol pode alterar a resposta acústica dos microbolhas e, portanto, só pode ser usado com métodos de imagem onde os microbolhas não são insonizados. - Coloque a suspensão de microbolhas em uma câmara com paredes finas para imagens ideais, como um slide de canal.
- Protocolo de imagem
- Ligue o microscópio confocal e selecione um objetivo adequado e o laser e scanner desejados para usar durante a microscopia confocal.
NOTA: Aqui, use um objetivo de imersão em água de 60x para uma resolução de 0,08 μm/pixel e dependendo do tamanho da bolha, imagem uma região de 256 x 256 pixels ou 128 x 128 pixels. Nestes experimentos específicos, use um laser de 488 nm e um scanner Galvano. O comprimento de onda de emissão depende do corante fluorescente e é tipicamente banda larga. - Encontre uma microbolhas em campo brilhante e mude para microscopia confocal. Defina os planos superior e inferior desejados entre os quais o microscópio confocal irá digitalizar. Adquirir uma pilha Z para observar a estrutura 3D; use um tamanho de passo de 100 nm na direção Z.
- Ligue o microscópio confocal e selecione um objetivo adequado e o laser e scanner desejados para usar durante a microscopia confocal.
- Preparação da amostra
- Microscopia de campo brilhante
- Montagem do sistema óptico
NOTA: Uma representação esquemática da configuração de microscopia de campo brilhante é mostrada na Figura 3A. Para garantir a propagação do ultrassom não perturbada, o banho de água contém duas aberturas: uma para uma fonte de luz e outra para um transdutor de ultrassom. O sistema óptico consiste em um microscópio (modular), uma câmera de alta velocidade e óptica correspondente. Como o período de oscilações de microbolhas é tipicamente da ordem de 1 μs (usando ultrassom de 1 MHz), a câmera deve ser definida para gravar em uma taxa de quadros de pelo menos 5 milhões de quadros por segundo. Aqui, a câmera deve ser definida para gravar em 10 milhões de quadros por segundo (256 x 400 pixels) para 256 quadros (25,6 μs) para capturar todos os detalhes da dinâmica da bolha, incluindo harmônicos mais elevados.- Conecte um objetivo de imersão hídrica com uma ampliação adequada, distância de trabalho e NA ao microscópio.
NOTA: Um objetivo de imersão na água foi utilizado para proporcionar uma distância de trabalho estável, apesar da evaporação gradual da água. Aqui, foi selecionado um objetivo de imersão em água com ampliação de 60x, uma distância de trabalho de 2 mm e um NA de 1. - Use uma luz estroboscópica com uma potência máxima de pelo menos 1 kW para iluminação e uma lente de tubo entre o microscópio e a câmera para garantir que o mínimo de luz ambiente possível atinja o sensor da câmera de alta velocidade.
- Use uma fonte de luz halógena dimmável para se concentrar em microbolhas únicas e alinhamento do sistema óptico e acústico para imagens em tempo real.
- Conecte um objetivo de imersão hídrica com uma ampliação adequada, distância de trabalho e NA ao microscópio.
- Montagem do sistema acústico
- Use um gerador de forma de onda arbitrária programável e um amplificador de energia (ganho de 56 dB) para conduzir o transdutor com um envoltório suave e forma de onda. Conecte um osciloscópio ao gerador de forma de onda arbitrária para verificar o sinal. Conecte um computador pessoal ao gerador de forma de onda arbitrária para programar a onda de pressão acústica recebida, usando um script escrito internamente.
- Use um gerador de pulso/atraso como gatilho mestre para sincronizar os sistemas óptico e acústico. Defina os atrasos do gatilho no gerador de pulso/atraso e no software da câmera de tal forma que a gravação comece 16 μs após a transmissão do ultrassom para permitir que a onda de ultrassom chegue às bolhas. Acione a fonte de luz 1,5 μs antes do início da gravação para garantir a iluminação adequada durante as oscilações da bolha (ver Figura 3B para o diagrama de tempo).
- Escolha um transdutor adequado com uma frequência central adequada. Coloque-o em uma abertura do banho de água, de modo que ele esteja em um ângulo com relação ao eixo óptico para minimizar reflexos das membranas do suporte da amostra e reduzir a formação de ondas em pé.
NOTA: Aqui, um transdutor de imersão focado em um único elemento com uma frequência central de 2,25 MHz, uma distância focal de 1" e diâmetro de elemento de 0,75" foi colocado em um ângulo de 35° em relação ao eixo óptico. A calibração da função de transferência precisa ser realizada utilizando o mesmo amplificador que é usado no sistema acústico. Calibrar a função de transferência da amplitude de tensão à amplitude de pressão do transdutor usando um hidrofone de fibra óptica em função da frequência de transmissão do ultrassom.
- Escolhendo o titular da amostra
- Use um suporte de amostra com membranas opticamente e acústica transparentes e um volume que seja grande o suficiente para permitir a imagem de várias microbolhas únicas dentro da mesma amostra.
NOTA: Aqui, foi utilizado um de cultura celular com volume de 10 mL, áreas de membrana de 25 cm2 e espessura da membrana de 175 μm. Devido a reflexões acústicas na membrana inferior, e interferência de ondas refletidas pelo objetivo do microscópio e pela membrana superior, a pressão acústica in situ pode diferir daquela programada no gerador de forma de onda arbitrária. Colocar o transdutor em um ângulo em relação às membranas do portador da amostra reduz a formação de ondas em pé, mas pode aumentar os reflexos das membranas. - Certifique-se de que a amostra pode ser totalmente submersa e trazida dentro do foco tanto do transdutor quanto do objetivo do microscópio. Use um suporte de alumínio ligado a um estágio de microposicionamento 3D para mover o suporte da amostra independentemente.
- Use um suporte de amostra com membranas opticamente e acústica transparentes e um volume que seja grande o suficiente para permitir a imagem de várias microbolhas únicas dentro da mesma amostra.
- Alinhamento dos sistemas ópticos e acústicos
- Para tradução 3D para alinhar a configuração, conecte o banho de água a um estágio de tradução XY e conecte o estágio a uma tabela óptica para garantir que ele não se mova durante os experimentos. Em seguida, encha o banho de água com água e ligue a fonte de luz halógena dimmável. Durante o alinhamento, mova o objetivo do microscópio para o lado para evitar reflexos de ultrassom.
- Conecte um hidrofone de agulha (0,2 mm) ao braço do porta-amostras e coloque o hidrofone de agulha no banho de água, com a ponta no campo de visão do objetivo. Ligue o amplificador e o gerador de forma de onda arbitrária; use pulsos únicos de 5 a 10 ciclos de ultrassom e uma frequência de repetição de pulso de 15 Hz. Certifique-se de que a ponta hidrofone está centrada e em foco na imagem do microscópio. Mova o tanque na direção XY e a agulha na direção Z até que a amplitude máxima de pressão seja atingida.
- Ajuste o foco do microscópio para se concentrar novamente na ponta do hidrofone.
NOTA: Este protocolo garante o alinhamento entre o foco do microscópio e o foco do transdutor. Não altere a posição do microscópio e do transdutor após o alinhamento.
- Preparação da amostra
- Repetir passos 2.1.1.1 a 2.1.1.3 para preparar a solução amostral. Diluir a solução de bolhas para permitir imagens de bolha única e excluir interações acústicas de bolhas vizinhas.
- Abra a saída do suporte de amostra. Usando uma seringa, injete a solução amostral na outra abertura do suporte da amostra até que esteja completamente preenchida. Certifique-se de que não há bolhas de ar dentro do suporte de amostra para evitar interações indesejadas com o campo de ultrassom.
- Feche ambas as válvulas do suporte da amostra e coloque o suporte da amostra perpendicular ao eixo óptico.
NOTA: Mantenha o nível do suporte da amostra preenchido para evitar a mudança das bolhas para um lado do suporte da amostra durante a movimentação.
- Protocolo de imagem
- Programe a frequência de condução de ultrassom desejada e pressão acústica no gerador de forma de onda arbitrária através do roteiro escrito interno acima mencionado.
NOTA: Aqui, a onda de pressão acústica foi uma única explosão de 40 ciclos, com um pulso gaussiano de 8 ciclos. As frequências de ultrassom utilizadas nesses experimentos foram de 1 MHz, 2 MHz ou 3 MHz, com amplitudes de pressão acústica variando de 81 kPa a 1200 kPa. - Mova o suporte de amostra contendo a solução amostral usando o estágio XYZ para localizar microbolhas únicas no foco do microscópio. Comece com um campo de visão em um canto do suporte de amostra, e certifique-se de que a borda dos microbolhas esteja claramente visível e em foco (veja Figura 3C para uma visão ideal da câmera).
- Conecte a extremidade de uma fibra óptica que foi previamente conectada à luz halógena a uma luz estroboscópica, de modo que a outra extremidade ainda esteja conectada ao banho de água. Acione a gravação.
- Repetir as etapas 2.2.6.2 a 2.2.6.3 quantas vezes desejarem por definição de ultrassom (frequência e pressão acústica), movendo o de cultura celular contendo os microbolhas pelo menos 2 mm (no plano focal) do local anterior para garantir que as microbolhas no campo de visão não sejam insalificadas em experimentos anteriores.
NOTA: Aqui, cada experimento foi repetido ~20 vezes. Quando todo o suporte da amostra estiver insonizado, esvazie o suporte da amostra e recarrete-o com uma solução de amostra fresca para experimentos subsequentes.
- Programe a frequência de condução de ultrassom desejada e pressão acústica no gerador de forma de onda arbitrária através do roteiro escrito interno acima mencionado.
- Análise de dados
- Adote um ambiente de programação para realizar a análise de dados de acordo com a questão da pesquisa e realize a detecção de bordas após o processamento das imagens. Utilizando uma função que mede propriedades de regiões de imagem, encontre o centroide de uma bolha e a derivada do perfil de intensidade ao redor de cada bolha para detectar o contorno da bolha (e, portanto, o raio de bolha R). Extrair parâmetros relevantes do raio ao longo do tempo para microbolhas únicas.
NOTA: No presente estudo, foi utilizado um ambiente de programação para processamento de imagens para binarizar e filtrar gravações de microbolhas únicas. Um script interno foi usado para encontrar a derivada do perfil de intensidade em torno de cada bolha.
- Adote um ambiente de programação para realizar a análise de dados de acordo com a questão da pesquisa e realize a detecção de bordas após o processamento das imagens. Utilizando uma função que mede propriedades de regiões de imagem, encontre o centroide de uma bolha e a derivada do perfil de intensidade ao redor de cada bolha para detectar o contorno da bolha (e, portanto, o raio de bolha R). Extrair parâmetros relevantes do raio ao longo do tempo para microbolhas únicas.
- Montagem do sistema óptico
- Microscopia de fluorescência
- Montagem do sistema óptico
- Construa a configuração para microscopia de fluorescência (Figura 4A), com a mesma base usada na microscopia de campo brilhante descrita na seção 2.2.
NOTA: A configuração descrita na seção 2.3 pode ser combinada com a descrita para microscopia de campo brilhante na seção 2.2. A combinação tanto da microscopia de fluorescência quanto da microscopia de campo brilhante permite a visualização do núcleo de gás de microbolhas enquanto a imagem da liberação de nanopartículas. - Defina a câmera de alta velocidade para gravar a 500.000 quadros por segundo (400 x 250 pixels) para 128 quadros (256 μs).
NOTA: O tempo de imagem é maior do que nos experimentos de campo brilhante, pois a intensidade da luz é limitada na fluorescência, e porque a escala de tempo sobre a qual a entrega de partículas ocorre é maior do que a da dinâmica da bolha. - Selecione um laser com uma potência alta o suficiente para fornecer luz suficiente e que tenha um comprimento de onda de excitação adequado, e certifique-se de que ele seja acoplado a um modulador acousto-óptico para evitar branqueamento da amostra.
NOTA: Neste estudo, um laser de onda contínua de 5 W com um comprimento de onda de excitação de 532 nm foi usado para excitar a fluorescência das nanopartículas. - Coloque um divisor de feixe, espelho dicroico e filtro de entalhe entre o laser e o objetivo do microscópio para direcionar a luz de excitação para a amostra, permitindo que a emissão de fluorescência chegue à câmera.
- Construa a configuração para microscopia de fluorescência (Figura 4A), com a mesma base usada na microscopia de campo brilhante descrita na seção 2.2.
- Montagem do sistema acústico
- Para inossonificar os microbolhas, use a mesma configuração acústica da seção 2.2.2. Alterar o transdutor nesses experimentos específicos para um transdutor de imersão de elemento único com uma frequência central de 2,25 MHz, uma distância focal de 1,88", e diâmetro do elemento de 1". Coloque-o em um ângulo de 35° em relação ao eixo óptico para minimizar reflexos das membranas do suporte da amostra e reduzir as formações de ondas em pé.
- Alinhamento dos sistemas ópticos e acústicos
- Repetir etapas descritas na seção 2.2.4.
- Preparação da amostra
- Prepare a solução amostral conforme descrito na seção 2.2.5.
- Protocolo de imagem
- Defina a frequência de condução de ultrassom desejada e a amplitude de pressão acústica no gerador de forma de onda arbitrária através do script escrito internamente.
NOTA: Aqui, a onda de pressão acústica foi programada para ser uma única explosão de ultrassom de 140 ciclos, com um pulso gaussiano de 10 ciclos. Durações de pulso mais longas são geralmente necessárias para induzir biofes em comparação com as necessárias para estudar a dinâmica das bolhas. As frequências de ultrassom utilizadas nesses experimentos foram de 1 MHz, 2 MHz ou 3 MHz, com amplitudes de pressão acústica variando de 81 kPa a 1200 kPa. - No gerador de pulso/atraso, defina o atraso do gatilho para o laser para excitação fluorescente das nanopartículas das microbolhas durante a gravação.
NOTA: Para esses experimentos específicos, o atraso do gatilho foi entre 20 μs e 170 μs por uma duração total de 150 μs. O diagrama de tempo é mostrado na Figura 4B. - Mova o suporte de amostra contendo a solução amostral usando o estágio XYZ para localizar microbolhas únicas no foco do microscópio. Comece com um campo de visão de um canto do porta-amostras; ver Figura 4C para uma visão ideal da câmera na qual a interface dos microbolhas é claramente visível e em foco. Acione a gravação.
- Repita o passo 2.3.5.3 quantas vezes desejar por definição de ultrassom (frequência e pressão acústica), movendo o de cultura celular contendo os microbolhas pelo menos 2 mm (no plano óptico) do local anterior para garantir que microbolhas no campo de visão não sejam sonicadas em experimentos anteriores.
NOTA: Neste estudo, cada experimento foi repetido ~10-20x. Quando todo o suporte da amostra estiver insonizado, esvazie o suporte da amostra e recarrete-o com uma solução de amostra fresca para experimentos subsequentes. Qual distância para mover o suporte de amostra entre experimentos depende do tamanho do feixe acústico.
- Defina a frequência de condução de ultrassom desejada e a amplitude de pressão acústica no gerador de forma de onda arbitrária através do script escrito internamente.
- Análise de dados
- Analise os registros de microscopia de fluorescência de acordo com a questão da pesquisa. Para cada microbolhas, determine visualmente se ocorreu a entrega das nanopartículas nos experimentos de microscopia de fluorescência. Se o desprendimento e a deposição das nanopartículas do núcleo de gás na membrana do suporte da amostra forem observados para uma única microbolhas, digite manualmente que a entrega ocorreu no ambiente de programação.
- Montagem do sistema óptico
3. Microscopia intravital
- Cirurgia da câmara de janela da pele dorsal (descrita anteriormente26,47,50)
- Aclimesse os animais por uma semana antes de colocar as câmaras da janela. Embora tanto os camundongos femininos quanto os machos possam ser usados, e a idade não seja importante, certifique-se de que o peso dos camundongos seja de pelo menos 22-24 g para que a pele seja suficientemente flexível.
- Realizar a cirurgia sob anestesia geral com tratamento analgésico intraoperatório e pós-operatório. Anestesiar o animal por uma injeção subcutânea de fentanil (0,05 mg/kg)/medetomidina (0,5 mg/kg)/midazolam (5 mg/kg)/água (2:1:2:5) a uma dose de 0,1 mL por 10 g de peso. Use uma almofada de aquecimento ou uma lâmpada de aquecimento para manter a temperatura corporal do animal.
- Puxe suavemente a camada dupla de pele na parte de trás do animal para que a pele seja sanduíche entre duas molduras de polioximetileno simétrico da câmara da janela. Fixar a câmara colocando dois parafusos estendendo-se através da camada de pele dupla e suturando ao longo da borda superior da câmara.
- Remova a pele dentro da estrutura circular da câmara de um lado da dobra da pele. Coloque um vidro de cobertura com um diâmetro de 11,8 mm dentro da estrutura onde a pele é removida para formar uma janela no tecido.
- Use uma injeção subcutânea de atipemazol (2,5 mg/kg), flumazenil (0,5 mg/kg) e água (1:1:8) a uma dose de 0,1 mL por 10 g como antídoto para terminar a anestesia. Coloque o animal em um rack de recuperação aquecido durante a noite. Suplementar a água para os animais com 25 mg/mL de enrofloxacina para prevenir infecções no local cirúrgico.
- Criação de modelo de tumor
- Mantenha as células cancerígenas a 37 °C e em uma atmosfera de CO2 de 5% em meio de cultura adequada complementada com soro bovino fetal de 10% e penicilina U/mL de 100 u/mL e estreptomicina de 100 mg/mL.
NOTA: A linha celular osteossarcoma humana (OHS) foi usada neste protocolo, mas outras linhas celulares também podem ser usadas. - No dia seguinte ao passo 3.1.5, anestesiar o animal por isoflurane (5% durante a indução e 1-2% durante a manutenção) por alguns minutos. Remova o vidro de cobertura, aplique 5 × 106 células cancerígenas em 30 μL de meio de cultura celular e substitua o vidro de cobertura.
- Permitir que os tumores cresçam por 2 semanas antes da imagem, e monitorar o peso e o estado de saúde dos animais pelo menos 3 vezes por semana durante este período.
- Mantenha as células cancerígenas a 37 °C e em uma atmosfera de CO2 de 5% em meio de cultura adequada complementada com soro bovino fetal de 10% e penicilina U/mL de 100 u/mL e estreptomicina de 100 mg/mL.
- Montagem do sistema óptico
- Realizar imagens intravitais durante o tratamento do ultrassom (como descrito em trabalhos anteriores26) com um microscópio adequado e objetivo dependendo da questão da pesquisa em jogo. Consulte a Figura 5A para obter uma representação esquemática da configuração experimental.
NOTA: Para este experimento específico, foi utilizado um microscópio multifotono, equipado com um objetivo de imersão de água de 20x (NA de 1,0 e distância de trabalho de 2 mm) e um laser pulsado. As imagens foram adquiridas em modo de varredura ressonante a 31 quadros por segundo (512 x 512 pixels) com um campo de visão de 400 x 400 μm2. O comprimento de onda de excitação foi de 790 nm. Os filtros na frente dos dois detectores de fosfeto de arsênio de gálio foram de passagem longa de 590 nm e band-pass 525/50 nm para detecção de fluorescência.
- Realizar imagens intravitais durante o tratamento do ultrassom (como descrito em trabalhos anteriores26) com um microscópio adequado e objetivo dependendo da questão da pesquisa em jogo. Consulte a Figura 5A para obter uma representação esquemática da configuração experimental.
- Montagem do sistema acústico
- Monte um transdutor de ultrassom adequado em um guia de ondas (feito sob medida) posicionado abaixo do objetivo em um ângulo de 45° em relação ao eixo óptico para minimizar reflexos do vidro de cobertura da câmara da janela dorsal da dobra da pele e reduzir as formações de ondas permanentes. Encha o guia de ondas com água destilada e desgaseada. Aplique gel de acoplamento ultrassônico em cima do guia de ondas.
- Alinhamento dos sistemas ópticos e acústicos
- Alinhe o eixo óptico com o foco do ultrassom. Posicione um hidrofone de fibra óptica no foco do objetivo. Em seguida, ligue o amplificador e o gerador de forma de onda arbitrária para excitar o transdutor com rajadas curtas (5-10 ciclos) com uma frequência de repetição de pulso de 100 Hz, e mova o transdutor de ultrassom para a posição onde a maior pressão é detectada com o sinal hidrofone no osciloscópio.
NOTA: Não altere a posição do transdutor após o alinhamento.
- Alinhe o eixo óptico com o foco do ultrassom. Posicione um hidrofone de fibra óptica no foco do objetivo. Em seguida, ligue o amplificador e o gerador de forma de onda arbitrária para excitar o transdutor com rajadas curtas (5-10 ciclos) com uma frequência de repetição de pulso de 100 Hz, e mova o transdutor de ultrassom para a posição onde a maior pressão é detectada com o sinal hidrofone no osciloscópio.
- Protocolo de imagem
- Posicione o suporte animal aquecido (projetado sob medida) conectado a um estágio de posicionamento XY entre o guia de ondas e o objetivo, e adicione mais gel de acoplamento. Anestesiar o animal e colocar um cateter da veia da cauda. Coloque o mouse no suporte aquecido e conserte a câmara da janela no suporte. Adicione uma gota de água em cima da tampa deslize na câmara da janela e mova o objetivo no lugar para a imagem do tecido tumoral.
-
A Figura 5B mostra o diagrama de tempo dos experimentos que retratam a ordem dos eventos. Injete 2 MDa dextran com rótulo fluorescente (30 μL, 4 mg/mL diluídos em soro fisiológico) para visualizar a vasculatura e mova o mouse usando o estágio de tradução XY para encontrar uma posição com vasos sanguíneos adequados. Grave imagens de base antes do tratamento de ultrassom. Ajuste a taxa de quadros, o campo de visão e o comprimento da gravação dependendo da questão da pesquisa e das especificidades do microscópio e dos corantes a serem imagens.
NOTA: Nestes experimentos, foram registrados 31 quadros por segundo com um campo de visão de 400 x 400 μm2, e a imagem foi feita continuamente por 5 minutos. - Defina a frequência de condução do ultrassom desejada, o comprimento do pulso e a amplitude de pressão acústica no gerador de forma de onda arbitrária.
NOTA: Para estes experimentos, foi utilizada uma frequência de 1 MHz com um comprimento de pulso de 10 ms e amplitudes de pressão negativa máxima entre 0,2 MPa e 0,8 MPa. Uma frequência de repetição de pulso de 0,5 Hz ou 0,1 Hz foi usada para permitir que novas microbolhas se reperfusessem na área tratada entre pulsos de ultrassom. - Injete 50 microbolhas μL (2 × 108 a 5 × 108 microbolhas/mL) por via intravenosa, e aplique ultrassom durante a imagem, conforme descrito em 26.
- Análise de dados
- Dependendo da questão da pesquisa, analise imagens com software de processamento de imagem (código aberto) e um ambiente de programação, conforme descrito em 26, para determinar parâmetros dos vasos sanguíneos (diâmetro, ramificação, velocidade de fluxo e direção), acúmulo de nanopartículas nos vasos, cinética e profundidade de penetração da extravasação de dextran e nanopartículas no tecido tumoral.
Resultados
Os microbolhas, produzidos conforme descrito no protocolo, foram analisados utilizando-se diversos métodos de microscopia e em várias escalas de tempo.
A fluorescência das nanopartículas na microscopia confocal (Figura 6A) indica que a casca tem uma distribuição de partículas não uniformes. Outros métodos de microscopia podem ser usados para caracterização de bolhas. Por exemplo, a Figura 6B mostra a estrutura geral do microbolhas usando microscopia eletrônica de varredura, como apresentado em trabalhos anteriores34.
A dinâmica radial e o comportamento da bolha fenomenológica podem ser estudados usando o método de microscopia de campo brilhante descrito in vitro , onde os microbolhas foram visualizados a 10 milhões de quadros por segundo. O raio de microbolhas individuais foi extraído ao longo do tempo usando um script escrito internamente. Um exemplo de tal resposta radial é mostrado na Figura 7.
Uma sequência de imagem de entrega típica de nanopartículas bem sucedidas, conforme descrito na seção 2.3.6, é mostrada na Figura 8A. As nanopartículas embutidas na concha de microbolhas podem ser vistas para acender devido à fluorescência quando a luz laser atinge a bolha. Impulsionadas pela insanação do ultrassom, as nanopartículas fluorescentes se desprendem do núcleo gasoso dos microbolhas e são depositadas na membrana do suporte da amostra. Finalmente, o laser é desligado, e as nanopartículas fluorescentes não estão mais animadas. A entrega mal sucedida da carga fluorescente dos microbolhas normalmente se parece com a sequência de imagem mostrada na Figura 8B, onde as nanopartículas fluorescentes acendem-se sobre a casca do microbolhas que permanece intacta durante a exposição ao ultrassom.
A microscopia multifotol intravital em tempo real durante o ultrassom foi usada para investigar os efeitos do ultrassom e microbolhas no comportamento de nanopartículas no sangue, melhoria da permeabilidade dos vasos sanguíneos tumorais e melhoria da entrega de nanopartículas. A extensão e cinética da penetração na matriz extracelular em função da pressão acústica, frequência e comprimentos de pulso podem ser caracterizadas. O efeito do tratamento de ultrassom pode variar em relação ao tamanho e morfologia dos vasos e consequente confinamento da bolha. Como o tratamento do ultrassom afeta o fluxo sanguíneo e a direção podem ser determinados. Um experimento de exemplo mostrando a extravasação de nanopartículas ao longo do tempo é mostrado na Figura 9 em um índice mecânico (MI) de 0,826. Os resultados da microscopia multifotílica intravital elucidam a extravasação espacial e temporal de nanopartículas durante a exposição ao ultrassom, o que é altamente benéfico para a compreensão completa dos mecanismos subjacentes à entrega mediada por ultrassom de nanopartículas e para otimizar tais tecnologias26.
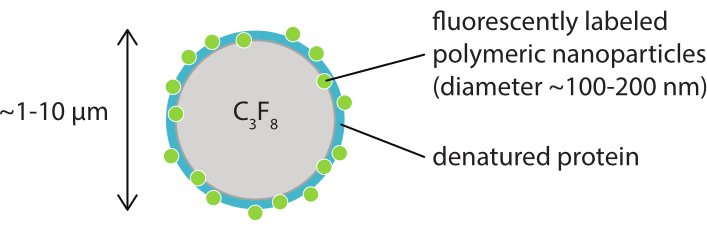
Figura 1: Representação esquemática de uma microbolhas com uma concha de nanopartículas poliméricas fluorescentes em caseína desnaturada. As microbolhas são tipicamente entre 1 μm e 10 μm de diâmetro. As nanopartículas têm um diâmetro principalmente entre 100 nm e 200 nm38. Abreviação: C3F8 = gás perfluoropropano. Clique aqui para ver uma versão maior desta figura.
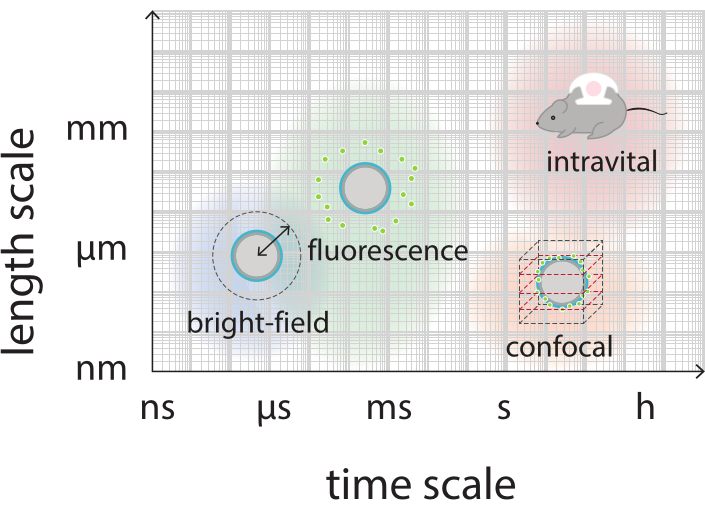
Figura 2: Visão geral de esquema mostrando as escalas de tempo e comprimento relevantes para microscopia de campo brilhante, fluorescência, confocal e intravital. Por favor, clique aqui para ver uma versão maior desta figura.
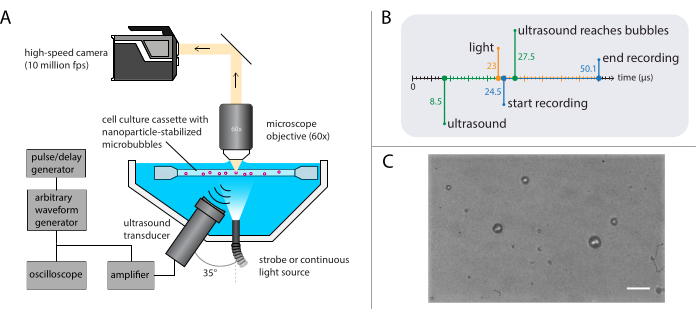
Figura 3: Representação esquemática de experimentos de microscopia de campo brilhante. (A) Configuração experimental, (B) o diagrama de tempo e (C) um quadro típico gravado. Barra de escala em (C) = 10 μm. Abreviação: fps = quadros por segundo. Clique aqui para ver uma versão maior desta figura.
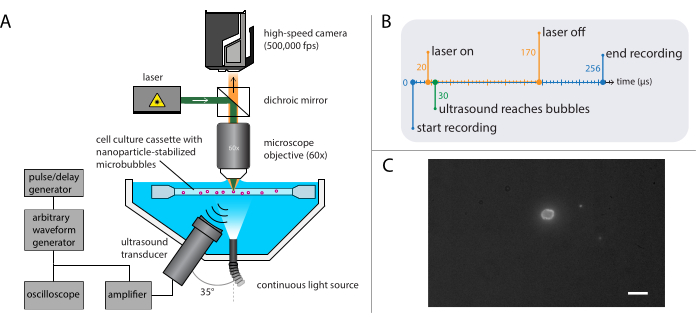
Figura 4: Representação esquemática de experimentos de microscopia de fluorescência. (A) Configuração experimental, (B) o diagrama de tempo e (C) um quadro típico gravado. Barra de escala em (C) = 10 μm. Abreviação: fps = quadros por segundo. Clique aqui para ver uma versão maior desta figura.
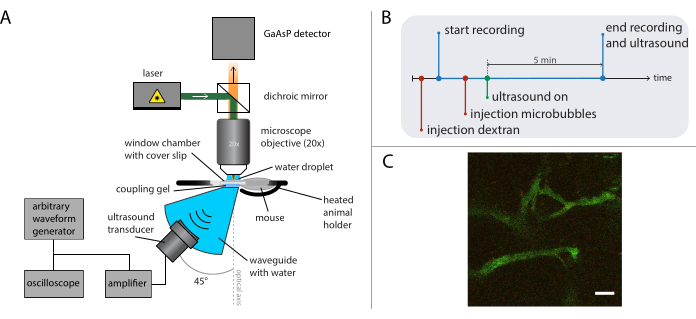
Figura 5: Representação esquemática de experimentos de microscopia intravital. (A) Configuração experimental, (B) o diagrama de tempo e (C) um quadro típico gravado. Barra de escala em (C) = 50 μm. O verde corresponde ao dextran-FITC e vermelho às nanopartículas. Abreviação: GaAsP = gálio arssenida fosfato. Clique aqui para ver uma versão maior desta figura.
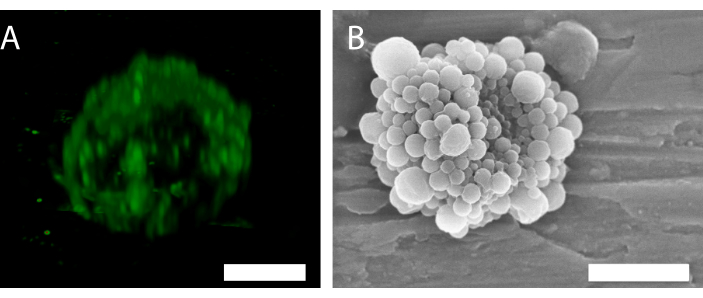
Figura 6: Estrutura 3D de uma única microbolça estabilizada por nanopartículas e proteínas. (A) Utilizando microscopia confocal para mostrar as nanopartículas, e (B) usando um microscópio eletrônico de varredura para mostrar a estrutura 3D. (B) foi reproduzido com permissão de 34. Barra de escala em (A) = 5 μm; barra de escala em (B) = 2 μm. Clique aqui para ver uma versão maior desta figura.
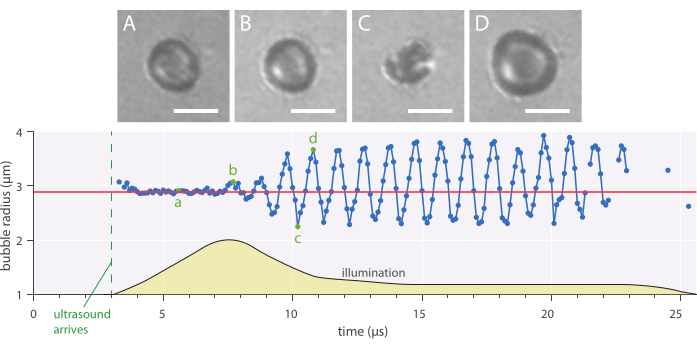
Figura 7: Oscilações esféricas típicas de um microbolhe de 2,89 μm de raio e proteína estabilizada em uma frequência de ultrassom de 1 MHz e uma amplitude de pressão acústica de 142 kPa. (A-D) Imagens da gravação de alta velocidade e do raio de bolha correspondente ao longo da curva do tempo (inferior). Barras de escala = 5 μm, e a linha vermelha indica o raio inicial. O perfil de iluminação (unidades arbitrárias) é indicado por amarelo. A ampliação é de 120x. Por favor clique aqui para ver uma versão maior desta figura.
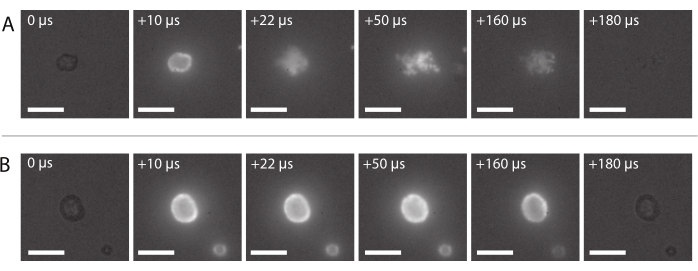
Figura 8: Sequência de imagem da microscopia de fluorescência de alta velocidade. (A) Entrega bem sucedida de nanopartículas fluorescentes de um microbolesco estabilizado por nanopartículas e proteínas em uma frequência de ultrassom de 2 MHz e uma amplitude de pressão acústica de 600 kPa. (B) Entrega mal sucedida de nanopartículas fluorescentes rotuladas de uma microbola estabilizada por nanopartículas e proteínas insonificada em uma frequência de ultrassom de 2 MHz e uma amplitude de pressão acústica de 210 kPa. Barras de escala = 10 μm. A ampliação é de 120x. Por favor clique aqui para ver uma versão maior desta figura.
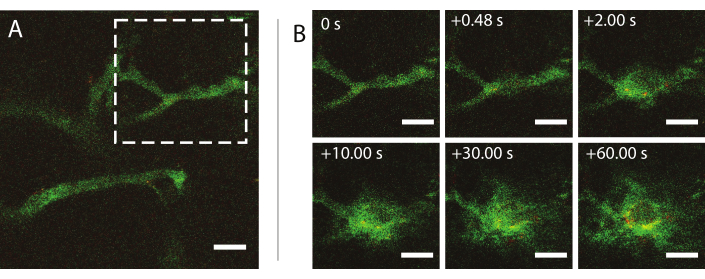
Figura 9: Microscopia intravital após inssonação de microbolhas estabilizadas por nanopartículas e proteínas a uma frequência de ultrassom de 1 MHz e uma amplitude de pressão acústica de 800 kPa. (A) Nanopartículas dentro do vaso, e (B) uma sequência de imagem da área indicada pelo quadrado branco tracejado em (A) representando a extravasação de dextran (verde) e nanopartículas (vermelho). Barras de escala = 50 μm. A ampliação é 20x. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Diferentes métodos ópticos de microscopia foram combinados para obter informações sobre as várias etapas na entrega de nanopartículas da superfície dos microbolhas para o meio circundante. Foram realizadas imagens das oscilações da bolha, bem como imagens da liberação das nanopartículas da casca de bolha, da extravasação e da penetração através da matriz extracelular dos tumores in vivo. A imagem in vitro permite a triagem de muitos parâmetros de ultrassom em comparação com as configurações in vivo mais complexas. O benefício de combinar essa gama de modalidades de imagem são as informações complementares que podem ser obtidas em diferentes escalas de tempo - característica crucial para caracterizar e otimizar as microbolhas para entrega bem sucedida e para obter eficácia terapêutica. Esta abordagem é útil para entender os mecanismos de entrega de todos os microbolhas, incluindo construções com nanopartículas e drogas fluorescentes.
Os passos mais críticos nos métodos de microscopia utilizados para estudar microbolhas simples são os seguintes. Para microscopia de fluorescência, as nanopartículas devem ser rotuladas fluorescentemente para permitir a visualização da liberação de partículas. Além disso, a solução amostral deve ser diluída o suficiente para isolar microbolhas únicas para análise em métodos de microscopia de confocal, de campo brilhante e fluorescência. Além disso, é importante escolher uma frequência de condução de ultrassom e pressão acústica para excitar as bolhas de forma mais eficiente, ou seja, em sua ressonância. Se a questão da pesquisa diz respeito à entrega da carga de nanopartículas, os parâmetros de ultrassom apropriados devem fazer parte da investigação. Ao lado da ressonância, essas bolhas também devem ser conduzidas a ou além de seu limiar para liberação de nanopartículas, tipicamente em amplitudes de pressão acústica relativamente altas (MI > 0,3)51. Para imagens de microscopia de campo brilhante, é fundamental escolher uma câmera de alta velocidade com uma taxa de quadro suficientemente alta para minimizar o desfoque de movimento e evitar o aliasing.
A microscopia de campo brilhante é limitada principalmente pelo framerate de imagem e intensidade das fontes de luz disponíveis, uma vez que uma taxa de quadros mais alta daria uma visão mais detalhada do tempo resolvido sobre a dinâmica da bolha, mas requer iluminação mais intensa devido a tempos de exposição mais curtos. Para estudar a liberação de partículas com mais detalhes, o framerate para imagens de fluorescência pode, em princípio, ser aumentado aumentando a intensidade da luz laser. No entanto, a absorção da luz laser de alta intensidade pelas microbolhas fluorescentes com rótulos fluorescentes gera calor, mesmo com corantes de alto rendimento quântico. Esse calor pode interferir com os experimentos em jogo e, em casos extremos, induzir cavitação foto-térmica52. Assim, na prática, há um limite para a fluência a laser aplicada. No entanto, a intensa iluminação a laser também pode ser deliberadamente usada para induzir a liberação de partículas de lipossomos53. A temperatura influencia a dinâmica da bolha e a resposta ao ultrassom, dependendo do tipo bolha54. Portanto, se os métodos in vitro e intravital forem comparados objetivamente, os métodos in vitro discutidos no protocolo devem ser realizados a 37 °C. Outra limitação dos métodos in vitro discutidos no artigo atual é que as bolhas não estão em um ambiente de campo livre, pois os microbolhas flutuarão abaixo da membrana do suporte da amostra. Além disso, há um viés de seleção ao fotografar microbolhas únicas. No entanto, a realização de experimentos repetidos em bolhas únicas permite a investigação do efeito do tamanho e remoção do fator de confusão - a distribuição de tamanho. Se a resposta da bolha em função do tamanho puder ser entendida enquanto a concentração não for muito alta para evitar interações bolha-bolha, a resposta de qualquer população de bolhas arbitrárias pode ser calculada. Finalmente, tanto os métodos de microscopia de campo brilhante quanto de fluorescência fornecem insights sobre microbolhas complicadas em uma imagem bidimensional (2D). Se a questão da pesquisa exigir mais de imagens 2D, o comportamento 3D das bolhas pode ser resolvido combinando a configuração descrita no protocolo com uma configuração de visão lateral para imagens multiplanas55.
Um método alternativo para estudar microbolhas é a caracterização acústica56. No entanto, medir o eco de um único microbolhas requer localizar e isolar uma única microbola dentro do feixe de ultrassom56, o que representa um desafio tipicamente enfrentado pelo uso de um tubo estreito ou pinça óptica ou acústica57,58. Para dimensionar bolhas acústicas, os microbolhas podem ser insonificados no regime de dispersão geométrica em frequências muito superiores à sua frequência de ressonância, o que não induz oscilações volumétricas de microbolhas59. O uso de uma "câmera acústica" é um método para imagem da dinâmica radial de microbolhas únicas em resposta ao ultrassom, onde uma sonda de ultrassom de alta frequência é usada para determinar a resposta radial da bolha a uma onda de condução de baixa frequência60. A desvantagem deste método é que ele só pode ser usado para determinar a alteração relativa do raio de microbolhas; portanto, outro método é necessário para determinar o raio de bolha absoluta, por exemplo, através de imagens ópticas61,62. A desvantagem dos métodos em que os microbolhas são expostos ao ultrassom em frequências superiores à sua frequência de ressonância é que, em frequências tão altas, a profundidade de penetração é reduzida59, limitando a usabilidade para aplicações in vivo. Outras formas de microscopia também podem ser usadas para estudar microbolhas como microscopia eletrônica de varredura, microscopia de força atômica e microscopia eletrônica de transmissão63. A resolução espátula-temporal alcançável dessas técnicas alternativas de microscopia, no entanto, é geralmente mais limitada, e essas técnicas têm a desvantagem de que a imagem é realizada antes ou depois da exposição ao ultrassom por análise off-line e normalmente apresentam um baixo throughput63. Outra alternativa é usar um método de dispersão de luz, que pode ser usado para estudar a dinâmica radial de microbolhas únicas em tempo real, mas tem uma baixa relação sinal-ruído em comparação com os métodos de dispersão acústica64.
A microscopia intravital em tempo real durante a exposição ao ultrassom é um método poderoso para adquirir uma nova visão sobre a vasculatura, comportamento de microbolhas, nanopartículas ou outras moléculas (como o dextran neste caso) durante a exposição ao ultrassom. Uma limitação geral ao realizar microscopia intravital em tempo real é que apenas uma pequena área do tecido é visualizada, e a profundidade de penetração da luz no tecido é limitada. Se os vasos de imagem contiveram pouquíssimas microbolhas e/ou nanopartículas dentro do campo de visão, pouca ou nenhuma informação sobre o comportamento da nanopartícula e extravasação pode ser obtida. Além disso, devido ao campo de visão limitado, um alinhamento adequado entre os caminhos de luz e ultrassom é crucial. Se a pressão do ultrassom for alta o suficiente para induzir a destruição da bolha, também é importante escolher uma frequência de repetição de pulso que permita que bolhas frescas se reperfusem no campo de visão entre pulsos de ultrassom. Além disso, como o ultrassom será refletido a partir do vidro de cobertura na câmara da janela e do objetivo, colocar o transdutor em um ângulo é importante para reduzir os reflexos, como para evitar a formação de ondas de pé, que distorcem o campo de pressão calibrado. Outra questão prática é que a configuração precisa ter espaço suficiente para montar o transdutor de ultrassom e guia de ondas acima ou abaixo do objetivo na configuração do microscópio. Os tumores na câmara da janela dorsal terão uma espessura limitada devido à câmara de confinamento e ao deslizamento da tampa; no entanto, se necessário, outros modelos poderiam ser usados. Exemplos são tumores de dobras cutâneas, por exemplo, na almofada de gordura mamária 65 ou na imagem intravital abdominal de tumores nos vários órgãos66. Tais tumores podem ser cultivados ortotopicamente no microambiente adequado e, como tal, apresentam um caso mais clinicamente relevante.
Os métodos descritos neste trabalho esclarecem o potencial de microbolhas fluorescentes para estudar os fundamentos das aplicações de entrega de medicamentos utilizando bolhas e ultrassom. Esta combinação de métodos de microscopia fornece uma visão valiosa sobre a resposta de microbolhas à inssonação do ultrassom e seu espaço de parâmetro acústico associado e apresenta uma visão clara do comportamento de microbolhas e cargas ao longo de uma faixa relevante de escalas de tempo e comprimento.
Divulgações
Os autores declaram que não há conflito de interesses.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
Referências
- Szabo, T. L. . Diagnostic ultrasound imaging: inside out. , (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197 (2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E., Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). , 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. . Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8 (2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -. N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103 (2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, &. #. 2. 2. 1. ;., et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876 (2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. . Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115 (2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103 (2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911 (2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501 (2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados