Method Article
초음파 트리거 약물 방출을 위한 형광 표지 마이크로 버블의 특성화를 위한 다중 시간 척도 현미경 검사법
요약
제시된 프로토콜은 그들의 활성화 기계장치 및 그들의 생체 효력을 포함하여 초음파 트리거한 약 납품 응용을 위해 디자인된 형광 표지마이크로버블의 반응을 특성화하기 위하여 이용될 수 있습니다. 이 백서는 관련 길이및 시간대를 포착하기 위해 수행된 다양한 시험관 내 및 생체 내 현미경 기술을 다룹니다.
초록
마이크로 버블 조영제는 초음파로 약물 전달 응용 프로그램에 대한 큰 약속을 보유하고 있습니다. 나노 입자에 약물을 캡슐화하면 전신 독성이 감소하고 약물의 순환 시간이 증가합니다. 마이크로 버블 보조 약물 전달에 대한 새로운 접근 방식에서 나노 입자는 마이크로 버블 쉘에 통합되어 초음파로 나노 입자 페이로드의 로컬 및 트리거 방출을 가능하게합니다. 광대한 초음파 매개 변수 공간 내의 방출 메커니즘에 대한 철저한 이해는 효율적이고 제어된 방출에 매우 중요합니다. 제시된 프로토콜의 이 세트는 형광 라벨을 포함하는 쉘이 있는 마이크로버블에 적용됩니다. 여기서, 초점은 폴리 (2-ethyl-butyl cyanoacrylate) 폴리머나노 입자로로드 된 마이크로 버블에, 수정 된 나일 레드 염료로 도핑. 파티클은 변성 카제인 쉘 내에 고정됩니다. 마이크로 버블은 격렬한 교반에 의해 생성되며, 카제인과 나노 입자를 포함하는 액체 단계에서 퍼플루오로프로판 가스의 분산을 형성하고, 그 후 마이크로 버블 쉘이 자체 조립됩니다. 나노입자 방출 공정의 모든 관련 시간대에 나노입자 안정화 마이크로버블을 특성화하기 위해서는 다양한 현미경 기술이 필요합니다. 나노 입자의 형광은 단일 마이크로 버블의 공초점 이미징을 가능하게하여 쉘 내의 입자 분포를 드러냅니다. 초당 1,000만 프레임의 밝은 필드 현미경 을 사용하여 체외 초고속 이미징은 초음파 발생에 대한 응답으로 거품 역학에 대한 통찰력을 제공합니다. 마지막으로, 버블 쉘에서 나노 입자 방출은 초당 500,000 프레임에서 수행된 형광 현미경 검사법에 의해 가장 잘 시각화됩니다. 생체 내 약물 전달을 특성화하기 위해, 혈관 내 내나노 입자의 트리거방출및 내피층을 넘어 그들의 사치품은 몇 분의 시간 동안 등색 피부 접이식 창방에 이식된 종양에 있는 중요한 현미경 검사를 사용하여 연구된다. 이러한 보완적인 특성화 기술의 조합은 시험관 내 및 생체 내 다양한 시간 및 길이 저울에서 마이크로 버블및 페이로드 방출의 동작 에 대한 고유한 통찰력을 제공합니다.
서문
초음파는 가장 널리 사용되는 의료 영상 기술입니다. 그것은 비 침습적, 빠른, 안전, 비용 효율적인, 휴대용1,2,3입니다. 그러나, 혈액은 가난한 초음파 산란기이며, 혈액 풀의 대비는 초음파 조영제3의 정맥 주사에 의해 강화 될 수있다3. 이러한 향상된 혈액 풀 콘트라스트는 관상 동맥 질환4 및 전이성 간 질환의 검출과 같은 진단 목적으로 기관 관류의 정량화를 가능하게 합니다5. 실제로, 종양 혈관은 중요한 예후 인자6인것으로 입증되었다6. 주요 연구 노력은 지금 치료 사용을 위한 microbubble 지원, 표적으로 한 분자 화상 진찰 및 조정 대비 에이전트를 향해 지시됩니다.
시판되는 초음파 조영제는 전형적으로 1 μm에서 10 μm9에 이르는 직경을 가진 코팅된 마이크로버블7,8의 현탁액으로 구성됩니다. 초음파 조영제 마이크로 버블은 적혈구보다 약간 작기 때문에7, 마이크로 버블은 폐색을 생성하지 않고 도작은 모세 혈관에도 안전하게 도달 할 수 있습니다3. 마이크로 버블은 압축 가스 코어11로 인해 조직10에 비해 초음파 백스캐터계수를 극적으로 증가시켰습니다. 또한, 마이크로 버블 에코는 매우 비선형, 즉, 그 스펙트럼은 구동 주파수의 고조파 및 하모니를 포함합니다. 또한, 에코 강도는 bubble12의 공명 반응에 크게 의존한다. 조직이 선형으로만 산란하는 동안, 소수의 마이크로 버블은 고조파 이미징13,14에서 높은 검출 감도를 달성하기에 충분합니다. 이 비선형 대비 생성은 신체의 단일 거품을 추적할 만큼 충분히 강할 수 있습니다15.
초음파 조영제의 껍질은 용해 및 결합에 대한 거품을 안정화시켜 혈액 풀16에서의 순환 시간을 증가시다. 껍질은 지질, 폴리머 또는 변성 단백질3,8로 구성될 수 있다. 그것은 얼굴 내 장력을 감소시켜 라플라스 압력 구동 용해17의 효과를 제한하고 가스 확산에 대한 저항 장벽을 만듭니다18. 안정성을 더욱 높이기 위해, 콘트라스트 마이크로버블은 전형적으로 혈중 용해도가 낮은 고분자 가기로 채워진다11. 마이크로 버블 쉘은 초음파 insonation1에 마이크로 버블의 반응을 극적으로 변화시다. 코팅되지 않은 가스 기포는 크기에 반비례하는 특징적인 공명 주파수를 가지며 지질 코팅을 첨가하면 쉘3의 본질적인 강성으로 인해 코팅되지 않은 부블의 공진 빈도가 증가합니다. 또한, 쉘은 팽창 점도를 통해 에너지를 발산하며, 이는 코팅 된 거품3에 대한 감쇠의 지배적 인 소스를 구성합니다. 안정화 쉘은 마이크로버블 표면에 리간드를 결합하여 기능화될 수 있다는 추가적인 이점을 갖는다. 이 표적화는 이러한 거품에 대한 많은 응용 프로그램을 가능하게하고, 특히 초음파14,19를 가진 분자 이미징.
마이크로 버블 조영제는 초음파로 약물 전달 응용 프로그램에 대한 큰 약속을 보유하고 있습니다. 혈관의 감금에서 진동하는 마이크로 버블은 모세관 벽에 국소 정상 및 전단 응력을 유발할 뿐만 아니라 마이크로 스트림을 유발할 수 있습니다3. 높은 음향 압력에서, 큰 진폭 진동은 관성 캐비테이션이라고 불리는 폭력적인 과정에서 마이크로 버블 붕괴로 이어질 수 있으며, 이는 차례로 혈관의 파열 또는 질로 이어질 수 있다20. 이러한 폭력적인 현상은 sonopermeation21과 같은 생체 효과를 유도할 수 있으며, 내피 벽을 가로 질러 중질 비질로 치료 약물의 사치를 향상시킬 수 있습니다. 그것은 또한 stroma 풍부한 종양의 세포외 매트릭스를 통해 치료 약제의 침투를 향상시킬 수 있습니다21,22 및 biofilms23,24, 비록이 메커니즘은 여전히 제대로 이해 26.
초음파 매개 약물 전달은 전임상 27,28 및 임상 시험22모두에서 유망한 결과를 보여주었습니다. 더욱이, 상대적으로 저주파 초음파(~1MHz)와 함께 사용될 경우, 마이크로버블은 국소로 보고되어 혈액-뇌 장벽 투과성을 일시적으로 증가시켜 전임상 및 임상 연구에서 29,31,32,33,34로 뇌 의 반구를 입력할 수 있게 되었다.
초음파 매개 약물 전달에 대한 일반적으로 두 가지 접근법이 있습니다: 치료 물질은 거품과 함께 공동 투여될 수 있거나, 또는 버블 쉘28,35,36에 부착되거나 적재될 수 있다. 두 번째 접근법은 약물 전달37 측면에서 보다 효율적인 것으로 나타났습니다. 마이크로버블은 나노입자(리포솜 또는 중합체 나노구조)에 캡슐화된 약물 또는 유전물질을 포함하거나 쉘에 부착되거나 마이크로버블 쉘35,36에 직접 통합될 수 있다. 나노입자로 적재된 마이크로버블은 (집중) 초음파에 의해 활성화되어 나노입자 페이로드28,33,38,39,40을 국소적으로 방출할 수 있다. 이러한 마이크로버블이 세포와 직접 접촉하는 경우, 탑재하중이 sonoprinting34,35라고 하는 공정에서 세포 세포막에 증착될 수 있다는 것을 시험관내에서 보여 왔다.
마이크로 버블 소네이션을 위한 초음파 매개변수 공간은 광범위하며 생체 내 생물학적 조건은 더욱 복잡성을 더합니다. 따라서, 집중초음파와 나노입자로 적재된 마이크로버블의 조합은 표적 치료제 분야에서 도전과제를 제기한다.
이 작업의 목적은 초음파 매개 변수의 함수로서 마이크로 버블의 반응을 이미지화하고 형광 표지 쉘 재료의 쉘 파열 및 후속 방출로 이어지는 메커니즘을 연구하는 데 사용할 수있는 프로토콜을 제공하는 것입니다. 이 프로토콜 집합은 형광염을 포함하는 쉘이 있는 마이크로버블에 적용됩니다. 도 1은 SINTEF(Trondheim, 노르웨이)에서 개발된 중합체 나노입자 및 단백질 안정화 마이크로버블의 회로도 표현을 나타낸다. 이들 기포는 퍼플루오로프로판 가스(C3F8)와 쉘을 안정화시키는 나노입자로 채워져 있으며, 이는 나일홍형염염색제38,43의 지동성 유도체인 NR668을 함유하고 있다. 나노 입자는 폴리 (2-에틸 부틸 시아노아크라이레이트)(PEBCA)로 구성되며 PEGylated된다. 폴리에틸렌 글리콜(PEG)을 사용하여 기능화하면 단일 핵 식세포 시스템에 의한 편형성 및 식세포증을 감소시켜 순환 시간을 14,44로 연장시킨다. 그 결과, PEGylation은 표적 부위에 도달하는 나노입자의 양을 증가시켜 치료의 효능을 향상시킨다16. 그림 2는 4개의 현미경 방법의 사용이 연구원이 모든 관련 시간 및 길이 비늘을 커버하는 방법을 보여줍니다. 광학 현미경 검사법에서 달성 가능한 공간 해상도는 목표의 빛및 수치 조리개(NA)의 파장및 개체 조명 소스45의 파장에 의존하는 회절 제한에 의해 결정된다는 점에 유의해야 한다. 현재 시스템의 경우 광학 해상도 제한은 일반적으로 200nm입니다. 추가적으로, 비중요한 현미경 검사는 세포 외 수준46에 심상에 이용될 수 있습니다. 이 작업에 사용되는 나노입자 및 단백질 안정화 마이크로버블의 경우, 근위 내 현미경 검사법과 관련된 최소 길이 척도는 작은 모세혈관(≥10 μm)의 크기이다. 시험관 내 고속 광학 이미징(초당 1,000만 프레임) 및 고속 형광 이미징(초당 500,000프레임) 실험은 단일 마이크로버블에 대해 설명되어 있습니다. 나노초 타임스케일의 고속 밝은 필드 이미징은 진동 기포의 시간 해결 된 방사형 역학을 연구하는 데 적합합니다. 대조적으로, 고속 형광 현미경 검사는 형광 표지 나노 입자의 방출의 직접 시각화를 허용합니다. 더욱이, 마이크로버블 쉘의 구조는 Z-스택 3차원(3D) 공초점 현미경검사법을 이용하여 조사될 수 있고, 전자 현미경 검사(후자의 프로토콜은 현재 작업에 포함되지 않음). 인트라바이탈 현미경 검사는 다광광 현미경을 사용하여 등쪽 창 챔버에서 성장하는 종양을 이미지하여 현지 혈류흐름에 대한 실시간 정보와 생체내에서 형광표 나노입자의 운명에 관한 것으로 구성됩니다. 이러한 현미경 검사법의 조합은 궁극적으로 시험관 내 및 생체 내 초음파에 반응하여 치료 마이크로 버블 에이전트의 행동에 대한 상세한 통찰력을 제공합니다.
프로토콜
참고: 모든 실험 절차는 노르웨이 동물 연구 당국의 승인을 받았습니다. 프로토콜에 사용된 재료의 세부 사항은 재료 표에서 찾을 수 있습니다.
1. 마이크로 버블 생산
참고: 이 작업에서, 관심있는 마이크로 버블은 단백질 및 나노 입자 안정화 마이크로 버블이며, 생산 프로토콜은 이전에 설명된 28,33,48. 따라서 제작 프로토콜은 여기에 간략하게 요약되었습니다.
- 먼저, 파이펫을 사용하여, 인산염 완충식식염(PBS)에서 카제인의 0.5wt% 및 형광염의 0.21wt%, NR668(변형된 나일 레드)로 표시된 나노입자의 1wt%를 멸균 유리 크림프 상반부(10mL, 직경 2cm)로 혼합한다. 중합체 나노입자는 Mørch 외에 의해 설명된 바와 같이 미니 에멀젼 중합 방법을 사용하여 제조된다. 38.
참고: 여기서, 염료는 나노입자 방출의 시각화를 가능하게 하는 모형 약으로서 기능합니다. 나노 입자 용액으로 작업 할 때, 실험실 코트, 고글 및 장갑을 착용하십시오. 100% 아세톤으로 나노입자 용액의 유출을 즉시 닦아냅니다. - 고무 캡으로 유리병을 캡, 약간 혼합하고, 가능한 골재를 제거하기 위해 실온에서 10 분 동안 초음파 욕조에 유리병을 배치합니다. 유리 바이알 의 바닥에서 ~ 0.5cm 교반기의 끝으로 분산 도구를 놓습니다. 가스 용기에 연결된 유리 파이펫을 사용하여 용액이 약간 거품이 날 때까지 용액을 포함하는 바이알의 헤드 공간에 퍼플루오로프로판 가스를 추가합니다.
참고: 교반 중 유리 바이알의 미끄러짐을 방지하기 위해 분산 공구 의 기지 주위에 자체 밀봉 필름을 감쌉니다. - 분산 도구를 사용하여 1935년 × g (반경 3mm회전시 24,000rpm)에서 4분 간 적극적으로 저어줍니다. 고무 캡으로 바이알을 닫고 유리병을 밀봉하여 추가 로 사용하십시오.
참고: 교반은 액체의 가스를 함정에 빠뜨리는 것입니다. 마이크로 버블 쉘은 활성 단계를 필요로하지 않고 이후에 자체 조립합니다. - 여분의 카제인 및 나노 입자 용액을 4 °C에 저장하고 100 % 아세톤으로 분산 도구를 청소하십시오.
2. 단일 버블 이미징
- 공초점 현미경 검사법
- 샘플 준비
- 다음과 같이 단일 마이크로 버블을 이미지화하기 위해 버블 용액을 희석합니다. 제1항에 기술된 절차에 따라 생성된 마이크로버블을 함유한 유리 압착 탑 바이알에 환기 바늘(19 G-21 G)을 놓는다. 유리병을 거꾸로 뒤집어 큰 거품이 유리병의 물개에서 멀리 이동할 수 있도록 합니다.
- 유리병에 작은 (~1mL) 주사기의 또 다른 바늘 팁(19G)을 삽입하고 바이알은 여전히 거꾸로 되어 있습니다. 소량의 버블 서스펜션을 제거하고 주사기의 내용을 작은 튜브로 전송하여 다음 단계에서 더 쉽게 피펫팅할 수 있습니다.
참고: 직접 추출하는 현탁액의 부피는 버블 서스펜션의 종류와 농도에 따라 달라집니다. 이 경우 0.2mL이 추출되었다. - 파이펫을 사용하여 여과된 PBS의 마이크로버블 서스펜션(1부에서)을 희석하여 105 마이크로버블/mL을 × 약 2× 105 마이크로버블/mL의 농도를 달성하여 단일 버블 이미징을 가능하게 한다.
참고: 거품 유형에 따라 거품 현탁액을 세척하여 형광염을 제거하는 것이 좋습니다. 이것은 형광염료가 껍질에 주입되는 기포에서 특히 중요합니다. 거품을 세척하려면 버블 서스펜션(예: PBS 의 10mL에서 버블 용액의 100 μL을 복용하여) 희석하고 원심분리기(일반적으로 100× g의 순서의 속도로)를 희석시한다. 마지막으로, 추가 분석을 위해 파이펫으로 마이크로 버블을 포함하는 상체를 제거합니다. 나머지 용액에는 무료 형광 입자가 포함되어 있으며 폐기할 수 있습니다. 세탁 단계는 필요에 따라 반복되어야합니다. - 글리세롤을 혼합물에 첨가하여 배지의 점도를 높이고 브라운 운동에 의해 유도된 움직임을 제거하여 다소 느린 공초점 Z-스택 이미징을 방해합니다.
참고: 글리세롤의 양은 이미지화된 거품의 종류에 따라 달라집니다(여기, ~50%). 거품의 일부 유형에 대 한, 글리 세 롤 안정성에 불리 한 영향을 미칠 수 있습니다49. 그러나, 공초점 화상 진찰의 밑에 대략 30 분 이상 기포에서 눈에 띄는 변경이 관찰되지 않았습니다. 더욱이, 글리세롤은 마이크로버블의 음향 반응을 바꿀 수 있고 따라서 마이크로버블이 인음이 없는 이미징 방법과 함께만 사용될 수 있다. - 채널 슬라이드와 같은 최적의 이미징을 위해 얇은 벽이있는 챔버에 마이크로 버블 서스펜션을 놓습니다.
- 이미징 프로토콜
- 공초점 현미경을 전환하고, 공초점 현미경 검사중에 사용하기에 적합한 목표와 원하는 레이저 및 스캐너를 선택합니다.
참고: 여기서는 0.08 μm/픽셀의 해상도에 60배 의 물 침수 목표를 사용하고 거품 크기에 따라 256 x 256픽셀 또는 128 x 128픽셀의 영역을 이미지화합니다. 이러한 특정 실험에서 488 nm 레이저와 갈바노 스캐너를 사용하십시오. 방출 파장형은 형광염염에 따라 다르며 일반적으로 광대역입니다. - 밝은 필드에서 마이크로 버블을 찾아 공초점 현미경 검사법으로 전환합니다. 공초점 현미경이 스캔하는 사이에 원하는 상단 및 하단 평면을 설정합니다. 3D 구조를 관찰하기 위해 Z 스택을 획득; Z 방향으로 100 nm의 단계 크기를 사용합니다.
- 공초점 현미경을 전환하고, 공초점 현미경 검사중에 사용하기에 적합한 목표와 원하는 레이저 및 스캐너를 선택합니다.
- 샘플 준비
- 밝은 필드 현미경 검사법
- 광학 시스템의 조립
참고: 밝은 필드 현미경 검사법의 회로도 표현은 도 3A에 표시됩니다. 방해받지 않는 초음파 전파를 보장하기 위해 수조에는 광원용과 초음파 트랜스듀서용 개구부 가 하나 포함됩니다. 광학 시스템은 (모듈식) 현미경, 고속 카메라 및 일치하는 광학으로 구성됩니다. 마이크로 버블 진동의 기간은 일반적으로 1 μs (1 MHz 초음파 사용)의 순서이기 때문에 카메라는 초당 최소 5 백만 프레임의 프레임 속도로 기록하도록 설정해야합니다. 여기서 카메라는 초당 1,000만 프레임(256 x 400픽셀)에서 256프레임(25.6 μs)으로 기록하여 고조파를 포함한 버블 역학의 모든 세부 사항을 캡처하도록 설정되어 있습니다.- 적절한 배율, 작업 거리 및 NA를 현미경에 부착합니다.
참고: 물의 점진적증발에도 불구하고 안정적인 작업 거리를 제공하기 위해 수분 침수 목표를 사용했습니다. 여기서, 60x의 배율, 2mm의 작업 거리 및 1의 NA를 가진 수침 목표가 선택되었습니다. - 현미경과 카메라 사이의 조명및 튜브 렌즈에 대해 최소 1kW의 피크 출력을 갖춘 스트로브 라이트를 사용하여 가능한 한 적은 주변 빛이 고속 카메라의 센서에 도달할 수 있도록 합니다.
- 단일 마이크로 버블과 광학 및 음향 시스템의 정렬에 초점을 맞추기 위해 조광 할로겐 광원을 사용하여 실시간 이미징을 사용할 수 있습니다.
- 적절한 배율, 작업 거리 및 NA를 현미경에 부착합니다.
- 음향 시스템의 조립
- 프로그래밍 가능한 임의 파형 생성기와 파워 앰프(56dB 게인)를 사용하여 매끄러운 포위및 파형으로 트랜스듀서를 구동합니다. 오실로스코프를 임의파형 발생기에 연결하여 신호를 확인합니다. 개인용 컴퓨터를 임의파형 생성기에 연결하여 사내에서 작성된 스크립트를 사용하여 들어오는 음향 압력 파를 프로그래밍합니다.
- 펄스/지연 생성기를 마스터 트리거로 사용하여 광학 및 음향 시스템을 동기화합니다. 초음파 전달 후 16 μs를 시작하여 초음파 파가 거품에 도달 할 수 있도록 펄스 / 지연 발생기 및 카메라 소프트웨어에 트리거 지연을 설정합니다. 발광 발진 중에 적절한 조명을 보장하기 위해 녹음시작 전에 광원 1.5 μs를 트리거합니다(타이밍 다이어그램의 그림 3B 참조).
- 적절한 센터 주파수를 가진 적합한 트랜스듀서를 선택합니다. 시료 홀더 멤브레인의 반사를 최소화하고 서 파 형성을 줄이기 위해 광학 축에 대하여 각도로 되어 있는지 수조의 개구부에 놓습니다.
참고: 여기서, 2.25MHz의 중심 주파수를 가진 단일 요소 집중 침지 변환기, 1"의 초점 거리 및 0.75"의 요소 직경은 광학 축에 대하여 35°의 각도로 배치되었습니다. 음향 시스템에서 사용되는 동일한 앰프를 사용하여 전송 함수의 교정을 수행해야 합니다. 전압 진폭에서 트랜스듀서의 압력 진폭까지 초음파 전송 주파수의 기능으로 광섬유 하이드로폰을 사용하여 이송 기능을 보정합니다.
- 샘플 홀더 선택
- 광학적이고 음향적으로 투명한 멤브레인과 동일한 샘플 내에서 여러 단일 마이크로 버블의 이미징을 할 수 있을 만큼 충분히 큰 부피를 가진 샘플 홀더를 사용합니다.
참고: 여기서, 10mL의 부피를 가진 세포 배양 카세트, 25cm2의 막 영역 및 175 μm의 막 두께가 사용되었다. 하부 멤브레인에 대한 음향 반사, 현미경 목표 및 상부 멤브레인에 의해 반사되는 파도로부터의 간섭으로 인해, 시투 음향 압력은 임의파형 발생기에서 프로그래밍된 압력과 다를 수 있습니다. 샘플 홀더 멤브레인에 대하여 감찰기를 비스듬히 배치하면 서 파 형성이 줄어들지만 멤브레인의 반사를 증가시킬 수 있습니다. - 샘플이 완전히 침수되어 트랜스듀서와 현미경 목표 모두의 초점 내에 가져올 수 있는지 확인합니다. 3D 마이크로포지팅 단계에 부착된 알루미늄 지지체를 사용하여 샘플 홀더를 독립적으로 이동시합니다.
- 광학적이고 음향적으로 투명한 멤브레인과 동일한 샘플 내에서 여러 단일 마이크로 버블의 이미징을 할 수 있을 만큼 충분히 큰 부피를 가진 샘플 홀더를 사용합니다.
- 광학 및 음향 시스템의 정렬
- 3D 번역을 위해 설정을 정렬하고, 수조를 XY 번역 단계에 연결하고, 실험 중에 움직이지 않도록 광학 테이블에 스테이지를 연결합니다. 그런 다음 수조를 물로 채우고 딤암이 가능한 할로겐 광원을 켭니다. 정렬 하는 동안, 초음파 반사를 방지 하기 위해 측면에 현미경 목표를 이동.
- 샘플 홀더 암에 바늘 하이드로폰(0.2 mm)을 부착하고 바늘 하이드로폰을 수조에 넣고, 목적의 시야에 팁이 있습니다. 증폭기 및 임의파형 발생기를 켭니다. 5~10개의 초음파 주기와 15Hz의 펄스 반복 주파수의 단일 펄스를 사용하십시오. 최대 압력 진폭에 도달할 때까지 XY 방향으로 탱크와 바늘을 Z 방향으로 이동합니다.
- 현미경의 초점을 조정하여 하이드로폰 의 끝에 다시 초점을 맞춥니다.
참고: 이 프로토콜은 현미경 초점과 트랜스듀서 초점 사이의 정렬을 보장합니다. 정렬 후 현미경 및 트랜스듀서의 위치를 변경하지 마십시오.
- 샘플 준비
- 샘플 솔루션을 준비하기 위해 2.1.1.1 ~ 2.1.1.3 단계를 반복합니다. 단일 버블 이미징을 활성화하고 이웃 거품의 음향 상호 작용을 배제하기 위해 거품 솔루션을 희석합니다.
- 샘플 홀더의 콘센트를 엽니다. 주사기를 사용하여 샘플 용액을 완전히 채워넣을 때까지 샘플 홀더의 다른 개구부에 주입합니다. 초음파 필드와의 원치 않는 상호 작용을 방지하기 위해 샘플 홀더 내부에 기포가 없는지 확인하십시오.
- 샘플 홀더의 두 밸브를 닫고 샘플 홀더를 광학 축에 수직으로 배치합니다.
참고: 이동 중에 거품이 샘플 홀더의 한쪽으로 이동하지 않도록 채워진 샘플 홀더 수준을 유지합니다.
- 이미징 프로토콜
- 상기 사내 서면 스크립트를 통해 임의파형 발생기에서 원하는 초음파 구동 주파수 및 음향 압력을 프로그래밍한다.
참고: 여기서 음향 압력 파는 8주기 가우시안 테이퍼 펄스로 40사이클의 단일 버스트였습니다. 이러한 실험에 사용된 초음파 주파수는 1MHz, 2MHz 또는 3MHz였으며, 81kPa에서 1200kPa에 이르는 음향 압력 진폭이 있었다. - XYZ-stage를 사용하여 샘플 용액을 포함하는 샘플 홀더를 이동하여 현미경의 초점에서 단일 마이크로 버블을 찾습니다. 샘플 홀더 의 모서리에 있는 시야로 시작하여 마이크로 버블의 가장자리가 선명하게 표시되고 초점이 맞추어지도록 합니다(이상적인 카메라 보기를 위한 그림 3C 참조).
- 이전에 할로겐 빛에 연결된 광섬유의 끝을 스트로브 광에 부착하여 다른 쪽 끝이 여전히 수조에 연결되도록 합니다. 레코딩을 트리거합니다.
- 반복 단계 2.2.6.2 ~ 2.2.6.3 초음파 설정당 원하는 횟수(주파수 및 음향 압력), 마이크로버블을 함유한 세포 배양 카세트를 이전 위치에서 최소 2mm(초점 평면)로 이동하여 전작의 마이크로버블이 이전 실험에서 음들여지지 않도록 한다.
참고 : 여기서, 각 실험은 ~ 20 번 반복되었다. 전체 샘플 홀더가 소인되면 샘플 홀더를 비우고 후속 실험을 위한 신선한 샘플 솔루션으로 리필합니다.
- 상기 사내 서면 스크립트를 통해 임의파형 발생기에서 원하는 초음파 구동 주파수 및 음향 압력을 프로그래밍한다.
- 데이터 분석
- 연구 질문에 따라 데이터 분석을 수행하고 이미지를 처리한 후 에지 감지를 수행하는 프로그래밍 환경을 채택한다. 이미지 영역의 특성을 측정하는 함수를 사용하여 각 버블 주위의 강도 프로파일의 중심및 유도체를 찾아 거품의 윤곽을 감지합니다(따라서, 거품 반경 R). 단일 마이크로 버블에 대해 시간이 지남에 따라 반지름에서 관련 매개 변수를 추출합니다.
참고: 본 연구에서는 단일 마이크로버블의 레코딩을 비나화하고 필터링하기 위해 이미지 처리에 프로그래밍 환경을 사용했습니다. 사내 스크립트는 각 버블 주위의 강도 프로파일의 파생 을 찾는 데 사용되었습니다.
- 연구 질문에 따라 데이터 분석을 수행하고 이미지를 처리한 후 에지 감지를 수행하는 프로그래밍 환경을 채택한다. 이미지 영역의 특성을 측정하는 함수를 사용하여 각 버블 주위의 강도 프로파일의 중심및 유도체를 찾아 거품의 윤곽을 감지합니다(따라서, 거품 반경 R). 단일 마이크로 버블에 대해 시간이 지남에 따라 반지름에서 관련 매개 변수를 추출합니다.
- 광학 시스템의 조립
- 형광 현미경 검사법
- 광학 시스템의 조립
- 2.2항에 기재된 밝은 필드 현미경 검사법에 사용되는 동일한 베이스로 형광 현미경 검사법(도 4A)에 대한 설정을 구축합니다.
참고: 섹션 2.3에 설명된 설정은 섹션 2.2에서 밝은 필드 현미경 검사법을 위해 설명된 것과 결합될 수 있습니다. 형광 현미경 검사법과 밝은 필드 현미경 검사를 모두 결합하면 나노 입자 방출을 이미징하는 동안 마이크로 버블 가스 코어의 시각화를 가능하게합니다. - 고속 카메라를 초당 500,000프레임(400 x 250픽셀)에서 128프레임(256μs)으로 기록하도록 설정합니다.
참고: 광 강도가 형광이 제한되어 있고 입자 전달이 발생하는 시간대가 버블 역학보다 길기 때문에 이미징 시간은 밝은 필드 실험에서보다 길다. - 충분한 빛을 공급할 수 있을 만큼 높은 전력을 가진 레이저를 선택하고 적절한 흥분 파장을 가지고 있으며, 시료 표백을 피하기 위해 아쿠스토 광학 변조기와 결합되었는지 확인합니다.
참고: 이 연구에서는 532nm의 흥분 파장을 가진 5W 연속 파레이저를 사용하여 나노 입자의 형광을 자극하는 데 사용되었습니다. - 형광 방출이 카메라에 닿을 수 있도록 하면서 레이저와 현미경 목표 사이에 빔 스플리터, 이색 거울 및 노치 필터를 배치하여 샘플쪽으로 흥분 광을 지시합니다.
- 2.2항에 기재된 밝은 필드 현미경 검사법에 사용되는 동일한 베이스로 형광 현미경 검사법(도 4A)에 대한 설정을 구축합니다.
- 음향 시스템의 조립
- 마이크로 버블을 인음화하려면 섹션 2.2.2와 동일한 음향 설정을 사용합니다. 이러한 특정 실험에서 트랜스듀서를 2.25MHz의 중심 주파수, 1.88MHz의 초점 거리 및 1"의 요소 직경으로 집중 된 몰입 변환기로 변경합니다. 광학 축과 관련하여 35°의 각도로 배치하여 샘플 홀더 멤브레인의 반사를 최소화하고 서 있는 파 형성을 줄입니다.
- 광학 및 음향 시스템의 정렬
- 섹션 2.2.4에 설명된 반복 단계입니다.
- 샘플 준비
- 섹션 2.2.5에 설명된 바와 같이 샘플 솔루션을 준비합니다.
- 이미징 프로토콜
- 앞서 언급한 사내 서면 스크립트를 통해 임의파형 발생기에서 원하는 초음파 구동 주파수 및 음향 압력 진폭을 설정합니다.
참고 : 여기에서 음향 압력 파는 10 사이클 가우시안 테이퍼 펄스와 함께 140 사이클의 단일 초음파 버스트로 프로그래밍되었습니다. 더 긴 펄스 기간은 일반적으로 거품 역학을 공부하는 데 필요한 것과 비교하여 바이오 효과를 유도하는 데 필요합니다. 이러한 실험에 사용된 초음파 주파수는 1MHz, 2MHz 또는 3MHz였으며, 81kPa에서 1200kPa에 이르는 음향 압력 진폭이 있었다. - 펄스/지연 발생기에서, 기록 하는 동안 마이크로 버블에서 나노 입자의 형광 흥분에 대 한 레이저에 대 한 트리거 지연을 설정 합니다.
참고: 이러한 특정 실험의 경우 트리거 지연은 총 150μs의 총 지속 시간 동안 20 μs와 170 μs 사이였습니다. 타이밍 다이어그램은 그림 4B에 표시됩니다. - XYZ-stage를 사용하여 샘플 용액을 포함하는 샘플 홀더를 이동하여 현미경의 초점에서 단일 마이크로 버블을 찾습니다. 샘플 홀더의 모서리의 시야로 시작합니다. 마이크로 버블의 인터페이스가 선명하고 초점을 맞추고 있는 이상적인 카메라 뷰는 그림 4C 를 참조하십시오. 레코딩을 트리거합니다.
- 반복 단계 2.3.5.3 초음파 설정당 원하는 횟수(주파수 및 음향 압력), 마이크로버블을 함유한 세포 배양 카세트를 이전 위치에서 최소 2mm(광학 평면)로 이동하여 전작의 마이크로버블이 이전 실험에서 초음파 처리되지 않도록 한다.
참고: 이 연구에서는 각 실험이 ~10-20x로 반복되었습니다. 전체 샘플 홀더가 소인되면 샘플 홀더를 비우고 후속 실험을 위한 신선한 샘플 솔루션으로 리필합니다. 실험 사이에 샘플 홀더를 이동하는 거리는 음향 빔 크기에 따라 달라집니다.
- 앞서 언급한 사내 서면 스크립트를 통해 임의파형 발생기에서 원하는 초음파 구동 주파수 및 음향 압력 진폭을 설정합니다.
- 데이터 분석
- 연구 질문에 따라 형광 현미경 검사기록을 분석한다. 모든 마이크로 버블에 대해 형광 현미경 실험에서 나노 입자의 전달이 발생했는지 여부를 시각적으로 결정합니다. 가스 코어에서 가스 코어에서 나노입자의 분리 및 증착이 샘플 홀더 멤브레인에 관찰되면 단일 마이크로버블에 대해 관찰되고, 프로그래밍 환경에서 그 전달이 발생하였다.
- 광학 시스템의 조립
3. 인트라바이탈 현미경 검사법
- 등쪽 피부 접이식 창 챔버 수술 (이전에 설명26,47,50)
- 창 챔버를 배치하기 전에 일주일 동안 동물을 적응. 암컷과 수컷 마우스가 모두 사용될 수 있고 나이는 중요하지 않지만, 마우스의 무게가 적어도 22-24g이되도록 피부가 충분히 유연하도록 하십시오.
- 수술 중 및 수술 후 진통제 치료로 전신 마취하에 수술을 수행하십시오. 펜타닐(0.05 mg/kg)/메데토미딘(0.5 mg/kg)/미다졸람(5 mg/kg)/물(2:1:2:5)의 피하 주사로 동물을 10g 무게당 0.1mL의 용량으로 마취한다. 가열 패드 또는 가열 램프를 사용하여 동물의 체온을 유지합니다.
- 피부가 창 챔버의 두 대칭 폴리옥시 메틸렌 프레임 사이에 끼워지 않도록 동물의 뒷면에 있는 피부의 이중 층을 부드럽게 당깁니다. 이중 피부 층을 통해 확장 두 나사를 배치하고 챔버의 상단 가장자리를 따라 봉합하여 챔버를 고정합니다.
- 피부 주름의 한쪽에 챔버의 원형 프레임 내에서 피부를 제거합니다. 피부가 제거되는 프레임 내에 직경 11.8mm의 커버 글래스를 배치하여 조직을 통해 창을 형성합니다.
- atipemazole의 피하 주사를 사용 (2.5 mg/kg), 플루마제닐 (0.5 mg/kg), 물 (1:1:8) 복용량에 0.1 mL 당 10 g 해독제로 해독제로 마취를 종료. 동물을 밤새 가열된 복구 랙에 놓습니다. 수술 부위의 감염을 방지하기 위해 enrofloxacin의 25 mg / mL로 동물을위한 물을 보충하십시오.
- 종양 모델 생성
- 암세포를 37°C에서 유지하였으며 적절한 배양 배지에서 5% CO2 대기를 10% 태아소 혈청과 100개의 U/mL 페니실린 및 100 mg/mL 연쇄절제술로 보충하였다.
참고: 인간 골육종(OHS) 세포주가 이 프로토콜에 사용되었지만 다른 세포주도 사용할 수 있습니다. - 3.1.5단계 다음 날, 이소플루란(인덕션 중 5%, 유지 보수 중 1~2%)으로 동물을 몇 분간 마취합니다. 커버 글래스를 제거하고, 세포 배양 배지의 30 μL에 5 × 106 암세포를 적용하고, 커버 글래스를 교체한다.
- 종양이 이미징 전에 2 주 동안 자라도록 허용하고이 기간 동안 동물의 체중과 건강 상태를 일주일에 적어도 3 번 모니터링하십시오.
- 암세포를 37°C에서 유지하였으며 적절한 배양 배지에서 5% CO2 대기를 10% 태아소 혈청과 100개의 U/mL 페니실린 및 100 mg/mL 연쇄절제술로 보충하였다.
- 광학 시스템의 조립
- 위험에 연구 질문에 따라 적절한 현미경 및 객관적으로 초음파 처리 (전작26에 설명된 대로)동안 중요한 화상 진찰을 수행하십시오. 실험 설정의 회로도 표현은 그림 5A 를 참조하십시오.
참고: 이 특정 실험의 경우 20배 물 침지 목표(NA 1.0 및 작동 거리 2mm)와 펄스 레이저를 장착한 다광현미경이 사용되었습니다. 이미지는 400 x 400 μm2의 시야가 있는 초당 31프레임(512 x 512픽셀)의 공진 스캐닝 모드에서 획득되었습니다. 흥분 파장 790 nm이었다. 두 갈륨 arsenide 인스피더 검출기 앞에 있는 필터는 형광검출을 위한 긴 패스 590 nm 및 밴드 패스 525/50 nm이었습니다.
- 위험에 연구 질문에 따라 적절한 현미경 및 객관적으로 초음파 처리 (전작26에 설명된 대로)동안 중요한 화상 진찰을 수행하십시오. 실험 설정의 회로도 표현은 그림 5A 를 참조하십시오.
- 음향 시스템의 조립
- 광학 축에 대하여 목표 아래에 위치한 도파관(사용자 정의 제작)에 적합한 초음파 트랜스듀서를 장착하여 등쪽 스킨폴드 윈도우 챔버의 커버 글래스의 반사를 최소화하고 서 있는 파형성을 줄입니다. 파도관을 증류물과 탈가스로 채웁니다. 파파가이드 위에 초음파 커플링 젤을 발라주세요.
- 광학 및 음향 시스템의 정렬
- 광학 축을 초음파의 초점과 정렬합니다. 목표의 초점에 광섬유 하이드로폰을 배치합니다. 이어서, 증폭기와 임의파형 발생기를 켜서 100Hz의 펄스 반복 주파수로 짧은 버스트(5-10 사이클)로 트랜스듀서를 자극하고, 초음파 트랜스듀서를 오실로스코프상에 하이드로폰 신호로 검출되는 위치로 이동한다.
참고: 정렬 후 트랜스듀서의 위치를 변경하지 마십시오.
- 광학 축을 초음파의 초점과 정렬합니다. 목표의 초점에 광섬유 하이드로폰을 배치합니다. 이어서, 증폭기와 임의파형 발생기를 켜서 100Hz의 펄스 반복 주파수로 짧은 버스트(5-10 사이클)로 트랜스듀서를 자극하고, 초음파 트랜스듀서를 오실로스코프상에 하이드로폰 신호로 검출되는 위치로 이동한다.
- 이미징 프로토콜
- 도파관과 목표 사이에 XY 포지셔닝 단계에 연결된 가열된 동물 홀더(사용자 지정 설계)를 배치하고 더 많은 커플링 젤을 추가합니다. 동물을 마취하고 꼬리 정맥 카테터를 놓습니다. 가열 된 홀더에 마우스를 놓고 홀더에 창 챔버를 고정합니다. 창 챔버의 덮개 슬립 위에 물방울을 추가하고 종양 조직을 이미지하기 위해 목표를 제자리에 이동합니다.
-
도 5B 는 이벤트 순서를 묘사하는 실험의 타이밍 다이어그램을 보여 주어 있다. 형광 라벨2 MDa dextran 정맥 내(30 μL, 식염수로 희석된 4 mg/mL)을 주입하여 혈관을 시각화하고 XY-번역 단계를 사용하여 마우스를 이동하여 적합한 혈관을 가진 위치를 찾습니다. 초음파 치료 전에 기준선 이미지를 기록합니다. 이미지화될 현미경 및 염료의 연구 질문 및 세부 사항에 따라 프레임 속도, 시야 및 기록 기간을 조정합니다.
참고: 이러한 실험에서 초당 31프레임은 400 x 400 μm2의 시야로 기록되었고, 이미징은 5분 동안 지속적으로 수행되었다. - 임의파형 발생기에서 원하는 초음파 구동 주파수, 펄스 길이 및 음향 압력 진폭을 설정합니다.
참고: 이러한 실험의 경우 1MHz의 주파수는 펄스 길이 10ms와 0.2 MPa와 0.8 MPa 사이의 피크 음압 진폭으로 사용되었습니다. 0.5Hz 또는 0.1Hz의 펄스 반복 주파수를 사용하여 새로운 마이크로버블이 초음파 펄스 사이의 처리 영역으로 재퍼퓨즈할 수 있도록 하였다. - 50 μL 마이크로 버블 (2 × 108 ~ 5 × 108 마이크로 버블 / mL)을 정맥으로 주입하고, 이미징 하는 동안 초음파를 적용, 에 설명 된 대로 26.
- 데이터 분석
- 연구 질문에 따라 26에 설명된 바와 같이(오픈 소스) 이미지 처리 소프트웨어 및 프로그래밍 환경과 이미지를 분석하여 혈관 파라미터(직경, 분기, 유량 속도 및 방향), 혈관 내 나노 입자 축적, 세포 및 나노 입자의 사치및 침투 깊이를 종양 조직으로 분석한다.
결과
프로토콜에 설명된 바와 같이 생성된 마이크로버블은 다양한 현미경 법및 다양한 시저에서 분석되었다.
공초점 현미경검사(도 6A)에서 나노입자의 형광은 쉘이 균일하지 않은 입자 분포를 가지고 있음을 나타낸다. 다른 현미경 검사법은 거품 특성화에 사용될 수 있다. 예를 들어, 도 6B 는 이전 작업34에서 제시된 바와 같이 스캐닝 전자 현미경을 사용하여 마이크로버블의 전체 구조를 나타낸다.
방사형 역학 및 현상학적 버블 거동은 마이크로버블이 초당 1,000만 프레임으로 이미지화된 생체 외 에서 밝은 필드 현미경검사 방법을 사용하여 연구될 수 있다. 단일 마이크로 버블의 반경은 사내에서 작성된 스크립트를 사용하여 시간이 지남에 따라 추출되었습니다. 이러한 방사형 반응의 예는 도 7에 도시된다.
섹션 2.3.6에 설명된 바와 같이 전형적인 성공적인 나노입자 전달의 이미지 시퀀스가 도 8A에 도시된다. 마이크로 버블 쉘에 내장된 나노 입자는 레이저 빛이 거품에 도달하면 형광으로 인해 점등되는 것을 볼 수 있다. 초음파 소네이션에 의해 구동, 형광 나노 입자는 마이크로 버블의 가스 코어에서 분리하고 샘플 홀더의 막에 증착된다. 마지막으로 레이저가 꺼지고 형광 나노 입자가 더 이상 흥분되지 않습니다. 마이크로버블의 형광 표지 페이로드의 실패한 전달은 전형적으로 초음파 노출 중에 그대로 유지되는 마이크로버블의 껍질에 형광 나노입자가 점등되는 도 8B에 표시된 이미지 서열처럼 보입니다.
초음파 중 실시간 인트라비티 다광원 현미경 검사는 혈액내 나노입자 거동에 대한 초음파 및 마이크로버블의 효과, 종양 혈관의 투과성 향상, 나노입자 전달 개선 등을 조사하는 데 사용되었다. 음향 압력, 주파수 및 펄스 길이의 함수로서 세포외 매트릭스내침투의 정도 및 운동도 특징이 될 수 있다. 초음파 치료의 효과는 혈관의 크기 및 형태와 거품의 결과로 감금에 따라 다를 수 있습니다. 초음파 치료가 혈류및 방향에 미치는 영향을 결정할 수 있습니다. 시간이 지남에 따라 나노 입자의 사치를 보여주는 예실험은 0.826의 기계지수(MI)에서 도 9에 도시된다. 중요한 다광자 현미경 검사의 결과는 초음파 노출 시 나노 입자의 공간 및 측두엽 을 해명하며, 이는 나노 입자의 초음파 매개 전달의 메커니즘을 완전히 이해하고 이러한 기술을 최적화하는 데 매우 유용합니다26.
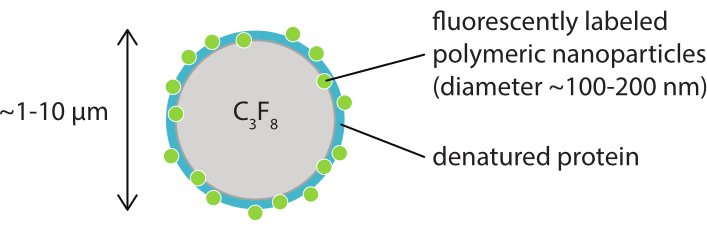
그림 1: 변성 카제인에 형광 표지 폴리머 나노 입자의 껍질이있는 마이크로 버블의 회로도 표현. 마이크로 버블은 일반적으로 직경 이 1 μm에서 10 μm 사이입니다. 나노 입자는 주로 100 nm와 200 nm38 사이의 직경을 갖는다. 약어: C3F8 = 퍼플루오로프로판 가스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
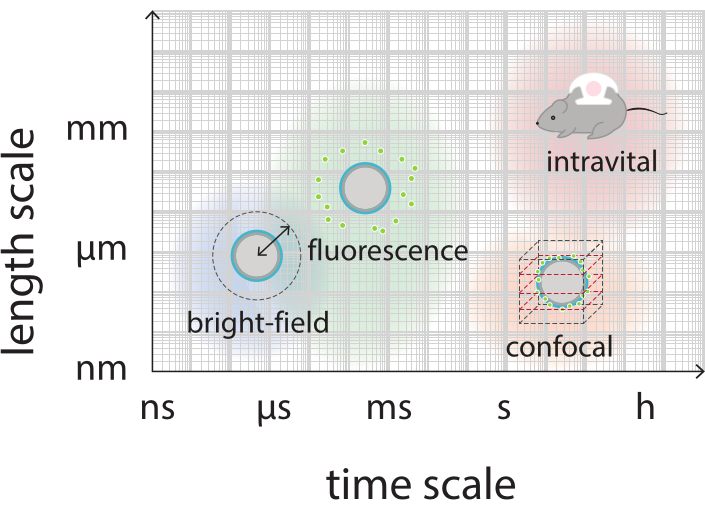
그림 2: 밝은 필드, 형광, 공초점 및 내 중요한 현미경 검사법에 대한 관련 시간 및 길이 저울을 보여주는 회로도 개요.
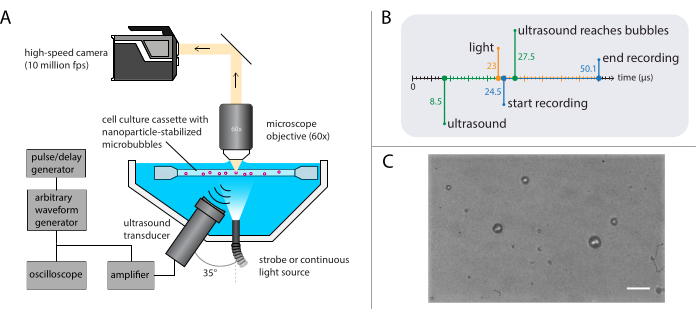
그림 3: 밝은 필드 현미경 실험의 회로도 표현. (A) 실험 설정, (B) 타이밍 다이어그램, (C) 전형적인 기록된 프레임. (C) = 10 μm의 배율 막대. 약어: 초당 fps = 프레임. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
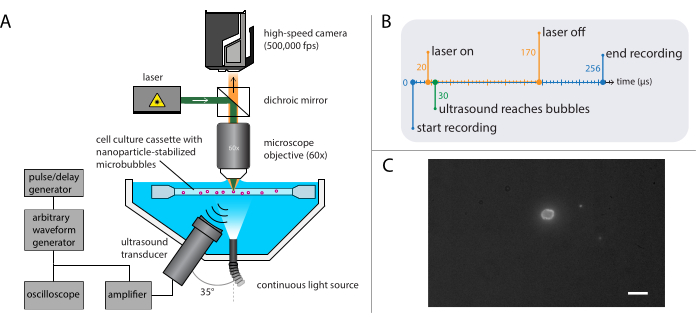
그림 4: 형광 현미경 실험의 회로도 표현. (A) 실험 설정, (B) 타이밍 다이어그램 및 (C) 전형적인 기록된 프레임. (C) = 10 μm의 배율 막대. 약어: 초당 fps = 프레임. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
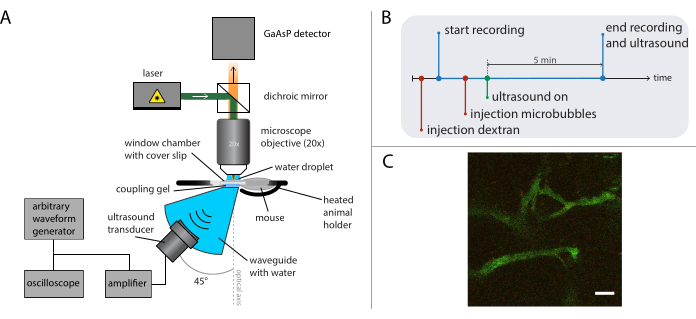
그림 5: 중요 내 현미경 실험의 회로도 표현. (A) 실험 설정, (B) 타이밍 다이어그램, 그리고 (C) 전형적인 기록된 프레임. (C) = 50 μm의 배율 막대. 녹색은 나노 입자에 dextran-FITC 및 빨간색에 해당합니다. 약어: GaAsP = 갈륨 아르세니드 포스피더. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
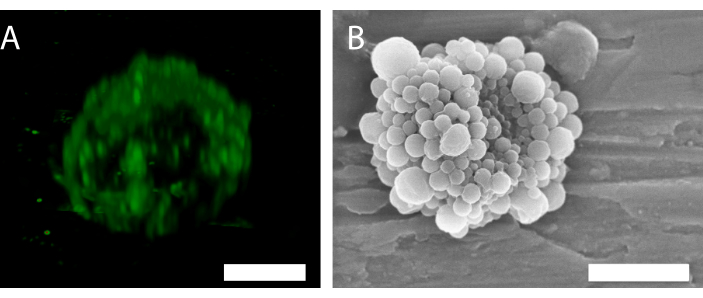
도 6: 단일 나노입자 및 단백질 안정화 마이크로버블의 3D 구조. (A) 공초점 현미경을 사용하여 나노입자를 나타내고, (B) 주사 전자 현미경을 이용하여 3D 구조를 보여준다. (B)는 34로부터의 허가하에 복제되었습니다. (A) = 5 μm의 배율 막대; (B) = 2 μm의 축척 막대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
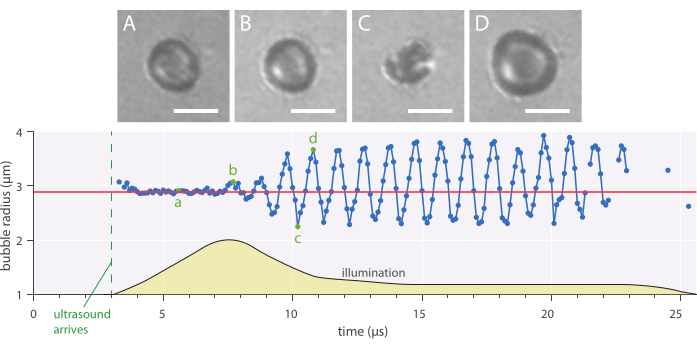
도 7: 1MHz의 초음파 주파수에서 인진화된 2.89 μm 반경 나노입자 및 단백질 안정화 마이크로버블의 전형적인 구형 진동및 142kPa의 음향 압력 진폭(A-D) 이미지의 고속 기록 및 시간 곡선(아래쪽)에 따른 해당 버블 반경(아래). 배율 막대 = 5 μm, 빨간색 선은 초기 반지름을 나타냅니다. 조명 프로파일(임의 단위)은 노란색으로 표시됩니다. 배율은 120배입니다.
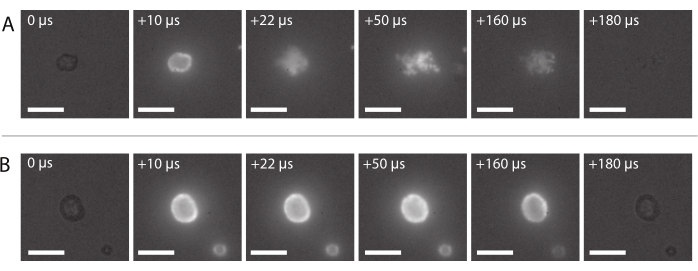
도 8: 고속 형광 현미경검사법에서 의 이미지 서열. (A) 나노입자 및 단백질 안정화 마이크로버블의 형광 표지 나노입자의 성공적인 전달은 2MHz의 초음파 주파수에서 발화되고 600 kPa의 음향 압력 진폭. (B) 2MHz의 초음파 주파수와 210 kPa의 음향 압력 진폭에서 인음이 있는 나노 입자 및 단백질 안정화 마이크로 버블의 형광 표지 나노 입자의 전달에 실패하였다. 스케일 바 = 10 μm. 배율은 120배입니다 .
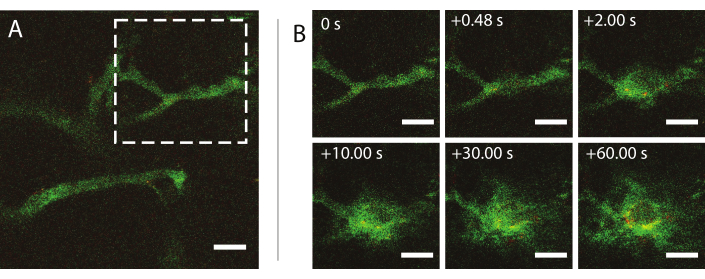
도 9: 1MHz의 초음파 주파수에서 나노입자 및 단백질 안정화 마이크로버블을 흡입한 후 의활력 현미경 검사법과 혈관 내 800kPa의 음향 압력 진폭, (B) (B) (A) dextran(greenparticle)의 엑스트라에 대한 엑스트라를 나타내는 백색 대시 사각형으로 표시된 영역의 이미지 서열.. 스케일 바 = 50 μm. 배율은 20배입니다.
토론
상이한 광학 현미경법은 마이크로버블 표면으로부터 주변 배지로 나노입자를 전달하는 다양한 단계에 대한 정보를 얻기 위해 결합되었다. 기포 진동의 이미징은 기포 껍질에서 나노 입자의 방출, 사치화 및 생체 내 종양의 세포외 매트릭스를 통한 침투의 이미징뿐만 아니라 수행되었다. 시험관 내 이미징은 생체 내 설정에서 더 복잡한에 비해 많은 초음파 매개 변수의 검사를 가능하게합니다. 이미징 양식의이 범위를 결합의 장점은 다른 시간대에 얻을 수있는 보완 정보입니다 - 성공적인 전달을 위해 마이크로 버블을 특성화하고 최적화하고 치료 효능을 얻기 위해 중요한 기능. 이 접근법은 형광으로 표지된 나노입자 및 약물을 가진 구조를 포함하여 모든 마이크로버블에 대한 전달 메커니즘을 이해하는 데 유용합니다.
단일 마이크로 버블을 연구하는 데 사용되는 현미경 검사법에서 가장 중요한 단계는 다음과 같습니다. 형광 현미경 검사법의 경우 나노 입자는 입자 방출의 시각화를 가능하게하기 위해 형광 으로 표시되어야합니다. 또한, 시료 용액은 공초점, 밝은 분야 및 형광 현미경 법에서 분석을 위해 단일 마이크로 버블을 분리할 만큼 충분히 희석되어야 합니다. 또한, 초음파 운전 주파수와 음향 압력을 선택하여 거품을 가장 효율적으로 자극하는 것이 중요합니다. 연구 질문이 나노 입자 탑재하중의 전달에 관한 경우 적절한 초음파 매개 변수는 조사의 일부가되어야합니다. 공명 옆에, 이 거품은 또한 나노 입자 방출을 위한 그들의 임계값 에서 또는 그 이상으로, 일반적으로 상대적으로 높은 음향 압력 진폭에서 (MI > 0.3)51에서 구동되어야 합니다. 밝은 필드 현미경 이미징의 경우 모션 블러를 최소화하고 별칭을 피하기에 충분한 프레임 레이트가 있는 고속 카메라를 선택하는 것이 중요합니다.
밝은 필드 현미경 검사는 주로 사용 가능한 광원의 이미징 프레임 속도와 강도에 의해 제한됩니다, 높은 프레임 레이트 거품 역학에 대한 보다 상세한 시간 해결 통찰력을 줄 것이다, 그러나 짧은 노출 시간으로 인해 더 강렬한 조명이 필요합니다. 입자 방출을 보다 자세하게 연구하기 위해 형광 이미징의 프레임레이트는 원칙적으로 레이저 광의 강도를 증가시킴으로써 증가할 수 있습니다. 그러나 형광 라벨이 부착된 마이크로버블에 의한 고강도 레이저 광의 흡수는 높은 양자 수율 염료로도 열을 생성합니다. 이 열은 위험에 실험을 방해 할 수 있으며, 극단적 인 경우, 사진 열 캐비테이션을 유도52. 따라서 실제로 는 적용된 레이저 연도에 제한이 있습니다. 그러나, 강렬한 레이저 조명은 또한 리포솜53에서 입자 방출을 유도하기 위하여 의도적으로 사용될 수 있다53. 온도는 버블 타입54에 따라 기포 역학 및 초음파 반응에 영향을 미칩니다. 따라서 시험관 내 및 인트라베이티 방법을 객관적으로 비교해야 하는 경우 프로토콜에서 논의된 체외 방법을 37°C에서 수행해야 한다. 현재 논문에서 논의된 시험관 내 방법의 또 다른 제한은 마이크로 버블이 샘플 홀더 멤브레인 아래에 떠 있기 때문에 거품이 자유 필드 환경에 있지 않다는 것입니다. 더욱이, 단일 마이크로버블을 이미징할 때 선택 편향이 있다. 그러나 단일 버블에 대한 반복적인 실험을 수행하면 혼동하는 계수-크기 분포의 크기 및 제거의 효과를 조사할 수 있습니다. 기포의 함수로서 거품 반응이 이해될 수 있는 반면 농도가 너무 높지 않아 기포-버블 상호 작용을 방지할 수 있으며 임의의 거품 집단의 반응을 계산할 수 있다. 마지막으로, 밝은 필드와 형광 현미경 검사법은 모두 2차원 (2D) 이미지로 응축된 마이크로 버블에 대한 통찰력을 제공합니다. 연구 질문이 2D 이미징 이상을 필요로 하는 경우, 프로토콜에 설명된 설정을 멀티플레인 이미징55에 대한 사이드뷰 설정과 결합하여 거품의 3D 동작을 해결할 수 있다.
마이크로 버블을 연구하는 다른 방법은 음향 특성56입니다. 그러나 단일 마이크로버블의 에코를 측정하려면 초음파 빔56 내에서 단일 마이크로버블을 찾아 격리해야 하며, 이는 일반적으로 좁은 튜브 또는 광학 또는 음향 핀셋57,58의 사용에 의해 다루어지는 과제를 제기한다. 음향적으로 거품의 크기를 지정하기 위해, 마이크로 버블은 공진 빈도보다 훨씬 높은 주파수에서 기하학적 산란 정권에서 소음될 수 있으며, 이는 체피 마이크로버블 진동을 유도하지 않는다59. "음향 카메라"의 사용은 초음파에 반응하여 단일 마이크로 버블의 방사형 역학을 이미지화하는 방법이며, 여기서 고주파 초음파 프로브는 저주파 구동 wave60에 버블의 방사형 반응을 결정하는 데 사용된다. 이 방법의 단점은 마이크로 버블 반경의 상대적 변화를 결정하는 데만 사용될 수 있다는 것입니다. 따라서 광학 이미징61,62를 통해 절대 버블 반경(예: 절대 버블 반경)을 결정하기 위한 또 다른 방법이 필요하다. 마이크로버블이 공진 빈도보다 높은 주파수에서 초음파에 노출되는 방법의 단점은 이러한 높은 주파수에서 침투 깊이가 감소하여 생체 내 적용에 대한 유용성을 제한한다는 것이다. 현미경 검사법의 그밖 양식은 또한 전자 현미경 검사법, 원자력 현미경 검사법 및 전송 전자 현미경63와 같은 마이크로 버블을 연구하기 위하여 이용될 수 있습니다. 그러나 이러한 대체 현미경 기술의 달성 가능한 주걱-측두형 해상도는 일반적으로 더 제한적이며, 이러한 기술은 화상 진찰이 오프 라인 분석에 의해 초음파 노출 전후에 수행되고 전형적으로 낮은 처리량을 제시하는 단점이 있다63. 또 다른 대안은 단일 마이크로 버블의 방사형 역학을 실시간으로 연구하는 데 사용할 수 있지만 음향 산란 방법에 비해 낮은 신호 대 잡음 비율을 가지는 광 산란 방법을 사용하는 것입니다64.
초음파 노출 중 실시간 내 비생체 현미경 검사는 초음파 노출 시 혈관, 미세 거품, 나노 입자 또는 기타 분자 (예 : 이 경우 dextran)에 대한 새로운 통찰력을 습득하는 강력한 방법입니다. 실시간 인트라비티 현미경 검사를 수행할 때 일반적인 제한은 조직의 작은 영역만 이미지화되고, 조직의 침투 깊이가 제한적이라는 것입니다. 이미지 된 용기가 시야 내에서 거의 또는 나노 입자를 포함하는 경우 나노 입자 거동 및 사치에 대한 정보가 거의 또는 전혀 없습니다. 또한 시야가 제한되어 있기 때문에 빛과 초음파 경로 간의 적절한 정렬이 중요합니다. 초음파 압력이 거품 파괴를 유도할 만큼 충분히 높으면, 신선한 거품이 초음파 펄스 사이의 시야로 재퍼퓨즈할 수 있는 펄스 반복 주파수를 선택하는 것도 중요합니다. 더욱이, 초음파가 창챔버내의 커버글래스로부터 반사되기 때문에, 트랜스듀서를 비스듬히 배치하는 것은 보정된 압력필드를 왜곡하는 서파도의 형성을 방지하는 것으로 반사를 줄이는 것이 중요하다. 또 다른 실질적인 문제는 현미경 설정의 목표 위 또는 아래에 초음파 트랜스듀서와 파도관을 장착할 충분한 공간이 필요하다는 것입니다. 등쪽 창 챔버내의 종양은 수축 챔버 및 커버 슬립으로 인해 제한된 두께를 가질 것이다; 그러나 필요한 경우 다른 모델을 사용할 수 있습니다. 예는 피부 접이식 종양, 예를 들어, 유방 지방 패드65 또는 다양한 기관에서 종양의 복부 내 생명 화상 진찰에 66. 이러한 종양은 적절한 미세 환경에서 정형소적으로 재배될 수 있으며, 따라서 보다 임상적으로 관련된 사례를 제시한다.
이 작품에 설명된 방법은 거품과 초음파를 사용하여 약물 전달 응용 프로그램의 기초를 연구하기 위해 형광 라벨마이크로 버블의 잠재력을 계몽합니다. 현미경 방법의 이 조합은 초음파 음광 및 관련 음향 매개 변수 공간에 대한 마이크로 버블 반응에 대한 귀중한 통찰력을 제공하고 관련 범위의 시간과 길이 스케일에 대한 마이크로 버블 및 페이로드 동작에 대한 명확한 전망을 제공합니다.
공개
저자는 이해 상충이 없다고 선언합니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
참고문헌
- Szabo, T. L. Diagnostic ultrasound imaging: inside out. , Academic Press. (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197(2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). Quaia, E. , Springer. Berlin, Heidelberg. 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8(2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076(2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102(2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103(2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, Ý, et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250(2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876(2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , Cambridge University Press. Cambridge; New York. (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115(2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103(2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911(2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501(2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유