Method Article
שיטות מיקרוסקופיה מרובות זמן לאפיון של Microbubbles פלואורסצנטרית שכותרתו לשחרור תרופות מופעלות אולטרסאונד
In This Article
Summary
הפרוטוקולים המוצגים יכולים לשמש כדי לאפיין את התגובה של microbubbles תווית פלואורסצנטית המיועדים ליישומי משלוח תרופות המופעלות על ידי אולטרסאונד, כולל מנגנוני ההפעלה שלהם, כמו גם bioeffects שלהם. נייר זה מכסה מגוון של טכניקות מיקרוסקופיה במבחנה ו - in vivo המבוצעות כדי ללכוד את האורך ואת לוחות הזמנים הרלוונטיים.
Abstract
סוכני ניגוד Microbubble להחזיק הבטחה גדולה עבור יישומי משלוח סמים עם אולטרסאונד. אנקפסולציה תרופות חלקיקים מפחית רעילות מערכתית ומגדיל את זמן זרימת הדם של התרופות. בגישה חדשנית לאספקת תרופות בסיוע microbubble, חלקיקים משולבים או על קליפות microbubble, המאפשר שחרור מקומי מופעל של מטען ננו-חלקיקים עם אולטרסאונד. הבנה מעמיקה של מנגנוני השחרור בתוך מרחב פרמטר אולטרסאונד עצום חיונית לשחרור יעיל ומבוקר. קבוצה זו של פרוטוקולים שהוצגו חלה על מיקרו-שטויות עם קליפה המכילה תווית פלואורסצנטית. כאן, ההתמקדות היא microbubbles טעון פולי (2-אתיל-בוטיל ציאנואקרילט) חלקיקים פולימריים, מסומם עם צבע אדום הנילוס שונה. החלקיקים קבועים בתוך קליפת קזאין דנטורית. המיקרו-יבלים מיוצרים על ידי ערבוב נמרץ, ויוצרים פיזור של גז פרפלואורופרופן בשלב הנוזלי המכיל קזאין וננו-חלקיקים, ולאחר מכן קליפת המיקרו-יבלים מורכבת מעצמה. מגוון טכניקות מיקרוסקופיה נדרשות כדי לאפיין את המיקרו-חלוקים המיוצבים בננו-חלקיקים בכל צירי הזמן הרלוונטיים של תהליך שחרור הננו-חלקיקים. פלואורסצנטיות של הננו-חלקיקים מאפשרת הדמיה קונפוקלית של מיקרו-יבלים בודדים, וחושף את התפלגות החלקיקים בתוך הקליפה. הפריה אולטרה-גבוהה הדמיה באמצעות מיקרוסקופיה שדה בהיר ב 10 מיליון פריימים לשנייה מספק תובנה על דינמיקת הבועה בתגובה אינסונציה אולטרסאונד. לבסוף, שחרור ננו-חלקיקים מקליפת הבועה מוצג בצורה הטובה ביותר באמצעות מיקרוסקופיה פלואורסצנטית, המבוצעת ב-500,000 פריימים לשנייה. כדי לאפיין את אספקת התרופה ב vivo, שחרור מופעל של חלקיקים בתוך vasculature ואת ההגזמה שלהם מעבר לשכבת אנדותל נחקר באמצעות מיקרוסקופיה תוך וינטלית בגידולים מושתל בתאי חלון עור אחורי, על פני ציר זמן של מספר דקות. השילוב של טכניקות אפיון משלימות אלה מספק תובנה ייחודית על התנהגותם של מיקרו-נבלים ושחרור המטען שלהם במגוון סולמות זמן ואורך, הן במבחנה והן ב- in vivo.
Introduction
אולטראסאונד היא טכניקת ההדמיה הרפואית הנפוצה ביותר. הוא אינו פולשני, מהיר, בטוח, חסכוני ונייד1,2,3. עם זאת, דם הוא פיזור אולטרסאונד עני, ואת הניגוד של בריכת הדם ניתן לשפר על ידי זריקה תוך ורידי של סוכני ניגוד אולטרסאונד3. ניגודיות משופרת זו של בריכת הדם מאפשרת כימות של זלוף איברים למטרות אבחון, למשל, בגילוי מחלת עורקים כלילית4 ומחלת כבד גרורתית5. ואכן, vasculature הגידול הוכח להיות גורם פרוגנוסטי חשוב6. מאמץ מחקרי גדול מכוון כעת להדמיה מולקולרית ממוקדת בסיוע מיקרו-יבלות ולתפירת חומרי ניגודיות לשימוש טיפולי.
סוכני ניגודיות אולטרסאונד זמין מסחרית בדרך כלל מורכבים השעיה של microbubbles מצופה7,8 עם קטרים הנעים בין 1 מיקרומטר ל 10 μm9. מאז microbubbles סוכן ניגוד אולטרסאונד הם מעט קטנים יותר מאשר תאי דם אדומים7, microbubbles יכול להגיע בבטחה אפילו נימים הקטנים ביותר מבלי ליצור חסימה3. Microbubbles יש מקדם אולטרסאונד מוגבר באופן דרמטי לעומת tissue10, בשל ליבת הגז הדחוס שלהם11. יתר על כן, הד microbubble הוא מאוד לא ליניארי, כלומר, הספקטרום שלה מכיל הרמוניות ותת-הרמוניה של תדר הנהיגה. בנוסף, כוח ההד תלוי מאוד בתגובת ההד של הבועה12. בעוד הרקמה מתפזרת רק באופן ליניארי, מספר קטן של microbubbles מספיק כדי להשיג רגישות גבוהה לזיהוי הדמיה הרמונית13,14. דור ניגודיות לא ליניארי זה יכול אפילו להיות חזק מספיק כדי לעקוב אחר בועות בודדות בגוף15.
הקליפה של סוכן ניגוד אולטרסאונד מייצבת את הבועות נגד פירוק והתמזגות, ובכך מגדילה את זמן זרימת הדם שלהם במאגר הדם16. הקליפה יכולה להיות מורכבת שומנים, פולימרים או חלבונים דנטוריים3,8. זה מקטין את המתח הבין-דתי, ובכך מגביל את ההשפעה של פירוק מונחה לחץ לפלס17 ויוצר מחסום התנגדותי נגד דיפוזיה של גז18. כדי להגביר עוד יותר את היציבות, microbubbles ניגודיות מלאים בדרך כלל בגז במשקל מולקולרי גבוה עם מסיסות נמוכה בדם11. מעטפת microbubble משנה באופן דרמטי את התגובה של microbubbles אינסונציה אולטרסאונד11. בועות גז לא מצופה יש תדר תהודה אופייני כי הוא פרופורציונלי הפוך לגודל שלהם תוספת של ציפוי שומנים מגדיל את תדירות התהודה ביחס לזה של buble לא מצופה בשל נוקשות מהותית של הקליפה3. יתר על כן, הקליפה ממפזרים אנרגיה באמצעות צמיגות מפלגתית, המהווה את המקור הדומיננטי של שיכוך עבור בועות מצופות3. למעטפת המייצבת יש יתרון נוסף שניתן לתפקד, למשל, על ידי כריכת ליגנדים מכוונים לפני השטח של מיקרו-יבלים. פילוח זה מאפשר יישומים רבים עבור בועות אלה, ובמיוחד, הדמיה מולקולרית עם אולטרסאונד14,19.
סוכני ניגוד Microbubble להחזיק הבטחה גדולה עבור יישומי משלוח סמים עם אולטרסאונד. Microbubbles מתנדנד בכליאה של כלי דם יכול לגרום microstreaming, כמו גם נורמלי מקומי גיסת לחצים על הקיר נימי3. בלחצים אקוסטיים גבוהים, תנודות משרעת גדולות עלולות להוביל לקריסת microbubble בתהליך אלים המכונה cavitation אינרציאלי, אשר, בתורו, עלול להוביל לקרע או פולציה של כלי הדם20. תופעות אלימות אלה יכולות לגרום bioeffects כגון sonopermeation21, שיפור הפזרנות של תרופות טיפוליות לתוך interstitium על פני הקיר אנדותל, או באופן צנחני או טרנסקולרי. זה עשוי גם לשפר את החדירה של סוכנים טיפוליים באמצעות מטריצה חוץ תאית של גידולים עשירים סטרומה21,22 ו biofilms23,24, אם כי מנגנון זה עדיין מובן היטב26.
משלוח תרופות בתיווך אולטראסאונד הראה תוצאות מבטיחות הן באופן פרה-קליני27,28 והן בניסויים קליניים22. יתר על כן, כאשר נעשה שימוש עם אולטרסאונד בתדר נמוך יחסית (~ 1 MHz), microbubbles דווחו באופן מקומי חולף מחסום הדם - מוח חדירות, ובכך לאפשר תרופות להיכנס פרנשימה המוח, הן במחקרים פרה קליניים ומחקרים קליניים29,30,31,32,33,34.
ישנן בדרך כלל שתי גישות לאספקת תרופות בתיווך אולטרסאונד: החומר הטיפולי יכול להיות מנוהל במשותף עם הבועות, או שניתן לחבר אותו או לטעון אותו במעטפת הבועה28,35,36. הגישה השנייה הוכח להיות יעיל יותר במונחים של משלוח סמים37. Microbubbles יכול להיות טעון עם תרופות או חומר גנטי encapsulated חלקיקים (ליפוזומים או ננו פולימריים) מחובר למעטפת או משולב ישירות במעטפת microbubble35,36. מיקרו-חלוקים טעונים בננו-חלקיקים יכולים להיות מופעלים על ידי אולטרסאונד (ממוקד) כדי לשחרר באופן מקומי את מטען הננו-חלקיקים28,33,38,39,40. אם microbubble כזה נמצא במגע ישיר עם תא, הוכח במבחנה כי המטען יכול אפילו להיות מופקד על הממברנה הציטופלסמית התא בתהליך שנקרא sonoprinting34,35.
מרחב פרמטר אולטרסאונד עבור אינסונציה microbubble הוא נרחב, ואת התנאים הביולוגיים in vivo להוסיף מורכבות נוספת. לכן, השילוב של אולטרסאונד ממוקד ו microbubbles ננו-חלקיקים מהווה אתגר בתחום של טיפולי ממוקדים.
מטרת עבודה זו היא לספק פרוטוקולים שניתן להשתמש בהם כדי לדמיין, בפירוט, את התגובה של microbubbles כפונקציה של הפרמטרים אולטרסאונד וללמוד את המנגנונים המובילים קרע פגז ושחרור לאחר מכן של חומר פגז תווית פלואורסצנטית. קבוצה זו של פרוטוקולים חלה על מיקרו-שטויות עם פגזים המכילים צבע פלואורסצנטי. איור 1 מציג ייצוג סכמטי של המיקרו-חלוקים המיוצבים-חלקיקים והחלבון שפותחו ב-SINTEF (טרונדהיים, נורווגיה). בועות אלה מלאות בגז פרפלואורופרופן (C3F8) וננו-חלקיקים המייצבים את הקליפה מכילים NR668, שהיא נגזרת ליפופילית של צבע פלואורסצנטי אדום הנילוס38,43. הננו-חלקיקים מורכבים מפולי (2-אתיל-בוטיל ציאנואקרילט) (PEBCA) והם PEGylated. פונקציונליזציה עם פוליאתילן גליקול (PEG) מפחיתה אופוזוניזציה ופגוציטוזיס על ידי מערכת הפאגוציט המונונוקלארית, ובכך מאריכה את זמן זרימת הדם14,44. כתוצאה מכך, PEGylation מגדיל את כמות הננו-חלקיקים המגיעים לאתר היעד, ובכך משפר את יעילות הטיפול16. איור 2 ממחיש כיצד השימוש בארבע שיטות מיקרוסקופיה מאפשר לחוקרים לכסות את כל סולמות הזמן והאורך הרלוונטיים. יש לציין כי הרזולוציה המרחבית ברת השגה במיקרוסקופיה אופטית נקבעת על ידי מגבלת העקיפה, התלויה באורך הגל של האור והצמצם המספרי (NA) של המטרה ושל מקור תאורת האובייקט45. עבור המערכות בהישג יד, מגבלת הרזולוציה האופטית היא בדרך כלל 200 ננומטר. בנוסף, מיקרוסקופיה תוך-ויאלית יכולה לשמש לתמונה ברמה התת-תאית46. עבור מיקרו-בועות מיקרו-חלקיקים וחלבון המיוצבים המשמשים בעבודה זו, סולם האורך המינימלי הרלוונטי למיקרוסקופיה תוך-וינטלית הוא בגודל של נימים קטנים (≥10 מיקרומטר). בהפריה הדמיה אופטית במהירות גבוהה (10 מיליון פריימים לשנייה) והדמיה פלואורסצנטית במהירות גבוהה (500,000 פריימים לשנייה) מתוארים לניסויים עבור מיקרו-יבלים בודדים. הדמיית שדה בהיר במהירות גבוהה בלוחות זמנים של ננו-שניות מתאימה לחקר הדינמיקה הרדיאלית שנפתרה בזמן של הבועות הרוטפות. לעומת זאת, מיקרוסקופיית פלואורסצנטיות במהירות גבוהה מאפשרת הדמיה ישירה של שחרור הננו-חלקיקים המסומנים בפלואורסצנטיות. יתר על כן, המבנה של מעטפת microbubble ניתן לחקור באמצעות Z-מחסנית תלת מימדי (3D) קונפוקיסקופיה, וסריקה מיקרוסקופיה אלקטרונים (הפרוטוקול עבור האחרון אינו כלול בעבודה הנוכחית). מיקרוסקופיה תוך-וינטלית מורכבת משימוש במיקרוסקופיה רב-photon כדי לדמות גידולים הגדלים בתאי חלונות שריריים כדי לספק מידע בזמן אמת על זרימת הדם המקומית ועל גורלם של חלקיקים בעלי תווית פלואורסצנטית ב- vivo47. השילוב של שיטות מיקרוסקופיה אלה מספק בסופו של דבר תובנה מפורטת על ההתנהגות של סוכני microbubble טיפולית בתגובה אולטרסאונד, הן במבחנה והן in vivo.
Protocol
הערה: כל ההליכים הניסיוניים אושרו על ידי הרשויות הנורבגיות לחקר בעלי חיים. פרטים על חומרים ששימשו בפרוטוקול ניתן למצוא בטבלת החומרים.
1. ייצור של מיקרו-יבלים
הערה: בעבודה זו, המיקרו-חלוקים של העניין הם מיקרו-חלוקים מיוצבים בחלבון וננו-חלקיקים, שעבורם פרוטוקול הייצור תואר בעבר28,33,48. לכן, פרוטוקול הייצור סוכם כאן בקצרה.
- ראשית, באמצעות פיפטה, לערבב מים אולטרה-סבר עם 0.5 wt% של קזאין מלוחים פוספט חוצץ (PBS) ו 1 wt% של חלקיקים המסומנים עם 0.21 wt% של צבע פלואורסצנטי, NR668 (שונה הנילוס אדום), ב בקבוקון העליון קרם זכוכית סטרילית (10 מ"ל, קוטר של 2 ס"מ). הננו-חלקיקים הפולימריים מוכנים בשיטת פילמור מיני אמולסיה כפי שתואר על ידי Mørch et al. 38.
הערה: כאן, הצבע מתפקד כסם מודל כדי לאפשר הדמיה של שחרור ננו-חלקיקים. בעת עבודה עם פתרון הננו-חלקיקים, לבש חלוק מעבדה, משקפי מגן וכפפות. לנגב את כל שפיכות של פתרון ננו-חלקיקים מיד עם 100% אצטון. - לכסות את הקרבון עם כובע גומי, לערבב מעט, ומניחים את הקרבון באמבטיה קולית במשך 10 דקות בטמפרטורת החדר כדי לחסל אגרגטים אפשריים. מניחים כלי פיזור עם קצה המערבב ~ 0.5 ס"מ מתחתית בקבוקון הזכוכית. בעזרת צינור זכוכית המחובר למיכל הגז, מוסיפים את גז פרפלואורופרופן למרחב הראש של בקבוקון המכיל את הפתרון עד שהפתרון מתחיל לבעבע מעט.
הערה: לעטוף סרט איטום עצמי סביב הבסיס של כלי הפיזור כדי למנוע החלקה של בקבוקון הזכוכית במהלך ערבוב. - מערבבים את הפתרון במרץ ב 1935 × גרם (24,000 סל"ד עם רדיוס של סיבוב של 3 מ"מ) במשך 4 דקות באמצעות כלי הפיזור. סוגרים את הקרבון עם מכסה הגומי, ואטמים את הקרבון לשימוש נוסף.
הערה: המערבב בודד את הגז בנוזל. מעטפת המיקרו-bblbble מתכנסת לאחר מכן מבלי להזדקק לצעד פעיל. - לאחסן את עודף קזאין ופתרון ננו-חלקיקים ב 4 °C ,, ולנקות את כלי הפיזור עם 100% אצטון.
2. הדמיה של בועות בודדות
- מיקרוסקופיה קונפוקלית
- הכנת דוגמה
- לדלל את פתרון הבועה כדי תמונה microbubbles יחיד כדלקמן. מניחים מחט אוורור (19 G-21 G) ב בקבוקון עליון מכווצים מזכוכית המכיל את המיקרו-יבלים המיוצרים על ידי ביצוע ההליך המתואר בסעיף 1. הפוך את הוויאל כדי לאפשר לבועות גדולות להתרחק מהחותם של הוויאל.
- הכנס קצה מחט נוסף (19 גרם) של מזרק קטן (~ 1 מ"ל) לתוך המצופה, בעוד שהביחון עדיין הפוך. הסר כמות קטנה של מתלה הבועה, ולהעביר את התוכן של המזרק לתוך צינור קטן עבור pipetting קל יותר בשלב הבא.
הערה: נפח המתלה לחלץ ישירות תלוי בסוג ובריכוז של השעיית הבועה. במקרה זה, 0.2 מ"ל חולצה. - באמצעות פיפטה, לדלל את ההשעיה microbubble (מסעיף 1) ב PBS מסונן כדי להשיג ריכוז של כ 2 × 105 עד 6 × 105 microbubbles / mL כדי לאפשר הדמיה בועות בודדות.
הערה: בהתאם לסוג הבועה, מומלץ לשטוף את השעיית הבועה כדי להסיר צבע פלואורסצנטי חינם. זה חשוב במיוחד עם בועות שעבורן צבע פלואורסצנטי הוא חדורים בקליפה. כדי לשטוף בועות, לדלל את ההשעיה בועה (למשל, על ידי לקיחת 100 μL של פתרון הבועה ב 10 מ"ל של PBS), ואת צנטריפוגה זה (בדרך כלל במהירויות בסדר גודל של 100 × גרם). לבסוף, להסיר את supernatant המכיל microbubbles עם pipette לניתוח נוסף. הפתרון הנותר מכיל את חלקיקי הפלואורסצנט החופשיים וניתן להשליך אותו. יש לחזור על שלב הכביסה לפי הצורך. - הוסף גלילסול לתערובת כדי להגדיל את הצמיגות של המדיום ולחסל את התנועה המושרה על ידי תנועה בראונית שאחרת היה מפריע הדמיה Z-stack קונפוקלי איטי למדי.
הערה: כמות הגליצריל תלויה בסוג הבועה שתמונה (כאן, ~50%). עבור סוגים מסוימים של בועות, גליסrol עשוי להיות השפעה שלילית על יציבות49. עם זאת, לא נצפה שינוי ניכר בבועות במשך כ -30 דקות תחת הדמיה קונפוקלית. יתר על כן, גליצרל עשוי לשנות את התגובה האקוסטית של microbubbles ולכן ניתן להשתמש בו רק עם שיטות הדמיה שבו microbubbles אינם חסידים. - מניחים את ההשעיה microbubble בתא עם קירות דקים להדמיה אופטימלית כגון שקופית ערוץ.
- פרוטוקול הדמיה
- הדליקו את המיקרוסקופ הקונפוקליבי ובחרו מטרה מתאימה ואת הלייזר והסורק הרצויים לשימוש במהלך מיקרוסקופיה קונפוקלית.
הערה: כאן, השתמש במטרה טבילת מים 60x לרזולוציה של 0.08 מיקרומטר/פיקסל ובהתאם לגודל הבועה, צלם אזור של 256 x 256 פיקסלים או 128 x 128 פיקסלים. בניסויים ספציפיים אלה, השתמש בלייזר 488 ננומטר וסורק גלוואנו. אורך גל הפליטה תלוי בצבע הפלואורסצנטי והוא בדרך כלל פס רחב. - מצא מיקרו-חלוק בשדה בהיר, ועבור למיקרוסקופיה קונפוקלית. הגדר את המישורים העליונים והתחתוניים הרצויים שביניהם יסרוק המיקרוסקופ הקונפוקלי. לרכוש Z-מחסנית כדי לצפות במבנה 3D; השתמש בגודל שלב של 100 ננומטר בכיוון Z.
- הדליקו את המיקרוסקופ הקונפוקליבי ובחרו מטרה מתאימה ואת הלייזר והסורק הרצויים לשימוש במהלך מיקרוסקופיה קונפוקלית.
- הכנת דוגמה
- מיקרוסקופיה של שדה בהיר
- הרכבה של המערכת האופטית
הערה: ייצוג סכמטי של הגדרת המיקרוסקופיה של השדה הבהיר מוצג באיור 3A. כדי להבטיח התפשטות אולטרסאונד ללא הפרעה, אמבט המים מכיל שני פתחים: אחד למקור אור ואחד למתמר אולטרסאונד. המערכת האופטית מורכבת ממיקרוסקופ (מודולרי), מצלמה במהירות גבוהה ואופטיקה תואמת. כמו התקופה של תנודות microbubble הוא בדרך כלל בסדר של 1 μs (באמצעות אולטרסאונד 1 MHz), המצלמה צריכה להיות מוגדרת להקליט בקצב framerate של לפחות 5 מיליון פריימים לשנייה. כאן, המצלמה אמורה להיות מוגדרת להקליט ב 10 מיליון פריימים לשנייה (256 x 400 פיקסלים) עבור 256 פריימים (25.6 μs) כדי ללכוד את כל הפרטים של דינמיקת הבועה כולל הרמוניות גבוהות יותר.- חבר למיקרוסקופ יעד טבילת מים עם הגדלה מתאימה, מרחק עבודה ו- NA.
הערה: מטרת טבילת מים שימשה כדי לספק מרחק עבודה יציב למרות אידוי הדרגתי של המים. כאן, יעד טבילת מים עם הגדלה של 60x, מרחק עבודה של 2 מ"מ, ו NA של 1 נבחר. - השתמש באור מהבהב עם תפוקת הספק שיא של לפחות 1 קילוואט להארה ועדשת צינור בין המיקרוסקופ למצלמה כדי להבטיח שאור הסביבה הקטן ככל האפשר יגיע לחיישן של המצלמה המהירה.
- השתמש במקור אור הלוגן מעומעם להתמקדות במיקרו-יבלים בודדים ויישור המערכת האופטית והאקוסטיקה להדמיה בזמן אמת.
- חבר למיקרוסקופ יעד טבילת מים עם הגדלה מתאימה, מרחק עבודה ו- NA.
- הרכבה של המערכת האקוסטית
- השתמש במחולל צורת גל שרירותי לתכנות ובמגבר כוח (רווח של 56 dB) כדי להניע את המתמר עם עוטף חלק וצורת גל. חבר אוסצילוסקופ למחולל צורת הגל השרירותי כדי לבדוק את האות. חבר מחשב אישי למחולל צורת הגל השרירותי כדי לתכנת את גל הלחץ האקוסטי הנכנס, באמצעות תסריט שנכתב בתוך הבית.
- השתמש במחולל דופק/עיכוב כגורם מפעיל ראשי כדי לסנכרן את המערכות האופטיות והאקוסטיקה. הגדר את עיכובים ההדק על מחולל דופק / עיכוב ואת תוכנת המצלמה, כך ההקלטה מתחילה 16 μs לאחר שידור אולטרסאונד כדי לאפשר את גל אולטרסאונד להגיע לבועות. הפעל את מקור האור 1.5 מיקרו-μs לפני תחילת ההקלטה כדי להבטיח תאורה נכונה במהלך תנודות הבועה (ראה איור 3B עבור דיאגרמת התזמון).
- בחר מתמר מתאים עם תדר מרכז מתאים. מניחים אותו בפתח של אמבט המים, כך שהוא בזווית ביחס לציר האופטי כדי למזער השתקפויות מממברנות מחזיק המדגם ולהפחית היווצרות גל עומד.
הערה: כאן, מתמר טבילה ממוקד אלמנט יחיד עם תדר מרכזי של 2.25 מגה-הרץ, מרחק מוקד של 1 אינץ' וקוטר אלמנט של 0.75 אינץ' הוצב בזווית של 35° ביחס לציר האופטי. הכיול של פונקציית ההעברה צריך להתבצע באמצעות אותו מגבר המשמש במערכת האקוסטית. כייל את פונקציית ההעברה ממשרעת מתח למשרעת לחץ של המתמר באמצעות הידרופון סיב אופטי כפונקציה של תדר שידור אולטרסאונד.
- בחירת מחזיק המדגם
- השתמש במחזיק מדגם עם ממברנות שקופות אופטית ואקוסטית ונפח גדול מספיק כדי לאפשר הדמיה של כמה microbubbles יחיד בתוך אותה מדגם.
הערה: כאן, קלטת תרבית התא עם נפח של 10 מ"ל, אזורי ממברנה של 25 cm2, ועובי ממברנה של 175 מיקרומטר שימש. בשל השתקפויות אקוסטיות על הממברנה התחתונה, והפרעות מגלים המשתקפים על ידי מטרת המיקרוסקופ והממברנה העליונה, הלחץ האקוסטי במקום עשוי להיות שונה מזה המתוכנת על מחולל צורת הגל השרירותי. הצבת המתמר בזווית ביחס לממברנות מחזיק המדגם מפחיתה היווצרות גל עומד, אך יכולה להגביר השתקפויות מהקרום. - ודא כי המדגם יכול להיות שקוע לחלוטין הביא בתוך המוקד של המתמר ואת המטרה מיקרוסקופ. השתמש בתמיכה באלומיניום המחוברת לשלב מיקרופוזיציה תלת-ממדי כדי להזיז את מחזיק הדגימה באופן עצמאי.
- השתמש במחזיק מדגם עם ממברנות שקופות אופטית ואקוסטית ונפח גדול מספיק כדי לאפשר הדמיה של כמה microbubbles יחיד בתוך אותה מדגם.
- יישור המערכות האופטיות והאקוסטיקה
- לתרגום תלת-ממדי כדי ליישר את ההתקנה, חבר את אמבט המים לשלב תרגום XY וצרף את הבמה לטבלה אופטית כדי להבטיח שהיא לא תזוז במהלך ניסויים. לאחר מכן, מלאו את אמבט המים במים, והדליקו את מקור האור הלוגן העמום. במהלך היישור, להזיז את מטרת המיקרוסקופ לצד כדי למנוע השתקפויות אולטרסאונד.
- חבר מחט הידרופון (0.2 מ"מ) לזרוע מחזיק המדגם, והניח את המחט הידרופון באמבט המים, עם הקצה בשדה הראייה של המטרה. הפעל את המגבר ואת מחולל צורת הגל השרירותי; השתמש פולסים בודדים של 5 עד 10 מחזורי אולטרסאונד ותדר חזרה דופק של 15 הרץ. ודא כי קצה הידרופון מרוכז ומתמקד בתמונת המיקרוסקופ. הזז את המיכל בכיוון XY ואת המחט בכיוון Z עד משרעת הלחץ המרבית מגיעה.
- התאימו את המוקד של המיקרוסקופ כדי להתמקד מחדש בקצה ההידרופון.
הערה: פרוטוקול זה מבטיח את היישור בין מוקד המיקרוסקופ לבין מוקד המתמר. אל תשנה את מיקום המיקרוסקופ והמתמר לאחר היישור.
- הכנת דוגמה
- חזור על שלבים 2.1.1.1 עד 2.1.1.3 כדי להכין את הפתרון לדוגמה. לדלל את פתרון הבועה כדי לאפשר הדמיה של בועה אחת ולשלול אינטראקציות אקוסטיות של בועות שכנות.
- פתח את השקע של מחזיק הדגימה. באמצעות מזרק, להזריק את הפתרון לדוגמה לתוך הפתיחה השנייה של מחזיק המדגם עד שהוא מלא לחלוטין. ודא כי אין בועות אוויר בתוך מחזיק המדגם כדי למנוע אינטראקציות לא רצויות עם שדה אולטרסאונד.
- סגור את שני השסתומים של מחזיק המדגם, והצב את מחזיק המדגם בניצב לציר האופטי.
הערה: שמור את רמת מחזיק הדגימה המלאה כדי למנוע הסטה של הבועות לצד אחד של מחזיק המדגם במהלך המעבר.
- פרוטוקול הדמיה
- תכנת את תדר הנהיגה האולטרה-סאונד הרצוי והלחץ האקוסטי במחולל צורת הגל השרירותי באמצעות התסריט הכתוב הנ"ל.
הערה: כאן, גל הלחץ האקוסטי היה פרץ יחיד של 40 מחזורים, עם דופק מחודד גאוס 8 מחזורים. תדרי אולטרסאונד המשמשים בניסויים אלה היו 1 MHz, 2 MHz, או 3 MHz, עם משרעת לחץ אקוסטית הנעה בין 81 kPa ל 1200 kPa. - הזז את מחזיק הדגימה המכיל את הפתרון לדוגמה באמצעות שלב XYZ כדי לאתר מיקרו-יבלים בודדים במוקד המיקרוסקופ. התחל עם שדה תצוגה בפינה של מחזיק הדגימה, וודא שקצה המיקרו-bblbbles גלוי בבירור ובפוקוס (ראה איור 3C לקבלת תצוגת מצלמה אידיאלית).
- חבר את הקצה של סיב אופטי שהיה מחובר בעבר לאור הלוגן לאור מהבהב, כך שהקצה השני עדיין מחובר לאמבט המים. הפעל את ההקלטה.
- חזור על שלבים 2.2.6.2 עד 2.2.6.3 פעמים ככל הרצוי לכל הגדרת אולטרסאונד (תדירות ולחץ אקוסטי), הזזת קלטת תרבית התא המכילה את microbubbles לפחות 2 מ"מ (במישור המוקד) מהמיקום הקודם כדי להבטיח כי microbubbles בתחום הראייה אינם ססונים בניסויים קודמים.
הערה: כאן, כל ניסוי חזר על עצמו ~ 20 פעמים. כאשר כל בעל המדגם הוא sonified, לרוקן את מחזיק המדגם, ולמלא אותו עם פתרון מדגם טרי לניסויים הבאים.
- תכנת את תדר הנהיגה האולטרה-סאונד הרצוי והלחץ האקוסטי במחולל צורת הגל השרירותי באמצעות התסריט הכתוב הנ"ל.
- ניתוח נתונים
- אמץ סביבת תכנות לביצוע ניתוח נתונים בהתאם לשאלת המחקר, ובצע זיהוי קצה לאחר עיבוד התמונות. באמצעות פונקציה המודדת מאפיינים של אזורי תמונה, מצא את הצנטרואיד של בועה ואת הנגזרת של פרופיל העוצמה סביב כל בועה כדי לזהות את קווי המתאר של הבועה (ולכן, רדיוס הבועה R). לחלץ פרמטרים רלוונטיים מהרדיוס לאורך זמן עבור microbubbles יחיד.
הערה: במחקר הנוכחי, סביבת תכנות שימשה לעיבוד תמונה כדי להפוך בינארי ולסנן הקלטות של microbubbles יחיד. סקריפט פנימי שימש למציאת הנגזרת של פרופיל האינטנסיביות סביב כל בועה.
- אמץ סביבת תכנות לביצוע ניתוח נתונים בהתאם לשאלת המחקר, ובצע זיהוי קצה לאחר עיבוד התמונות. באמצעות פונקציה המודדת מאפיינים של אזורי תמונה, מצא את הצנטרואיד של בועה ואת הנגזרת של פרופיל העוצמה סביב כל בועה כדי לזהות את קווי המתאר של הבועה (ולכן, רדיוס הבועה R). לחלץ פרמטרים רלוונטיים מהרדיוס לאורך זמן עבור microbubbles יחיד.
- הרכבה של המערכת האופטית
- מיקרוסקופיית פלואורסצנטיות
- הרכבה של המערכת האופטית
- בנה את ההתקנה עבור מיקרוסקופיית פלואורסצנטיות (איור 4A), עם אותו בסיס המשמש במיקרוסקופיה של שדה בהיר המתוארת בסעיף 2.2.
הערה: ניתן לשלב את ההתקנה המתוארת בסעיף 2.3 עם ההתקנה המתוארת עבור מיקרוסקופיה של שדה בהיר בסעיף 2.2. שילוב הן של מיקרוסקופיה פלואורסצנטית והן מיקרוסקופיה של שדה בהיר מאפשר הדמיה של ליבת הגז microbubble תוך הדמיה של שחרור הננו-חלקיקים. - הגדר את המצלמה המהירה כך שתוקלט במהירות של 500,000 פריימים לשנייה (400 x 250 פיקסלים) עבור 128 פריימים (256 מיקרו-פיקסל).
הערה: זמן ההדמיה ארוך יותר מאשר בניסויים בשדה הבהיר מכיוון שעוצמת האור מוגבלת בפלואורסצנטיות, ומכיוון שציר הזמן שבו מתרחשת מסירת החלקיקים ארוך יותר מזה של דינמיקת הבועה. - בחר לייזר עם כוח גבוה מספיק כדי לספק מספיק אור וכי יש אורך גל עירור מתאים, ולוודא כי הוא יחד עם אפנון acousto-אופטי כדי למנוע להלבין את המדגם.
הערה: במחקר זה, לייזר גל 5 W רציף עם אורך גל עירור של 532 ננומטר שימש כדי לרגש את הפלואורסצנטיות של הננו-חלקיקים. - הנח מפצל קרן, מראה dichroic ומסנן חריץ בין הלייזר לבין מטרת המיקרוסקופ כדי לכוון את אור העירור לכיוון המדגם תוך מתן פליטת פלואורסצנטיות להגיע למצלמה.
- בנה את ההתקנה עבור מיקרוסקופיית פלואורסצנטיות (איור 4A), עם אותו בסיס המשמש במיקרוסקופיה של שדה בהיר המתוארת בסעיף 2.2.
- הרכבה של המערכת האקוסטית
- כדי להחדיר את המיקרו-יבלות, השתמש באותה הגדרה אקוסטית כמו בסעיף 2.2.2. שנה את המתמר בניסויים ספציפיים אלה למתמר טבילה ממוקד של אלמנט יחיד עם תדר מרכזי של 2.25 מגה-הרץ, מרחק מוקד של 1.88 אינץ', וקוטר אלמנט של 1 אינץ'. מניחים אותו בזווית של 35° ביחס לציר האופטי כדי למזער השתקפויות מקרום מחזיק המדגם ולהפחית תצורות גל עומד.
- יישור המערכות האופטיות והאקוסטיקה
- חזור על שלבים המתוארים בסעיף 2.2.4.
- הכנת דוגמה
- הכן את הפתרון לדוגמה כמתואר בסעיף 2.2.5.
- פרוטוקול הדמיה
- הגדר את תדר הנהיגה הרצוי אולטרסאונד משרעת לחץ אקוסטית על מחולל צורת הגל השרירותי באמצעות התסריט הכתוב בבית הנ"ל.
הערה: כאן, גל הלחץ האקוסטי תוכנת להיות פרץ יחיד של אולטרסאונד של 140 מחזורים, עם דופק גאוסי 10 מחזורים מחודד. משכי דופק ארוכים יותר נדרשים בדרך כלל כדי לגרום להשפעות ביולוגיות בהשוואה לאלו הנדרשות כדי לחקור דינמיקת בועה. תדרי אולטרסאונד המשמשים בניסויים אלה היו 1 MHz, 2 MHz, או 3 MHz, עם משרעת לחץ אקוסטית הנעה בין 81 kPa ל 1200 kPa. - על מחולל הדופק / עיכוב, הגדר את השהיית ההדק עבור הלייזר עבור עירור פלואורסצנטי של חלקיקים מן microbubbles במהלך ההקלטה.
הערה: עבור ניסויים ספציפיים אלה, עיכוב ההדק היה בין 20 μs ו 170 μs למשך כולל של 150 μs. דיאגרמת התזמון מוצגת באיור 4ב. - הזז את מחזיק הדגימה המכיל את הפתרון לדוגמה באמצעות שלב XYZ כדי לאתר מיקרו-יבלים בודדים במוקד המיקרוסקופ. התחל בשדה תצוגה של פינת מחזיק המדגם; ראו איור 4C לקבלת תצוגת מצלמה אידיאלית שבה הממשק של המיקרו-bblbbles גלוי בבירור ובפוקוס. הפעל את ההקלטה.
- חזור על שלב 2.3.5.3 פי כמה שתרצו לכל הגדרת אולטרסאונד (תדירות ולחץ אקוסטי), הזזת קלטת תרבית התא המכילה את המיקרו-bblbbles לפחות 2 מ"מ (במישור האופטי) מהמיקום הקודם כדי להבטיח שמיקרו-יבלים בשדה הראייה לא יתמלאו בניסויים קודמים.
הערה: במחקר זה, כל ניסוי חזר על עצמו ~ 10-20x. כאשר כל בעל המדגם הוא sonified, לרוקן את מחזיק המדגם, ולמלא אותו עם פתרון מדגם טרי לניסויים הבאים. המרחק להעביר את מחזיק הדגימה בין הניסויים תלוי בגודל הקרן האקוסטית.
- הגדר את תדר הנהיגה הרצוי אולטרסאונד משרעת לחץ אקוסטית על מחולל צורת הגל השרירותי באמצעות התסריט הכתוב בבית הנ"ל.
- ניתוח נתונים
- לנתח את הקלטות מיקרוסקופיה פלואורסצנטית על פי שאלת המחקר. עבור כל microbubble, חזותית לקבוע אם משלוח של חלקיקים בניסויי מיקרוסקופיה פלואורסצנטי התרחש. אם ניתוק ותצהיר של חלקיקים core Core הגז אל קרום מחזיק המדגם הוא ציין עבור microbubble יחיד, באופן ידני להיכנס כי המסירה התרחשה בסביבת התכנות.
- הרכבה של המערכת האופטית
3. מיקרוסקופיה תוך-ויאלית
- ניתוח תאי חלון עם מעטפת העור בגב (שתואר בעבר26,47,50)
- התאקלם בבעלי החיים במשך שבוע לפני הצבת תאי החלונות. למרות שעכברים נקביים וגבריים כאחד יכולים לשמש, והגיל אינו חשוב, ודאו כי משקל העכברים הוא לפחות 22-24 גרם, כך שהעור גמיש מספיק.
- בצע את הניתוח תחת הרדמה כללית עם טיפול תוך ניתוחי ולאחר הניתוח. מרדים את החיה על ידי הזרקה תת עורית של פנטניל (0.05 מ"ג/ק"ג)/מדטומידין (0.5 מ"ג/ק"ג)/מידזולם (5 מ"ג/ק"ג)/מים (2:1:2:5) במינון של 0.1 מ"ל ל-10 גרם משקל. השתמש כרית חימום או מנורת חימום כדי לשמור על טמפרטורת הגוף של החיה.
- משכו בעדינות על השכבה הכפולה של העור על גב החיה, כך שהעור יידחק בין שתי מסגרות פוליאוקסימתילן סימטריות של תא החלון. תקן את התא על ידי הצבת שני ברגים המשתרעים דרך שכבת העור הכפולה ותפירה לאורך הקצה העליון של התא.
- הסר את העור בתוך המסגרת המעגלית של התא בצד אחד של קיפול העור. מניחים כיסוי בקוטר של 11.8 ממ בתוך המסגרת שבה העור מוסר כדי ליצור חלון לתוך הרקמה.
- השתמש הזרקה תת עורית של atipemazole (2.5 מ"ג/ קילוגרם), flumazenil (0.5 מ"ג/ קילוגרם), ומים (1:1:8) במינון של 0.1 מ"ל לכל 10 גרם כנוגדן כדי לסיים את ההרדמה. מניחים את החיה במדף התאוששות מחומם למשך הלילה. להשלים את המים עבור בעלי חיים עם 25 מ"ג/מ"ל של enrofloxacin כדי למנוע זיהום באתר הניתוח.
- יצירת מודל גידול
- לשמור על תאים סרטניים ב 37 °C (5%) ובאווירת CO2 5% במדיום תרבית מתאימה בתוספת סרום בקר עוברי 10% ו 100 U /mL פניצילין ו 100 מ"ג / מ"ל סטרפטומיצין.
הערה: קו התא אוסטאוסרקומה האנושי (OHS) שימש בפרוטוקול זה, אך ניתן להשתמש גם בקווי תאים אחרים. - ביום שאחרי שלב 3.1.5, מרדים את החיה על ידי איזופלוראן (5% במהלך אינדוקציה ו 1-2% במהלך התחזוקה) במשך כמה דקות. הסר את הכיסוי, להחיל 5 × 106 תאים סרטניים ב 30 μL של תרבית תאים בינוני, ולהחליף את זכוכית הכיסוי.
- אפשר לגידולים לגדול במשך שבועיים לפני ההדמיה, ולעקוב אחר המשקל והמצב הבריאותי של בעלי החיים לפחות 3 פעמים בשבוע בתקופה זו.
- לשמור על תאים סרטניים ב 37 °C (5%) ובאווירת CO2 5% במדיום תרבית מתאימה בתוספת סרום בקר עוברי 10% ו 100 U /mL פניצילין ו 100 מ"ג / מ"ל סטרפטומיצין.
- הרכבה של המערכת האופטית
- בצע הדמיה תוך-וינטלית במהלך טיפול אולטרסאונד (כמתואר בעבודה קודמת26) עם מיקרוסקופ ומטרה מתאימים בהתאם לשאלת המחקר על כף המאזניים. ראה איור 5A לקבלת ייצוג סכמטי של ההתקנה הניסיונית.
הערה: לניסוי ספציפי זה, נעשה שימוש במיקרוסקופ מולטי-פוטוני, המצויד במטרה לטבילת מים פי 20 (NA של 1.0 ומרחק עבודה של 2 מ"מ) ולייזר פעמו. התמונות נרכשו במצב סריקה מהדהד במהירות של 31 פריימים לשנייה (512 x 512 פיקסלים) עם שדה ראייה של 400 x 400 מיקרומטר2. אורך גל העירור היה 790 ננומטר. המסננים מול שני גלאי פוספיד ארסניד gallium היו ארוכי לעבור 590 ננומטר ופס לעבור 525/50 ננומטר לגילוי פלואורסצנטיות.
- בצע הדמיה תוך-וינטלית במהלך טיפול אולטרסאונד (כמתואר בעבודה קודמת26) עם מיקרוסקופ ומטרה מתאימים בהתאם לשאלת המחקר על כף המאזניים. ראה איור 5A לקבלת ייצוג סכמטי של ההתקנה הניסיונית.
- הרכבה של המערכת האקוסטית
- הר מתמר אולטרסאונד מתאים במגן גל (מותאם אישית) הממוקם מתחת למטרה בזווית של 45° ביחס לציר האופטי כדי למזער השתקפויות מזכוכית הכיסוי של תא החלון של מעטפת העור של העור ולצמצם תצורות גל עומד. מלאו את מזחלת הגל במים מזוקקים ומנוגדים. החל ג'ל צימוד קולי על גבי מצעד הגל.
- יישור המערכות האופטיות והאקוסטיקה
- ישר את הציר האופטי עם המוקד של אולטרסאונד. מקם הידרופון סיב אופטי במוקד המטרה. לאחר מכן, הפעל את המגבר ואת מחולל צורת הגל השרירותי כדי לרגש את המתמר עם התפרצויות קצרות (5-10 מחזורים) עם תדר חזרה דופק של 100 הרץ, ולהעביר את מתמר אולטרסאונד למיקום שבו הלחץ הגבוה ביותר מזוהה עם אות הידרופון על oscilloscope.
הערה: אל תשנה את מיקום המתמר לאחר היישור.
- ישר את הציר האופטי עם המוקד של אולטרסאונד. מקם הידרופון סיב אופטי במוקד המטרה. לאחר מכן, הפעל את המגבר ואת מחולל צורת הגל השרירותי כדי לרגש את המתמר עם התפרצויות קצרות (5-10 מחזורים) עם תדר חזרה דופק של 100 הרץ, ולהעביר את מתמר אולטרסאונד למיקום שבו הלחץ הגבוה ביותר מזוהה עם אות הידרופון על oscilloscope.
- פרוטוקול הדמיה
- מקם את בעל החיים המחומם (מעוצב בהתאמה אישית) מחובר לשלב מיקום XY בין מנגויד הגל למטרה, והוסף עוד ג'ל צימוד. להרדים את החיה, ולהניח צנתר וריד זנב. הנח את העכבר במחזיק המחומם ותקן את תא החלון במחזיק. מוסיפים טיפת מים על גבי פתק הכיסוי בתא החלון, ומזיזים את המטרה במקום כדי לדמיין את רקמת הגידול.
-
איור 5B מציג את דיאגרמת התזמון של הניסויים המתארים את סדר האירועים. הזריקו 2 דקסטרן תוך ורידי (30 מיקרול, 4 מ"ג/מ"ל מדוללים מלוחים) כדי לדמיין את כלי הדם, ולהזיז את העכבר באמצעות שלב תרגום XY כדי למצוא תנוחה עם כלי דם מתאימים. הקלט תמונות בסיסיות לפני הטיפול באולטרסאונד. התאם את קצב הפריימים, שדה הראייה ואורך ההקלטה בהתאם לשאלת המחקר ולפרטים של המיקרוסקופ והצבעים שיש לדמיין.
הערה: בניסויים אלה, 31 פריימים לשנייה נרשמו עם שדה ראייה של 400 x 400 מיקרומטר2, והדמיה נעשתה ברציפות במשך 5 דקות. - הגדר את תדר הנהיגה הרצוי אולטרסאונד, אורך הדופק, משרעת לחץ אקוסטית על מחולל צורת הגל השרירותי.
הערה: עבור ניסויים אלה, תדירות של 1 MHz שימש עם אורך דופק של 10 אלפיות שני ו משרעת לחץ שלילי שיא בין 0.2 MPa ו 0.8 MPa. תדר חזרה דופק של 0.5 הרץ או 0.1 הרץ שימש כדי לאפשר microbubbles חדש reperfuse לתוך האזור המטופל בין פולסים אולטרסאונד. - הזריקו 50 מיקרו-יבלות μL (2 × 108 עד 5 × 108 מיקרו-יבלים/מ"ל) תוך ורידי, והחלו אולטרסאונד בזמן ההדמיה, כמתואר ב-26.
- ניתוח נתונים
- בהתאם לשאלת המחקר, לנתח תמונות עם (קוד פתוח) תוכנת עיבוד תמונה וסביבת תכנות, כמתואר ב-26, כדי לקבוע פרמטרים של כלי דם (קוטר, הסתעפות, מהירות זרימה וכיוון), הצטברות של חלקיקים בכלי הדם, וקינטיקה ועומק חדירה של אקסטרונס של dextran וננו חלקיקים לתוך רקמת הגידול.
תוצאות
המיקרו-יבלים, המיוצרים כמתואר בפרוטוקול, נותחו בשיטות מיקרוסקופיות שונות ובלולי זמן שונים.
הפלואורסצנטיות של הננו-חלקיקים במיקרוסקופיה קונפוקלית (איור 6A) מצביעה על כך שלקליפה יש התפלגות חלקיקים לא אחידה. שיטות מיקרוסקופיה אחרות יכולות לשמש לאפיון בועה. לדוגמה, איור 6B מציג את המבנה הכולל של המיקרו-חלוק באמצעות מיקרוסקופיית אלקטרונים סורקת, כפי שהוצג בעבודה הקודמת34.
דינמיקה רדיאלית והתנהגות בועה פנומנולוגית ניתן ללמוד באמצעות שיטת מיקרוסקופיה שדה בהיר במבחנה המתוארת שבה מיקרו-בועות צולמו ב -10 מיליון פריימים לשנייה. הרדיוס של מיקרו-נבלים בודדים חולץ עם הזמן באמצעות תסריט שנכתב בתוך הבית. דוגמה לתגובה רדיאלית כזו מוצגת באיור 7.
רצף תמונות של מסירת חלקיקים מוצלחת טיפוסית, כמתואר בסעיף 2.3.6, מוצג באיור 8A. ניתן לראות את הננו-חלקיקים המוטבעים במעטפת המיקרו-bblbble נדלקים עקב פלואורסצנטיות כאשר אור הלייזר מגיע לבועה. מונע על ידי אינסונציה אולטרסאונד, חלקיקי פלואורסצנטי לנתק את ליבת הגז של microbubbles והם מופקדים על הממברנה של מחזיק המדגם. לבסוף, הלייזר כבוי, וננו-חלקיקי הפלורסנט כבר לא מתרגשים. משלוח לא מוצלח של המטען בעל התווית הפלואורסצנטית של המיקרו-חלוקים נראה בדרך כלל כמו רצף התמונה המוצג באיור 8B, שבו חלקיקי הפלואורסצנט נדלקים על קליפת המיקרו-חלוק שנשארת שלמה במהלך חשיפה לאולטרה-סאונד.
מיקרוסקופיה מולטי-פוטונית תוך-וינטלית בזמן אמת במהלך אולטרסאונד שימשה כדי לחקור את ההשפעות של אולטרסאונד ומיקרו-יבלים על התנהגות ננו-חלקיקים בדם, שיפור החדרות של כלי הדם הגידוליים ושיפור המסירה של חלקיקים. ניתן לאפיין את היקף וקינטיקה של חדירה לתוך המטריצה החוץ תאית כפונקציה של לחץ אקוסטי, תדירות ואורכי פעימה. ההשפעה של טיפול אולטרסאונד עשוי להשתנות ביחס לגודל ומורפולוגיה של כלי הדם וכתוצאה מכך כליאה של הבועה. כיצד הטיפול באולטרסאונד משפיע על זרימת הדם והכיוון ניתן לקבוע. ניסוי לדוגמה המציג את ההגזמה של חלקיקים לאורך זמן מוצג באיור 9 במדד מכני (MI) של 0.826. תוצאות של מיקרוסקופיה מולטיפוטונית תוך-ויאלית מפארות את ההגזמה המרחבית והטמפורלית של חלקיקים במהלך חשיפה לאולטרסאונד, אשר מועילה מאוד להבנה מלאה של המנגנונים שבבסיס משלוח אולטרסאונד בתיווך של חלקיקים ולייעל טכנולוגיות כאלה26.
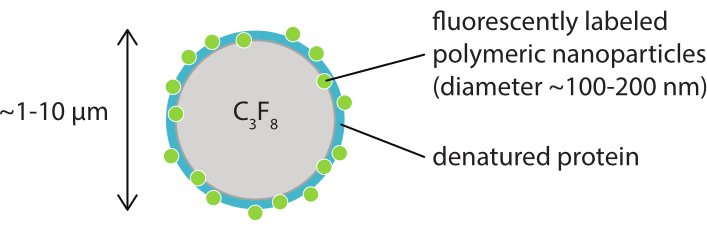
איור 1: ייצוג סכמטי של מיקרו-חלוק עם קליפה של חלקיקים פולימריים בעלי תווית פלואורסצנטית בקזאין דנטורי. microbubbles הם בדרך כלל בין 1 מיקרומטר ו 10 מיקרומטר קוטר. הננו-חלקיקים יש קוטר בעיקר בין 100 ננומטר ו 200 nm38. קיצור: C3F8 = גז פרפלואורופרופן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
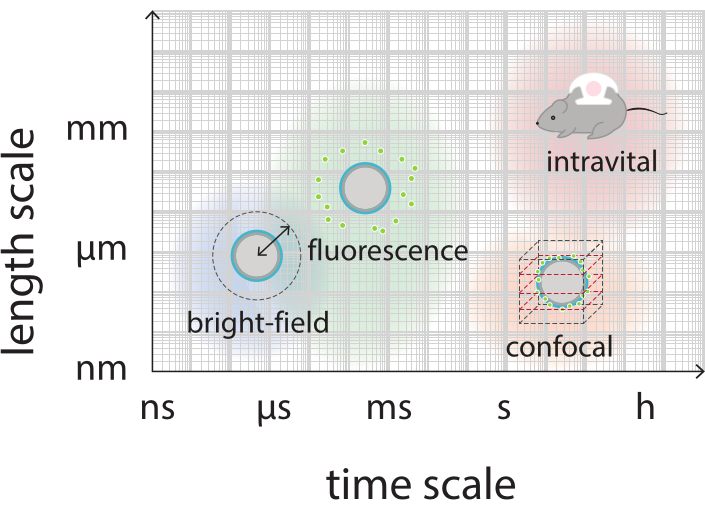
איור 2: סקירה סכמטית המציגה את סרגלי הזמן והאורך הרלוונטיים עבור מיקרוסקופיה בהירה, פלואורסצנטית, קונפוקלית ומיקרוסקופיה תוך - וינטלית.
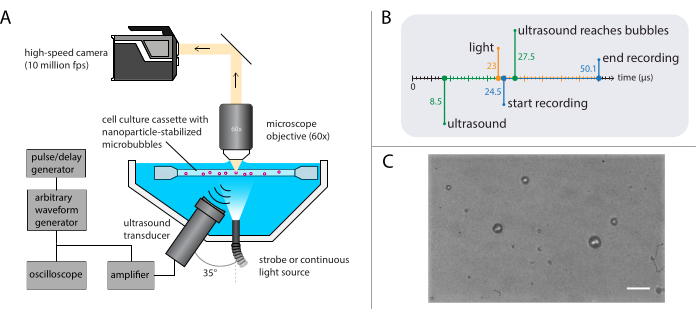
איור 3: ייצוג סכמטי של ניסויי מיקרוסקופיה בשדה בהיר. (A) התקנה ניסיונית, (B) דיאגרמת התזמון ו-(C) מסגרת מוקלטת טיפוסית. סרגל קנה מידה ב - (C) = 10 מיקרומטר. קיצור: fps = מסגרות לשניה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
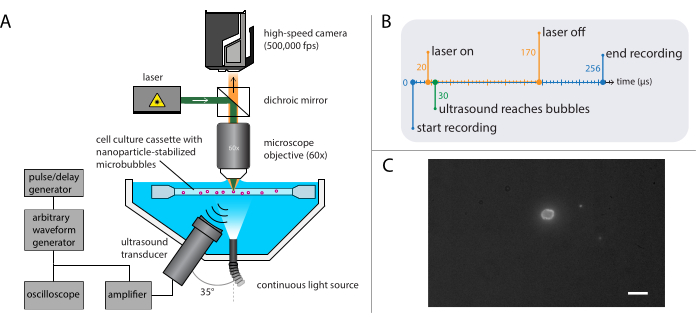
איור 4: ייצוג סכמטי של ניסויי מיקרוסקופיה פלואורסצנטית. (A) הגדרה ניסיונית, (B) דיאגרמת התזמון ו- (C) מסגרת מוקלטת טיפוסית. סרגל קנה מידה ב - (C) = 10 מיקרומטר. קיצור: fps = מסגרות לשניה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
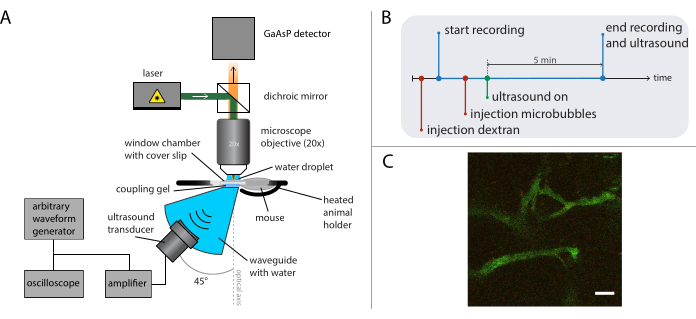
איור 5: ייצוג סכמטי של ניסויים מיקרוסקופיים תוך-וינטליים. (A) התקנה ניסיונית, (B) דיאגרמת התזמון ו-(C) מסגרת מוקלטת טיפוסית. סרגל קנה מידה ב - (C) = 50 מיקרומטר. ירוק מתאים לדקסטרן-FITC ואדום לננו-חלקיקים. קיצור: GaAsP = גליום ארסניד פוספיד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
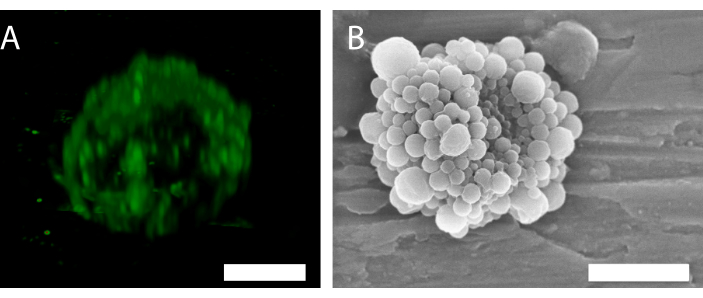
איור 6: מבנה תלת-ממדי של מיקרו-חלוק יחיד המיוצב על-ידי חלקיקים וחלבון. (A) שימוש במיקרוסקופיה קונפוקלית כדי להציג את הננו-חלקיקים, ו-(B) באמצעות מיקרוסקופ אלקטרונים סורק כדי להציג את המבנה התלת-ממדי. (B) שוחזר עם הרשאה מ- 34. סרגל קנה מידה ב ( A) = 5 מיקרומטר; סרגל קנה מידה ב - (B) = 2 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
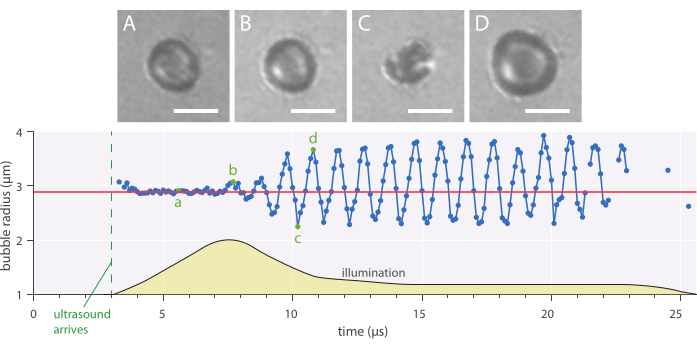
איור 7: תנודות כדוריות אופייניות של מיקרו-חלוק מיקרו-חלקיקים ומיוצב חלבונים ברדיוס של 2.89 מיקרומטר, שהוחלו בתדר אולטרסאונד של 1 מגה-הרץ ומשרעת לחץ אקוסטית של 142 kPa. (A-D) תמונות מההקלטה המהירה ומרדיוס הבועה המתאים בעקומת הזמן (למטה). סרגלי קנה מידה = 5 מיקרומטר, והקו האדום מציין את הרדיוס ההתחלתי. פרופיל התאורה (יחידות שרירותיות) מצוין בצהוב. ההגדלה היא 120x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
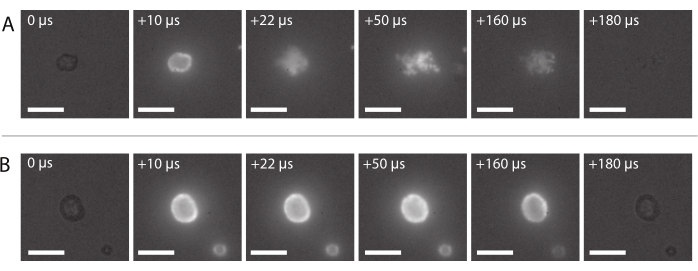
איור 8: רצף תמונות ממיקרוסקופיה פלואורסצנטית במהירות גבוהה. (A) אספקה מוצלחת של חלקיקים בעלי תווית פלואורסצנטית של מיקרו-חלוק ננו-חלקיקים ומיוצב חלבונים ביזום בתדר אולטרסאונד של 2 מגה-הרץ ומשרעת לחץ אקוסטית של 600 kPa. (B) אספקה לא מוצלחת של חלקיקים בעלי תווית פלואורסצנטית של מיקרו-חלוק מיוצב בננו-חלקיקים וחלבון שהוססו בתדר אולטרסאונד של 2 מגה-הרץ ומשרעת לחץ אקוסטית של 210 kPa. סרגלי קנה מידה = 10 מיקרומטר. ההגדלה היא 120x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
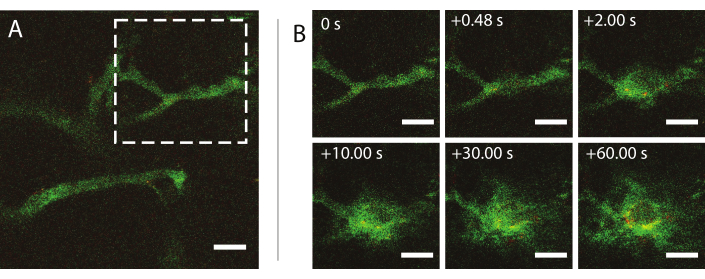
איור 9: מיקרוסקופיה תוך-וינטלית לאחר אינסונציה של מיקרו-חלוקים מיוצבים בננו-חלקיקים וחלבון בתדר אולטרסאונד של 1 מגה-הרץ ומשרעת לחץ אקוסטית של 800 kPa. (A) חלקיקים בתוך הכלי, ו-(B) רצף תמונה של האזור המצוין על ידי הריבוע המקווקו הלבן ב-(A) המתאר את ההפצה של dextran (ירוק) וננו-חלקיקים (אדום). סרגלי קנה מידה = 50 מיקרומטר. ההגדלה היא פי 20. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
שיטות מיקרוסקופיה אופטיות שונות שולבו כדי לקבל מידע על השלבים השונים באספקת חלקיקים מפני השטח של microbubbles למדיום שמסביב. הדמיה של תנודות הבועה בוצעה, כמו גם הדמיה של שחרור הננו-חלקיקים מקליפת הבועה, ההפצה והחדירה דרך המטריצה החוץ-תאית של גידולים ב- vivo. הדמיה במבחנה מאפשרת סינון של פרמטרי אולטרסאונד רבים בהשוואה למערכות vivo המורכבות יותר. היתרון של שילוב מגוון זה של שיטות הדמיה הוא המידע המשלים שניתן להשיג בלוחות זמנים שונים - תכונה חיונית לאפיון ולייעול המיקרו-יבלות למסירה מוצלחת ולהשגת יעילות טיפולית. גישה זו שימושית כדי להבין את מנגנוני המסירה עבור כל microbubbles כאחד, כולל מבנים עם חלקיקים ותרופות תווית פלואורסצנטית.
השלבים הקריטיים ביותר בשיטות המיקרוסקופיה המשמשות לחקר מיקרו-יבלים בודדים הם כדלקמן. עבור מיקרוסקופיה פלואורסצנטית, הננו-חלקיקים צריכים להיות מתויגים באופן פלואורסצנטי כדי לאפשר הדמיה של שחרור החלקיקים. יתר על כן, הפתרון לדוגמה צריך להיות מדולל מספיק כדי לבודד microbubbles יחיד לניתוח בשיטות קונפוקליות, שדה בהיר, פלואורסצנטיות מיקרוסקופיות. בנוסף, חשוב לבחור תדר נהיגה אולטרסאונד ולחץ אקוסטי כדי לרגש את הבועות בצורה היעילה ביותר, כלומר בתהודה שלהם. אם שאלת המחקר נוגעת למסירת מטען הננו-חלקיקים, הפרמטרים המתאימים של אולטרסאונד צריכים להיות חלק מהחקירה. לצד תהודה, בועות אלה צריכות להיות מונעות גם בסף או מעבר לסף שלהם לשחרור ננו-חלקיקים, בדרך כלל במשבריעת לחץ אקוסטית גבוהה יחסית (MI > 0.3)51. להדמיית מיקרוסקופיה בעלת שדה בהיר, חשוב לבחור מצלמה במהירות גבוהה עם קצב מסגרת גבוה מספיק כדי למזער את טשטוש התנועה ולהימנע מכינוי.
מיקרוסקופיה של שדה בהיר מוגבלת בעיקר על ידי קצב הדמיה ועוצמת מקורות האור הזמינים, שכן קצב מסגרת גבוה יותר ייתן תובנה מפורטת יותר שנפתרה בזמן על דינמיקת הבועה, אך דורש תאורה אינטנסיבית יותר עקב זמני חשיפה קצרים יותר. כדי לחקור שחרור חלקיקים בפירוט רב יותר, מסגרת הדמיית פלואורסצנטית יכול, באופן עקרוני, להיות מוגבר על ידי הגדלת עוצמת אור הלייזר. עם זאת, ספיגת אור הלייזר בעוצמה גבוהה על ידי המיקרו-חלוקים המסומנים בפלואורסצנטיות מייצרת חום, אפילו עם צבעי תפוקה קוונטית גבוהים. חום זה יכול להפריע לניסויים על כף המאזניים, ובמקרים קיצוניים, לגרום cavitation פוטו-תרמי52. לכן, בפועל, יש גבול לשפעת הלייזר המיושמת. עם זאת, תאורת לייזר אינטנסיבית יכולה לשמש גם בכוונה כדי לגרום לשחרור חלקיקים ליפוזומים53. הטמפרטורה משפיעה על דינמיקת בועות ותגובת אולטרסאונד, בהתאם לסוג הבועה54. לכן, אם יש להשוות באופן אובייקטיבי את שיטות ההחמרה והאינטרה , שיטות ההחמרה שנידונו בפרוטוקול צריכות להתבצע ב-37 °C (50 °F). מגבלה נוספת של שיטות ההחצפה הנידונות במאמר הנוכחי היא שהבועות אינן בסביבה של שדה חופשי, שכן מיקרו-בועות יצופו מתחת לממברנה של מחזיק הדגימה. יתר על כן, יש הטיית בחירה בעת הדמיה מיקרו-נבלים בודדים. עם זאת, ביצוע ניסויים חוזרים ונשנים על בועות בודדות מאפשר לחקור את ההשפעה של גודל והסרה של הגורם מבלבל - התפלגות הגודל. אם ניתן להבין את תגובת הבועה כפונקציה בגודל בעוד הריכוז אינו גבוה מדי כדי למנוע אינטראקציות בועת בועה, ניתן לחשב את התגובה של כל אוכלוסיית בועה שרירותית. לבסוף, הן שיטות מיקרוסקופיה של שדה בהיר והן שיטות מיקרוסקופיות פלואורסצנטיות מספקות תובנה על מיקרו-חלוקים מפותלים בתמונה דו-ממדית (דו-ממדית). אם שאלת המחקר דורשת יותר מהדמיה דו-ממדית, ניתן לפתור את אופן הפעולה התלת-ממדי של הבועות על-ידי שילוב ההתקנה המתוארת בפרוטוקול עם הגדרת תצוגה צדדית להדמיה כפולה55.
שיטה חלופית לחקר מיקרו-נבלים היא אפיון אקוסטי56. עם זאת, מדידת ההד של microbubble יחיד דורש איתור ובידוד microbubble יחיד בתוך קרן אולטרסאונד56, אשר מציב אתגר בדרך כלל להתמודד על ידי שימוש בצינור צר או פינצטה אופטית או אקוסטית57,58. כדי להגדיל בועות אקוסטית, microbubbles יכול להיות סבון במשטר פיזור גיאומטרי בתדרים גבוהים בהרבה מתדר התהודה שלהם, אשר אינו גורם תנודות microbubble נפחי59. השימוש ב"מצלמה אקוסטית " היא שיטה כזו לדמיין את הדינמיקה הרדיאלית של מיקרו-בועות בודדות בתגובה לאולטרסאונד, שבה נעשה שימוש בבדיקת אולטרסאונד בתדר גבוה כדי לקבוע את התגובה הרדיאלית של הבועה לגל נהיגה בתדר נמוך60. החיסרון של שיטה זו הוא כי זה יכול לשמש רק כדי לקבוע את השינוי היחסי של רדיוס microbubble; לפיכך, דרושה שיטה אחרת כדי לקבוע את רדיוס הבועה המוחלט, למשל, באמצעות הדמיה אופטית61,62. החיסרון של שיטות שבהן microbubbles חשופים אולטרסאונד בתדרים גבוהים יותר מאשר תדירות התהודה שלהם הוא כי בתדרים גבוהים כאלה, עומק החדירה הוא ירד59, הגבלת השימושיות עבור יישומי vivo. צורות אחרות של מיקרוסקופיה עשויות לשמש גם לחקר מיקרו-חלוקים כגון סריקת מיקרוסקופיית אלקטרונים, מיקרוסקופיה של כוח אטומי ומיקרוסקופיה אלקטרונית שידור63. הרזולוציה המרחבית-זמנית ברת השגה של טכניקות מיקרוסקופיות חלופיות אלה, עם זאת, היא בדרך כלל מוגבלת יותר, וטכניקות אלה יש את החיסרון כי הדמיה מבוצעת לפני או אחרי חשיפה אולטרסאונד על ידי ניתוח off-line ובדרך כלל להציג תפוקה נמוכה63. חלופה נוספת היא להשתמש בשיטת פיזור אור, אשר ניתן להשתמש בה כדי לחקור דינמיקה רדיאלית של microbubbles יחיד בזמן אמת, אבל יש יחס אות לרעש נמוך בהשוואה לשיטות פיזור אקוסטי64.
מיקרוסקופיה תוך-ויאלית בזמן אמת במהלך חשיפה לאולטרסאונד היא שיטה רבת עוצמה לרכישת תובנה חדשה על כלי היתוך, התנהגות של microbubbles, חלקיקים, או מולקולות אחרות (כגון dextran במקרה זה) במהלך חשיפה אולטרסאונד. מגבלה כללית בעת ביצוע מיקרוסקופיה תוך-וינטלית בזמן אמת היא שרק שטח קטן של הרקמה הוא בתמונה, ועומק החדירה של האור לרקמה מוגבל. אם כלי הדמיה מכילים מעט מאוד מיקרו-יבלים ו/או חלקיקים בתחום הראייה, ניתן להשיג מעט או ללא מידע על התנהגות הננו-חלקיקים וההפצה. בנוסף, בגלל שדה הראייה המוגבל, יישור נכון בין נתיבי האור לנתיבים אולטרסאונד הוא קריטי. אם לחץ האולטרסאונד גבוה מספיק כדי לגרום להרס בועה, חשוב גם לבחור תדירות חזרה דופק המאפשר בועות טריות reperfuse לתוך שדה הראייה בין פולסים אולטרסאונד. יתר על כן, כמו אולטרסאונד ישתקף מזכוכית הכיסוי בתא החלון ואת המטרה, הצבת המתמר בזווית חשוב להפחית השתקפויות כדי למנוע היווצרות של גלים עומדים, אשר מעוותים את שדה הלחץ מכויל. בעיה מעשית נוספת היא כי ההתקנה צריכה להיות מספיק מקום כדי להרכיב את מתמר אולטרסאונד waveguide מעל או מתחת למטרה במערך המיקרוסקופ. הגידולים בתא החלון הגב יהיה עובי מוגבל בשל תא confining ואת הפתק כיסוי; עם זאת, במידת הצורך, ניתן להשתמש בדגמים אחרים. דוגמאות הן גידולים בגלגלי העור, למשל, בפנקס השומן הממארי65 או הדמיה תוך-וינטלית בבטן של גידולים באיברים השונים66. גידולים כאלה יכולים לגדול באופן אורתופי במיקרו-סביבה המתאימה, וככאלה, מציגים מקרה רלוונטי יותר מבחינה קלינית.
השיטות המתוארות בעבודה זו מאירות את הפוטנציאל של microbubbles תווית פלואורסצנטית ללמוד את היסודות של יישומי משלוח סמים באמצעות בועות ואולטרסאונד. שילוב זה של שיטות מיקרוסקופיה מספק תובנה רבת ערך על תגובת microbubble לאינסונציה של אולטרסאונד ומרחב הפרמטר האקוסטי הקשור לה ומציג תצוגה ברורה של התנהגות המיקרו-חלוק והמטען על פני טווח רלוונטי של סולמות זמן ואורך.
Disclosures
המחברים מצהירים שאין ניגוד אינטרסים.
Materials
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
References
- Szabo, T. L. . Diagnostic ultrasound imaging: inside out. , (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197 (2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E., Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). , 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. . Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8 (2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -. N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103 (2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, &. #. 2. 2. 1. ;., et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876 (2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. . Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115 (2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103 (2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911 (2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501 (2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved