Method Article
Metodi di microscopia multi-timescale per la caratterizzazione di microbolle marcate fluorescenti per il rilascio di farmaci attivati da ultrasuoni
In questo articolo
Riepilogo
I protocolli presentati possono essere utilizzati per caratterizzare la risposta di microbolle marcate fluorescenti progettate per applicazioni di somministrazione di farmaci attivate da ultrasuoni, compresi i loro meccanismi di attivazione e i loro bioeffetti. Questo documento copre una serie di tecniche di microscopia in vitro e in vivo eseguite per catturare la lunghezza e le tempistiche pertinenti.
Abstract
Gli agenti di contrasto a microbolle sono molto promettenti per le applicazioni di somministrazione di farmaci con ultrasuoni. L'incapsulamento di farmaci in nanoparticelle riduce la tossicità sistemica e aumenta il tempo di circolazione dei farmaci. In un nuovo approccio alla somministrazione di farmaci assistita da microbolle, le nanoparticelle sono incorporate in o su gusci di microbolle, consentendo il rilascio locale e innescato del carico utile della nanoparticella con ultrasuoni. Una conoscenza approfondita dei meccanismi di rilascio all'interno del vasto spazio dei parametri a ultrasuoni è fondamentale per un rilascio efficiente e controllato. Questo insieme di protocolli presentati è applicabile alle microbolle con un guscio contenente un'etichetta fluorescente. Qui, l'attenzione si concentra sulle microbolle caricate con nanoparticelle polimeriche poli (2-etil-butilici cianoacrilato), drogate con un colorante rosso nilo modificato. Le particelle sono fissate all'interno di un guscio di caseina denaturato. Le microbolle sono prodotte da una vigorosa agitazione, formando una dispersione di gas perfluoropropano nella fase liquida contenente caseina e nanoparticelle, dopo di che il guscio di microbolle si autoassembla. Una varietà di tecniche di microscopia sono necessarie per caratterizzare le microbolle stabilizzate con nanoparticelle in tutte le scale temporali rilevanti del processo di rilascio delle nanoparticelle. La fluorescenza delle nanoparticelle consente l'imaging confocale di singole microbolle, rivelando la distribuzione delle particelle all'interno del guscio. L'imaging in vitro ad altissima velocità utilizzando la microscopia a campo luminoso a 10 milioni di fotogrammi al secondo fornisce informazioni sulla dinamica delle bolle in risposta all'insonazione ad ultrasuoni. Infine, il rilascio di nanoparticelle dal guscio della bolla viene visualizzato al meglio mediante microscopia a fluorescenza, eseguita a 500.000 fotogrammi al secondo. Per caratterizzare la somministrazione di farmaci in vivo, il rilascio innescato di nanoparticelle all'interno della vascolarizzazione e il loro stravaso oltre lo strato endoteliale viene studiato utilizzando la microscopia intravitale in tumori impiantati nelle camere delle finestre dorsali della pelle, in un arco di tempo di diversi minuti. La combinazione di queste tecniche di caratterizzazione complementari fornisce una visione unica del comportamento delle microbolle e del loro rilascio di carico utile in una gamma di scale temporali e di lunghezza, sia in vitro che in vivo.
Introduzione
L'ecografia è la tecnica di imaging medico più utilizzata. È non invasivo, veloce, sicuro, economico e portatile1,2,3. Tuttavia, il sangue è uno scarso scatterer di ultrasuoni e il contrasto del pool sanguigno può essere migliorato da un'iniezione endovenosa di agenti di contrasto ad ultrasuoni3. Questo contrasto potenziato tra pool sanguigno consente la quantificazione della perfusione d'organo a fini diagnostici, ad esempio nella rilevazione della malattia coronarica4 e della malattia epatica metastatica5. In effetti, la vascolarizzazione tumorale ha dimostrato di essere un importante fattore prognostico6. Un importante sforzo di ricerca è ora diretto verso l'imaging molecolare mirato assistito da microbolle e gli agenti di contrasto su misura per uso terapeutico.
I mezzi di contrasto ad ultrasuoni disponibili in commercio consistono tipicamente in una sospensione di microbolle rivestite7,8 con diametri che vanno da 1 μm a 10 μm9. Poiché le microbolle con mezzo di contrasto ad ultrasuoni sono leggermente più piccole dei globuli rossi7, le microbolle possono raggiungere in modo sicuro anche i capillari più piccoli senza creare un'occlusione3. Le microbolle hanno un coefficiente di retrodiffusione ad ultrasuoni notevolmente aumentato rispetto al tessuto10, a causa del loro nucleo di gas comprimibile11. Inoltre, l'eco della microbolla è altamente non lineare, cioè il suo spettro contiene armoniche e subarmoniche della frequenza di guida. Inoltre, la forza dell'eco dipende fortemente dalla risposta risonante della bolla12. Mentre il tessuto si disperde solo linearmente, un piccolo numero di microbolle è sufficiente per ottenere un'elevata sensibilità di rilevamento nell'imaging armonico13,14. Questa generazione di contrasto non lineare può anche essere abbastanza forte da tracciare singole bolle nel corpo15.
Il guscio del mezzo di contrasto ad ultrasuoni stabilizza le bolle contro la dissoluzione e la coalescenza, aumentando così il loro tempo di circolazione nel pool sanguigno16. Il guscio può essere costituito da lipidi, polimeri o proteine denaturate3,8. Diminuisce la tensione interfacciale, limitando così l'effetto della dissoluzione guidata dalla pressione di Laplace17 e crea una barriera resistiva contro la diffusione del gas18. Per aumentare ulteriormente la stabilità, le microbolle di contrasto sono tipicamente riempite con un gas ad alto peso molecolare con bassa solubilità nel sangue11. Il guscio di microbolle cambia drasticamente la risposta delle microbolle all'insonazione ad ultrasuoni11. Le bolle di gas non rivestite hanno una frequenza di risonanza caratteristica che è inversamente proporzionale alla loro dimensione e l'aggiunta di un rivestimento lipidico aumenta la frequenza di risonanza rispetto a quella di un buble non rivestito a causa della rigidità intrinseca del guscio3. Inoltre, il guscio dissipa energia attraverso la viscosità dilatazionale, che costituisce la fonte dominante di smorzamento per le bolle rivestite3. Il guscio stabilizzante ha l'ulteriore vantaggio di poter essere funzionalizzato, ad esempio legando i ligandi di puntamento alla superficie delle microbolle. Questo targeting consente molte applicazioni per queste bolle e, in particolare, l'imaging molecolare con ultrasuoni14,19.
Gli agenti di contrasto a microbolle sono molto promettenti per le applicazioni di somministrazione di farmaci con ultrasuoni. Le microbolle oscillanti nel confinamento di un vaso sanguigno possono causare microstreaming e tensioni locali normali e di taglio sulla parete capillare3. A pressioni acustiche elevate, grandi oscillazioni di ampiezza possono portare al collasso di microbolle in un processo violento chiamato cavitazione inerziale, che, a sua volta, può portare alla rottura o all'invaginazione del vaso sanguigno20. Questi fenomeni violenti possono indurre bioeffetti come la sonopermeazione21, migliorando lo stravaso di farmaci terapeutici nell'interstizio attraverso la parete endoteliale, sia paracellulare che transcellulare. Può anche migliorare la penetrazione degli agenti terapeutici attraverso la matrice extracellulare dei tumori ricchi di stroma21,22 e dei biofilm23,24, sebbene questo meccanismo sia ancora poco compreso26.
La somministrazione di farmaci mediata da ultrasuoni ha mostrato risultati promettenti sia preclinicamente27,28 che in studi clinici22. Inoltre, se utilizzate con ultrasuoni a frequenza relativamente bassa (~1 MHz), è stato riportato che le microbolle aumentano localmente e transitoriamente la permeabilità della barriera emato-encefalica, consentendo così ai farmaci di entrare nel parenchima cerebrale, sia in studi preclinici che clinici29,30,31,32,33,34.
Esistono generalmente due approcci alla somministrazione di farmaci mediata dagli ultrasuoni: il materiale terapeutico può essere co-somministrato con le bolle, oppure può essere attaccato o caricato nel guscio della bolla28,35,36. Il secondo approccio si è dimostrato più efficiente in termini di somministrazione dei farmaci37. Le microbolle possono essere caricate con farmaci o materiale genetico incapsulato in nanoparticelle (liposomi o nanocostrutture polimeriche) attaccate al guscio o incorporate direttamente nel guscio di microbolle35,36. Le microbolle caricate con nanoparticelle possono essere attivate da ultrasuoni (focalizzati) per rilasciare localmente il carico utile della nanoparticella28,33,38,39,40. Se una tale microbolla è in contatto diretto con una cellula, è stato dimostrato in vitro che il carico utile può anche essere depositato sulla membrana citoplasmatica cellulare in un processo chiamato sonoprinting34,35.
Lo spazio dei parametri ecografici per l'insonazione delle microbolle è ampio e le condizioni biologiche in vivo aggiungono ulteriore complessità. Pertanto, la combinazione di ultrasuoni focalizzati e microbolle caricate con nanoparticelle rappresenta una sfida nel campo delle terapie mirate.
Lo scopo di questo lavoro è quello di fornire protocolli che possano essere utilizzati per visualizzare, in dettaglio, la risposta delle microbolle in funzione dei parametri ecografici e per studiare i meccanismi che portano alla rottura del guscio e al successivo rilascio del materiale del guscio marcato fluorescentemente. Questo insieme di protocolli è applicabile alle microbolle con gusci che contengono un colorante fluorescente. La Figura 1 mostra una rappresentazione schematica delle microbolle stabilizzate con nanoparticelle e proteine polimeriche sviluppate presso SINTEF (Trondheim, Norvegia). Queste bolle sono riempite con gas perfluoropropano (C3F8) e le nanoparticelle che stabilizzano il guscio contengono NR668, che è un derivato lipofilo del colorante fluorescente rosso nilo38,43. Le nanoparticelle sono costituite da poli(2-etil-butilcianoacrilato) (PEBCA) e sono PEGilate. La funzionalizzazione con glicole polietilenico (PEG) riduce l'opsonizzazione e la fagocitosi da parte del sistema fagocitario mononucleato, estendendo così il tempo di circolazione14,44. Di conseguenza, la PEGilazione aumenta la quantità di nanoparticelle che raggiungono il sito bersaglio, migliorando così l'efficacia del trattamento16. La Figura 2 illustra come l'uso di quattro metodi di microscopia consenta ai ricercatori di coprire tutte le scale di tempo e lunghezza rilevanti. Va notato che la risoluzione spaziale raggiungibile in microscopia ottica è determinata dal limite di diffrazione, che dipende dalla lunghezza d'onda della luce e dall'apertura numerica (NA) dell'obiettivo e da quella della sorgente di illuminazione dell'oggetto45. Per i sistemi in questione, il limite di risoluzione ottica è in genere di 200 nm. Inoltre, la microscopia intravitale può essere utilizzata per l'immagine a livello subcellulare46. Per le microbolle stabilizzate con nanoparticelle e proteine utilizzate in questo lavoro, la scala di lunghezza minima rilevante per la microscopia intravitale è la dimensione dei piccoli capillari (≥10 μm). Gli esperimenti di imaging ottico ad alta velocità in vitro (10 milioni di fotogrammi al secondo) e di imaging a fluorescenza ad alta velocità (500.000 fotogrammi al secondo) sono descritti per singole microbolle. L'imaging a campo luminoso ad alta velocità su scale temporali di nanosecondi è adatto per studiare la dinamica radiale risolta nel tempo delle bolle vibranti. Al contrario, la microscopia a fluorescenza ad alta velocità consente la visualizzazione diretta del rilascio delle nanoparticelle marcate fluorescentemente. Inoltre, la struttura del guscio di microbolle può essere studiata utilizzando la microscopia confocale tridimensionale (3D) Z-stack e la microscopia elettronica a scansione (il protocollo per quest'ultimo non è incluso nel lavoro attuale). La microscopia intravitale consiste nell'utilizzare la microscopia multifotonica per fotografare i tumori che crescono nelle camere delle finestre dorsali per fornire informazioni in tempo reale sul flusso sanguigno locale e sul destino delle nanoparticelle marcate fluorescentemente in vivo47. La combinazione di questi metodi di microscopia fornisce in definitiva una visione dettagliata del comportamento degli agenti di microbolle terapeutici in risposta agli ultrasuoni, sia in vitro che in vivo.
Protocollo
NOTA: Tutte le procedure sperimentali sono state approvate dalle autorità norvegesi per la ricerca sugli animali. I dettagli dei materiali utilizzati nel protocollo sono disponibili nella Tabella dei materiali.
1. Produzione di microbolle
NOTA: In questo lavoro, le microbolle di interesse sono microbolle stabilizzate con proteine e nanoparticelle, per le quali il protocollo di produzione è stato descritto in precedenza28,33,48. Pertanto, il protocollo di fabbricazione è stato brevemente riassunto qui.
- In primo luogo, utilizzando una pipetta, mescolare acqua ultrapura con lo 0,5% in peso di caseina in soluzione salina tamponata con fosfato (PBS) e l'1% in peso delle nanoparticelle etichettate con lo 0,21% in peso del colorante fluorescente, NR668 (rosso Nilo modificato), in una fiala superiore a crimpare di vetro sterile (10 ml, diametro di 2 cm). Le nanoparticelle polimeriche sono preparate utilizzando il metodo di polimerizzazione mini-emulsione come descritto da Mørch et al. 38.
NOTA: Qui, il colorante funziona come un farmaco modello per consentire la visualizzazione del rilascio di nanoparticelle. Quando si lavora con la soluzione di nanoparticelle, indossare un cappotto da laboratorio, occhiali e guanti. Pulire immediatamente eventuali fuoriuscite della soluzione di nanoparticelle con acetone al 100%. - Tappare la fiala con il tappo di gomma, mescolare leggermente e posizionare la fiala in un bagno ad ultrasuoni per 10 minuti a temperatura ambiente per eliminare possibili aggregati. Posizionare uno strumento di dispersione con la punta dell'agitatore a ~0,5 cm dal fondo del flaconcino di vetro. Utilizzando una pipetta di vetro collegata al contenitore del gas, aggiungere il gas perfluoropropano allo spazio di testa del flaconcino contenente la soluzione fino a quando la soluzione inizia a gorgogliare leggermente.
NOTA: Avvolgere la pellicola autosigillante attorno alla base dello strumento di dispersione per evitare lo scivolamento del flaconcino di vetro durante l'agitazione. - Mescolare vigorosamente la soluzione a 1935 × g (24.000 giri/min con un raggio di rotazione di 3 mm) per 4 minuti utilizzando lo strumento di dispersione. Chiudere il flaconcino con il tappo di gomma e sigillare il flaconcino per un ulteriore utilizzo.
NOTA: L'agitazione intrappola il gas nel liquido. Il guscio di microbolle si autoassembla successivamente senza richiedere alcun passaggio attivo. - Conservare la caseina in eccesso e la soluzione di nanoparticelle a 4 °C e pulire lo strumento di dispersione con acetone al 100%.
2. Imaging di bolle singole
- Microscopia confocale
- Preparazione del campione
- Diluire la soluzione a bolle per visualizzare singole microbolle come segue. Introdurre un ago di sfiato (19 G-21 G) in un flaconcino superiore a crimpare di vetro contenente le microbolle prodotte seguendo la procedura descritta al paragrafo 1. Capovolgere il flaconcino per consentire alle bolle di grandi dimensioni di allontanarsi dal sigillo del flaconcino.
- Inserire un'altra punta dell'ago (19 G) di una piccola siringa (~1 mL) nel flaconcino, mentre il flaconcino è ancora capovolto. Rimuovere una piccola quantità della sospensione a bolle e trasferire il contenuto della siringa in un piccolo tubo per facilitare il pipettaggio nella fase successiva.
NOTA: Il volume della sospensione da estrarre dipende direttamente dal tipo e dalla concentrazione della sospensione a bolle. In questo caso, sono stati estratti 0,2 ml. - Utilizzando una pipetta, diluire la sospensione di microbolle (dalla sezione 1) in PBS filtrato per ottenere una concentrazione di circa 2 × 105 a 6 × 105 microbolle/mL per consentire l'imaging a bolla singola.
NOTA: A seconda del tipo di bolla, si consiglia di lavare la sospensione a bolle per rimuovere il colorante fluorescente libero. Questo è particolarmente importante con le bolle per le quali il colorante fluorescente viene infuso nel guscio. Per lavare le bolle, diluire la sospensione a bolle (ad esempio, prendendo 100 μL della soluzione a bolle in 10 mL di PBS) e centrifugarla (in genere a velocità dell'ordine di 100 × g). Infine, rimuovere il surnatante contenente le microbolle con una pipetta per ulteriori analisi. La soluzione rimanente contiene le particelle fluorescenti libere e può essere scartata. La fase di lavaggio deve essere ripetuta se necessario. - Aggiungere glicerolo alla miscela per aumentare la viscosità del mezzo ed eliminare il movimento indotto dal movimento browniano che altrimenti interferirebbe con l'imaging confocale Z-stack piuttosto lento.
NOTA: La quantità di glicerolo dipende dal tipo di bolla che viene fotografata (qui, ~ 50%). Per alcuni tipi di bolle, il glicerolo potrebbe avere un effetto negativo sulla stabilità49. Tuttavia, non è stato osservato alcun cambiamento evidente nelle bolle per circa 30 minuti sotto imaging confocale. Inoltre, il glicerolo può modificare la risposta acustica delle microbolle e può quindi essere utilizzato solo con metodi di imaging in cui le microbolle non sono insonificate. - Posizionare la sospensione di microbolle in una camera con pareti sottili per un'immagine ottimale, ad esempio una diapositiva del canale.
- Protocollo di imaging
- Accendere il microscopio confocale e selezionare un obiettivo adatto e il laser e lo scanner desiderati da utilizzare durante la microscopia confocale.
NOTA: qui, utilizzare un obiettivo di immersione in acqua 60x per una risoluzione di 0,08 μm/pixel e, a seconda delle dimensioni della bolla, visualizzare un'immagine di una regione di 256 x 256 pixel o 128 x 128 pixel. In questi esperimenti specifici, utilizzare un laser a 488 nm e uno scanner Galvano. La lunghezza d'onda di emissione dipende dal colorante fluorescente ed è tipicamente a banda larga. - Trova una microbolla in campo luminoso e passa alla microscopia confocale. Impostare i piani superiore e inferiore desiderati tra i quali verrà eseguita la scansione del microscopio confocale. Acquisire uno Z-stack per osservare la struttura 3D; utilizzare una dimensione del passo di 100 nm nella direzione Z.
- Accendere il microscopio confocale e selezionare un obiettivo adatto e il laser e lo scanner desiderati da utilizzare durante la microscopia confocale.
- Preparazione del campione
- Microscopia a campo luminoso
- Assemblaggio del sistema ottico
NOTA: una rappresentazione schematica della configurazione della microscopia a campo luminoso è mostrata nella Figura 3A. Per garantire una propagazione indisturbata degli ultrasuoni, il bagno d'acqua contiene due aperture: una per una sorgente luminosa e una per un trasduttore ad ultrasuoni. Il sistema ottico è costituito da un microscopio (modulare), una telecamera ad alta velocità e ottiche corrispondenti. Poiché il periodo delle oscillazioni delle microbolle è tipicamente dell'ordine di 1 μs (utilizzando ultrasuoni a 1 MHz), la telecamera deve essere impostata per registrare a un framerate di almeno 5 milioni di fotogrammi al secondo. Qui, la fotocamera deve essere impostata per registrare a 10 milioni di fotogrammi al secondo (256 x 400 pixel) per 256 fotogrammi (25,6 μs) per catturare tutti i dettagli della dinamica della bolla, comprese le armoniche più elevate.- Collegare un obiettivo ad immersione in acqua con un ingrandimento appropriato, una distanza di lavoro e NA al microscopio.
NOTA: è stato utilizzato un obiettivo di immersione in acqua per fornire una distanza di lavoro stabile nonostante la graduale evaporazione dell'acqua. Qui è stato selezionato un obiettivo ad immersione in acqua con un ingrandimento di 60x, una distanza di lavoro di 2 mm e un NA di 1. - Utilizzare una luce stroboscopica con una potenza di picco di almeno 1 kW per l'illuminazione e un obiettivo valvolare tra il microscopio e la fotocamera per garantire che la minor quantità possibile di luce ambientale raggiunga il sensore della telecamera ad alta velocità.
- Utilizzare una sorgente luminosa alogena dimmerabile per concentrarsi su singole microbolle e allineare il sistema ottico e acustico per l'imaging in tempo reale.
- Collegare un obiettivo ad immersione in acqua con un ingrandimento appropriato, una distanza di lavoro e NA al microscopio.
- Assemblaggio del sistema acustico
- Utilizzare un generatore di forme d'onda arbitrarie programmabili e un amplificatore di potenza (guadagno di 56 dB) per pilotare il trasduttore con una avvolgimento e una forma d'onda lisci. Collegare un oscilloscopio al generatore di forme d'onda arbitrarie per controllare il segnale. Collegare un personal computer al generatore di forme d'onda arbitrarie per programmare l'onda di pressione acustica in entrata, utilizzando uno script scritto internamente.
- Utilizzare un generatore di impulsi/ritardi come trigger principale per sincronizzare i sistemi ottici e acustici. Impostare i ritardi di innesco sul generatore di impulsi / ritardo e sul software della telecamera in modo tale che la registrazione inizi 16 μs dopo la trasmissione ad ultrasuoni per consentire all'onda ultrasonica di raggiungere le bolle. Attivare la sorgente luminosa 1,5 μs prima dell'inizio della registrazione per garantire una corretta illuminazione durante le oscillazioni della bolla (vedere la Figura 3B per il diagramma temporale).
- Scegli un trasduttore adatto con una frequenza centrale appropriata. Posizionarlo in un'apertura del bagno d'acqua, in modo che sia ad angolo rispetto all'asse ottico per ridurre al minimo i riflessi dalle membrane portacampioni e ridurre la formazione di onde stazionarie.
NOTA: Qui, un trasduttore ad immersione focalizzato a singolo elemento con una frequenza centrale di 2,25 MHz, una distanza focale di 1 "e un diametro dell'elemento di 0,75" è stato posizionato con un angolo di 35 ° rispetto all'asse ottico. La calibrazione della funzione di trasferimento deve essere eseguita utilizzando lo stesso amplificatore utilizzato nel sistema acustico. Calibrare la funzione di trasferimento dall'ampiezza di tensione all'ampiezza di pressione del trasduttore utilizzando un idrofono in fibra ottica in funzione della frequenza di trasmissione degli ultrasuoni.
- Scelta del portacampioni
- Utilizzare un portacampioni con membrane trasparenti otticamente e acusticamente e un volume sufficientemente grande da consentire l'imaging di più microbolle singole all'interno dello stesso campione.
NOTA: Qui è stata utilizzata una cassetta di coltura cellulare con un volume di 10 ml, aree di membrana di 25 cm2 e spessore della membrana di 175 μm. A causa delle riflessioni acustiche sulla membrana inferiore e dell'interferenza delle onde riflesse dall'obiettivo del microscopio e dalla membrana superiore, la pressione acustica in situ potrebbe differire da quella programmata sul generatore di forme d'onda arbitrarie. Posizionare il trasduttore ad angolo rispetto alle membrane portacampioni riduce la formazione di onde stazionarie, ma può aumentare i riflessi dalle membrane. - Assicurarsi che il campione possa essere completamente sommerso e portato a fuoco sia del trasduttore che dell'obiettivo del microscopio. Utilizzare un supporto in alluminio collegato a uno stadio di microposizionamento 3D per spostare il portacampioni in modo indipendente.
- Utilizzare un portacampioni con membrane trasparenti otticamente e acusticamente e un volume sufficientemente grande da consentire l'imaging di più microbolle singole all'interno dello stesso campione.
- Allineamento dei sistemi ottici e acustici
- Affinché la traduzione 3D allinei la configurazione, collegare il bagno d'acqua a uno stadio di traduzione XY e collegare il palco a una tavola ottica per assicurarsi che non si muova durante gli esperimenti. Quindi, riempire il bagno d'acqua con acqua e accendere la fonte di luce alogena dimmerabile. Durante l'allineamento, spostare l'obiettivo del microscopio di lato per evitare riflessioni ecografiche.
- Attaccare un idrofono ad ago (0,2 mm) al braccio portacampioni e posizionare l'idrofono dell'ago a bagnomaria, con la punta nel campo visivo dell'obiettivo. Accendere l'amplificatore e il generatore di forme d'onda arbitrarie; utilizzare impulsi singoli da 5 a 10 cicli di ultrasuoni e una frequenza di ripetizione dell'impulso di 15 Hz. Assicurarsi che la punta dell'idrofono sia centrata e messa a fuoco sull'immagine del microscopio. Spostare il serbatoio nella direzione XY e l'ago nella direzione Z fino a raggiungere l'ampiezza massima della pressione.
- Regolare la messa a fuoco del microscopio per rimettere a fuoco la punta dell'idrofono.
NOTA: questo protocollo garantisce l'allineamento tra la messa a fuoco del microscopio e la messa a fuoco del trasduttore. Non modificare la posizione del microscopio e del trasduttore dopo l'allineamento.
- Preparazione del campione
- Ripetere i passaggi da 2.1.1.1 a 2.1.1.3 per preparare la soluzione campione. Diluire la soluzione a bolle per consentire l'imaging a bolla singola ed escludere interazioni acustiche di bolle vicine.
- Aprire l'uscita del portacampioni. Utilizzando una siringa, iniettare la soluzione campione nell'altra apertura del portacampioni fino a quando non è completamente riempita. Assicurarsi che non ci siano bolle d'aria all'interno del portacampioni per evitare interazioni indesiderate con il campo ad ultrasuoni.
- Chiudere entrambe le valvole del portacampioni e posizionare il portacampioni perpendicolarmente all'asse ottico.
NOTA: mantenere il livello del portacampioni riempito per evitare lo spostamento delle bolle su un lato del portacampioni durante lo spostamento.
- Protocollo di imaging
- Programmare la frequenza di guida degli ultrasuoni desiderata e la pressione acustica nel generatore di forme d'onda arbitrarie attraverso il suddetto script scritto internamente.
NOTA: Qui, l'onda di pressione acustica era una singola raffica di 40 cicli, con un impulso conico gaussiano a 8 cicli. Le frequenze ultrasoniche utilizzate in questi esperimenti erano 1 MHz, 2 MHz o 3 MHz, con ampiezze di pressione acustica che andavano da 81 kPa a 1200 kPa. - Spostare il portacampioni contenente la soluzione campione utilizzando lo stadio XYZ per individuare singole microbolle a fuoco del microscopio. Iniziare con un campo visivo in un angolo del supporto del campione e assicurarsi che il bordo delle microbolle sia chiaramente visibile e a fuoco (vedere la Figura 3C per una vista ideale della telecamera).
- Collegare l'estremità di una fibra ottica precedentemente collegata alla luce alogena a una luce stroboscopica, in modo che l'altra estremità sia ancora collegata al bagno d'acqua. Attiva la registrazione.
- Ripetere i passaggi da 2.2.6.2 a 2.2.6.3 tutte le volte desiderate per impostazione ecografica (frequenza e pressione acustica), spostando la cassetta di coltura cellulare contenente le microbolle di almeno 2 mm (nel piano focale) dalla posizione precedente per garantire che le microbolle nel campo visivo non siano insonificate in esperimenti precedenti.
NOTA: Qui, ogni esperimento è stato ripetuto ~ 20 volte. Quando l'intero portacampione è insonificato, svuotare il portacampioni e riempirlo con una nuova soluzione campione per esperimenti successivi.
- Programmare la frequenza di guida degli ultrasuoni desiderata e la pressione acustica nel generatore di forme d'onda arbitrarie attraverso il suddetto script scritto internamente.
- Analisi dei dati
- Adottare un ambiente di programmazione per eseguire l'analisi dei dati in base alla domanda di ricerca ed eseguire il rilevamento dei bordi dopo l'elaborazione delle immagini. Utilizzando una funzione che misura le proprietà delle regioni dell'immagine, trova il centroide di una bolla e la derivata del profilo di intensità attorno a ciascuna bolla per rilevare il contorno della bolla (e quindi il raggio della bolla R). Estrarre i parametri rilevanti dal raggio nel tempo per le singole microbolle.
NOTA: Nel presente studio, è stato utilizzato un ambiente di programmazione per l'elaborazione delle immagini per binariizzare e filtrare le registrazioni di singole microbolle. Uno script interno è stato utilizzato per trovare la derivata del profilo di intensità attorno a ciascuna bolla.
- Adottare un ambiente di programmazione per eseguire l'analisi dei dati in base alla domanda di ricerca ed eseguire il rilevamento dei bordi dopo l'elaborazione delle immagini. Utilizzando una funzione che misura le proprietà delle regioni dell'immagine, trova il centroide di una bolla e la derivata del profilo di intensità attorno a ciascuna bolla per rilevare il contorno della bolla (e quindi il raggio della bolla R). Estrarre i parametri rilevanti dal raggio nel tempo per le singole microbolle.
- Assemblaggio del sistema ottico
- Microscopia a fluorescenza
- Assemblaggio del sistema ottico
- Costruire il setup per la microscopia a fluorescenza (Figura 4A), con la stessa base utilizzata nella microscopia a campo luminoso descritta nella sezione 2.2.
NOTA: La configurazione descritta al paragrafo 2.3 può essere combinata con quella descritta per la microscopia a campo luminoso nel paragrafo 2.2. La combinazione di microscopia a fluorescenza e microscopia a campo luminoso consente la visualizzazione del nucleo di gas microbollica durante l'imaging del rilascio di nanoparticelle. - Impostare la fotocamera ad alta velocità per registrare a 500.000 fotogrammi al secondo (400 x 250 pixel) per 128 fotogrammi (256 μs).
NOTA: il tempo di imaging è più lungo rispetto agli esperimenti in campo luminoso poiché l'intensità della luce è limitata nella fluorescenza e perché la scala temporale su cui si verifica la consegna delle particelle è più lunga di quella della dinamica della bolla. - Selezionare un laser con una potenza sufficientemente elevata da fornire luce sufficiente e che abbia una lunghezza d'onda di eccitazione adeguata e assicurarsi che sia accoppiato con un modulatore acusto-ottico per evitare di sbiancare il campione.
NOTA: In questo studio, un laser a onda continua da 5 W con una lunghezza d'onda di eccitazione di 532 nm è stato utilizzato per eccitare la fluorescenza delle nanoparticelle. - Posizionare uno splitter a fascio, uno specchio dicroico e un filtro notch tra il laser e l'obiettivo del microscopio per dirigere la luce di eccitazione verso il campione, consentendo al contempo all'emissione di fluorescenza di raggiungere la telecamera.
- Costruire il setup per la microscopia a fluorescenza (Figura 4A), con la stessa base utilizzata nella microscopia a campo luminoso descritta nella sezione 2.2.
- Assemblaggio del sistema acustico
- Per insonificare le microbolle, utilizzare la stessa configurazione acustica di cui al punto 2.2.2. Cambia il trasduttore in questi esperimenti specifici in un trasduttore ad immersione focalizzato a singolo elemento con una frequenza centrale di 2,25 MHz, una distanza focale di 1,88 "e un diametro dell'elemento di 1". Posizionarlo con un angolo di 35° rispetto all'asse ottico per ridurre al minimo i riflessi dalle membrane portacampioni e ridurre le formazioni di onde stazionarie.
- Allineamento dei sistemi ottici e acustici
- Ripetere i passaggi descritti nella sezione 2.2.4.
- Preparazione del campione
- Preparare la soluzione campione come descritto al punto 2.2.5.
- Protocollo di imaging
- Imposta la frequenza di guida degli ultrasuoni desiderata e l'ampiezza della pressione acustica sul generatore di forme d'onda arbitrarie attraverso il suddetto script scritto internamente.
NOTA: Qui, l'onda di pressione acustica è stata programmata per essere una singola raffica di ultrasuoni di 140 cicli, con un impulso rastremato gaussiano a 10 cicli. Sono generalmente necessarie durate di impulso più lunghe per indurre bio-effetti rispetto a quelli necessari per studiare la dinamica delle bolle. Le frequenze ultrasoniche utilizzate in questi esperimenti erano 1 MHz, 2 MHz o 3 MHz, con ampiezze di pressione acustica che andavano da 81 kPa a 1200 kPa. - Sul generatore di impulsi/ritardo, impostare il ritardo di trigger per il laser per l'eccitazione fluorescente delle nanoparticelle dalle microbolle durante la registrazione.
NOTA: Per questi esperimenti specifici, il ritardo di innesco era compreso tra 20 μs e 170 μs per una durata totale di 150 μs. Il diagramma temporale è mostrato nella Figura 4B. - Spostare il portacampioni contenente la soluzione campione utilizzando lo stadio XYZ per individuare singole microbolle a fuoco del microscopio. Iniziare con un campo visivo di un angolo del portacampioni; vedere la Figura 4C per una vista ideale della telecamera in cui l'interfaccia delle microbolle è chiaramente visibile e a fuoco. Attiva la registrazione.
- Ripetere il passo 2.3.5.3 tutte le volte desiderate per impostazione ecografica (frequenza e pressione acustica), spostando la cassetta di coltura cellulare contenente le microbolle di almeno 2 mm (nel piano ottico) dalla posizione precedente per garantire che le microbolle nel campo visivo non vengano sonicate in esperimenti precedenti.
NOTA: In questo studio, ogni esperimento è stato ripetuto ~ 10-20x. Quando l'intero portacampione è insonificato, svuotare il portacampioni e riempirlo con una nuova soluzione campione per esperimenti successivi. La distanza per spostare il portacampioni tra gli esperimenti dipende dalla dimensione del fascio acustico.
- Imposta la frequenza di guida degli ultrasuoni desiderata e l'ampiezza della pressione acustica sul generatore di forme d'onda arbitrarie attraverso il suddetto script scritto internamente.
- Analisi dei dati
- Analizzare le registrazioni al microscopio a fluorescenza in base alla domanda di ricerca. Per ogni microbolla, determinare visivamente se si è verificata la consegna delle nanoparticelle negli esperimenti di microscopia a fluorescenza. Se si osserva il distacco e la deposizione delle nanoparticelle dal nucleo del gas sulla membrana portacampione per una singola microbolla, inserire manualmente che la consegna è avvenuta nell'ambiente di programmazione.
- Assemblaggio del sistema ottico
3. Microscopia intravitale
- Chirurgia della camera della finestra della piega dorsale della pelle (descritta in precedenza26,47,50)
- Acclimatare gli animali per una settimana prima di posizionare le camere della finestra. Sebbene sia i topi femmina che quelli maschi possano essere utilizzati e l'età non sia importante, assicurarsi che il peso dei topi sia di almeno 22-24 g in modo che la pelle sia sufficientemente flessibile.
- Eseguire l'intervento chirurgico in anestesia generale con trattamento analgesico intraoperatorio e postoperatorio. Anestetizzare l'animale mediante iniezione sottocutanea di fentanil (0,05 mg/kg)/medetomidina (0,5 mg/kg)/midazolam (5 mg/kg)/acqua (2:1:2:5) alla dose di 0,1 ml per 10 g di peso. Utilizzare una piastra riscaldante o una lampada riscaldante per mantenere la temperatura corporea dell'animale.
- Tirare delicatamente sul doppio strato di pelle sul retro dell'animale in modo che la pelle sia inserita tra due telai simmetrici in poliossimetilene della camera della finestra. Fissare la camera posizionando due viti che si estendono attraverso lo strato a doppia pelle e suturando lungo il bordo superiore della camera.
- Rimuovere la pelle all'interno della cornice circolare della camera su un lato della piega della pelle. Posizionare un vetro di copertura con un diametro di 11,8 mm all'interno del telaio in cui la pelle viene rimossa per formare una finestra nel tessuto.
- Utilizzare un'iniezione sottocutanea di atipemazolo (2,5 mg/kg), flumazenil (0,5 mg/kg) e acqua (1:1:8) alla dose di 0,1 ml per 10 g come antidoto per terminare l'anestesia. Metti l'animale in una griglia di recupero riscaldata durante la notte. Integrare l'acqua per gli animali con 25 mg / mL di enrofloxacina per prevenire l'infezione nel sito chirurgico.
- Creazione di modelli tumorali
- Mantenere le cellule tumorali a 37 °C e in un'atmosfera di CO2 al 5% in un terreno di coltura appropriato integrato con il 10% di siero bovino fetale e 100 U/mL di penicillina e 100 mg/mL di streptomicina.
NOTA: La linea cellulare dell'osteosarcoma umano (OHS) è stata utilizzata in questo protocollo, ma possono essere utilizzate anche altre linee cellulari. - Il giorno dopo il passo 3.1.5, anestetizzare l'animale con isoflurano (5% durante l'induzione e 1-2% durante il mantenimento) per un paio di minuti. Rimuovere il vetro di copertura, applicare 5 × 106 cellule tumorali in 30 μL di terreno di coltura cellulare e sostituire il vetro di copertura.
- Lasciare che i tumori crescano per 2 settimane prima dell'imaging e monitorare il peso e lo stato di salute degli animali almeno 3 volte a settimana durante questo periodo.
- Mantenere le cellule tumorali a 37 °C e in un'atmosfera di CO2 al 5% in un terreno di coltura appropriato integrato con il 10% di siero bovino fetale e 100 U/mL di penicillina e 100 mg/mL di streptomicina.
- Assemblaggio del sistema ottico
- Eseguire l'imaging intravitale durante il trattamento ecografico (come descritto nel lavoro precedente26) con un microscopio adatto e obiettivo a seconda della questione di ricerca in gioco. Vedere la Figura 5A per una rappresentazione schematica della configurazione sperimentale.
NOTA: Per questo specifico esperimento è stato utilizzato un microscopio multifotone, dotato di un obiettivo di immersione in acqua 20x (NA di 1,0 e distanza di lavoro di 2 mm) e di un laser pulsato. Le immagini sono state acquisite in modalità di scansione risonante a 31 fotogrammi al secondo (512 x 512 pixel) con un campo visivo di 400 x 400 μm2. La lunghezza d'onda di eccitazione era di 790 nm. I filtri davanti ai due rivelatori di fosfuro di arseniuro di gallio erano long-pass 590 nm e band-pass 525/50 nm per il rilevamento della fluorescenza.
- Eseguire l'imaging intravitale durante il trattamento ecografico (come descritto nel lavoro precedente26) con un microscopio adatto e obiettivo a seconda della questione di ricerca in gioco. Vedere la Figura 5A per una rappresentazione schematica della configurazione sperimentale.
- Assemblaggio del sistema acustico
- Montare un adeguato trasduttore ad ultrasuoni in una guida d'onda (realizzata su misura) posizionata sotto l'obiettivo con un angolo di 45° rispetto all'asse ottico per ridurre al minimo i riflessi dal vetro di copertura della camera della finestra dorsale skinfold e per ridurre le formazioni di onde stazionarie. Riempire la guida d'onda con acqua distillata e degassata. Applicare il gel di accoppiamento ad ultrasuoni sulla parte superiore della guida d'onda.
- Allineamento dei sistemi ottici e acustici
- Allineare l'asse ottico con il fuoco dell'ecografia. Posizionare un idrofono in fibra ottica al centro dell'obiettivo. Quindi, accendere l'amplificatore e il generatore di forme d'onda arbitrarie per eccitare il trasduttore con brevi raffiche (5-10 cicli) con una frequenza di ripetizione degli impulsi di 100 Hz e spostare il trasduttore ad ultrasuoni nella posizione in cui viene rilevata la pressione più alta con il segnale idrofonico sull'oscilloscopio.
NOTA: non modificare la posizione del trasduttore dopo l'allineamento.
- Allineare l'asse ottico con il fuoco dell'ecografia. Posizionare un idrofono in fibra ottica al centro dell'obiettivo. Quindi, accendere l'amplificatore e il generatore di forme d'onda arbitrarie per eccitare il trasduttore con brevi raffiche (5-10 cicli) con una frequenza di ripetizione degli impulsi di 100 Hz e spostare il trasduttore ad ultrasuoni nella posizione in cui viene rilevata la pressione più alta con il segnale idrofonico sull'oscilloscopio.
- Protocollo di imaging
- Posizionare il supporto per animali riscaldato (progettato su misura) collegato a uno stadio di posizionamento XY tra la guida d'onda e l'obiettivo e aggiungere più gel di accoppiamento. Anestetizzare l'animale e posizionare un catetere della vena della coda. Posizionare il mouse nel supporto riscaldato e fissare la camera della finestra nel supporto. Aggiungere una goccia d'acqua sulla parte superiore del coperchio scivolare nella camera della finestra e spostare l'obiettivo in posizione per visualizzare il tessuto tumorale.
-
La Figura 5B mostra il diagramma temporale degli esperimenti che raffigura l'ordine degli eventi. Iniettare 2 MDa destrano marcati con fluorescenza per via endovenosa (30 μL, 4 mg/mL diluiti in soluzione salina) per visualizzare la vascolarizzazione e spostare il mouse utilizzando lo stadio di traduzione XY per trovare una posizione con vasi sanguigni adatti. Registrare le immagini di base prima del trattamento ad ultrasuoni. Regola la frequenza dei fotogrammi, il campo visivo e la durata della registrazione in base alla domanda di ricerca e alle specifiche del microscopio e dei coloranti da visualizzare.
NOTA: In questi esperimenti, sono stati registrati 31 fotogrammi al secondo con un campo visivo di 400 x 400 μm2 e l'imaging è stato eseguito continuamente per 5 minuti. - Impostare la frequenza di guida degli ultrasuoni desiderata, la lunghezza dell'impulso e l'ampiezza della pressione acustica sul generatore di forme d'onda arbitrarie.
NOTA: per questi esperimenti, è stata utilizzata una frequenza di 1 MHz con una lunghezza dell'impulso di 10 ms e ampiezze di pressione negativa di picco comprese tra 0,2 MPa e 0,8 MPa. Una frequenza di ripetizione degli impulsi di 0,5 Hz o 0,1 Hz è stata utilizzata per consentire alle nuove microbolle di riperfondersi nell'area trattata tra gli impulsi ad ultrasuoni. - Iniettare microbolle da 50 μL (da 2 × 108 a 5 × 108 microbolle/ml) per via endovenosa e applicare ultrasuoni durante l'imaging, come descritto in26.
- Analisi dei dati
- A seconda della domanda di ricerca, analizzare le immagini con un software di elaborazione delle immagini (open source) e un ambiente di programmazione, come descritto in26, per determinare i parametri dei vasi sanguigni (diametro, ramificazione, velocità del flusso e direzione), l'accumulo di nanoparticelle nei vasi e la cinetica e la profondità di penetrazione dello stravaso di destrano e nanoparticelle nel tessuto tumorale.
Risultati
Le microbolle, prodotte come descritto nel protocollo, sono state analizzate utilizzando vari metodi di microscopia e in varie scale temporali.
La fluorescenza delle nanoparticelle in microscopia confocale (Figura 6A) indica che il guscio ha una distribuzione delle particelle non uniforme. Altri metodi di microscopia possono essere utilizzati per la caratterizzazione delle bolle. Ad esempio, la Figura 6B mostra la struttura complessiva della microbolla utilizzando la microscopia elettronica a scansione, come presentato in lavori precedenti34.
La dinamica radiale e il comportamento fenomenologico delle bolle possono essere studiati utilizzando il metodo di microscopia a campo luminoso in vitro descritto in cui le microbolle sono state fotografate a 10 milioni di fotogrammi al secondo. Il raggio delle singole microbolle è stato estratto nel tempo utilizzando uno script scritto internamente. Un esempio di tale risposta radiale è mostrato nella Figura 7.
Una sequenza di immagini della tipica consegna di nanoparticelle di successo, come descritto nella sezione 2.3.6, è mostrata nella Figura 8A. Le nanoparticelle incorporate nel guscio della microbolla possono essere viste illuminarsi a causa della fluorescenza quando la luce laser raggiunge la bolla. Guidate dall'insonazione ad ultrasuoni, le nanoparticelle fluorescenti si staccano dal nucleo gassoso delle microbolle e si depositano sulla membrana del portacampioni. Infine, il laser viene spento e le nanoparticelle fluorescenti non sono più eccitate. La consegna non riuscita del carico utile marcato fluorescente delle microbolle assomiglia in genere alla sequenza di immagini mostrata nella Figura 8B, in cui le nanoparticelle fluorescenti si illuminano sul guscio della microbolla che rimane intatta durante l'esposizione agli ultrasuoni.
La microscopia multifotonica intravitale in tempo reale durante gli ultrasuoni è stata utilizzata per studiare gli effetti degli ultrasuoni e delle microbolle sul comportamento delle nanoparticelle nel sangue, il miglioramento della permeabilità dei vasi sanguigni tumorali e il miglioramento della consegna delle nanoparticelle. L'estensione e la cinetica della penetrazione nella matrice extracellulare in funzione della pressione acustica, della frequenza e delle lunghezze degli impulsi possono essere caratterizzate. L'effetto del trattamento ad ultrasuoni può variare rispetto alle dimensioni e alla morfologia dei vasi e al conseguente confinamento della bolla. È possibile determinare in che modo il trattamento ecografico influisce sul flusso sanguigno e sulla direzione. Un esperimento di esempio che mostra lo stravaso di nanoparticelle nel tempo è mostrato nella Figura 9 con un indice meccanico (MI) di 0,826. I risultati della microscopia multifotonica intravitale chiariscono lo stravaso spaziale e temporale delle nanoparticelle durante l'esposizione agli ultrasuoni, il che è estremamente utile per la completa comprensione dei meccanismi alla base della somministrazione di nanoparticelle mediata da ultrasuoni e per ottimizzare tali tecnologie26.
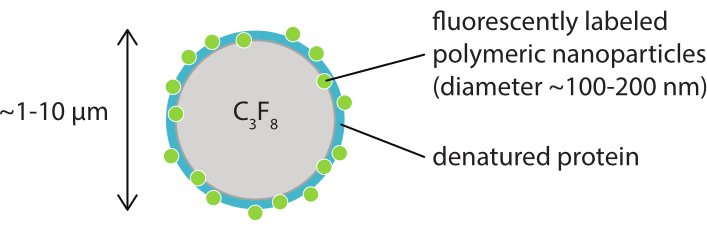
Figura 1: Rappresentazione schematica di una microbolla con un guscio di nanoparticelle polimeriche marcate fluorescentemente in caseina denaturata. Le microbolle hanno un diametro compreso tra 1 μm e 10 μm. Le nanoparticelle hanno un diametro per lo più compreso tra 100 nm e 200 nm38. Abbreviazione: C3F8 = gas perfluoropropano. Fare clic qui per visualizzare una versione più grande di questa figura.
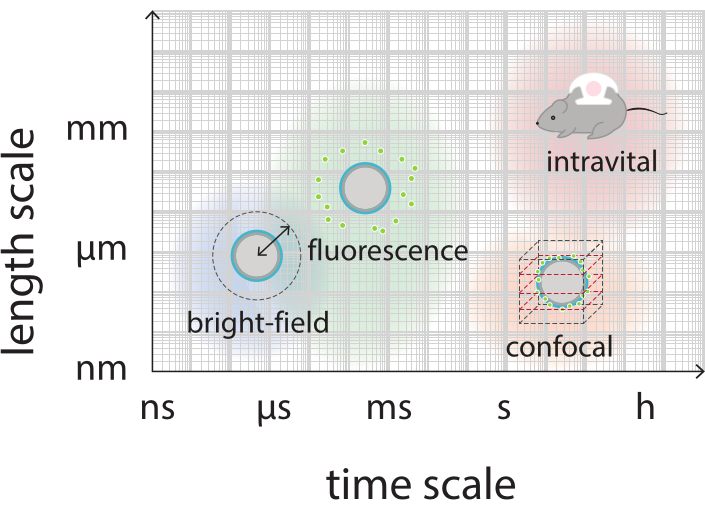
Figura 2: Panoramica schematica che mostra le scale di tempo e lunghezza rilevanti per la microscopia a campo luminoso, fluorescenza, confocale e intravitale. Fare clic qui per visualizzare una versione più ampia di questa figura.
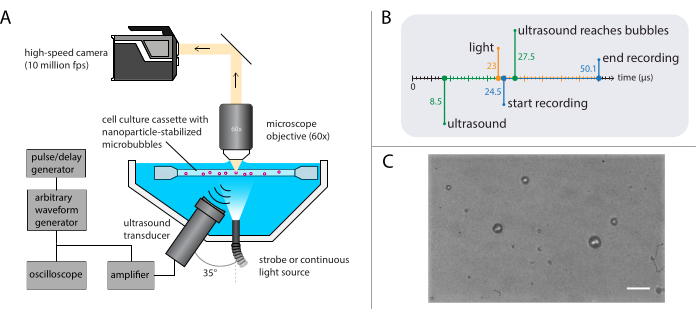
Figura 3: Rappresentazione schematica di esperimenti di microscopia a campo luminoso. (A) Configurazione sperimentale, (B) il diagramma temporale e (C) un tipico fotogramma registrato. Barra della scala in (C) = 10 μm. Abbreviazione: fps = fotogrammi al secondo. Fare clic qui per visualizzare una versione più grande di questa figura.
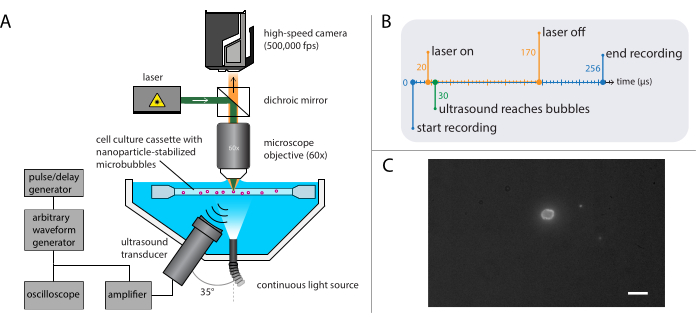
Figura 4: Rappresentazione schematica di esperimenti di microscopia a fluorescenza. (A) Configurazione sperimentale, (B) il diagramma di temporizzazione e (C) un tipico fotogramma registrato. Barra della scala in (C) = 10 μm. Abbreviazione: fps = fotogrammi al secondo. Fare clic qui per visualizzare una versione più grande di questa figura.
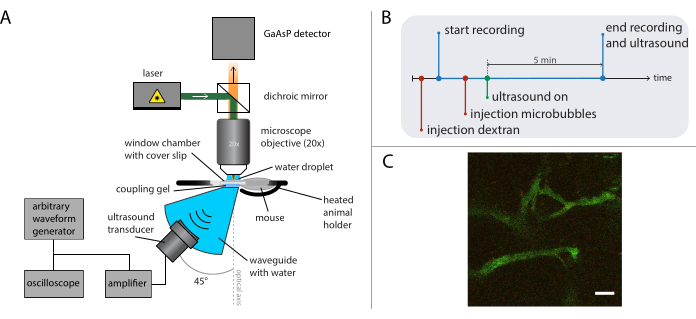
Figura 5: Rappresentazione schematica di esperimenti di microscopia intravitale. (A) Configurazione sperimentale, (B) il diagramma temporale e (C) un tipico fotogramma registrato. Barra della scala in (C) = 50 μm. Il verde corrisponde al destrano-FITC e il rosso alle nanoparticelle. Abbreviazione: GaAsP = fosfuro di arseniuro di gallio. Fare clic qui per visualizzare una versione più grande di questa figura.
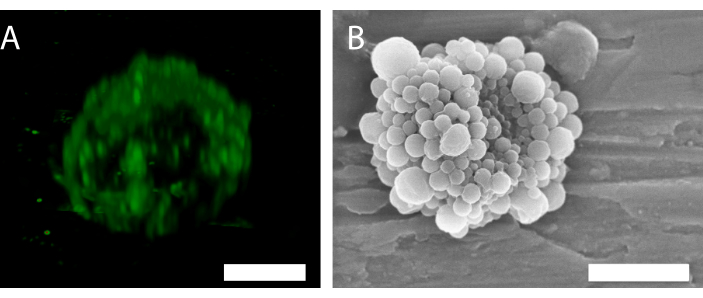
Figura 6: Struttura 3D di una singola microbolla stabilizzata con nanoparticelle e proteine. (A) Utilizzo della microscopia confocale per mostrare le nanoparticelle e (B) utilizzo di un microscopio elettronico a scansione per mostrare la struttura 3D. (B) è stato riprodotto con il permesso di34. Barra di scala in (A) = 5 μm; barra della scala in (B) = 2 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
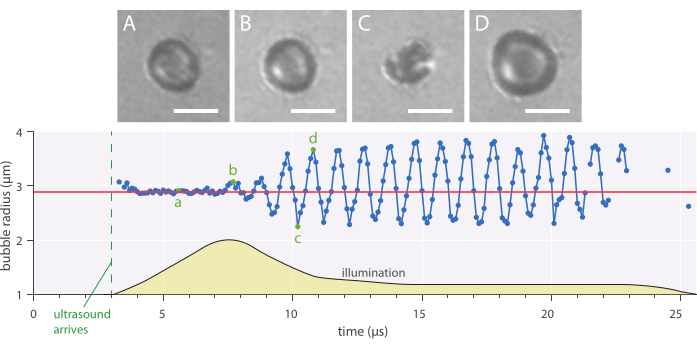
Figura 7: Oscillazioni sferiche tipiche di una microbolla stabilizzata con nanoparticelle e proteine con raggio di 2,89 μm insonificate a una frequenza ultrasonica di 1 MHz e un'ampiezza di pressione acustica di 142 kPa. (A-D) Immagini dalla registrazione ad alta velocità e dal corrispondente raggio della bolla sulla curva temporale (in basso). Barre di scala = 5 μm e la linea rossa indica il raggio iniziale. Il profilo di illuminazione (unità arbitrarie) è indicato dal giallo. L'ingrandimento è 120x. Fare clic qui per visualizzare una versione più grande di questa figura.
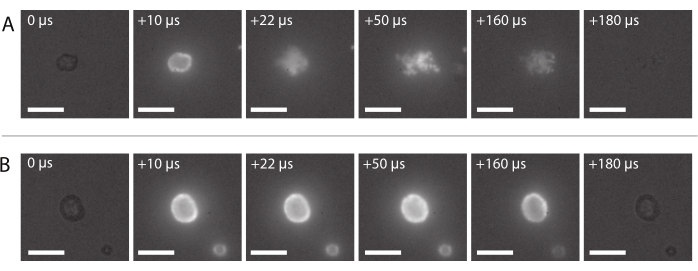
Figura 8: Sequenza di immagini dalla microscopia a fluorescenza ad alta velocità. (A) Consegna riuscita di nanoparticelle marcate fluorescentemente di una microbolla stabilizzata con nanoparticelle e proteine insonificata a una frequenza ultrasonica di 2 MHz e un'ampiezza di pressione acustica di 600 kPa. (B) Consegna infruttuosa di nanoparticelle marcate fluorescentemente di una microbolla stabilizzata con nanoparticelle e proteine insonificate a una frequenza ultrasonica di 2 MHz e un'ampiezza di pressione acustica di 210 kPa. Barre della scala = 10 μm. L'ingrandimento è 120x. Fare clic qui per visualizzare una versione più grande di questa figura.
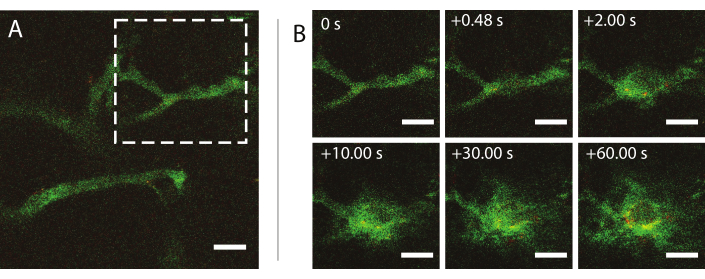
Figura 9: Microscopia intravitale dopo insonazione di microbolle stabilizzate con nanoparticelle e proteine a una frequenza ultrasonica di 1 MHz e un'ampiezza di pressione acustica di 800 kPa. (A) Nanoparticelle all'interno del vaso e (B) una sequenza di immagini dell'area indicata dal quadrato tratteggiato bianco in (A) raffigurante lo stravaso di destrano (verde) e nanoparticelle (rosso). Barre di scala = 50 μm. L'ingrandimento è 20x. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Sono stati combinati diversi metodi di microscopia ottica per ottenere informazioni sulle varie fasi della consegna delle nanoparticelle dalla superficie delle microbolle al mezzo circostante. È stata eseguita l'imaging delle oscillazioni della bolla, così come l'imaging del rilascio delle nanoparticelle dal guscio della bolla, lo stravaso e la penetrazione attraverso la matrice extracellulare dei tumori in vivo. L'imaging in vitro consente lo screening di molti parametri ecografici rispetto alle configurazioni in vivo più complesse. Il vantaggio di combinare questa gamma di modalità di imaging è l'informazione complementare che può essere ottenuta in diverse scale temporali - una caratteristica cruciale per caratterizzare e ottimizzare le microbolle per una consegna di successo e per ottenere l'efficacia terapeutica. Questo approccio è utile per comprendere i meccanismi di consegna per tutte le microbolle allo stesso modo, compresi i costrutti con nanoparticelle e farmaci marcati fluorescentemente.
I passaggi più critici nei metodi di microscopia utilizzati per studiare le singole microbolle sono i seguenti. Per la microscopia a fluorescenza, le nanoparticelle devono essere etichettate fluorescentemente per consentire la visualizzazione del rilascio di particelle. Inoltre, la soluzione campione deve essere diluita abbastanza da isolare singole microbolle per l'analisi in metodi di microscopia confocale, a campo luminoso e a fluorescenza. Inoltre, è importante scegliere una frequenza di guida ad ultrasuoni e una pressione acustica per eccitare le bolle nel modo più efficiente, vale a dire alla loro risonanza. Se la domanda di ricerca riguarda la consegna del carico utile della nanoparticella, i parametri ecografici appropriati dovrebbero far parte dell'indagine. Accanto alla risonanza, queste bolle dovrebbero anche essere guidate a o oltre la loro soglia per il rilascio di nanoparticelle, in genere ad ampiezze di pressione acustica relativamente elevate (MI > 0,3) 51. Per l'imaging al microscopio a campo luminoso, è fondamentale scegliere una telecamera ad alta velocità con un framerate sufficientemente elevato per ridurre al minimo la sfocatura del movimento ed evitare l'aliasing.
La microscopia a campo luminoso è principalmente limitata dal framerate di imaging e dall'intensità delle sorgenti luminose disponibili, poiché un framerate più elevato fornirebbe una visione più dettagliata risolta nel tempo della dinamica delle bolle, ma richiede un'illuminazione più intensa a causa di tempi di esposizione più brevi. Per studiare il rilascio di particelle in modo più dettagliato, il framerate per l'imaging a fluorescenza può, in linea di principio, essere aumentato aumentando l'intensità della luce laser. Tuttavia, l'assorbimento della luce laser ad alta intensità da parte delle microbolle marcate fluorescenti genera calore, anche con coloranti ad alta resa quantistica. Questo calore può interferire con gli esperimenti in gioco e, in casi estremi, indurre la cavitazione fototermica52. Quindi, in pratica, c'è un limite alla fluenza laser applicata. Tuttavia, l'intensa illuminazione laser può anche essere utilizzata deliberatamente per indurre il rilascio di particelle dai liposomi53. La temperatura influenza la dinamica delle bolle e la risposta agli ultrasuoni, a seconda del tipo di bolla54. Pertanto, se i metodi in vitro e intravitali devono essere confrontati obiettivamente, i metodi in vitro discussi nel protocollo devono essere eseguiti a 37 °C. Un'altra limitazione dei metodi in vitro discussi nel presente documento è che le bolle non si trovano in un ambiente a campo libero, poiché le microbolle fluttueranno sotto la membrana portacampioni. Inoltre, c'è un bias di selezione quando si visualizzano singole microbolle. Tuttavia, l'esecuzione di esperimenti ripetuti su singole bolle consente di studiare l'effetto delle dimensioni e la rimozione del fattore confondente, la distribuzione delle dimensioni. Se la risposta della bolla in funzione delle dimensioni può essere compresa mentre la concentrazione non è troppo alta per prevenire interazioni bolla-bolla, è possibile calcolare la risposta di qualsiasi popolazione di bolle arbitraria. Infine, entrambi i metodi di microscopia a campo luminoso e a fluorescenza forniscono informazioni sulle microbolle contorte in un'immagine bidimensionale (2D). Se la domanda di ricerca richiede più dell'imaging 2D, il comportamento 3D delle bolle può essere risolto combinando la configurazione descritta nel protocollo con una configurazione sideview per l'imaging multipiattaforma55.
Un metodo alternativo per studiare le microbolle è la caratterizzazione acustica56. Tuttavia, la misurazione dell'eco di una singola microbolla richiede la localizzazione e l'isolamento di una singola microbolla all'interno del fascio di ultrasuoni56, il che rappresenta una sfida tipicamente affrontata con l'uso di un tubo stretto o di pinzette ottiche o acustiche57,58. Per dimensionare le bolle acusticamente, le microbolle possono essere insonificate nel regime di scattering geometrico a frequenze molto più alte della loro frequenza di risonanza, che non induce oscillazioni volumetriche di microbolle59. L'uso di una "telecamera acustica" è un metodo per visualizzare la dinamica radiale di singole microbolle in risposta agli ultrasuoni, in cui una sonda ad ultrasuoni ad alta frequenza viene utilizzata per determinare la risposta radiale della bolla a un'onda di guida a bassa frequenza60. Lo svantaggio di questo metodo è che può essere utilizzato solo per determinare il cambiamento relativo del raggio della microbolla; quindi, è necessario un altro metodo per determinare il raggio assoluto della bolla, ad esempio attraverso l'imaging ottico61,62. Lo svantaggio dei metodi in cui le microbolle sono esposte agli ultrasuoni a frequenze superiori alla loro frequenza di risonanza è che a frequenze così elevate, la profondità di penetrazione è diminuita59, limitando l'usabilità per le applicazioni in vivo. Altre forme di microscopia possono anche essere utilizzate per studiare microbolle come la microscopia elettronica a scansione, la microscopia a forza atomica e la microscopia elettronica a trasmissione63. La risoluzione spazio-temporale raggiungibile di queste tecniche di microscopia alternative, tuttavia, è generalmente più limitata e queste tecniche hanno lo svantaggio che l'imaging viene eseguito prima o dopo l'esposizione agli ultrasuoni mediante analisi off-line e in genere presentano un basso rendimento63. Un'altra alternativa è quella di utilizzare un metodo di diffusione della luce, che può essere utilizzato per studiare la dinamica radiale di singole microbolle in tempo reale, ma ha un basso rapporto segnale/rumore rispetto ai metodi di scattering acustico64.
La microscopia intravitale in tempo reale durante l'esposizione agli ultrasuoni è un metodo potente per acquisire nuove informazioni sulla vascolarizzazione, sul comportamento di microbolle, nanoparticelle o altre molecole (come il destro in questo caso) durante l'esposizione agli ultrasuoni. Una limitazione generale quando si esegue la microscopia intravitale in tempo reale è che viene riprodotta solo una piccola area del tessuto e la profondità di penetrazione della luce nel tessuto è limitata. Se i vasi ripresi contengono pochissime microbolle e/o nanoparticelle all'interno del campo visivo, è possibile ottenere poche o nessuna informazione sul comportamento delle nanoparticelle e sullo stravaso. Inoltre, a causa del campo visivo limitato, è fondamentale un corretto allineamento tra i percorsi luminosi e ultrasonici. Se la pressione degli ultrasuoni è abbastanza alta da indurre la distruzione delle bolle, è anche importante scegliere una frequenza di ripetizione degli impulsi che consenta alle bolle fresche di riperfondersi nel campo visivo tra gli impulsi ad ultrasuoni. Inoltre, poiché gli ultrasuoni saranno riflessi dal vetro di copertura nella camera della finestra e dall'obiettivo, posizionare il trasduttore ad angolo è importante per ridurre i riflessi in modo da prevenire la formazione di onde stazionarie, che distorcono il campo di pressione calibrato. Un altro problema pratico è che la configurazione deve avere spazio sufficiente per montare il trasduttore ad ultrasuoni e la guida d'onda sopra o sotto l'obiettivo nella configurazione del microscopio. I tumori nella camera della finestra dorsale avranno uno spessore limitato a causa della camera di confinamento e dello slittamento della copertura; tuttavia, se necessario, potrebbero essere utilizzati altri modelli. Esempi sono i tumori della piega cutanea, ad esempio, nel cuscinetto di grasso mammario65 o l'imaging intravitale addominale dei tumori nei vari organi66. Tali tumori possono essere coltivati ortotopicamente nel microambiente appropriato e, come tali, presentare un caso clinicamente più rilevante.
I metodi descritti in questo lavoro illuminano il potenziale delle microbolle marcate fluorescentemente per studiare i fondamenti delle applicazioni di somministrazione di farmaci utilizzando bolle e ultrasuoni. Questa combinazione di metodi di microscopia fornisce preziose informazioni sulla risposta delle microbolle all'insonazione ad ultrasuoni e sullo spazio dei parametri acustici associato e presenta una visione chiara del comportamento della microbolla e del carico utile su un intervallo rilevante di scale di tempo e lunghezza.
Divulgazioni
Gli autori dichiarano che non vi è alcun conflitto di interessi.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
Riferimenti
- Szabo, T. L. . Diagnostic ultrasound imaging: inside out. , (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197 (2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E., Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). , 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. . Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8 (2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -. N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103 (2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, &. #. 2. 2. 1. ;., et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876 (2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. . Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115 (2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103 (2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911 (2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501 (2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon