Method Article
Métodos de microscopía a escala de tiempo múltiple para la caracterización de microburbujas marcadas con fluorescencia para la liberación de fármacos desencadenada por ultrasonido
En este artículo
Resumen
Los protocolos presentados se pueden utilizar para caracterizar la respuesta de microburbujas marcadas con fluorescencia diseñadas para aplicaciones de administración de fármacos activadas por ultrasonido, incluidos sus mecanismos de activación y sus bioefectos. Este documento cubre una gama de técnicas de microscopía in vitro e in vivo realizadas para capturar la duración y las escalas de tiempo relevantes.
Resumen
Los agentes de contraste de microburbujas son muy prometedores para aplicaciones de administración de medicamentos con ultrasonido. La encapsulación de fármacos en nanopartículas reduce la toxicidad sistémica y aumenta el tiempo de circulación de los fármacos. En un enfoque novedoso para la administración de medicamentos asistida por microburbujas, las nanopartículas se incorporan en o sobre las conchas de microburbujas, lo que permite la liberación local y desencadenada de la carga útil de nanopartículas con ultrasonido. Una comprensión profunda de los mecanismos de liberación dentro del vasto espacio de parámetros de ultrasonido es crucial para una liberación eficiente y controlada. Este conjunto de protocolos presentados es aplicable a las microburbujas con una carcasa que contiene una etiqueta fluorescente. Aquí, la atención se centra en las microburbujas cargadas con nanopartículas poliméricas poliméricas de poli(2-etil-butil cianoacrilato), dopadas con un tinte rojo del Nilo modificado. Las partículas se fijan dentro de una cáscara de caseína desnaturalizada. Las microburbujas se producen por agitación vigorosa, formando una dispersión de gas perfluoropropano en la fase líquida que contiene caseína y nanopartículas, después de lo cual la cáscara de la microburbuja se autoensambla. Se necesita una variedad de técnicas de microscopía para caracterizar las microburbujas estabilizadas con nanopartículas en todas las escalas de tiempo relevantes del proceso de liberación de nanopartículas. La fluorescencia de las nanopartículas permite obtener imágenes confocales de microburbujas individuales, revelando la distribución de partículas dentro de la cáscara. Las imágenes in vitro de ultra alta velocidad que utilizan microscopía de campo brillante a 10 millones de fotogramas por segundo proporcionan información sobre la dinámica de las burbujas en respuesta a la insonación del ultrasonido. Finalmente, la liberación de nanopartículas de la cáscara de la burbuja se visualiza mejor por medio de microscopía de fluorescencia, realizada a 500.000 fotogramas por segundo. Para caracterizar la administración de fármacos in vivo, se estudia la liberación desencadenada de nanopartículas dentro de la vasculatura y su extravasación más allá de la capa endotelial mediante microscopía intravital en tumores implantados en cámaras de ventana del pliegue cutáneo dorsal, en una escala de tiempo de varios minutos. La combinación de estas técnicas de caracterización complementarias proporciona una visión única del comportamiento de las microburbujas y su liberación de carga útil en un rango de escalas de tiempo y longitud, tanto in vitro como in vivo.
Introducción
El ultrasonido es la técnica de imagen médica más utilizada. Es no invasivo, rápido, seguro, rentable y portátil1,2,3. Sin embargo, la sangre es un dispersor de ultrasonido pobre, y el contraste de la piscina de sangre puede mejorarse mediante una inyección intravenosa de agentes de contraste de ultrasonido3. Este contraste mejorado del pool sanguíneo permite cuantificar la perfusión de órganos con fines diagnósticos, por ejemplo, en la detección de enfermedad coronaria4 y enfermedad hepática metastásica5. De hecho, la vasculatura tumoral demostró ser un factor pronóstico importante6. Un importante esfuerzo de investigación se dirige ahora hacia imágenes moleculares dirigidas asistidas por microburbujas y la adaptación de agentes de contraste para uso terapéutico.
Los agentes de contraste de ultrasonido disponibles comercialmente consisten típicamente en una suspensión de microburbujas recubiertas7,8 con diámetros que van desde 1 μm a 10 μm9. Dado que las microburbujas del agente de contraste por ultrasonido son ligeramente más pequeñas que los glóbulos rojos7, las microburbujas pueden llegar con seguridad incluso a los capilares más pequeños sin crear una oclusión3. Las microburbujas tienen un coeficiente de retrodispersión de ultrasonido dramáticamente mayor en comparación con el tejido10, debido a su núcleo de gas compresible11. Además, el eco de microburbujas es altamente no lineal, es decir, su espectro contiene armónicos y subarmónicos de la frecuencia de conducción. Además, la fuerza del eco depende en gran medida de la respuesta resonante de la burbuja12. Mientras que el tejido se dispersa solo linealmente, un pequeño número de microburbujas es suficiente para lograr una alta sensibilidad de detección en imágenes armónicas13,14. Esta generación de contraste no lineal puede incluso ser lo suficientemente fuerte como para rastrear burbujas individuales en el cuerpo15.
La cáscara del agente de contraste ecográfico estabiliza las burbujas contra la disolución y la coalescencia, aumentando así su tiempo de circulación en el grupo sanguíneo16. La cáscara puede consistir en lípidos, polímeros o proteínas desnaturalizadas3,8. Disminuye la tensión interfacial, limitando así el efecto de la disolución impulsada por presión de Laplace17 y crea una barrera resistiva contra la difusión de gas18. Para aumentar aún más la estabilidad, las microburbujas de contraste generalmente se llenan con un gas de alto peso molecular con baja solubilidad en sangre11. La carcasa de la microburbuja cambia drásticamente la respuesta de las microburbujas a la insonación ecográfica11. Las burbujas de gas no recubiertas tienen una frecuencia de resonancia característica que es inversamente proporcional a su tamaño y la adición de un recubrimiento lipídico aumenta la frecuencia de resonancia con respecto a la de un buble no recubierto debido a la rigidez intrínseca de la cáscara3. Además, la cáscara disipa la energía a través de la viscosidad dilatacional, que constituye la fuente dominante de amortiguación para las burbujas recubiertas3. La carcasa estabilizadora tiene la ventaja adicional de que se puede funcionalizar, por ejemplo, uniendo ligandos dirigidos a la superficie de las microburbujas. Esta focalización permite muchas aplicaciones para estas burbujas y, en particular, imágenes moleculares con ultrasonido14,19.
Los agentes de contraste de microburbujas son muy prometedores para aplicaciones de administración de medicamentos con ultrasonido. Las microburbujas que oscilan en el confinamiento de un vaso sanguíneo pueden causar microstreaming, así como tensiones locales normales y de cizallamiento en la pared capilar3. A altas presiones acústicas, las oscilaciones de gran amplitud pueden conducir al colapso de la microburbuja en un proceso violento denominado cavitación inercial, que, a su vez, puede conducir a la ruptura o invaginación del vaso sanguíneo20. Estos fenómenos violentos pueden inducir bioefectos como la sonopermeación21, potenciando la extravasación de fármacos terapéuticos en el intersticio a través de la pared endotelial, ya sea paracelular o transcelularmente. También puede mejorar la penetración de agentes terapéuticos a través de la matriz extracelular de tumores ricos en estroma21,22 y biofilms23,24, aunque este mecanismo aún es poco conocido26.
La administración de fármacos mediada por ecografía ha mostrado resultados prometedores tanto preclínicamente27,28 como en ensayos clínicos22. Además, cuando se usan con ultrasonido de frecuencia relativamente baja (~ 1 MHz), se ha informado que las microburbujas aumentan local y transitoriamente la permeabilidad de la barrera hematoencefálica, lo que permite que los medicamentos ingresen al parénquima cerebral, tanto en estudios preclínicos como clínicos29,30,31,32,33,34.
En general, existen dos enfoques para la administración de fármacos mediados por ultrasonido: el material terapéutico puede ser coadministrado con las burbujas, o puede ser unido o cargado en la cáscara de la burbuja28,35,36. El segundo enfoque ha demostrado ser más eficiente en términos de administración de fármacos37. Las microburbujas pueden cargarse con fármacos o material genético encapsulado en nanopartículas (liposomas o nanoconstructos poliméricos) unidos a la cáscara o incorporados directamente en la carcasa de la microburbuja35,36. Las microburbujas cargadas de nanopartículas se pueden activar mediante ultrasonido (enfocado) para liberar localmente la carga útil de nanopartículas28,33,38,39,40. Si dicha microburbuja está en contacto directo con una célula, se ha demostrado in vitro que la carga útil puede incluso depositarse sobre la membrana citoplasmática celular en un proceso llamado sonoimpresión34,35.
El espacio de parámetros de ultrasonido para la insonación de microburbujas es extenso, y las condiciones biológicas in vivo agregan complejidad aún más. Por lo tanto, la combinación de ultrasonido enfocado y microburbujas cargadas de nanopartículas plantea un desafío en el campo de la terapéutica dirigida.
El objetivo de este trabajo es proporcionar protocolos que puedan utilizarse para obtener imágenes, en detalle, de la respuesta de las microburbujas en función de los parámetros de ultrasonido y estudiar los mecanismos que conducen a la ruptura de la cáscara y la posterior liberación del material de la carcasa marcado fluorescentemente. Este conjunto de protocolos es aplicable a microburbujas con conchas que contienen un tinte fluorescente. La Figura 1 muestra una representación esquemática de las microburbujas estabilizadas con nanopartículas y proteínas poliméricas desarrolladas en SINTEF (Trondheim, Noruega). Estas burbujas están llenas de gas perfluoropropano (C3F8) y las nanopartículas que estabilizan la cáscara contienen NR668, que es un derivado lipofílico del colorante fluorescente rojo del Nilo38,43. Las nanopartículas consisten en poli(2-etil-butil cianoacrilato) (PEBCA) y son PEGilados. La funcionalización con polietilenglicol (PEG) reduce la opsonización y fagocitosis por el sistema de fagocitos mononucleares, extendiendo así el tiempo de circulación14,44. Como resultado, la PEGilación aumenta la cantidad de nanopartículas que llegan al sitio objetivo, mejorando así la eficacia del tratamiento16. La Figura 2 ilustra cómo el uso de cuatro métodos de microscopía permite a los investigadores cubrir todas las escalas de tiempo y longitud relevantes. Cabe destacar que la resolución espacial alcanzable en microscopía óptica viene determinada por el límite de difracción, que depende de la longitud de onda de la luz y de la apertura numérica (NA) del objetivo y de la fuente de iluminación del objeto45. Para los sistemas en cuestión, el límite de resolución óptica suele ser de 200 nm. Además, la microscopía intravital se puede utilizar para obtener imágenes a nivel subcelular46. Para las microburbujas estabilizadas con nanopartículas y proteínas utilizadas en este trabajo, la escala de longitud mínima relevante para la microscopía intravital es el tamaño de los capilares pequeños (≥10 μm). Se describen experimentos de imágenes ópticas de alta velocidad in vitro (10 millones de fotogramas por segundo) e imágenes de fluorescencia de alta velocidad (500.000 fotogramas por segundo) para microburbujas individuales. Las imágenes de campo brillante de alta velocidad a escalas de tiempo de nanosegundos son adecuadas para estudiar la dinámica radial resuelta en el tiempo de las burbujas vibrantes. Por el contrario, la microscopía de fluorescencia de alta velocidad permite la visualización directa de la liberación de las nanopartículas marcadas fluorescentemente. Además, la estructura de la carcasa de la microburbuja se puede investigar utilizando microscopía confocal tridimensional (3D) de pila Z y microscopía electrónica de barrido (el protocolo para esta última no está incluido en el trabajo actual). La microscopía intravital consiste en utilizar la microscopía multifotónica para obtener imágenes de tumores que crecen en cámaras de ventana dorsal para proporcionar información en tiempo real sobre el flujo sanguíneo local y sobre el destino de las nanopartículas marcadas fluorescentemente in vivo47. La combinación de estos métodos de microscopía en última instancia proporciona una visión detallada del comportamiento de los agentes de microburbujas terapéuticos en respuesta al ultrasonido, tanto in vitro como in vivo.
Protocolo
NOTA: Todos los procedimientos experimentales fueron aprobados por las Autoridades Noruegas de Investigación Animal. Los detalles de los materiales que se utilizaron en el protocolo se pueden encontrar en la Tabla de materiales.
1. Producción de microburbujas
NOTA: En este trabajo, las microburbujas de interés son microburbujas estabilizadas con proteínas y nanopartículas, para las cuales se ha descrito previamente el protocolo de producción28,33,48. Por lo tanto, el protocolo de fabricación se ha resumido brevemente aquí.
- Primero, usando una pipeta, mezcle agua ultrapura con 0.5% en peso de caseína en solución salina tamponada con fosfato (PBS) y 1% en peso de las nanopartículas etiquetadas con 0.21% en peso del tinte fluorescente, NR668 (rojo del Nilo modificado), en un vial superior de vidrio estéril (10 ml, diámetro de 2 cm). Las nanopartículas poliméricas se preparan utilizando el método de polimerización en miniemulsión descrito por Mørch et al. 38.
NOTA: Aquí, el tinte funciona como un fármaco modelo para permitir la visualización de la liberación de nanopartículas. Cuando trabaje con la solución de nanopartículas, use una bata de laboratorio, gafas y guantes. Limpie cualquier derrame de la solución de nanopartículas inmediatamente con 100% acetona. - Cubra el vial con la tapa de goma, mezcle ligeramente y coloque el vial en un baño ultrasónico durante 10 minutos a temperatura ambiente para eliminar posibles agregados. Coloque una herramienta de dispersión con la punta del agitador ~ 0.5 cm desde la parte inferior del vial de vidrio. Usando una pipeta de vidrio conectada al recipiente de gas, agregue el gas perfluoropropano al espacio de la cabeza del vial que contiene la solución hasta que la solución comience a burbujear ligeramente.
NOTA: Envuelva la película autosellante alrededor de la base de la herramienta de dispersión para evitar el deslizamiento del vial de vidrio durante la agitación. - Revuelva la solución vigorosamente a 1935 × g (24.000 rpm con un radio de rotación de 3 mm) durante 4 min utilizando la herramienta de dispersión. Cierre el vial con la tapa de goma y selle el vial para su uso posterior.
NOTA: La agitación atrapa el gas en el líquido. Posteriormente, la carcasa de la microburbuja se autoensambla sin requerir ningún paso activo. - Guarde el exceso de caseína y la solución de nanopartículas a 4 °C y limpie la herramienta de dispersión con acetona al 100%.
2. Imágenes de burbujas individuales
- Microscopía confocal
- Preparación de muestras
- Diluya la solución de burbujas para obtener imágenes de microburbujas individuales de la siguiente manera. Coloque una aguja de ventilación (19 G-21 G) en un vial superior de vidrio que contenga las microburbujas producidas siguiendo el procedimiento descrito en la sección 1. Gire el vial boca abajo para permitir que las burbujas grandes se alejen del sello del vial.
- Inserte otra punta de aguja (19 G) de una jeringa pequeña (~1 ml) en el vial, mientras el vial todavía está boca abajo. Retire una pequeña cantidad de la suspensión de burbujas y transfiera el contenido de la jeringa a un tubo pequeño para facilitar el pipeteo en el siguiente paso.
NOTA: El volumen de la suspensión a extraer depende directamente del tipo y concentración de la suspensión de burbujas. En este caso, se extrajeron 0,2 ml. - Usando una pipeta, diluya la suspensión de microburbujas (de la sección 1) en PBS filtrado para lograr una concentración de aproximadamente 2 × 105 a 6 × 105 microburbujas / ml para permitir imágenes de una sola burbuja.
NOTA: Dependiendo del tipo de burbuja, se recomienda lavar la suspensión de burbujas para eliminar el tinte fluorescente libre. Esto es particularmente importante con las burbujas para las cuales el tinte fluorescente se infunde en la cáscara. Para lavar las burbujas, diluya la suspensión de la burbuja (por ejemplo, tomando 100 μL de la solución de burbujas en 10 ml de PBS) y centrífuga (generalmente a velocidades del orden de 100 × g). Finalmente, retire el sobrenadante que contiene las microburbujas con una pipeta para un análisis más detallado. La solución restante contiene las partículas fluorescentes libres y se puede desechar. El paso de lavado debe repetirse según sea necesario. - Agregue glicerol a la mezcla para aumentar la viscosidad del medio y eliminar el movimiento inducido por el movimiento browniano que de otro modo interferiría con la imagen de la pila Z confocal bastante lenta.
NOTA: La cantidad de glicerol depende del tipo de burbuja que se muestre (aquí, ~ 50%). Para algunos tipos de burbujas, el glicerol podría tener un efecto adverso sobre la estabilidad49. Sin embargo, no se observó ningún cambio notable en las burbujas durante aproximadamente 30 minutos bajo imágenes confocales. Además, el glicerol puede cambiar la respuesta acústica de las microburbujas y, por lo tanto, solo se puede usar con métodos de imagen donde las microburbujas no están insonificadas. - Coloque la suspensión de microburbujas en una cámara con paredes delgadas para obtener imágenes óptimas, como un portaobjetos de canal.
- Protocolo de imágenes
- Encienda el microscopio confocal y seleccione un objetivo adecuado y el láser y el escáner deseados para usar durante la microscopía confocal.
NOTA: Aquí, use un objetivo de inmersión en agua de 60x para una resolución de 0.08 μm / píxel y, dependiendo del tamaño de la burbuja, imagine una región de 256 x 256 píxeles o 128 x 128 píxeles. En estos experimentos específicos, utilice un láser de 488 nm y un escáner Galvano. La longitud de onda de emisión depende del colorante fluorescente y es típicamente de banda ancha. - Encuentre una microburbuja en campo brillante y cambie a microscopía confocal. Coloque los planos superior e inferior deseados entre los cuales escaneará el microscopio confocal. Adquirir una pila Z para observar la estructura 3D; utilice un tamaño de paso de 100 nm en la dirección Z.
- Encienda el microscopio confocal y seleccione un objetivo adecuado y el láser y el escáner deseados para usar durante la microscopía confocal.
- Preparación de muestras
- Microscopía de campo brillante
- Montaje del sistema óptico
NOTA: En la figura 3A se muestra una representación esquemática de la configuración de microscopía de campo brillante. Para garantizar una propagación de ultrasonido sin interrupciones, el baño de agua contiene dos aberturas: una para una fuente de luz y otra para un transductor de ultrasonido. El sistema óptico consiste en un microscopio (modular), una cámara de alta velocidad y una óptica coincidente. Como el período de oscilaciones de microburbujas suele ser del orden de 1 μs (utilizando ultrasonido de 1 MHz), la cámara debe configurarse para grabar a una velocidad de fotogramas de al menos 5 millones de fotogramas por segundo. Aquí, la cámara se configurará para grabar a 10 millones de fotogramas por segundo (256 x 400 píxeles) durante 256 fotogramas (25,6 μs) para capturar todos los detalles de la dinámica de la burbuja, incluidos los armónicos más altos.- Conecte un objetivo de inmersión en agua con un aumento apropiado, distancia de trabajo y NA al microscopio.
NOTA: Se utilizó un objetivo de inmersión en agua para proporcionar una distancia de trabajo estable a pesar de la evaporación gradual del agua. Aquí, se seleccionó un objetivo de inmersión en agua con un aumento de 60x, una distancia de trabajo de 2 mm y un NA de 1. - Utilice una luz estroboscópica con una potencia máxima de salida de al menos 1 kW para la iluminación y una lente de tubo entre el microscopio y la cámara para garantizar que la menor cantidad de luz ambiental posible llegue al sensor de la cámara de alta velocidad.
- Utilice una fuente de luz halógena regulable para centrarse en microburbujas individuales y alinear el sistema óptico y acústico para obtener imágenes en tiempo real.
- Conecte un objetivo de inmersión en agua con un aumento apropiado, distancia de trabajo y NA al microscopio.
- Montaje del sistema acústico
- Utilice un generador de forma de onda arbitraria programable y un amplificador de potencia (ganancia de 56 dB) para accionar el transductor con una envoltura y forma de onda suaves. Conecte un osciloscopio al generador de forma de onda arbitraria para comprobar la señal. Conecte una computadora personal al generador de forma de onda arbitraria para programar la onda de presión acústica entrante, utilizando un script escrito internamente.
- Utilice un generador de pulsos/retardo como disparador maestro para sincronizar los sistemas ópticos y acústicos. Configure los retardos de disparo en el generador de pulso/retardo y en el software de la cámara de tal manera que la grabación comience 16 μs después de la transmisión del ultrasonido para permitir que la onda de ultrasonido llegue a las burbujas. Active la fuente de luz 1,5 μs antes del inicio de la grabación para garantizar una iluminación adecuada durante las oscilaciones de burbujas (consulte la Figura 3B para el diagrama de tiempo).
- Elija un transductor adecuado con una frecuencia central adecuada. Colóquelo en una abertura del baño de agua, de modo que esté en ángulo con respecto al eje óptico para minimizar los reflejos de las membranas del soporte de la muestra y reducir la formación de ondas estacionarias.
NOTA: Aquí, se colocó un transductor de inmersión enfocado de un solo elemento con una frecuencia central de 2.25 MHz, una distancia focal de 1" y un diámetro de elemento de 0.75" en un ángulo de 35° con respecto al eje óptico. La calibración de la función de transferencia debe realizarse utilizando el mismo amplificador que se utiliza en el sistema acústico. Calibre la función de transferencia de amplitud de voltaje a amplitud de presión del transductor utilizando un hidrófono de fibra óptica en función de la frecuencia de transmisión de ultrasonido.
- Elección del soporte de muestra
- Utilice un soporte de muestra con membranas óptica y acústicamente transparentes y un volumen que sea lo suficientemente grande como para permitir la obtención de imágenes de varias microburbujas individuales dentro de la misma muestra.
NOTA: Aquí, se utilizó un casete de cultivo celular con un volumen de 10 mL, áreas de membrana de 25 cm2 y espesor de membrana de 175 μm. Debido a las reflexiones acústicas en la membrana inferior y a la interferencia de las ondas reflejadas por el objetivo del microscopio y la membrana superior, la presión acústica in situ puede diferir de la programada en el generador de forma de onda arbitraria. Colocar el transductor en ángulo con respecto a las membranas del soporte de la muestra reduce la formación de ondas estacionarias, pero puede aumentar las reflexiones de las membranas. - Asegúrese de que la muestra pueda sumergirse completamente y colocarse dentro del foco tanto del transductor como del objetivo del microscopio. Utilice un soporte de aluminio unido a una etapa de microposicionamiento 3D para mover el soporte de la muestra de forma independiente.
- Utilice un soporte de muestra con membranas óptica y acústicamente transparentes y un volumen que sea lo suficientemente grande como para permitir la obtención de imágenes de varias microburbujas individuales dentro de la misma muestra.
- Alineación de los sistemas ópticos y acústicos
- Para que la traducción 3D alinee la configuración, conecte el baño de agua a una etapa de traducción XY y conecte el escenario a una mesa óptica para asegurarse de que no se mueva durante los experimentos. Luego, llene el baño de agua con agua y encienda la fuente de luz halógena regulable. Durante la alineación, mueva el objetivo del microscopio hacia un lado para evitar reflejos de ultrasonido.
- Conecte un hidrófono de aguja (0,2 mm) al brazo del soporte de la muestra y coloque el hidrófono de la aguja en el baño de agua, con la punta en el campo de visión del objetivo. Encienda el amplificador y el generador de forma de onda arbitraria; utilice pulsos individuales de 5 a 10 ciclos de ultrasonido y una frecuencia de repetición de pulsos de 15 Hz. Asegúrese de que la punta del hidrófono esté centrada y enfocada en la imagen del microscopio. Mueva el tanque en la dirección XY y la aguja en la dirección Z hasta que se alcance la amplitud de presión máxima.
- Ajuste el enfoque del microscopio para volver a enfocar la punta del hidrófono.
NOTA: Este protocolo garantiza la alineación entre el foco del microscopio y el foco del transductor. No cambie la posición del microscopio y del transductor después de la alineación.
- Preparación de muestras
- Repita los pasos 2.1.1.1 a 2.1.1.3 para preparar la solución de ejemplo. Diluya la solución de burbujas para permitir la obtención de imágenes de una sola burbuja y descartar interacciones acústicas de burbujas vecinas.
- Abra la salida del soporte de la muestra. Con una jeringa, inyecte la solución de muestra en la otra abertura del portamuestras hasta que esté completamente llena. Asegúrese de que no haya burbujas de aire dentro del soporte de la muestra para evitar interacciones no deseadas con el campo de ultrasonido.
- Cierre ambas válvulas del portamuestras y coloque el portamuestras perpendicular al eje óptico.
NOTA: Mantenga el nivel del soporte de muestra lleno para evitar el desplazamiento de las burbujas a un lado del soporte de muestra durante el movimiento.
- Protocolo de imágenes
- Programe la frecuencia de conducción de ultrasonido y la presión acústica deseadas en el generador de forma de onda arbitraria a través del guión escrito interno antes mencionado.
NOTA: Aquí, la onda de presión acústica fue una sola ráfaga de 40 ciclos, con un pulso cónico gaussiano de 8 ciclos. Las frecuencias de ultrasonido utilizadas en estos experimentos fueron 1 MHz, 2 MHz o 3 MHz, con amplitudes de presión acústica que oscilan entre 81 kPa y 1200 kPa. - Mueva el soporte de muestra que contiene la solución de muestra utilizando la etapa XYZ para ubicar microburbujas individuales en el foco del microscopio. Comience con un campo de visión en una esquina del soporte de muestra y asegúrese de que el borde de las microburbujas esté claramente visible y enfocado (consulte la Figura 3C para obtener una vista de cámara ideal).
- Conecte el extremo de una fibra óptica que estaba previamente conectada a la luz halógena a una luz estroboscópica, de modo que el otro extremo todavía esté conectado al baño de agua. Activa la grabación.
- Repita los pasos 2.2.6.2 a 2.2.6.3 tantas veces como desee por ajuste de ultrasonido (frecuencia y presión acústica), moviendo el cassette de cultivo celular que contiene las microburbujas al menos 2 mm (en el plano focal) desde la ubicación anterior para asegurarse de que las microburbujas en el campo de visión no estén insonificadas en experimentos anteriores.
NOTA: Aquí, cada experimento se repitió ~ 20 veces. Cuando todo el soporte de la muestra esté insonificado, vacíe el soporte de la muestra y vuelva a llenarlo con una solución de muestra fresca para experimentos posteriores.
- Programe la frecuencia de conducción de ultrasonido y la presión acústica deseadas en el generador de forma de onda arbitraria a través del guión escrito interno antes mencionado.
- Análisis de datos
- Adopte un entorno de programación para realizar análisis de datos de acuerdo con la pregunta de investigación y realice la detección de bordes después de procesar las imágenes. Usando una función que mide las propiedades de las regiones de la imagen, encuentre el centroide de una burbuja y la derivada del perfil de intensidad alrededor de cada burbuja para detectar el contorno de la burbuja (y por lo tanto, el radio de la burbuja R). Extraiga los parámetros relevantes del radio a lo largo del tiempo para microburbujas individuales.
NOTA: En el presente estudio, se utilizó un entorno de programación para el procesamiento de imágenes para binarize y filtrar grabaciones de microburbujas individuales. Se utilizó un script interno para encontrar la derivada del perfil de intensidad alrededor de cada burbuja.
- Adopte un entorno de programación para realizar análisis de datos de acuerdo con la pregunta de investigación y realice la detección de bordes después de procesar las imágenes. Usando una función que mide las propiedades de las regiones de la imagen, encuentre el centroide de una burbuja y la derivada del perfil de intensidad alrededor de cada burbuja para detectar el contorno de la burbuja (y por lo tanto, el radio de la burbuja R). Extraiga los parámetros relevantes del radio a lo largo del tiempo para microburbujas individuales.
- Montaje del sistema óptico
- Microscopía de fluorescencia
- Montaje del sistema óptico
- Construir la configuración para la microscopía de fluorescencia (Figura 4A), con la misma base utilizada en la microscopía de campo brillante descrita en la sección 2.2.
NOTA: La configuración descrita en la sección 2.3 se puede combinar con la descrita para la microscopía de campo brillante en la sección 2.2. La combinación de microscopía de fluorescencia y microscopía de campo brillante permite la visualización del núcleo de gas de la microburbuja mientras se obtienen imágenes de la liberación de nanopartículas. - Configure la cámara de alta velocidad para que grabe a 500.000 fotogramas por segundo (400 x 250 píxeles) durante 128 fotogramas (256 μs).
NOTA: El tiempo de imagen es más largo que en los experimentos de campo brillante, ya que la intensidad de la luz está limitada en fluorescencia, y porque la escala de tiempo en la que se produce la entrega de partículas es más larga que la de la dinámica de burbujas. - Seleccione un láser con una potencia lo suficientemente alta como para suministrar suficiente luz y que tenga una longitud de onda de excitación adecuada, y asegúrese de que esté acoplado con un modulador acústico-óptico para evitar el blanqueo de la muestra.
NOTA: En este estudio, se utilizó un láser de onda continua de 5 W con una longitud de onda de excitación de 532 nm para excitar la fluorescencia de las nanopartículas. - Coloque un divisor de haz, un espejo dicroico y un filtro de muesca entre el láser y el objetivo del microscopio para dirigir la luz de excitación hacia la muestra mientras permite que la emisión de fluorescencia llegue a la cámara.
- Construir la configuración para la microscopía de fluorescencia (Figura 4A), con la misma base utilizada en la microscopía de campo brillante descrita en la sección 2.2.
- Montaje del sistema acústico
- Para insonificar las microburbujas, utilice la misma configuración acústica que en la sección 2.2.2. Cambie el transductor en estos experimentos específicos a un transductor de inmersión enfocado de un solo elemento con una frecuencia central de 2.25 MHz, una distancia focal de 1.88" y un diámetro de elemento de 1". Colóquelo en un ángulo de 35° con respecto al eje óptico para minimizar las reflexiones de las membranas del soporte de la muestra y reducir las formaciones de onda estacionaria.
- Alineación de los sistemas ópticos y acústicos
- Repita los pasos descritos en la sección 2.2.4.
- Preparación de muestras
- Prepare la solución de ejemplo como se describe en la sección 2.2.5.
- Protocolo de imágenes
- Establezca la frecuencia de conducción de ultrasonido deseada y la amplitud de presión acústica en el generador de forma de onda arbitraria a través del guión escrito interno antes mencionado.
NOTA: Aquí, la onda de presión acústica fue programada para ser una sola ráfaga de ultrasonido de 140 ciclos, con un pulso cónico gaussiano de 10 ciclos. Por lo general, se requieren duraciones de pulso más largas para inducir bioefectos en comparación con las requeridas para estudiar la dinámica de las burbujas. Las frecuencias de ultrasonido utilizadas en estos experimentos fueron 1 MHz, 2 MHz o 3 MHz, con amplitudes de presión acústica que oscilan entre 81 kPa y 1200 kPa. - En el generador de pulso/retardo, establezca el retardo de disparo para el láser para la excitación fluorescente de las nanopartículas de las microburbujas durante la grabación.
NOTA: Para estos experimentos específicos, el retardo desencadenante fue de entre 20 μs y 170 μs para una duración total de 150 μs. El diagrama de tiempo se muestra en la Figura 4B. - Mueva el soporte de muestra que contiene la solución de muestra utilizando la etapa XYZ para ubicar microburbujas individuales en el foco del microscopio. Comience con un campo de visión de una esquina del soporte de la muestra; consulte la Figura 4C para obtener una vista de cámara ideal en la que la interfaz de las microburbujas sea claramente visible y esté enfocada. Activa la grabación.
- Repita el paso 2.3.5.3 tantas veces como desee por configuración de ultrasonido (frecuencia y presión acústica), moviendo el cassette de cultivo celular que contiene las microburbujas al menos 2 mm (en el plano óptico) de la ubicación anterior para garantizar que las microburbujas en el campo de visión no se sonicen en experimentos anteriores.
NOTA: En este estudio, cada experimento se repitió ~ 10-20x. Cuando todo el soporte de la muestra esté insonificado, vacíe el soporte de la muestra y vuelva a llenarlo con una solución de muestra fresca para experimentos posteriores. La distancia a la que se debe mover el soporte de la muestra entre experimentos depende del tamaño del haz acústico.
- Establezca la frecuencia de conducción de ultrasonido deseada y la amplitud de presión acústica en el generador de forma de onda arbitraria a través del guión escrito interno antes mencionado.
- Análisis de datos
- Analice los registros de microscopía de fluorescencia de acuerdo con la pregunta de investigación. Para cada microburbuja, determine visualmente si se produjo la entrega de las nanopartículas en los experimentos de microscopía de fluorescencia. Si se observa el desprendimiento y la deposición de las nanopartículas del núcleo de gas en la membrana del soporte de la muestra para una sola microburbuja, ingrese manualmente que la entrega ocurrió en el entorno de programación.
- Montaje del sistema óptico
3. Microscopía intravital
- Cirugía de la cámara de la ventana del pliegue cutáneo dorsal (descrita anteriormente26,47,50)
- Aclimatar a los animales durante una semana antes de colocar las cámaras de la ventana. Aunque se pueden usar ratones hembra y macho, y la edad no es importante, asegúrese de que el peso de los ratones sea de al menos 22-24 g para que la piel sea lo suficientemente flexible.
- Realizar la cirugía bajo anestesia general con tratamiento analgésico intraoperatorio y postoperatorio. Anestesiar al animal mediante una inyección subcutánea de fentanilo (0,05 mg/kg)/medetomidina (0,5 mg/kg)/midazolam (5 mg/kg)/agua (2:1:2:5) a una dosis de 0,1 ml por 10 g de peso. Use una almohadilla térmica o una lámpara de calefacción para mantener la temperatura corporal del animal.
- Tire suavemente de la doble capa de piel en la parte posterior del animal para que la piel se intercale entre dos marcos simétricos de polioximetileno de la cámara de la ventana. Fije la cámara colocando dos tornillos que se extienden a través de la doble capa de piel y suturando a lo largo del borde superior de la cámara.
- Retire la piel dentro del marco circular de la cámara en un lado del pliegue de la piel. Coloque una cubierta de vidrio con un diámetro de 11,8 mm dentro del marco donde se retira la piel para formar una ventana hacia el tejido.
- Use una inyección subcutánea de atipemazol (2,5 mg/kg), flumazenil (0,5 mg/kg) y agua (1:1:8) a una dosis de 0,1 ml por 10 g como antídoto para terminar la anestesia. Coloque al animal en un estante de recuperación con calefacción durante la noche. Suplementar el agua para los animales con 25 mg/ml de enrofloxacina para prevenir la infección en el sitio quirúrgico.
- Creación de modelos tumorales
- Mantener las células cancerosas a 37 °C y en una atmósfera de CO2 al 5% en un medio de cultivo apropiado suplementado con suero bovino fetal al 10% y 100 U/mL de penicilina y 100 mg/ml de estreptomicina.
NOTA: La línea celular de osteosarcoma humano (SHO) se utilizó en este protocolo, pero también se pueden usar otras líneas celulares. - En el día después del paso 3.1.5, anestesiar al animal con isoflurano (5% durante la inducción y 1-2% durante el mantenimiento) durante un par de minutos. Retire el vidrio de la cubierta, aplique 5 × 106 células cancerosas en 30 μL de medio de cultivo celular y reemplace el vidrio de la cubierta.
- Permita que los tumores crezcan durante 2 semanas antes de la toma de imágenes y controle el peso y el estado de salud de los animales al menos 3 veces por semana durante este período.
- Mantener las células cancerosas a 37 °C y en una atmósfera de CO2 al 5% en un medio de cultivo apropiado suplementado con suero bovino fetal al 10% y 100 U/mL de penicilina y 100 mg/ml de estreptomicina.
- Montaje del sistema óptico
- Realizar imágenes intravitales durante el tratamiento ecográfico (como se describe en trabajos anteriores26) con un microscopio adecuado y objetivo en función de la cuestión de investigación en juego. Consulte la Figura 5A para obtener una representación esquemática de la configuración experimental.
NOTA: Para este experimento específico, se utilizó un microscopio multifotón, equipado con un objetivo de inmersión de agua 20x (NA de 1.0 y distancia de trabajo de 2 mm) y un láser pulsado. Las imágenes se adquirieron en modo de escaneo resonante a 31 fotogramas por segundo (512 x 512 píxeles) con un campo de visión de 400 x 400 μm2. La longitud de onda de excitación fue de 790 nm. Los filtros frente a los dos detectores de fosfuro de arseniuro de galio eran de paso largo de 590 nm y de paso de banda de 525/50 nm para la detección de fluorescencia.
- Realizar imágenes intravitales durante el tratamiento ecográfico (como se describe en trabajos anteriores26) con un microscopio adecuado y objetivo en función de la cuestión de investigación en juego. Consulte la Figura 5A para obtener una representación esquemática de la configuración experimental.
- Montaje del sistema acústico
- Monte un transductor de ultrasonido adecuado en una guía de onda (hecha a medida) colocada debajo del objetivo en un ángulo de 45 ° con respecto al eje óptico para minimizar los reflejos del vidrio de la cubierta de la cámara de la ventana del pliegue cutáneo dorsal y reducir las formaciones de onda estacionaria. Llene la guía de ondas con agua destilada y desgasificada. Aplique gel de acoplamiento ultrasónico en la parte superior de la guía de onda.
- Alineación de los sistemas ópticos y acústicos
- Alinear el eje óptico con el foco del ultrasonido. Coloque un hidrófono de fibra óptica en el foco del objetivo. Luego, encienda el amplificador y el generador de forma de onda arbitraria para excitar el transductor con ráfagas cortas (5-10 ciclos) con una frecuencia de repetición de pulsos de 100 Hz, y mueva el transductor de ultrasonido a la posición donde se detecta la presión más alta con la señal del hidrófono en el osciloscopio.
NOTA: No cambie la posición del transductor después de la alineación.
- Alinear el eje óptico con el foco del ultrasonido. Coloque un hidrófono de fibra óptica en el foco del objetivo. Luego, encienda el amplificador y el generador de forma de onda arbitraria para excitar el transductor con ráfagas cortas (5-10 ciclos) con una frecuencia de repetición de pulsos de 100 Hz, y mueva el transductor de ultrasonido a la posición donde se detecta la presión más alta con la señal del hidrófono en el osciloscopio.
- Protocolo de imágenes
- Coloque el soporte para animales calentado (diseñado a medida) conectado a una etapa de posicionamiento XY entre la guía de onda y el objetivo, y agregue más gel de acoplamiento. Anestesiar al animal y colocar un catéter de vena de la cola. Coloque el mouse en el soporte calefactado y fije la cámara de la ventana en el soporte. Agregue una gota de agua en la parte superior del resbalón de la cubierta en la cámara de la ventana y mueva el objetivo en su lugar para obtener imágenes del tejido tumoral.
-
La Figura 5B muestra el diagrama de tiempo de los experimentos que representan el orden de los eventos. Inyecte 2 MDa dextrano marcado fluorescentemente por vía intravenosa (30 μL, 4 mg/ml diluido en solución salina) para visualizar la vasculatura y mueva al ratón utilizando la etapa de traducción XY para encontrar una posición con vasos sanguíneos adecuados. Registre las imágenes basales antes del tratamiento de ultrasonido. Ajuste la velocidad de fotogramas, el campo de visión y la duración de la grabación según la pregunta de investigación y los detalles del microscopio y los tintes que se van a tomar como imagen.
NOTA: En estos experimentos, se registraron 31 fotogramas por segundo con un campo de visión de 400 x 400 μm2, y las imágenes se realizaron de forma continua durante 5 min. - Establezca la frecuencia de conducción de ultrasonido deseada, la longitud del pulso y la amplitud de la presión acústica en el generador de forma de onda arbitraria.
NOTA: Para estos experimentos, se utilizó una frecuencia de 1 MHz con una longitud de pulso de 10 ms y amplitudes de presión negativa máxima entre 0,2 MPa y 0,8 MPa. Se utilizó una frecuencia de repetición de pulsos de 0,5 Hz o 0,1 Hz para permitir que nuevas microburbujas se volvieran a fusionar en el área tratada entre pulsos de ultrasonido. - Inyecte microburbujas de 50 μL (2 × 108 a 5 × 108 microburbujas/ml) por vía intravenosa y aplique ultrasonido durante la toma de imágenes, como se describe en26.
- Análisis de datos
- Dependiendo de la pregunta de investigación, analice las imágenes con un software de procesamiento de imágenes (de código abierto) y un entorno de programación, como se describe en26, para determinar los parámetros de los vasos sanguíneos (diámetro, ramificación, velocidad de flujo y dirección), la acumulación de nanopartículas en los vasos y la cinética y la profundidad de penetración de la extravasación de dextrano y nanopartículas en el tejido tumoral.
Resultados
Las microburbujas, producidas como se describe en el protocolo, se analizaron utilizando varios métodos de microscopía y en varias escalas de tiempo.
La fluorescencia de las nanopartículas en la microscopía confocal (Figura 6A) indica que la cáscara tiene una distribución de partículas no uniforme. Se pueden utilizar otros métodos de microscopía para la caracterización de burbujas. Por ejemplo, la Figura 6B muestra la estructura general de la microburbuja utilizando microscopía electrónica de barrido, como se presentó en trabajos anteriores34.
La dinámica radial y el comportamiento fenomenológico de las burbujas se pueden estudiar utilizando el método de microscopía de campo brillante in vitro descrito en el que se tomaron imágenes de microburbujas a 10 millones de fotogramas por segundo. El radio de las microburbujas individuales se extrajo a lo largo del tiempo utilizando un script escrito internamente. Un ejemplo de tal respuesta radial se muestra en la Figura 7.
En la figura 8A se muestra una secuencia de imágenes de la entrega exitosa típica de nanopartículas, como se describe en la sección 2.3.6. Se puede ver que las nanopartículas incrustadas en la cubierta de la microburbuja se iluminan debido a la fluorescencia cuando la luz láser llega a la burbuja. Impulsadas por la insonación por ultrasonido, las nanopartículas fluorescentes se desprenden del núcleo de gas de las microburbujas y se depositan en la membrana del soporte de la muestra. Finalmente, el láser se apaga y las nanopartículas fluorescentes ya no se excitan. La entrega infructuosa de la carga útil marcada fluorescentemente de las microburbujas generalmente se parece a la secuencia de imágenes que se muestra en la Figura 8B, donde las nanopartículas fluorescentes se iluminan en la cáscara de la microburbuja que permanece intacta durante la exposición al ultrasonido.
Se utilizó la microscopía multifotónica intravital en tiempo real durante el ultrasonido para investigar los efectos del ultrasonido y las microburbujas en el comportamiento de las nanopartículas en la sangre, la mejora de la permeabilidad de los vasos sanguíneos tumorales y la mejora de la administración de nanopartículas. Se puede caracterizar la extensión y la cinética de penetración en la matriz extracelular en función de la presión acústica, la frecuencia y la longitud del pulso. El efecto del tratamiento ecográfico puede variar con respecto al tamaño y la morfología de los vasos y el confinamiento resultante de la burbuja. Se puede determinar cómo el tratamiento de ultrasonido afecta el flujo sanguíneo y la dirección. Un experimento de ejemplo que muestra la extravasación de nanopartículas a lo largo del tiempo se muestra en la Figura 9 a un índice mecánico (IM) de 0,826. Los resultados de la microscopía multifotónica intravital dilucidan la extravasación espacial y temporal de las nanopartículas durante la exposición al ultrasonido, lo que es altamente beneficioso para la comprensión completa de los mecanismos subyacentes a la administración mediada por ultrasonido de nanopartículas y para optimizar dichas tecnologías26.
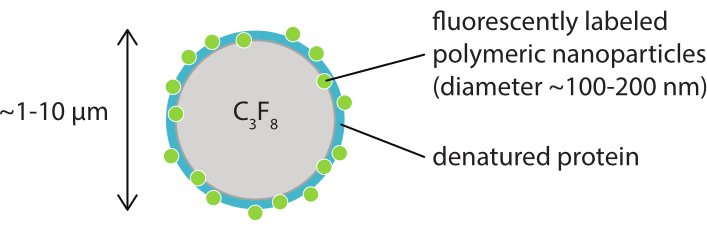
Figura 1: Representación esquemática de una microburbuja con una capa de nanopartículas poliméricas marcadas fluorescentemente en caseína desnaturalizada. Las microburbujas son típicamente entre 1 μm y 10 μm de diámetro. Las nanopartículas tienen un diámetro mayormente entre 100 nm y 200 nm38. Abreviatura: C3F8 = gas perfluoropropano. Haga clic aquí para ver una versión más grande de esta figura.
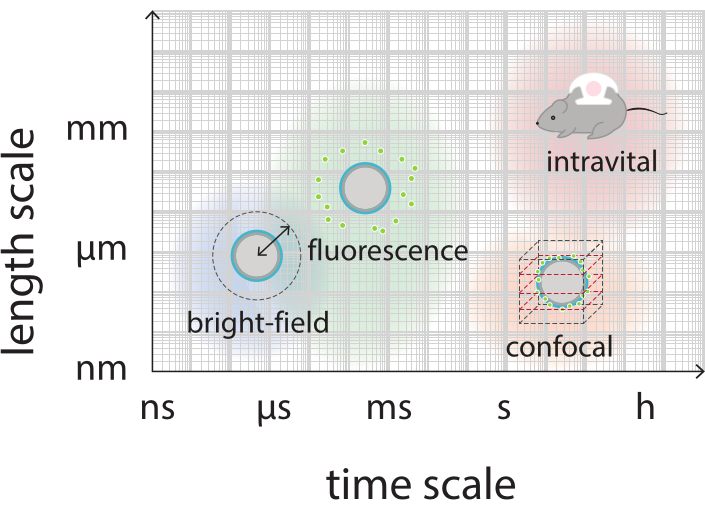
Figura 2: Descripción general esquemática que muestra las escalas de tiempo y longitud relevantes para la microscopía de campo brillante, fluorescencia, confocal e intravital. Haga clic aquí para ver una versión más grande de esta figura.
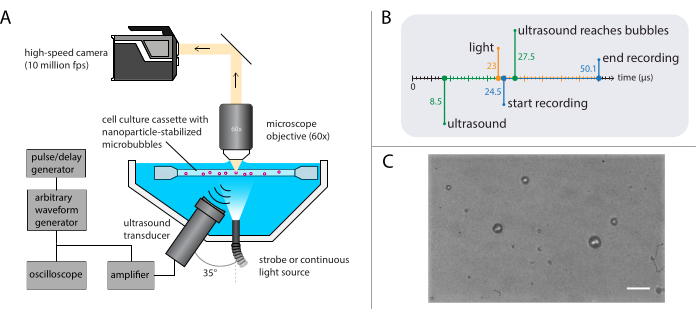
Figura 3: Representación esquemática de experimentos de microscopía de campo brillante. (A) Configuración experimental, (B) el diagrama de tiempo y (C) un marco grabado típico. Barra de escala en (C) = 10 μm. Abreviatura: fps = fotogramas por segundo. Haga clic aquí para ver una versión más grande de esta figura.
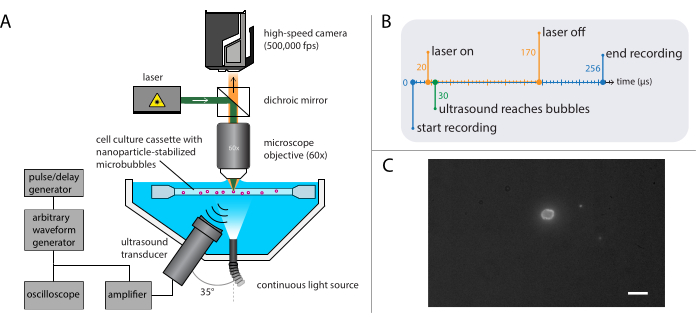
Figura 4: Representación esquemática de experimentos de microscopía de fluorescencia. (A) Configuración experimental, (B) el diagrama de tiempo y (C) un marco grabado típico. Barra de escala en (C) = 10 μm. Abreviatura: fps = fotogramas por segundo. Haga clic aquí para ver una versión más grande de esta figura.
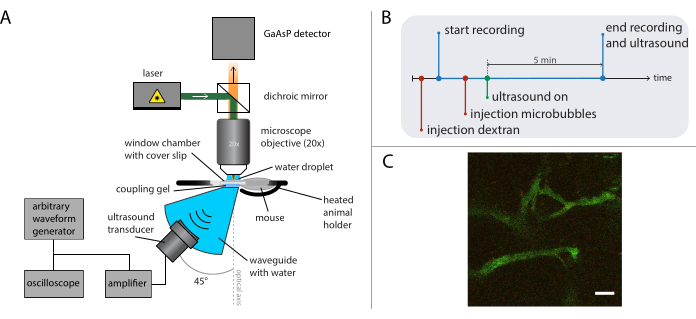
Figura 5: Representación esquemática de experimentos de microscopía intravital. (A) Configuración experimental, (B) el diagrama de tiempo y (C) un marco grabado típico. Barra de escala en (C) = 50 μm. El verde corresponde al dextrano-FITC y el rojo a las nanopartículas. Abreviatura: GaAsP = fosfuro de arseniuro de galio. Haga clic aquí para ver una versión más grande de esta figura.
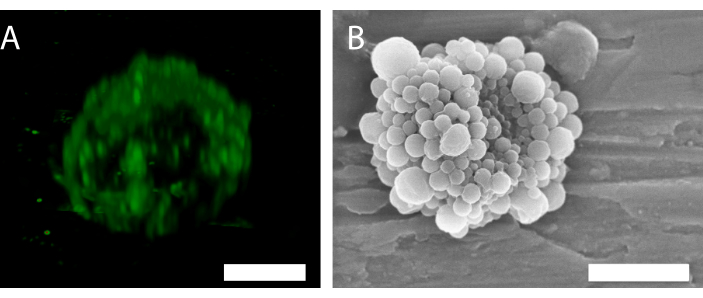
Figura 6: Estructura 3D de una sola microburbuja estabilizada con nanopartículas y proteínas. (A) Uso de microscopía confocal para mostrar las nanopartículas, y (B) uso de un microscopio electrónico de barrido para mostrar la estructura 3D. (B) ha sido reproducido con permiso de34. Barra de escala en (A) = 5 μm; barra de escala en (B) = 2 μm. Haga clic aquí para ver una versión más grande de esta figura.
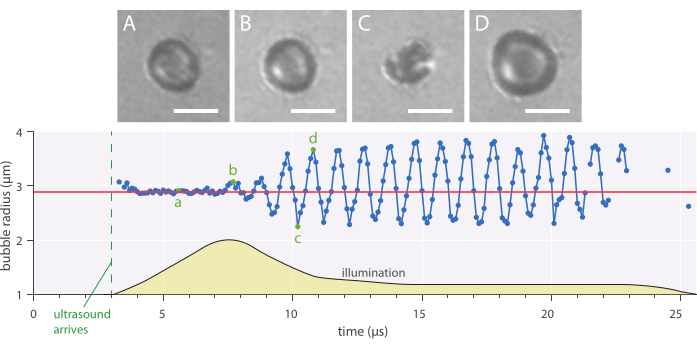
Figura 7: Oscilaciones esféricas típicas de una microburbuja estabilizada con nanopartículas y proteínas de 2,89 μm de radio insonificadas a una frecuencia de ultrasonido de 1 MHz y una amplitud de presión acústica de 142 kPa. (A-D) Imágenes de la grabación de alta velocidad y la curva de radio de burbuja correspondiente a lo largo del tiempo (abajo). Barras de escala = 5 μm, y la línea roja indica el radio inicial. El perfil de iluminación (unidades arbitrarias) se indica en amarillo. La ampliación es de 120x. Haga clic aquí para ver una versión más grande de esta figura.
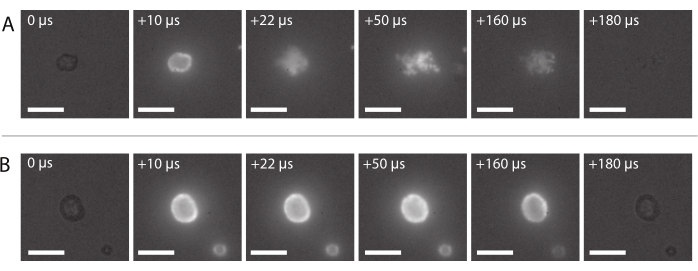
Figura 8: Secuencia de imágenes de microscopía de fluorescencia de alta velocidad. (A) Entrega exitosa de nanopartículas marcadas fluorescentemente de una microburbuja estabilizada con nanopartículas y proteínas insonificadas a una frecuencia de ultrasonido de 2 MHz y una amplitud de presión acústica de 600 kPa. (B) Entrega infructuosa de nanopartículas marcadas fluorescentemente de una microburbuja estabilizada con nanopartículas y proteínas insonificada a una frecuencia de ultrasonido de 2 MHz y una amplitud de presión acústica de 210 kPa. Barras de escala = 10 μm. La ampliación es de 120x. Haga clic aquí para ver una versión más grande de esta figura.
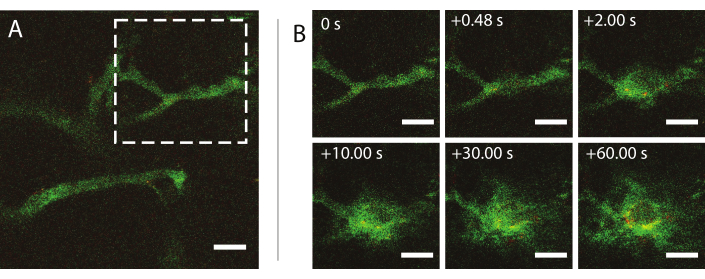
Figura 9: Microscopía intravital después de la insonación de microburbujas estabilizadas con nanopartículas y proteínas a una frecuencia de ultrasonido de 1 MHz y una amplitud de presión acústica de 800 kPa. (A) Nanopartículas dentro del vaso, y (B) una secuencia de imágenes del área indicada por el cuadrado discontinuo blanco en (A) que representa la extravasación de dextrano (verde) y nanopartículas (rojo). Barras de escala = 50 μm. La ampliación es de 20x. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se combinaron diferentes métodos de microscopía óptica para obtener información sobre los diversos pasos en la entrega de nanopartículas desde la superficie de las microburbujas hasta el medio circundante. Se realizaron imágenes de las oscilaciones de burbujas, así como imágenes de la liberación de las nanopartículas de la capa de burbujas, la extravasación y la penetración a través de la matriz extracelular de tumores in vivo. Las imágenes in vitro permiten la detección de muchos parámetros de ultrasonido en comparación con las configuraciones in vivo más complejas. El beneficio de combinar esta gama de modalidades de imágenes es la información complementaria que se puede obtener en diferentes escalas de tiempo, una característica que es crucial para caracterizar y optimizar las microburbujas para una entrega exitosa y para obtener eficacia terapéutica. Este enfoque es útil para comprender los mecanismos de administración de todas las microburbujas por igual, incluidas las construcciones con nanopartículas y medicamentos marcados con fluorescencia.
Los pasos más críticos en los métodos de microscopía utilizados para estudiar microburbujas individuales son los siguientes. Para la microscopía de fluorescencia, las nanopartículas deben estar marcadas fluorescentemente para permitir la visualización de la liberación de partículas. Además, la solución de muestra debe diluirse lo suficiente como para aislar microburbujas individuales para su análisis en métodos de microscopía confocal, de campo brillante y de fluorescencia. Además, es importante elegir una frecuencia de conducción por ultrasonido y presión acústica para excitar las burbujas de la manera más eficiente, es decir, en su resonancia. Si la pregunta de investigación se refiere a la entrega de la carga útil de nanopartículas, los parámetros de ultrasonido apropiados deben ser parte de la investigación. Junto a la resonancia, estas burbujas también deben ser conducidas en o más allá de su umbral para la liberación de nanopartículas, típicamente a amplitudes de presión acústica relativamente altas (MI > 0.3)51. Para las imágenes de microscopía de campo brillante, es fundamental elegir una cámara de alta velocidad con una velocidad de fotogramas lo suficientemente alta como para minimizar el desenfoque de movimiento y evitar el aliasing.
La microscopía de campo brillante está limitada principalmente por la velocidad de fotogramas de las imágenes y la intensidad de las fuentes de luz disponibles, ya que una velocidad de fotogramas más alta daría una visión más detallada y resuelta en el tiempo de la dinámica de la burbuja, pero requiere una iluminación más intensa debido a los tiempos de exposición más cortos. Para estudiar la liberación de partículas con más detalle, la velocidad de fotogramas para las imágenes de fluorescencia puede, en principio, aumentarse aumentando la intensidad de la luz láser. Sin embargo, la absorción de la luz láser de alta intensidad por las microburbujas marcadas fluorescentemente genera calor, incluso con tintes de alto rendimiento cuántico. Este calor puede interferir con los experimentos en juego y, en casos extremos, inducir la cavitación fototérmica52. Por lo tanto, en la práctica, hay un límite para la fluencia láser aplicada. Sin embargo, la iluminación láser intensa también se puede utilizar deliberadamente para inducir la liberación de partículas de liposomas53. La temperatura influye en la dinámica de las burbujas y en la respuesta del ultrasonido, dependiendo del tipo de burbuja54. Por lo tanto, si los métodos in vitro e intravital deben compararse objetivamente, los métodos in vitro discutidos en el protocolo deben realizarse a 37 °C. Otra limitación de los métodos in vitro discutidos en el documento actual es que las burbujas no están en un entorno de campo libre, ya que las microburbujas flotarán debajo de la membrana del soporte de la muestra. Además, existe un sesgo de selección al obtener imágenes de microburbujas individuales. Sin embargo, la realización de experimentos repetidos en burbujas individuales permite la investigación del efecto del tamaño y la eliminación del factor de confusión: la distribución del tamaño. Si la respuesta de la burbuja en función del tamaño se puede entender mientras que la concentración no es demasiado alta para evitar las interacciones burbuja-burbuja, se puede calcular la respuesta de cualquier población arbitraria de burbujas. Finalmente, tanto los métodos de microscopía de campo brillante como los de fluorescencia proporcionan información sobre microburbujas enrevesadas en una imagen bidimensional (2D). Si la pregunta de investigación requiere más de imágenes 2D, el comportamiento 3D de las burbujas se puede resolver combinando la configuración descrita en el protocolo con una configuración de vista lateral para imágenes multiplano55.
Un método alternativo para estudiar las microburbujas es la caracterización acústica56. Sin embargo, medir el eco de una sola microburbuja requiere localizar y aislar una sola microburbuja dentro del haz de ultrasonido56, lo que plantea un desafío típicamente abordado por el uso de un tubo estrecho o pinzas ópticas o acústicas57,58. Para dimensionar las burbujas acústicamente, las microburbujas pueden ser insonificadas en el régimen de dispersión geométrica a frecuencias muy superiores a su frecuencia de resonancia, lo que no induce oscilaciones volumétricas de microburbujas59. El uso de una "cámara acústica" es un método de este tipo para obtener imágenes de la dinámica radial de microburbujas individuales en respuesta al ultrasonido, en el que se utiliza una sonda de ultrasonido de alta frecuencia para determinar la respuesta radial de la burbuja a una onda impulsora de baja frecuencia60. La desventaja de este método es que solo se puede usar para determinar el cambio relativo del radio de la microburbuja; por lo tanto, se necesita otro método para determinar el radio de burbuja absoluto, por ejemplo, a través de imágenes ópticas61,62. La desventaja de los métodos en los que las microburbujas se exponen al ultrasonido a frecuencias superiores a su frecuencia de resonancia es que a frecuencias tan altas, la profundidad de penetración disminuye59, lo que limita la usabilidad para aplicaciones in vivo. También se pueden utilizar otras formas de microscopía para estudiar microburbujas como la microscopía electrónica de barrido, la microscopía de fuerza atómica y la microscopía electrónica de transmisión63. La resolución espacio-temporal alcanzable de estas técnicas alternativas de microscopía, sin embargo, es generalmente más limitada, y estas técnicas tienen la desventaja de que las imágenes se realizan antes o después de la exposición al ultrasonido mediante análisis fuera de línea y generalmente presentan un bajo rendimiento63. Otra alternativa es utilizar un método de dispersión de luz, que se puede utilizar para estudiar la dinámica radial de microburbujas individuales en tiempo real, pero tiene una baja relación señal/ruido en comparación con los métodos de dispersión acústica64.
La microscopía intravital en tiempo real durante la exposición al ultrasonido es un método poderoso para adquirir nuevos conocimientos sobre la vasculatura, el comportamiento de las microburbujas, las nanopartículas u otras moléculas (como el dextrano en este caso) durante la exposición al ultrasonido. Una limitación general al realizar microscopía intravital en tiempo real es que solo se toma una imagen de un área pequeña del tejido y la profundidad de penetración de la luz en el tejido es limitada. Si los vasos fotografiados contienen muy pocas microburbujas y/o nanopartículas dentro del campo de visión, se puede obtener poca o ninguna información sobre el comportamiento y la extravasación de las nanopartículas. Además, debido al campo de visión limitado, una alineación adecuada entre las rutas de luz y ultrasonido es crucial. Si la presión del ultrasonido es lo suficientemente alta como para inducir la destrucción de burbujas, también es importante elegir una frecuencia de repetición de pulsos que permita que las burbujas frescas se vuelvan a fusionar en el campo de visión entre los pulsos de ultrasonido. Además, como el ultrasonido se reflejará desde el vidrio de la cubierta en la cámara de la ventana y el objetivo, colocar el transductor en ángulo es importante para reducir los reflejos y evitar la formación de ondas estacionarias, que distorsionan el campo de presión calibrado. Otro problema práctico es que la configuración debe tener suficiente espacio para montar el transductor de ultrasonido y la guía de onda por encima o por debajo del objetivo en la configuración del microscopio. Los tumores en la cámara de la ventana dorsal tendrán un grosor limitado debido a la cámara de confinamiento y el deslizamiento de la cubierta; sin embargo, si es necesario, se podrían utilizar otros modelos. Algunos ejemplos son los tumores del pliegue cutáneo, por ejemplo, en la almohadilla de grasa mamaria65 o la imagen intravital abdominal de tumores en los diversos órganos66. Tales tumores pueden ser cultivados ortotópicamente en el microambiente apropiado, y como tal, presentan un caso clínicamente más relevante.
Los métodos descritos en este trabajo iluminan el potencial de las microburbujas marcadas fluorescentemente para estudiar los fundamentos de las aplicaciones de administración de fármacos utilizando burbujas y ultrasonido. Esta combinación de métodos de microscopía proporciona información valiosa sobre la respuesta de la microburbuja a la insonación por ultrasonido y su espacio de parámetros acústicos asociado y presenta una visión clara del comportamiento de la microburbuja y la carga útil en un rango relevante de escalas de tiempo y longitud.
Divulgaciones
Los autores declaran que no hay conflicto de intereses.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
Referencias
- Szabo, T. L. . Diagnostic ultrasound imaging: inside out. , (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197 (2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E., Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). , 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. . Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8 (2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -. N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103 (2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, &. #. 2. 2. 1. ;., et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876 (2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. . Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115 (2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103 (2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911 (2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501 (2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados