Method Article
Многовременные методы микроскопии для характеристики флуоресцентно меченых микропузырьков для ультразвукового высвобождения лекарственных средств
В этой статье
Резюме
Представленные протоколы могут быть использованы для характеристики реакции флуоресцентно меченых микропузырьков, предназначенных для применения в ультразвуковой доставке лекарств, включая их механизмы активации, а также их биоэффекты. В этой статье рассматривается ряд методов микроскопии in vitro и in vivo , выполняемых для захвата соответствующей длины и временных масштабов.
Аннотация
Микропузырьковые контрастные вещества имеют большие перспективы для доставки лекарств с ультразвуком. Инкапсуляция препаратов в наночастицы снижает системную токсичность и увеличивает время циркуляции препаратов. В новом подходе к доставке лекарств с помощью микропузырьков наночастицы включаются в или на микропузырьковых оболочках, что обеспечивает локальное и триггерное высвобождение полезной нагрузки наночастиц с помощью ультразвука. Глубокое понимание механизмов высвобождения в обширном пространстве параметров ультразвука имеет решающее значение для эффективного и контролируемого высвобождения. Данный набор представленных протоколов применим к микропузырькам с оболочкой, содержащей флуоресцентную метку. Здесь основное внимание уделяется микропузырькам, нагруженным поли(2-этил-бутилцианоакрилатом) полимерными наночастицами, легированными модифицированным красителем Nile Red. Частицы фиксируются внутри денатурированной казеиновой оболочки. Микропузырьки получают путем энергичного перемешивания, образуя дисперсию газа перфторпропана в жидкой фазе, содержащей казеин и наночастицы, после чего оболочка микропузырька самосборется. Различные методы микроскопии необходимы для характеристики стабилизированных наночастицами микропузырьков во всех соответствующих временных масштабах процесса высвобождения наночастиц. Флуоресценция наночастиц позволяет конфокальной визуализации отдельных микропузырьков, выявляя распределение частиц внутри оболочки. Сверхскоростная визуализация in vitro с использованием микроскопии яркого поля со скоростью 10 миллионов кадров в секунду дает представление о динамике пузырьков в ответ на ультразвуковое инсонирование. Наконец, высвобождение наночастиц из оболочки пузыря лучше всего визуализируется с помощью флуоресцентной микроскопии, выполняемой со скоростью 500 000 кадров в секунду. Чтобы охарактеризовать доставку лекарств in vivo, триггерное высвобождение наночастиц в сосудистой системе и их экстравазацию за пределы эндотелиального слоя изучают с помощью прижизненной микроскопии в опухолях, имплантированных в дорсальные оконные камеры кожи, в течение нескольких минут. Сочетание этих дополнительных методов характеризации дает уникальное представление о поведении микропузырьков и высвобождении их полезной нагрузки в диапазоне временных и длинных масштабов, как in vitro , так и in vivo.
Введение
Ультразвук является наиболее широко используемым методом медицинской визуализации. Он неинвазивный, быстрый, безопасный, экономичный и портативный1,2,3. Однако кровь является плохим ультразвуковым рассеивателем, и контрастность кровотока может быть усилена внутривенной инъекцией ультразвуковых контрастных веществ3. Этот улучшенный контраст между пулом крови позволяет количественно оценить перфузию органов в диагностических целях, например, при выявлении ишемической болезни сердца4 и метастатической болезни печени5. Действительно, было доказано, что опухолевая сосудистая система является важным прогностическим фактором6. Основные исследовательские усилия в настоящее время направлены на микропузырьковую, целевую молекулярную визуализацию и адаптацию контрастных агентов для терапевтического использования.
Коммерчески доступные ультразвуковые контрастные вещества обычно состоят из суспензии покрытых микропузырьков7,8 диаметром от 1 мкм до 10 мкм9. Поскольку микропузырьки ультразвукового контрастного вещества немного меньше, чем эритроциты7, микропузырьки могут безопасно достигать даже самых маленьких капилляров, не создавая окклюзии3. Микропузырьки имеют резко повышенный коэффициент обратного рассеяния ультразвука по сравнению с тканью10 из-за их сжимаемого газового ядра11. Кроме того, микропузырьковое эхо очень нелинейно, т.е. его спектр содержит гармоники и субгармоники движущей частоты. Кроме того, сила эха сильно зависит от резонансной реакции пузыря12. В то время как ткань рассеивается только линейно, небольшого количества микропузырьков достаточно для достижения высокой чувствительности обнаружения в гармонической визуализации13,14. Эта нелинейная генерация контраста может быть даже достаточно сильной, чтобы отслеживать одиночные пузырьки в теле15.
Оболочка ультразвукового контрастного вещества стабилизирует пузырьки против растворения и слияния, тем самым увеличивая время их циркуляции в бассейне крови16. Оболочка может состоять из липидов, полимеров или денатурированных белков3,8. Он уменьшает межфазное напряжение, тем самым ограничивая эффект растворения, управляемого давлением Лапласа17, и создает резистивный барьер против диффузии газа18. Для дальнейшего повышения стабильности контрастные микропузырьки обычно заполняются высокомолекулярным газом с низкой растворимостью в крови11. Оболочка микропузырька резко изменяет реакцию микропузырьков на ультразвуковую инсонацию11. Пузырьки газа без покрытия имеют характерную резонансную частоту, которая обратно пропорциональна их размеру, и добавление липидного покрытия увеличивает резонансную частоту по отношению к частоте непокрытого пузырька из-за внутренней жесткости оболочки3. Кроме того, оболочка рассеивает энергию через дилатационную вязкость, которая является доминирующим источником демпфирования для покрытых пузырьков3. Стабилизирующая оболочка имеет дополнительное преимущество, заключающееся в том, что она может быть функционализирована, например, путем связывания целевых лигандов с поверхностью микропузырьков. Это нацеливание позволяет использовать множество применений для этих пузырьков и, в частности, молекулярную визуализацию с помощью ультразвука14,19.
Микропузырьковые контрастные вещества имеют большие перспективы для доставки лекарств с ультразвуком. Микропузырьки, колеблющиеся в замкнутости кровеносного сосуда, могут вызывать микропоток, а также локальные нормальные и сдвиговые нагрузки на стенку капилляра3. При высоких акустических давлениях колебания большой амплитуды могут привести к коллапсу микропузырьков в бурном процессе, называемом инерционной кавитацией, что, в свою очередь, может привести к разрыву или инвагинации кровеносного сосуда20. Эти насильственные явления могут вызывать биоэффекты, такие как сонопермеация21, усиливая экстравазацию терапевтических препаратов в интерстиций через эндотелиальную стенку, либо параклеточную, либо трансклеточную. Он также может улучшить проникновение терапевтических агентов через внеклеточный матрикс богатых стромой опухолей21,22 и биопленок23,24, хотя этот механизм все еще плохо изучен26.
Ультразвукопосредованная доставка лекарств показала многообещающие результаты как доклинически27,28, так и в клинических испытаниях22. Кроме того, при использовании с относительно низкочастотным ультразвуком (~ 1 МГц) сообщалось, что микропузырьки локально и временно увеличивают проницаемость гематоэнцефалического барьера, тем самым позволяя препаратам проникать в паренхиму головного мозга, как в доклинических, так и в клинических исследованиях29,30,31,32,33,34.
Как правило, существует два подхода к доставке лекарственного средства, опосредованной ультразвуком: терапевтический материал можно вводить совместно с пузырьками, или он может быть прикреплен или загружен в оболочку пузыря28,35,36. Было показано, что второй подход более эффективен с точки зрения доставки лекарств37. Микропузырьки могут быть загружены лекарственными средствами или генетическим материалом, инкапсулированным в наночастицы (липосомы или полимерные наноконструкции), прикрепленные к оболочке или включенные непосредственно в микропузырьковую оболочку35,36. Микропузырьки, нагруженные наночастицами, могут быть активированы (сфокусированным) ультразвуком для локального высвобождения полезной нагрузки наночастиц28,33,38,39,40. Если такой микропузырь находится в прямом контакте с клеткой, было показано in vitro, что полезная нагрузка может быть даже нанесена на цитоплазматическую мембрану клетки в процессе, называемом сонопечатью34,35.
Пространство параметров ультразвука для микропузырьковой инсонации обширно, а биологические условия in vivo еще больше усложняют. Таким образом, сочетание сфокусированного ультразвука и микропузырьков, нагруженных наночастицами, представляет собой проблему в области таргетной терапии.
Целью этой работы является предоставление протоколов, которые могут быть использованы для детального изображения реакции микропузырьков в зависимости от параметров ультразвука и изучения механизмов, приводящих к разрыву оболочки и последующему высвобождению флуоресцентно меченого материала оболочки. Этот набор протоколов применим к микропузырькам с оболочками, которые содержат флуоресцентный краситель. На рисунке 1 показано схематическое изображение полимерно-наночастиц-и-белково-стабилизированных микропузырьков, разработанных в SINTEF (Тронхейм, Норвегия). Эти пузырьки заполнены газообразным перфторпропаном (C3F8), а наночастицы, стабилизирующие оболочку, содержат NR668, который является липофильным производным флуоресцентного красителя Nile Red38,43. Наночастицы состоят из поли(2-этил-бутилцианоакрилата) (PEBCA) и являются PEGylated. Функционализация полиэтиленгликолем (ПЭГ) уменьшает опсонизацию и фагоцитоз мононуклеарной фагоцитарной системой, тем самым продлевая время циркуляции14,44. В результате ПЭГилирование увеличивает количество наночастиц, достигающих целевого участка, тем самым повышая эффективность лечения16. Рисунок 2 иллюстрирует, как использование четырех методов микроскопии позволяет исследователям охватить все соответствующие шкалы времени и длины. Следует отметить, что пространственное разрешение, достижимое в оптической микроскопии, определяется дифракционным пределом, который зависит от длины волны света и числовой апертуры (NA) объектива и источника освещения объекта45. Для имеющихся систем предел оптического разрешения обычно составляет 200 нм. Кроме того, прижизненная микроскопия может быть использована для изображения на субклеточном уровне46. Для микропузырьков, стабилизированных наночастицами и белками, используемых в этой работе, минимальной шкалой длины, относящейся к прижизненной микроскопии, является размер малых капилляров (≥10 мкм). Эксперименты in vitro с высокоскоростной оптической визуализацией (10 миллионов кадров в секунду) и высокоскоростной флуоресцентной визуализацией (500 000 кадров в секунду) описаны для одиночных микропузырьков. Высокоскоростная визуализация яркого поля на наносекундных временных масштабах подходит для изучения радиальной динамики вибрирующих пузырьков с временным разрешением. Напротив, высокоскоростная флуоресцентная микроскопия позволяет непосредственно визуализировать высвобождение флуоресцентно меченых наночастиц. Кроме того, структура микропузырьковой оболочки может быть исследована с помощью Z-стековой трехмерной (3D) конфокальной микроскопии и сканирующей электронной микроскопии (протокол для последней не включен в текущую работу). Прижизненная микроскопия заключается в использовании многофотонной микроскопии для изображения опухолей, растущих в дорсальных оконных камерах, для предоставления информации в режиме реального времени о местном кровотоке и о судьбе флуоресцентно меченых наночастиц in vivo47. Комбинация этих методов микроскопии в конечном итоге дает подробное представление о поведении терапевтических микропузырьковых агентов в ответ на ультразвук, как in vitro, так и in vivo.
протокол
ПРИМЕЧАНИЕ: Все экспериментальные процедуры были одобрены Норвежскими органами по исследованию животных. Подробную информацию о материалах, которые были использованы в протоколе, можно найти в Таблице материалов.
1. Производство микропузырьков
ПРИМЕЧАНИЕ: В этой работе представляющими интерес микропузырьками являются стабилизированные белками и наночастицами микропузырьки, для которых протокол производства был описан ранее28,33,48. Поэтому протокол фабрикации был кратко обобщен здесь.
- Во-первых, используя пипетку, смешайте сверхчистую воду с 0,5 мас.% казеина в фосфатно-буферном физиологическом растворе (PBS) и 1 мас.% наночастиц, помеченных 0,21 мас.% флуоресцентного красителя NR668 (модифицированный Nile Red), в стерильном стеклянном обжимном верхнем флаконе (10 мл, диаметр 2 см). Полимерные наночастицы получают с использованием метода мини-эмульсионной полимеризации, описанного Mørch et al. 38.
ПРИМЕЧАНИЕ: Здесь краситель функционирует как модельный препарат, позволяющий визуализировать высвобождение наночастиц. При работе с раствором наночастиц надевайте лабораторный халат, очки и перчатки. Немедленно вытрите любые разливы раствора наночастиц 100% ацетоном. - Закройте флакон резиновым колпачком, слегка перемешайте и поместите флакон в ультразвуковую ванну на 10 минут при комнатной температуре, чтобы исключить возможные агрегаты. Поместите дисперсионный инструмент с наконечником мешалки ~0,5 см от дна стеклянного флакона. Используя стеклянную пипетку, соединенную с газовым баллоном, добавьте газ перфторпропан в пространство головки флакона, содержащего раствор, до тех пор, пока раствор не начнет слегка бурлить.
ПРИМЕЧАНИЕ: Оберните самогерметизируемую пленку вокруг основания дисперсионного инструмента, чтобы предотвратить скольжение стеклянного флакона во время перемешивания. - Энергично перемешайте раствор при 1935 × г (24 000 об/мин с радиусом вращения 3 мм) в течение 4 мин с помощью дисперсионного инструмента. Закройте флакон резиновым колпачком и запечатайте флакон для дальнейшего использования.
ПРИМЕЧАНИЕ: Перемешивание задерживает газ в жидкости. Микропузырьковая оболочка впоследствии самособирается, не требуя какого-либо активного шага. - Храните избыток казеина и раствора наночастиц при 4 °C и очищайте дисперсионный инструмент 100% ацетоном.
2. Визуализация одиночных пузырьков
- Конфокальная микроскопия
- Пробоподготовка
- Разбавьте пузырьковый раствор для изображения одиночных микропузырьков следующим образом. Поместите вентиляционную иглу (19 G-21 G) в стеклянный обжимной верхний флакон, содержащий микропузырьки, полученные путем выполнения процедуры, описанной в разделе 1. Переверните флакон вверх дном, чтобы позволить крупным пузырькам отойти от уплотнения флакона.
- Вставьте еще один наконечник иглы (19 г) небольшого (~1 мл) шприца во флакон, пока флакон все еще перевернут. Удалите небольшое количество пузырьковой суспензии и перенесите содержимое шприца в небольшую трубку для облегчения пипетки на следующем этапе.
ПРИМЕЧАНИЕ: Объем извлекаемой суспензии напрямую зависит от типа и концентрации пузырьковой суспензии. В этом случае было извлечено 0,2 мл. - Используя пипетку, разбавьте микропузырьковую суспензию (из секции 1) в фильтрованном PBS для достижения концентрации приблизительно 2 × 105-6 × 105 микропузырьков/мл, чтобы обеспечить однопузырьковую визуализацию.
ПРИМЕЧАНИЕ: В зависимости от типа пузырьков рекомендуется промывать пузырьковую суспензию для удаления свободного флуоресцентного красителя. Это особенно важно с пузырьками, для которых флуоресцентный краситель вливается в оболочку. Для промывания пузырьков разбавляют пузырьковую суспензию (например, взяв 100 мкл пузырькового раствора в 10 мл PBS) и центрифугируют ее (обычно со скоростью порядка 100 × г). Наконец, удалите супернатант, содержащий микропузырьки, пипеткой для дальнейшего анализа. Оставшийся раствор содержит свободные флуоресцентные частицы и может быть выброшен. Этап стирки следует повторять по мере необходимости. - Добавьте глицерин в смесь, чтобы увеличить вязкость среды и устранить движение, вызванное броуновским движением, которое в противном случае мешало бы довольно медленной конфокальной визуализации Z-стека.
ПРИМЕЧАНИЕ: Количество глицерина зависит от типа пузырька, который изображен (здесь, ~ 50%). Для некоторых типов пузырьков глицерин может оказывать неблагоприятное влияние на стабильность49. Тем не менее, никаких заметных изменений не наблюдалось в пузырьках в течение примерно 30 минут при конфокальной визуализации. Кроме того, глицерин может изменять акустическую реакцию микропузырьков и поэтому может использоваться только с методами визуализации, где микропузырьки не инсонируются. - Поместите микропузырьковую суспензию в камеру с тонкими стенками для оптимального изображения, такого как скольжение канала.
- Протокол обработки изображений
- Включите конфокальный микроскоп и выберите подходящий объектив и нужный лазер и сканер для использования во время конфокальной микроскопии.
ПРИМЕЧАНИЕ: Здесь используйте объектив погружения в воду 60x для разрешения 0,08 мкм/пиксель и, в зависимости от размера пузырька, изображение в области 256 x 256 пикселей или 128 x 128 пикселей. В этих конкретных экспериментах используют лазер 488 нм и сканер Galvano. Длина волны излучения зависит от флуоресцентного красителя и, как правило, является широкополосной. - Найдите микропузырь в ярком поле и переключитесь на конфокальную микроскопию. Установите желаемую верхнюю и нижнюю плоскости, между которыми будет сканировать конфокальный микроскоп. Приобретите Z-стек для наблюдения за 3D-структурой; использовать шаг размером 100 нм в Z-направлении.
- Включите конфокальный микроскоп и выберите подходящий объектив и нужный лазер и сканер для использования во время конфокальной микроскопии.
- Пробоподготовка
- Ярко-полевая микроскопия
- Сборка оптической системы
ПРИМЕЧАНИЕ: Схематическое изображение установки микроскопии яркого поля показано на рисунке 3А. Для обеспечения беспрепятственного распространения ультразвука водяная баня содержит два отверстия: одно для источника света и одно для ультразвукового преобразователя. Оптическая система состоит из (модульного) микроскопа, высокоскоростной камеры и соответствующей оптики. Поскольку период микропузырьковых колебаний обычно составляет порядка 1 мкс (с использованием ультразвука 1 МГц), камера должна быть настроена на запись с частотой кадров не менее 5 миллионов кадров в секунду. Здесь камера должна быть настроена на запись со скоростью 10 миллионов кадров в секунду (256 x 400 пикселей) для 256 кадров (25,6 мкс), чтобы захватить все детали динамики пузырьков, включая более высокие гармоники.- Прикрепите к микроскопу объектив погружения в воду с соответствующим увеличением, рабочим расстоянием и NA.
ПРИМЕЧАНИЕ: Цель погружения в воду использовалась для обеспечения стабильного рабочего расстояния, несмотря на постепенное испарение воды. Здесь был выбран водоигровой объектив с увеличением 60x, рабочим расстоянием 2 мм и NA 1. - Используйте стробоскоп с пиковой выходной мощностью не менее 1 кВт для освещения и ламповой объектив между микроскопом и камерой, чтобы как можно меньше окружающего света достигало датчика высокоскоростной камеры.
- Используйте затемняемый галогенный источник света для фокусировки на одиночных микропузырьках и выравнивания оптической и акустической системы для визуализации в режиме реального времени.
- Прикрепите к микроскопу объектив погружения в воду с соответствующим увеличением, рабочим расстоянием и NA.
- Монтаж акустической системы
- Используйте программируемый генератор сигналов произвольной формы и усилитель мощности (коэффициент усиления 56 дБ) для привода преобразователя с плавным обволакиванием и формой сигнала. Подключите осциллограф к генератору сигналов произвольной формы для проверки сигнала. Подключите персональный компьютер к генератору сигналов произвольной формы для программирования входящей волны акустического давления, используя сценарий, написанный собственными силами.
- Используйте генератор импульсов/задержек в качестве главного триггера для синхронизации оптической и акустической систем. Установите триггерные задержки на генераторе импульсов / задержек и программном обеспечении камеры таким образом, чтобы запись начиналась через 16 мкс после ультразвуковой передачи, чтобы ультразвуковая волна достигла пузырьков. Включите источник света за 1,5 мкс до начала записи, чтобы обеспечить надлежащее освещение во время пузырьковых колебаний (см. диаграмму синхронизации на рисунке 3B ).
- Выберите подходящий преобразователь с соответствующей центральной частотой. Поместите его в отверстие водяной бани, чтобы он находился под углом по отношению к оптической оси, чтобы свести к минимуму отражения от мембран держателя образца и уменьшить образование стоячей волны.
ПРИМЕЧАНИЕ: Здесь одноэлементный сфокусированный погружной преобразователь с центральной частотой 2,25 МГц, фокусным расстоянием 1" и диаметром элемента 0,75" был размещен под углом 35° по отношению к оптической оси. Калибровка передаточной функции должна выполняться с использованием того же усилителя, который используется в акустической системе. Откалибруйте функцию передачи от амплитуды напряжения до амплитуды давления преобразователя с помощью волоконно-оптического гидрофона в зависимости от частоты передачи ультразвука.
- Выбор держателя образца
- Используйте держатель образца с оптически и акустически прозрачными мембранами и объемом, достаточно большим, чтобы можно было визуализировать несколько отдельных микропузырьков в одном образце.
ПРИМЕЧАНИЕ: Здесь использовалась кассета клеточной культуры объемом 10 мл, площадью мембраны 25 см2 и толщиной мембраны 175 мкм. Из-за акустических отражений на нижней мембране и помех от волн, отраженных объективом микроскопа и верхней мембраной, акустическое давление in situ может отличаться от давления, запрограммированного на генераторе сигналов произвольной формы. Размещение преобразователя под углом по отношению к мембранам держателя образца уменьшает образование стоячей волны, но может увеличить отражения от мембран. - Убедитесь, что образец может быть полностью погружен и помещен в фокус как датчика, так и объектива микроскопа. Используйте алюминиевую опору, прикрепленную к 3D-ступени микропозиционирования, чтобы перемещать держатель образца независимо.
- Используйте держатель образца с оптически и акустически прозрачными мембранами и объемом, достаточно большим, чтобы можно было визуализировать несколько отдельных микропузырьков в одном образце.
- Выравнивание оптической и акустической систем
- Чтобы 3D-трансляция выровняла установку, прикрепите водяную баню к сцене XY-трансляции и прикрепите сцену к оптическому столу, чтобы она не двигалась во время экспериментов. Затем наполните водяную баню водой и включите затемняемый галогенный источник света. Во время выравнивания переместите объектив микроскопа в сторону, чтобы предотвратить ультразвуковые отражения.
- Прикрепите игольчатый гидрофон (0,2 мм) к кронштейну держателя образца и поместите игольчатый гидрофон в водяную баню, наконечником в поле зрения объектива. Включите усилитель и генератор сигналов произвольной формы; используйте одиночные импульсы от 5 до 10 циклов ультразвука и частоту повторения импульсов 15 Гц. Убедитесь, что наконечник гидрофона центрирован и сфокусирован на изображении микроскопа. Перемещайте резервуар в направлении XY, а иглу в Z-направлении до достижения максимальной амплитуды давления.
- Отрегулируйте фокус микроскопа, чтобы перефокусироваться на наконечнике гидрофона.
ПРИМЕЧАНИЕ: Этот протокол обеспечивает выравнивание между фокусом микроскопа и фокусом преобразователя. Не изменяйте положение микроскопа и преобразователя после выравнивания.
- Пробоподготовка
- Повторите шаги 2.1.1.1-2.1.1.3 для подготовки образца раствора. Разбавьте пузырьковый раствор, чтобы обеспечить однопузырьковую визуализацию и исключить акустические взаимодействия соседних пузырьков.
- Откройте выходное отверстие держателя образца. Используя шприц, вводите раствор образца в другое отверстие держателя образца до тех пор, пока он полностью не будет заполнен. Убедитесь, что внутри держателя образца нет пузырьков воздуха, чтобы предотвратить нежелательные взаимодействия с ультразвуковым полем.
- Закройте оба клапана держателя образца и поместите держатель образца перпендикулярно оптической оси.
ПРИМЕЧАНИЕ: Держите заполненный держатель образца на уровне, чтобы предотвратить смещение пузырьков в одну сторону держателя образца во время перемещения.
- Протокол обработки изображений
- Запрограммируйте требуемую частоту ультразвукового управления и акустическое давление в генераторе сигналов произвольной формы с помощью вышеупомянутого собственного письменного сценария.
ПРИМЕЧАНИЕ: Здесь волна акустического давления представляла собой одиночный всплеск из 40 циклов с 8-тактным гауссовским коническим импульсом. Ультразвуковые частоты, используемые в этих экспериментах, составляли 1 МГц, 2 МГц или 3 МГц, с амплитудами акустического давления в диапазоне от 81 кПа до 1200 кПа. - Переместите держатель образца, содержащий раствор образца, используя XYZ-стадию, чтобы найти отдельные микропузырьки в фокусе микроскопа. Начните с поля зрения в углу держателя образца и убедитесь, что край микропузырьков хорошо виден и находится в фокусе (см. Рисунок 3C для идеального обзора камеры).
- Прикрепите конец оптического волокна, которое ранее было подключено к галогенному свету, к стробоскопу, чтобы другой конец все еще был подключен к водяной бане. Запустите запись.
- Повторяйте шаги 2.2.6.2-2.2.6.3 столько раз, сколько требуется для ультразвуковой настройки (частота и акустическое давление), перемещая кассету клеточной культуры, содержащую микропузырьки, по меньшей мере на 2 мм (в фокальной плоскости) из предыдущего местоположения, чтобы гарантировать, что микропузырьки в поле зрения не будут инсонифицированы в предыдущих экспериментах.
ПРИМЕЧАНИЕ: Здесь каждый эксперимент повторялся ~20 раз. Когда весь держатель образца будет инсонизирован, опорожните держатель образца и наполните его свежим раствором образца для последующих экспериментов.
- Запрограммируйте требуемую частоту ультразвукового управления и акустическое давление в генераторе сигналов произвольной формы с помощью вышеупомянутого собственного письменного сценария.
- Анализ данных
- Примите среду программирования для выполнения анализа данных в соответствии с вопросом исследования и выполните обнаружение краев после обработки изображений. Используя функцию, которая измеряет свойства областей изображения, найдите центроид пузыря и производную профиля интенсивности вокруг каждого пузыря, чтобы обнаружить контур пузыря (и, следовательно, радиус пузыря R). Извлекайте соответствующие параметры из радиуса с течением времени для одиночных микропузырьков.
ПРИМЕЧАНИЕ: В настоящем исследовании для обработки изображений использовалась среда программирования для бинаризации и фильтрации записей одиночных микропузырьков. Внутренний скрипт был использован для поиска производной профиля интенсивности вокруг каждого пузыря.
- Примите среду программирования для выполнения анализа данных в соответствии с вопросом исследования и выполните обнаружение краев после обработки изображений. Используя функцию, которая измеряет свойства областей изображения, найдите центроид пузыря и производную профиля интенсивности вокруг каждого пузыря, чтобы обнаружить контур пузыря (и, следовательно, радиус пузыря R). Извлекайте соответствующие параметры из радиуса с течением времени для одиночных микропузырьков.
- Сборка оптической системы
- Флуоресцентная микроскопия
- Сборка оптической системы
- Постройте установку для флуоресцентной микроскопии (рисунок 4А) с тем же основанием, которое используется в микроскопии яркого поля, описанной в разделе 2.2.
ПРИМЕЧАНИЕ: Установка, описанная в разделе 2.3, может быть объединена с установкой, описанной для микроскопии яркого поля в разделе 2.2. Сочетание флуоресцентной микроскопии и микроскопии яркого поля позволяет визуализировать микропузырьковое газовое ядро при визуализации высвобождения наночастиц. - Установите высокоскоростную камеру для записи со скоростью 500 000 кадров в секунду (400 x 250 пикселей) в течение 128 кадров (256 мкс).
ПРИМЕЧАНИЕ: Время визуализации больше, чем в экспериментах с ярким полем, поскольку интенсивность света ограничена флуоресценцией, и потому что временная шкала, в течение которой происходит доставка частиц, длиннее, чем у динамики пузырьков. - Выберите лазер с мощностью, достаточно высокой для подачи достаточного количества света, и который имеет подходящую длину волны возбуждения, и убедитесь, что он соединен с акустооптическим модулятором, чтобы избежать отбеливания образца.
ПРИМЕЧАНИЕ: В этом исследовании для возбуждения флуоресценции наночастиц использовался лазер непрерывной волны мощностью 5 Вт с длиной волны возбуждения 532 нм. - Поместите делитель луча, дихроичное зеркало и выемчатый фильтр между лазером и объективом микроскопа, чтобы направить свет возбуждения к образцу, позволяя флуоресцентному излучению достичь камеры.
- Постройте установку для флуоресцентной микроскопии (рисунок 4А) с тем же основанием, которое используется в микроскопии яркого поля, описанной в разделе 2.2.
- Монтаж акустической системы
- Чтобы озвучить микропузырьки, используйте ту же акустическую установку, что и в разделе 2.2.2. Измените преобразователь в этих конкретных экспериментах на одноэлементный, сфокусированный погружной преобразователь с центральной частотой 2,25 МГц, фокусным расстоянием 1,88", и диаметром элемента 1". Поместите его под углом 35° по отношению к оптической оси, чтобы свести к минимуму отражения от мембран держателя образца и уменьшить образования стоячей волны.
- Выравнивание оптической и акустической систем
- Повторите шаги, описанные в разделе 2.2.4.
- Пробоподготовка
- Подготовьте образец раствора, как описано в разделе 2.2.5.
- Протокол обработки изображений
- Установите желаемую частоту ультразвукового привода и амплитуду акустического давления на генераторе сигналов произвольной формы с помощью вышеупомянутого собственного письменного сценария.
ПРИМЕЧАНИЕ: Здесь волна акустического давления была запрограммирована как один всплеск ультразвука из 140 циклов с 10-циклным гауссовским коническим импульсом. Для индуцирования биоэффектов обычно требуется более длительная продолжительность импульса по сравнению с теми, которые требуются для изучения динамики пузырьков. Ультразвуковые частоты, используемые в этих экспериментах, составляли 1 МГц, 2 МГц или 3 МГц, с амплитудами акустического давления в диапазоне от 81 кПа до 1200 кПа. - На генераторе импульсов/задержек установите триггерную задержку для лазера для флуоресцентного возбуждения наночастиц из микропузырьков во время записи.
ПРИМЕЧАНИЕ: Для этих конкретных экспериментов задержка триггера составляла от 20 мкс до 170 мкс при общей продолжительности 150 мкс. Временная диаграмма показана на рисунке 4B. - Переместите держатель образца, содержащий раствор образца, используя XYZ-стадию, чтобы найти отдельные микропузырьки в фокусе микроскопа. Начните с поля зрения угла держателя образца; см. рисунок 4C для идеального обзора камеры, в котором интерфейс микропузырьков хорошо виден и сфокусирован. Запустите запись.
- Повторите этап 2.3.5.3 столько раз, сколько требуется на ультразвуковой настройке (частота и акустическое давление), перемещая кассету клеточной культуры, содержащую микропузырьки, по меньшей мере, на 2 мм (в оптической плоскости) из предыдущего местоположения, чтобы убедиться, что микропузырьки в поле зрения не обрабатываются ультразвуком в предыдущих экспериментах.
ПРИМЕЧАНИЕ: В этом исследовании каждый эксперимент повторялся ~10-20x. Когда весь держатель образца будет инсонизирован, опорожните держатель образца и наполните его свежим раствором образца для последующих экспериментов. Какое расстояние перемещать держатель образца между экспериментами, зависит от размера акустического пучка.
- Установите желаемую частоту ультразвукового привода и амплитуду акустического давления на генераторе сигналов произвольной формы с помощью вышеупомянутого собственного письменного сценария.
- Анализ данных
- Анализ записей флуоресцентной микроскопии в соответствии с вопросом исследования. Для каждого микропузырька визуально определите, произошла ли доставка наночастиц в экспериментах флуоресцентной микроскопии. Если отслоение и осаждение наночастиц из газового ядра на мембрану держателя образца наблюдается для одного микропузырька, вручную введите, что доставка произошла в среде программирования.
- Сборка оптической системы
3. Прижизненная микроскопия
- Хирургия дорсальной оконной камеры (описана ранее26,47,50)
- Акклиматизируйте животных в течение одной недели перед размещением оконных камер. Хотя можно использовать как самок, так и самцов мышей, а возраст не важен, убедитесь, что вес мышей составляет не менее 22-24 г, чтобы кожа была достаточно гибкой.
- Проводят операцию под общим наркозом с интраоперационным и послеоперационным обезболивающим лечением. Обезболить животное подкожной инъекцией фентанила (0,05 мг/кг)/медетомидина (0,5 мг/кг)/мидазолама (5 мг/кг)/воды (2:1:2:5) в дозе 0,1 мл на 10 г веса. Используйте грелку или нагревательную лампу для поддержания температуры тела животного.
- Осторожно потяните за двойной слой кожи на спине животного так, чтобы кожа была зажата между двумя симметричными полиоксиметиленовыми рамами оконной камеры. Закрепите камеру, поместив два винта, проходящих через двойной слой кожи и зашивающих вдоль верхнего края камеры.
- Удалите кожу в рамках круглой камеры с одной стороны кожной складки. Поместите покровное стекло диаметром 11,8 мм в раму, где снимается кожа, чтобы сформировать окно в ткань.
- Используйте подкожную инъекцию атипемазола (2,5 мг/кг), флумазенила (0,5 мг/кг) и воды (1:1:8) в дозе 0,1 мл на 10 г в качестве антидота для прекращения анестезии. Поместите животное в отапливаемую стойку для восстановления на ночь. Дополните воду для животных 25 мг / мл энрофлоксацина для предотвращения инфекции в месте операции.
- Создание модели опухоли
- Поддерживать раковые клетки при 37 °C и в атмосфере 5% CO2 в соответствующей питательной среде, дополненной 10% фетальной бычьей сывороткой и 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина.
ПРИМЕЧАНИЕ: В этом протоколе использовалась клеточная линия остеосаркомы человека (СГЯ), но могут использоваться и другие клеточные линии. - На следующий день после шага 3.1.5 обезболивают животное изофлураном (5% при индукции и 1-2% при содержании) в течение пары минут. Снимите покровное стекло, нанесите 5 × 106 раковых клеток на 30 мкл клеточной культуральной среды и замените покровное стекло.
- Позвольте опухолям расти в течение 2 недель до визуализации и контролируйте вес и состояние здоровья животных не менее 3 раз в неделю в течение этого периода.
- Поддерживать раковые клетки при 37 °C и в атмосфере 5% CO2 в соответствующей питательной среде, дополненной 10% фетальной бычьей сывороткой и 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина.
- Сборка оптической системы
- Выполняйте прижизненную визуализацию во время ультразвукового лечения (как описано в предыдущей работе26) с помощью подходящего микроскопа и цели в зависимости от поставленного на карту исследовательского вопроса. См. рисунок 5A для схематичного представления экспериментальной установки.
ПРИМЕЧАНИЕ: Для этого конкретного эксперимента был использован многофотонный микроскоп, оснащенный 20-кратным водоопускающим объективом (NA 1,0 и рабочее расстояние 2 мм) и импульсным лазером. Изображения были получены в режиме резонансного сканирования со скоростью 31 кадр в секунду (512 x 512 пикселей) с полем зрения 400 x 400 мкм2. Длина волны возбуждения составляла 790 нм. Фильтры перед двумя детекторами фосфида арсенида галлия были длиннопроходными 590 нм и полосовыми 525/50 нм для обнаружения флуоресценции.
- Выполняйте прижизненную визуализацию во время ультразвукового лечения (как описано в предыдущей работе26) с помощью подходящего микроскопа и цели в зависимости от поставленного на карту исследовательского вопроса. См. рисунок 5A для схематичного представления экспериментальной установки.
- Монтаж акустической системы
- Установите подходящий ультразвуковой преобразователь в волновод (изготовленный на заказ), расположенный под объективом под углом 45° по отношению к оптической оси, чтобы свести к минимуму отражения от покровного стекла дорсальной оконной камеры и уменьшить образования стоячей волны. Наполните волновод дистиллированной и дегазированной водой. Нанесите ультразвуковой соединительный гель поверх волновода.
- Выравнивание оптической и акустической систем
- Выровняйте оптическую ось с фокусом ультразвука. Расположите волоконно-оптический гидрофон в фокусе цели. Затем включите усилитель и генератор сигналов произвольной формы, чтобы возбудить преобразователь короткими всплесками (5-10 циклов) с частотой повторения импульсов 100 Гц, и переместите ультразвуковой преобразователь в положение, где с помощью гидрофонного сигнала на осциллографе обнаруживается наибольшее давление.
ПРИМЕЧАНИЕ: Не изменяйте положение датчика после выравнивания.
- Выровняйте оптическую ось с фокусом ультразвука. Расположите волоконно-оптический гидрофон в фокусе цели. Затем включите усилитель и генератор сигналов произвольной формы, чтобы возбудить преобразователь короткими всплесками (5-10 циклов) с частотой повторения импульсов 100 Гц, и переместите ультразвуковой преобразователь в положение, где с помощью гидрофонного сигнала на осциллографе обнаруживается наибольшее давление.
- Протокол обработки изображений
- Поместите нагретый держатель животного (специально разработанный), подключенный к ступени позиционирования XY между волноводом и объективом, и добавьте еще гель связи. Обезболить животное, и поместить катетер в хвостовую вену. Поместите мышь в подогреваемый держатель и закрепите оконную камеру в держателе. Добавьте каплю воды поверх крышки в оконной камере и переместите объектив на место, чтобы визуализировать опухолевую ткань.
-
На рисунке 5B показана временная диаграмма экспериментов, изображающая порядок событий. Внутривенно вводят флуоресцентно меченый декстран 2 МДа (30 мкл, 4 мг/мл, разбавленные в физиологическом растворе) для визуализации сосудистой системы и перемещают мышь с помощью стадии XY-трансляции, чтобы найти положение с подходящими кровеносными сосудами. Записывайте исходные изображения перед ультразвуковым лечением. Отрегулируйте частоту кадров, поле зрения и длину записи в зависимости от исследовательского вопроса и специфики микроскопа и красителей, которые будут визуализироваться.
ПРИМЕЧАНИЕ: В этих экспериментах был записан 31 кадр в секунду с полем зрения 400 х 400 мкм2, и визуализация производилась непрерывно в течение 5 минут. - Установите требуемую частоту ультразвукового привода, длину импульса и амплитуду акустического давления на генераторе сигналов произвольной формы.
ПРИМЕЧАНИЕ: Для этих экспериментов использовалась частота 1 МГц с длиной импульса 10 мс и пиковыми амплитудами отрицательного давления от 0,2 МПа до 0,8 МПа. Частота повторения импульсов 0,5 Гц или 0,1 Гц использовалась для того, чтобы новые микропузырьки репертифицировались в обработанную область между ультразвуковыми импульсами. - Вводите 50 мкл микропузырьков (2 × от 108 до 5 × 108 микропузырьков / мл) внутривенно и применяйте ультразвук во время визуализации, как описано в 26.
- Анализ данных
- В зависимости от вопроса исследования, анализируйте изображения с помощью программного обеспечения для обработки изображений (с открытым исходным кодом) и среды программирования, как описано в 26, для определения параметров кровеносных сосудов (диаметр, ветвление, скорость потока и направление), накопления наночастиц в сосудах, а также кинетики и глубины проникновения экстравазации декстрана и наночастиц в опухолевую ткань.
Результаты
Микропузырьки, полученные, как описано в протоколе, анализировали с использованием различных методов микроскопии и в различных временных масштабах.
Флуоресценция наночастиц в конфокальной микроскопии (рисунок 6А) указывает на то, что оболочка имеет неравномерное распределение частиц. Другие методы микроскопии могут быть использованы для характеристики пузырьков. Например, на рисунке 6B показана общая структура микропузырька с использованием сканирующей электронной микроскопии, как представлено в предыдущей работе34.
Радиальная динамика и феноменологическое поведение пузырьков могут быть изучены с использованием описанного метода микроскопии яркого поля in vitro, в котором микропузырьки были изображены со скоростью 10 миллионов кадров в секунду. Радиус одиночных микропузырьков был извлечен с течением времени с помощью сценария, написанного собственными силами. Пример такого радиального отклика показан на рисунке 7.
Последовательность изображений типичной успешной доставки наночастиц, как описано в разделе 2.3.6, показана на рисунке 8А. Можно увидеть, как наночастицы, встроенные в микропузырьковую оболочку, загораются из-за флуоресценции, когда лазерный свет достигает пузыря. Приводимые в действие ультразвуковым инсонацией, флуоресцентные наночастицы отделяются от газового ядра микропузырьков и оседают на мембране держателя образца. Наконец, лазер отключается, и флуоресцентные наночастицы больше не возбуждаются. Неудачная доставка флуоресцентно меченой полезной нагрузки микропузырьков обычно выглядит как последовательность изображений, показанная на рисунке 8B, где флуоресцентные наночастицы загораются на оболочке микропузырька, который остается нетронутым во время ультразвукового воздействия.
Прижизненная многофотонная микроскопия в режиме реального времени во время УЗИ использовалась для исследования влияния ультразвука и микропузырьков на поведение наночастиц в крови, повышение проницаемости опухолевых кровеносных сосудов и улучшение доставки наночастиц. Можно охарактеризовать степень и кинетику проникновения во внеклеточный матрикс в зависимости от акустического давления, частоты и длины импульсов. Эффект ультразвукового лечения может варьироваться в зависимости от размера и морфологии сосудов и последующего удержания пузыря. Как ультразвуковое лечение влияет на кровоток и направление может быть определено. Пример эксперимента, показывающий экстравазацию наночастиц с течением времени, показан на рисунке 9 при механическом индексе (MI) 0,826. Результаты прижизненной многофотонной микроскопии проясняют пространственную и временную экстравазацию наночастиц при ультразвуковом воздействии, что очень полезно для полного понимания механизмов, лежащих в основе ультразвуковой опосредованной доставки наночастиц, и для оптимизации таких технологий26.
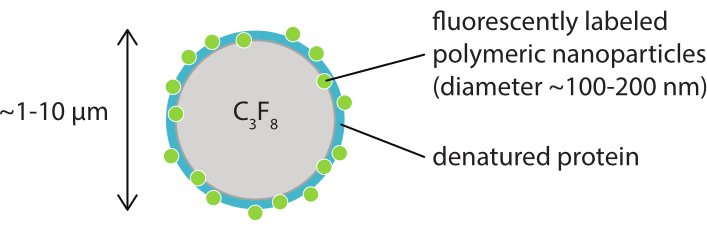
Рисунок 1: Схематическое изображение микропузырька с оболочкой флуоресцентно меченых полимерных наночастиц в денатурированном казеине. Микропузырьки обычно имеют диаметр от 1 мкм до 10 мкм. Наночастицы имеют диаметр в основном от 100 нм до 200 нм38. Аббревиатура: C3F8 = газ перфторпропан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
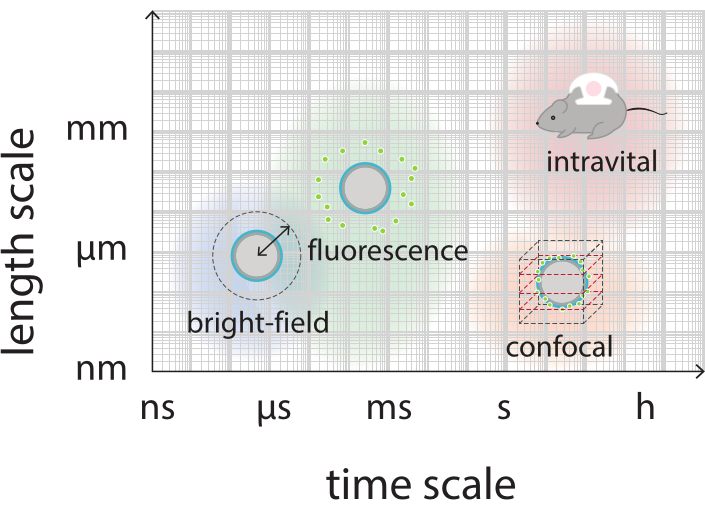
Рисунок 2: Схематический обзор, показывающий соответствующие шкалы времени и длины для ярко-полевой, флуоресцентной, конфокальной и прижизненной микроскопии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
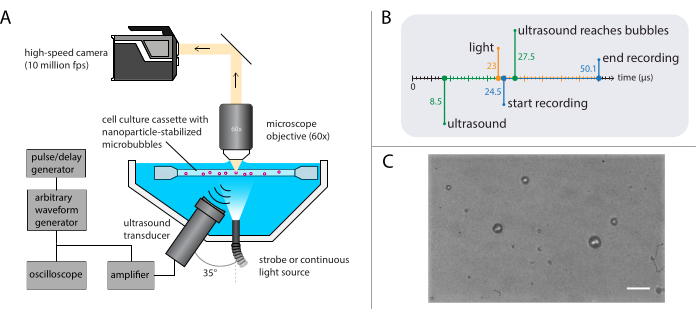
Рисунок 3: Схематическое представление экспериментов с микроскопией яркого поля. (A) Экспериментальная установка, (B) временная диаграмма и (C) типичный записанный кадр. Шкала в (C) = 10 мкм. Аббревиатура: fps = кадров в секунду. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
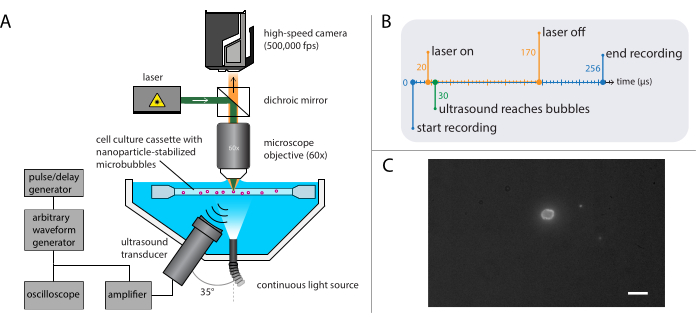
Рисунок 4: Схематическое изображение экспериментов флуоресцентной микроскопии. (A) Экспериментальная установка, (B) временная диаграмма и (C) типичный записанный кадр. Шкала в (C) = 10 мкм. Аббревиатура: fps = кадров в секунду. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
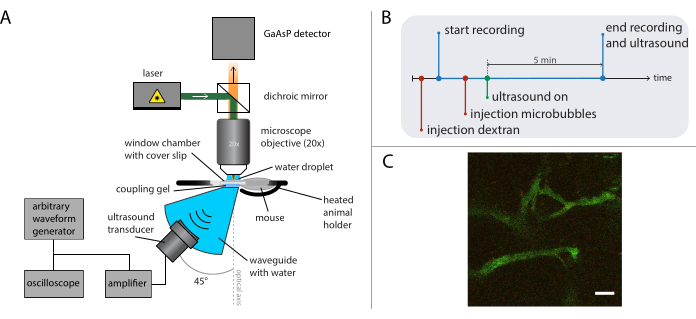
Рисунок 5: Схематическое изображение экспериментов по прижизненной микроскопии. (А) Экспериментальная установка, (Б) временная диаграмма и (В) типичный записанный кадр. Шкала в (C) = 50 мкм. Зеленый соответствует декстран-ФИТК, а красный – наночастицам. Аббревиатура: GaAsP = арсенид галлия фосфид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
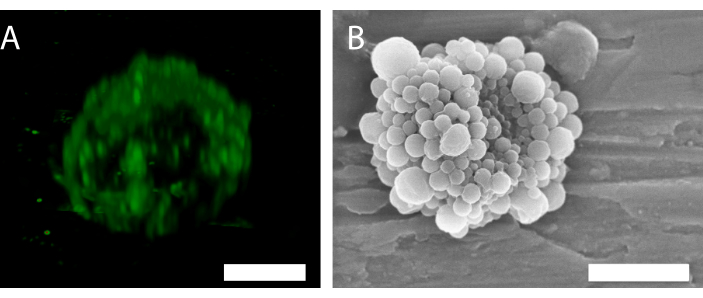
Рисунок 6: 3D-структура одного микропузырька, стабилизированного наночастицами и белками. (A) Использование конфокальной микроскопии для отображения наночастиц и (B) использование сканирующего электронного микроскопа для отображения 3D-структуры. (B) был воспроизведен с разрешения от34. Шкала в (A) = 5 мкм; шкала в (B) = 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
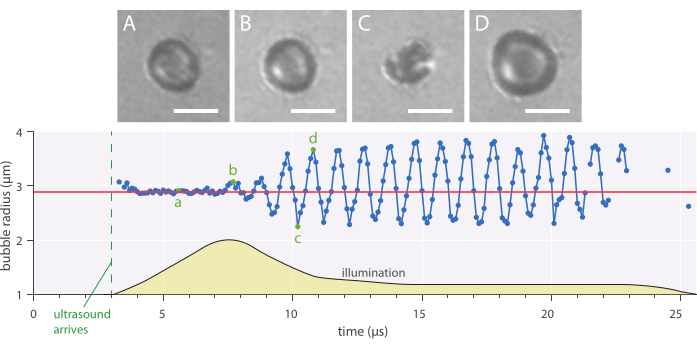
Рисунок 7: Типичные сферические колебания микропузырьков радиусом 2,89 мкм, стабилизированные наночастицами и белками, озвученные на ультразвуковой частоте 1 МГц и амплитуде акустического давления 142 кПа (A-D) Изображения из высокоскоростной записи и соответствующей кривой радиуса пузырька во времени (дно). Шкала = 5 мкм, а красная линия указывает на начальный радиус. Профиль освещения (произвольные единицы) обозначается желтым цветом. Увеличение 120x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
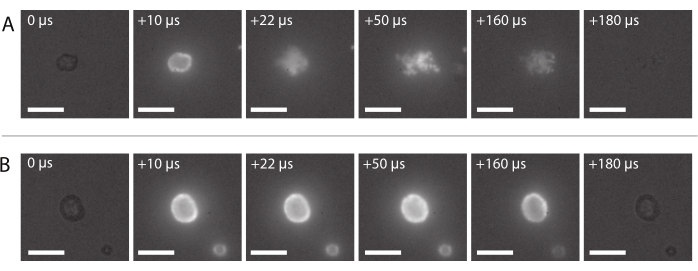
Рисунок 8: Последовательность изображений из высокоскоростной флуоресцентной микроскопии. (A) Успешная доставка флуоресцентно меченых наночастиц стабилизированного наночастицами и белками микропузырька, озвученного на ультразвуковой частоте 2 МГц и амплитуде акустического давления 600 кПа. (B) Неудачная доставка флуоресцентно меченых наночастиц стабилизированного наночастицами и белками микропузырька, инсонифицированного на ультразвуковой частоте 2 МГц и амплитуде акустического давления 210 кПа. Шкала стержней = 10 мкм. Увеличение 120x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
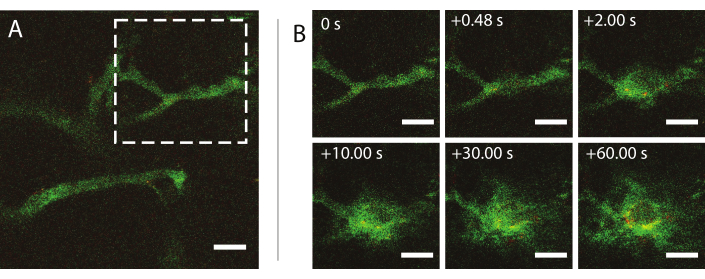
Рисунок 9: Прижизненная микроскопия после инсонации стабилизированных наночастицами и белками микропузырьков на частоте ультразвука 1 МГц и амплитуде акустического давления 800 кПа. (А) Наночастицы внутри сосуда и (В) последовательность изображений области, обозначенной белым пунктирным квадратом в (А), изображающая экстравазацию декстрана (зеленый) и наночастиц (красный). Шкала стержней = 50 мкм. Увеличение 20x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Различные методы оптической микроскопии были объединены для получения информации о различных этапах доставки наночастиц с поверхности микропузырьков в окружающую среду. Была выполнена визуализация пузырьковых колебаний, а также визуализация высвобождения наночастиц из оболочки пузырька, экстравазации и проникновения через внеклеточный матрикс опухолей in vivo. Визуализация in vitro позволяет проводить скрининг многих ультразвуковых параметров по сравнению с более сложными установками in vivo . Преимуществом объединения этого диапазона методов визуализации является дополнительная информация, которая может быть получена в разных временных масштабах - особенность, которая имеет решающее значение для характеристики и оптимизации микропузырьков для успешной доставки и получения терапевтической эффективности. Этот подход полезен для понимания механизмов доставки для всех микропузырьков, включая конструкции с флуоресцентно мечеными наночастицами и лекарствами.
Наиболее важные этапы в методах микроскопии, используемых для изучения отдельных микропузырьков, заключаются в следующем. Для флуоресцентной микроскопии наночастицы должны быть флуоресцентно помечены, чтобы обеспечить визуализацию высвобождения частиц. Кроме того, раствор образца должен быть достаточно разбавлен, чтобы выделить отдельные микропузырьки для анализа в конфокальных, ярко-полевых и флуоресцентных методах микроскопии. Кроме того, важно выбрать ультразвуковую движущую частоту и акустическое давление, чтобы возбуждать пузырьки наиболее эффективно, а именно при их резонансе. Если исследовательский вопрос касается доставки полезной нагрузки наночастиц, соответствующие параметры ультразвука должны быть частью исследования. Наряду с резонансом, эти пузырьки также должны быть запущены на уровне или выше их порога для высвобождения наночастиц, как правило, при относительно высоких амплитудах акустического давления (MI > 0,3)51. Для визуализации в ярко-полевой микроскопии важно выбрать высокоскоростную камеру с достаточно высокой частотой кадров, чтобы минимизировать размытие движения и избежать сглаживания.
Микроскопия яркого поля в основном ограничена частотой кадров изображения и интенсивностью доступных источников света, поскольку более высокая частота кадров даст более подробное представление о динамике пузырьков с временным разрешением, но требует более интенсивного освещения из-за более короткого времени экспозиции. Чтобы изучить высвобождение частиц более подробно, частота кадров для флуоресцентной визуализации может быть, в принципе, увеличена за счет увеличения интенсивности лазерного света. Однако поглощение лазерного света высокой интенсивности флуоресцентно мечеными микропузырьками генерирует тепло, даже с высококвантовыми красителями. Это тепло может помешать экспериментам, поставленным на карту, и в крайних случаях вызвать фототермическую кавитацию52. Таким образом, на практике существует предел применяемого лазерного флюенса. Однако интенсивное лазерное освещение также может быть преднамеренно использовано для индуцирования высвобождения частиц из липосом53. Температура влияет на динамику пузырьков и ультразвуковой отклик, в зависимости от типа пузырька54. Поэтому, если методы in vitro и intravital должны быть объективно сопоставлены, то методы in vitro , обсуждаемые в протоколе, должны выполняться при 37 °C. Другим ограничением методов in vitro , обсуждаемых в настоящей статье, является то, что пузырьки не находятся в среде свободного поля, поскольку микропузырьки будут плавать под мембраной держателя образца. Кроме того, существует смещение выбора при визуализации одиночных микропузырьков. Однако проведение повторных экспериментов на одиночных пузырьках позволяет исследовать влияние размера и устранить смешанный фактор - распределение размеров. Если реакцию пузыря как функцию размера можно понять, пока концентрация не слишком высока, чтобы предотвратить взаимодействия пузырь-пузырь, можно рассчитать реакцию любой произвольной популяции пузыря. Наконец, методы микроскопии с ярким полем и флуоресцентной микроскопией дают представление о микропузырьках, запутанных в двумерном (2D) изображении. Если исследовательский вопрос требует более чем 2D-изображения, 3D-поведение пузырьков может быть решено путем объединения настройки, описанной в протоколе, с настройкой бокового обзора для многоплоскостной визуализации55.
Альтернативным методом исследования микропузырьков является акустическая характеристика56. Однако измерение эха одного микропузырька требует обнаружения и изоляции одного микропузырька в ультразвуковом луче56, что представляет собой проблему, обычно решаемую с помощью узкой трубки или оптического или акустического пинцета57,58. Для акустического размера пузырьков микропузырьки могут быть озвучены в режиме геометрического рассеяния на частотах, значительно превышающих их резонансную частоту, что не вызывает объемных микропузырьковых колебаний59. Использование «акустической камеры» является таким методом для изображения радиальной динамики одиночных микропузырьков в ответ на ультразвук, при котором высокочастотный ультразвуковой зонд используется для определения радиального отклика пузыря на низкочастотную движущую волну60. Недостатком данного метода является то, что его можно использовать только для определения относительного изменения радиуса микропузырька; следовательно, необходим другой метод для определения абсолютного радиуса пузырька, например, с помощью оптической визуализации61,62. Недостатком методов, в которых микропузырьки подвергаются воздействию ультразвука на частотах, превышающих их резонансную частоту, является то, что на таких высоких частотах глубина проникновения уменьшается59, что ограничивает удобство использования для приложений in vivo. Другие формы микроскопии также могут быть использованы для изучения микропузырьков, таких как сканирующая электронная микроскопия, атомно-силовая микроскопия и просвечивающая электронная микроскопия63. Однако достижимое пространственно-временное разрешение этих альтернативных методов микроскопии, как правило, более ограничено, и эти методы имеют тот недостаток, что визуализация выполняется либо до, либо после ультразвукового воздействия путем автономного анализа и обычно представляет низкую пропускную способность63. Другой альтернативой является использование метода рассеяния света, который может быть использован для изучения радиальной динамики одиночных микропузырьков в режиме реального времени, но имеет низкое отношение сигнал/шум по сравнению с методами акустического рассеяния64.
Прижизненная микроскопия в режиме реального времени во время ультразвукового воздействия является мощным методом для получения нового понимания сосудистой системы, поведения микропузырьков, наночастиц или других молекул (таких как декстран в данном случае) во время ультразвукового воздействия. Общим ограничением при выполнении прижизненной микроскопии в режиме реального времени является то, что визуализируется только небольшая область ткани, а глубина проникновения света в ткань ограничена. Если изображенные сосуды содержат очень мало микропузырьков и/или наночастиц в поле зрения, мало или вообще никакой информации о поведении и экстравазации наночастиц можно получить. Кроме того, из-за ограниченного поля зрения решающее значение имеет правильное выравнивание между световым и ультразвуковым путями. Если ультразвуковое давление достаточно высокое, чтобы вызвать разрушение пузырьков, также важно выбрать частоту повторения импульса, которая позволяет свежим пузырькам репертифицироваться в поле зрения между ультразвуковыми импульсами. Кроме того, поскольку ультразвук будет отражаться от покровного стекла в оконной камере и объектива, размещение преобразователя под углом важно для уменьшения отражений, чтобы предотвратить образование стоячих волн, которые искажают калиброванное поле давления. Другая практическая проблема заключается в том, что установка должна иметь достаточно места для установки ультразвукового преобразователя и волновода выше или ниже объектива в установке микроскопа. Опухоли в дорсальной оконной камере будут иметь ограниченную толщину из-за ограничивающей камеры и скольжения крышки; однако при необходимости можно использовать и другие модели. Примерами являются опухоли кожной складки, например, в жировой подушке молочной железы65 или абдоминальная прижизненная визуализация опухолей в различных органах66. Такие опухоли могут быть выращены ортотопически в соответствующей микросреде и, как таковые, представляют собой более клинически значимый случай.
Методы, описанные в этой работе, раскрывают потенциал флуоресцентно меченых микропузырьков для изучения основ применения доставки лекарств с использованием пузырьков и ультразвука. Эта комбинация методов микроскопии дает ценную информацию о реакции микропузырька на ультразвуковую инсонацию и связанное с ней пространство акустических параметров и представляет четкое представление о поведении микропузырьков и полезной нагрузки в соответствующем диапазоне временных и длинных масштабов.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
Ссылки
- Szabo, T. L. Diagnostic ultrasound imaging: inside out. , Academic Press. (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197(2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). Quaia, E. , Springer. Berlin, Heidelberg. 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8(2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076(2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102(2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103(2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, Ý, et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250(2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876(2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , Cambridge University Press. Cambridge; New York. (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115(2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103(2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911(2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501(2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены