Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una célula a célula macromoleculares de transporte de ensayo En la Planta La utilización de bombardeo biolística
En este artículo
Resumen
El tráfico de macromoléculas entre las células vegetales se pueden evaluar de forma transitoria que expresa una proteína fluorescente con etiquetas de interés y el análisis de su distribución intra e intercelulares mediante microscopia confocal.
Resumen
A continuación, presentamos un protocolo sencillo y rápido para detectar y evaluar la magnitud de la célula a célula de transporte macromolecular en la planta. En este protocolo, marcado con fluorescencia de proteínas de interés se expresa de forma transitoria en el tejido vegetal después de la entrega biolística de su ADN que codifica para la construcción. La distribución intra e intercelulares de la proteína marcada se analiza por microscopía confocal. Se describe en detalle esta tecnología, ofreciendo paso a paso a protocolos de ensayo y evaluar la magnitud del transporte de proteínas simplástica en tres especies de plantas, Arabidopsis thaliana, Nicotiana benthamiana y N. tabacum (tabaco).
Protocolo
Fondo
Simplástica transporte de macromoléculas a través de conexiones intercelulares de plantas, los plasmodesmos, es de interés para muchos patólogos de plantas y biólogos. Por ejemplo, varias proteínas virales son conocidas para regular plasmodesmal límites de exclusión de tamaño para permitir el movimiento viral 1-3. Además, algunas proteínas endógenas, entre ellos importantes reguladores de desarrollo, se supone que se mueven de célula a célula, presumiblemente a través de los plasmodesmos, que la función no de células de forma autónoma 4. Por lo tanto, una metodología fiable para identificar y visualizar transporte macromolecular entre las células vegetales es muy solicitado.
1) Cultivar las plantas de destino
Para la eficiencia de transformación de alto, las plantas sanas, robustas se debe utilizar.
1. Plantas de Arabidopsis
Crecer una planta de Arabidopsis en Pro-Mix BX en una olla (10 cm x 10 cm x 10 cm) en una cámara de ambiente controlado con un fotoperiodo corto (8 horas de 130 a 150 μE m -2 s -1 luz a 23 ° C/16 h oscuridad a 20 ° C) y 40-65% de humedad relativa durante 6 a 8 semanas 5. Fertilizar vez en cuando con los productos disponibles comercialmente como se describe 5. Hojas con el mayor tamaño de 15 mm x 35 mm (incluye la medición de la longitud del pecíolo) son seleccionados para los experimentos.
2. N. benthamiana y N. tabacum
Crecer una planta en el Pro-Mix BX en una olla (20 cm x 20 cm x 20 cm) en una cámara de ambiente controlado con un fotoperíodo largo (16 horas de 130 a 150 μE m -2 s -1 luz a 23 ° C / 8 h oscuridad a 20 ° C) y 40-65% de humedad relativa durante 7 a 10 semanas. Fertilizar vez en cuando con los productos disponibles comercialmente como se describe. Hojas con un tamaño mayor de 50 mm x 70 mm para N. benthamiana mm o 100 x 125 mm para N. tabacum (estas medidas no incluyen la longitud del pecíolo) son seleccionados para los experimentos.
2) Preparación del cartucho de pistola de genes con el ADN recubierto de oro micropartículas
El protocolo para esta etapa experimental se ha descrito en detalle previamente 6. Es muy importante usar el ADN y plásmido purificado a altas concentraciones (~ 1 mg / l) para obtener la mayor eficiencia de la transformación de la facilidad de análisis de microscopía confocal en las últimas etapas del experimento.
Para este ensayo, es importante cerciorarse de que el cartucho preparado no transformar dos o más celdas adyacentes al mismo tiempo a altas frecuencias, debido a que el número de células de la asociación con un grupo de la señal fluorescente se utiliza como un indicador del grado de transporte simplástica (es decir, , una sola célula que contiene la señal indica que no hay movimiento, mientras que un grupo de señales multicelulares indica el movimiento). La calidad de los cartuchos cada uno se puede comprobar mediante el análisis de la expresión de la proteína de 16 a 20 horas después del bombardeo. Nuestro protocolo de 6 cartuchos que produce rendimientos grupos multicelulares única expresión de <3% de todos los eventos de expresión en este período de tiempo, por lo tanto adecuado para este experimento.
3) Entrega biolística del ADN-micropartículas recubiertas
- Quite las hojas de la misma etapa de desarrollo (es decir, con el mismo tamaño y edad, ver paso 1) con una navaja afilada e inmediatamente ponerlos a los lados abaxial hacia arriba sobre una superficie plana de espuma de poliestireno. El lado abaxial de la hoja representa un mejor sustrato para el bombardeo, debido a su baja densidad de tricomas y más delgada cutícula. Hojas de Arabidopsis, debido a su tamaño relativamente pequeño, debe ser cubierto con un pedazo de malla ventana de la pantalla, y la malla se fija con chinchetas a la superficie de espuma de poliestireno. El mantenimiento de hojas planas aumenta la eficiencia de la entrega de las partículas y reduce al mínimo el daño a los tejidos durante microbombardment.
- Inserte el cartucho con el ADN de micropartículas recubiertas (preparado en el paso 1) en la pistola. De Arabidopsis, el rodaje se lleva a cabo a presiones de 80 a 110 psi para el 1-m micropartículas y 140-160 psi para micropartículas de 0,6 micras. Para N. benthamiana y el tabaco, el rodaje se lleva a cabo a presiones de 100 a 120 psi para el 1-m micropartículas y 160-180 psi de 0,6 micras micropartículas. De Arabidopsis, por lo general utilizan un cartucho por hoja, ya que cada hoja tiene superficie suficiente sólo para un disparo que se extiende micropartículas en un área de 10-12 mm de diámetro. Con mayor N. benthamiana y las hojas de tabaco, los bombardeos múltiples de la misma hoja son posibles, sin embargo, deben hacerse en las posiciones simétricas a cada lado de la nervadura de las áreas de destino de la hoja en la misma etapa de desarrollo (ver Discusión).
- Quitar las hojas de la superficie de espuma de poliestireno y colocarlos ino una placa de Petri en 3 capas de papel de filtro Whatman mojado, sellar la placa de Petri con Parafilm y se incuban a temperatura ambiente durante 36-48 horas para permitir la expresión de los transgenes entrega y el potencial de célula a célula movimiento de sus productos proteicos .
4) Imagen de la expresión de la proteína
La señal de fluorescencia de las proteínas expresadas de forma transitoria marcado es visualizado por microscopía confocal. Se debe tener cuidado para encontrar los ajustes óptimos de microscopía para la detección de cada proteína de la prueba. Por ejemplo, las proteínas que muestran la acumulación intracelular limitada con la intensidad de la señal es débil, como la localización de la proteína plasmodesmal del mosaico del tabaco movimiento del virus (TMV MP) 1-3,6, deben ser observados bajo un lente objetivo de 40X, lo que proporciona una mayor resolución y sensibilidad, mientras que las proteínas que muestran la distribución citoplasmática con la intensidad de señal fuerte, como libre de YFP, se puede visualizar con un lente objetivo de 10X con función de zoom de imagen confocal de más rápido (ver Figura 1).
Transporte simplástica se deduce de la aparición de grupos multicelulares que contienen la señal fluorescente. El número de estas agrupaciones y el número de células en cada grupo es indicativo de la magnitud del transporte de célula a célula. Para obtener datos fiables, por lo menos 100 grupos de expresión deben ser registrados por cada sistema experimental. Por ejemplo, si el movimiento de célula a célula de una proteína se compara en dos fondos genéticos diferentes (por ejemplo, de tipo salvaje y las plantas transgénicas), de un total de 200 grupos de expresión deben ser registrados. Es importante destacar que, los experimentos, cuyos resultados deben ser comparados entre sí, deben llevarse a cabo de forma simultánea.
5. Resultados representante
La siguiente figura ilustra experimentos representante para la detección de las proteínas de transporte simplástica marcado con fluorescencia. Los grupos A y B muestran las imágenes típicas que se obtienen confocal microbombardment siguiente de N. benthamiana con una hoja de TMV-MP-YFP expresar construir. En el panel A movimiento, simplásica de TMV MP-YFP se observa sobre la base de la aparición de grupos multicelulares de la señal de YFP. No todos transitoriamente expresó TMV MP-YFP es capaz de moverse como se evidencia por una sola célula de la señal en algunos microbombardments (panel B). Estadísticamente, en <40% de los racimos de la señal en cuenta, TMV MP-YFP no es capaz de moverse entre las celdas, mientras que en> 60% de los racimos, la proteína se mueve entre 2-5 células, con la difusión de dos células es el más frecuente (ca. 50% ~ de los casos) (fig. 1C).
Las proteínas con un tamaño molecular relativamente pequeño, sin actividad de los movimientos innatos pueden difundirse a través de PD para pasar de célula a célula. Por ejemplo, YFP gratuita o 1xYFP (unos 27 kDa, panel D), los diferenciales entre varias células en el 30% de los grupos de contado (paneles C). Esta difusión no específica no está presente para un dimmer YFP traslación, o 2xYFP (54 kDa, panel E), que es comparable en tamaño a la proteína de fusión TMV MP-YFP (57 kDa), y que es completamente células autónomas (Figura 1C).
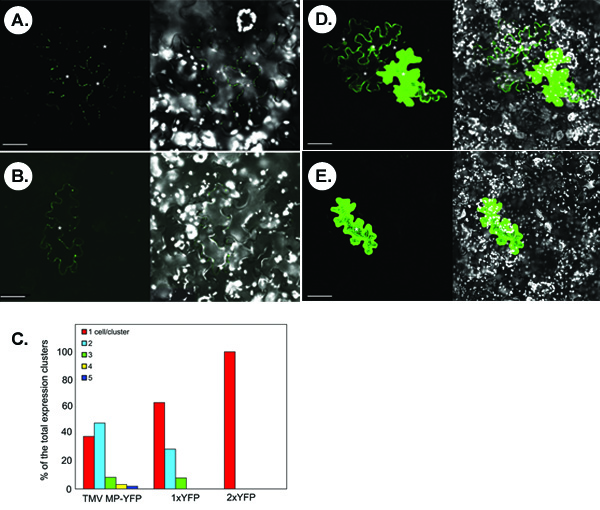
Figura 1. Típicos resultados obtenidos en el ensayo de transporte simplástica en N. benthamiana hoja de tejidos. (A, B) La visualización de TMV MP-YFP. (C) La cuantificación de grupos de la señal. 1xYFP y 2xYFP, sin YFP y traslacional YFP dímero, respectivamente. (D) Visualización de 1xYFP. (E) Visualización de 2xYFP. En microfotografías, los paneles de la izquierda muestra la señal de YFP y los paneles de la derecha muestran imágenes fusionadas de YFP (en verde) y la autofluorescencia del cloroplasto (en blanco) señales. Las imágenes son solo las secciones confocal. Los asteriscos en las micrografías muestran las células epidérmicas que muestra la señal de YFP. Barras = 50 micras.
Discusión
La clave para el éxito del ensayo de transporte simplástica es la obtención de la eficiencia de transformación de alto, que permite la producción de racimos de señal estadísticamente significativa y detectable fácilmente. Esto puede lograrse utilizando las hojas cosechadas de plantas sanas, robustas, y la preparación de partículas de oro recubiertas por una preparación de ADN puro y concentrado.
Utilizando las hojas en la misma etapa de crecimiento también es vital para la fiabil...
Divulgaciones
Agradecimientos
Nuestro trabajo es apoyado por becas de NIH / NIGMS, NSF, USDA / Nifa, y BARD a VC.
Materiales
| Name | Company | Catalog Number | Comments |
| Gold microparticles, 1.0 μm in diameter | Bio-Rad | 165-2262 | |
| Gold microparticles, 0.6 μm in diameter | Bio-Rad | 165-2263 | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Tefzel tubing | Bio-Rad | 165-2441 | |
| Helios cartridge preparatory station | Bio-Rad | 165-2420 | |
| Tubing cutter | Bio-Rad | 165-2422 | |
| Helios gene gun | Bio-Rad | 165-2432 | |
| Helium gas regulator | Bio-Rad | 165-2413 |
Referencias
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of non-destructive cell-to-cell and systemic movement of plant viruses. . Crit Rev Plant Sci. 23, 195-250 (2004).
- Lucas, W. J. Plant viral movement proteins: agents for cell-to-cell trafficking of viral genomes. Virology. 344, 169-184 (2006).
- Epel, B. L. Plant viruses spread by diffusion on ER-associated movement-protein-rafts through plasmodesmata gated by viral induced host beta-1,3-glucanases. Semin Cell Dev Biol. 20, 1074-1081 (2009).
- Zambryski, P. C., Crawford, K. Plasmodesmata: gatekeepers for cell-to-cell transport of developmental signals in plants. Annu Rev Cell Dev Biol. 16, 393-421 (2000).
- Rivero-Lepinckas, L., Crist, D., Scholl, R. Growth of plants and presercation of seeds. Methods Mol Biol. 323, 3-12 (2006).
- Ueki, S., Lacroix, B., Krichevsky, A., Lazarowitz, S. G., Citovsky, V. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nat Protoc. 4, 71-77 (2009).
- Oparka, K. J. Simple, but not branched, plasmodesmata allow the nonspecific trafficking of proteins in developing tobacco leaves. Cell. 97, 743-754 (1999).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11, 309-322 (1999).
- Gisel, A., Barella, S., Hempel, F. D., Zambryski, P. C. Temporal and spatial regulation of symplastic trafficking during development in Arabidopsis thaliana apices. Development. 126, 1879-1889 (1999).
- Kim, I., Cho, E., Crawford, K. M., Hempel, F. D., Zambryski, P. C. Cell-to-cell movement of GFP during embryogenesis and early seedling development in Arabidopsis. Proc Natl Acad Sci USA. 102, 2227-2231 (2005).
- Crawford, K. M., Zambryski, P. C. Non-targeted and targeted protein movement through plasmodesmata in leaves in different developmental and physiological states. Plant Physiol. 125, 1802-1812 (2001).
- Roberts, A. G. Phloem unloading in sink leaves of Nicotiana benthamiana: comparison of a fluorescent solute with a fluorescent virus. Plant Cell. 9, 1381-1396 (1997).
- Guenoune-Gelbart, D., Elbaum, M., Sagi, G., Levy, A., Epel, B. L. Tobacco mosaic virus (TMV) replicase and movement protein function synergistically in facilitating TMV spread by lateral diffusion in the plasmodesmal desmotubule of Nicotiana benthamiana. Mol Plant Microbe Interact. 21, 335-345 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados