È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una cellula-cellula Macromolecole saggio di trasporto In Planta Utilizzando Bombardamento Biolistic
In questo articolo
Riepilogo
Traffico macromolecolari tra le cellule delle piante può essere valutata transitoriamente esprimere una proteina fluorescente-tagged di interesse e per analizzarne la distribuzione intra-ed intercellulare mediante microscopia confocale.
Abstract
Qui, vi presentiamo un protocollo semplice e rapido per rilevare e valutare l'entità del cellula-cellula trasporto macromolecolari in planta. In questo protocollo, una fluorescente con tag proteina di interesse è transitoriamente espressa in tessuti vegetali dopo la consegna biolistic del suo DNA codifica costruire. La distribuzione intra-ed intercellulare della proteina tag viene quindi analizzato al microscopio confocale. Descriviamo questa tecnologia nel dettaglio, fornendo passo-passo protocolli di saggiare e valutare l'entità del trasporto delle proteine symplastic in tre specie di piante, Arabidopsis thaliana, Nicotiana benthamiana e N. tabacum (tabacco).
Protocollo
Fondo
Symplastic trasporto di macromolecole attraverso connessioni impianto intercellulari, il plasmodesmi, è di interesse per molti patologi vegetali e biologi. Per esempio, diverse proteine virali sono noti per regolare plasmodesmal limiti di esclusione dimensioni per permettere il movimento virale 1-3. Inoltre, alcune proteine endogene, tra i quali importanti regolatori dello sviluppo, si presume per passare da una cella all'altra, presumibilmente attraverso plasmodesmi, per funzionare non-cell-autonomo 4. Così, una metodologia affidabile per identificare e visualizzare il trasporto macromolecolare tra cellule vegetali è molto richiesto.
1) Far crescere le piantine bersaglio
Per la trasformazione ad alta efficienza, piante sane, robuste dovrebbe essere usato.
1. Arabidopsis piante
Crescere una pianta di Arabidopsis su Pro-Mix BX in un vaso (10 cm x 10 cm x 10 cm) in un ambiente controllato da camera con un fotoperiodo breve (8 ore di 130-150 μE m -2 s -1 luce a 23 ° C/16 ore al buio a 20 ° C) e del 40-65% di umidità relativa da 6 a 8 settimane 5. Fecondarle tanto in tanto con prodotti disponibili in commercio, come descritto 5. Foglie con la dimensione maggiore di 15 mm x 35 mm (la misura di lunghezza include picciolo) vengono selezionati per gli esperimenti.
2. N. benthamiana e N. tabacum
Cresce una pianta su Pro-Mix BX in un vaso (20 cm x 20 cm x 20 cm) in un ambiente controllato da camera con un fotoperiodo lungo (16 ore di 130-150 μE m -2 s -1 luce a 23 ° C / 8 ore al buio a 20 ° C) e del 40-65% di umidità relativa da 7 a 10 settimane. Fecondarle tanto in tanto con prodotti disponibili in commercio come descrivere. Foglie con dimensioni maggiori di 50 mm x 70 mm per N. benthamiana, o 100 mm x 125 mm per N. tabacum (queste misure di lunghezza non comprendono picciolo) vengono selezionati per gli esperimenti.
2) Preparazione della cartuccia Gene Gun con DNA microparticelle rivestite d'oro
Il protocollo per questa fase sperimentale è stato descritto in dettaglio in precedenza 6. E 'molto importante usare bene purificato il DNA plasmidico ad alte concentrazioni (~ 1 mg / mL) per ottenere la massima efficienza di trasformazione per la facilità di analisi di microscopia confocale durante le fasi successive della sperimentazione.
Per questo test, è importante accertarsi che la cartuccia preparato non trasformare due o più celle adiacenti contemporaneamente ad alta frequenza, perché i numeri di cellule associazione con un cluster segnale fluorescente viene utilizzato come indicatore del grado di trasporto symplastic (cioè , una singola cellula che contiene il segnale indica nessun movimento, mentre un cluster segnale multicella indica il movimento). La qualità dei ogni cartuccia può essere verificato analizzando l'espressione della proteina 16-20 dopo bombardamento ore. Il nostro protocollo 6 produce cartucce che producono cluster espressione multicella solo in <3% di tutti gli eventi espressione in questo lasso di tempo, quindi adatto per questo esperimento.
3) Consegna Biolistic di microparticelle rivestite di DNA
- Togliere le foglie della stessa fase di sviluppo (cioè con le stesse dimensioni e stessa età, vedi punto 1) con una lama di rasoio affilato e immediatamente posto con i lati abaxial rivolto verso l'alto su una superficie piana di polistirolo. Il lato abaxial della foglia rappresenta un substrato migliore per il bombardamento a causa della sua densità tricomi più basso e più sottile cuticola. Foglie di Arabidopsis, a causa delle loro dimensioni relativamente piccole, dovrebbero essere coperti con un pezzo di maglia finestra dello schermo, e la rete poi fissato con pushpins alla superficie di polistirolo. Il mantenimento di foglie piatte aumenta l'efficienza della consegna delle particelle e riduce al minimo i danni al tessuto durante microbombardment.
- Inserire la cartuccia con microparticelle rivestite di DNA (preparata al punto 1) nella pistola. Per Arabidopsis, il tiro viene eseguita a pressioni di 80-110 psi per 1-micron microparticelle, e 140-160 psi per 0,6 micron microparticelle. Per N. benthamiana e tabacco, il tiro viene eseguita a pressioni di 100-120 psi per 1-micron microparticelle, e 160-180 psi per 0,6 micron microparticelle. Per Arabidopsis, di solito si utilizza una cartuccia per anta, in quanto ogni foglia ha uno spazio sufficiente superficie per un solo colpo microparticelle che si estende su una superficie di 10-12 mm di diametro. Con grande N. benthamiana e foglie di tabacco, bombardamenti multipli della stessa foglia sono possibili, tuttavia, deve essere fatto nelle posizioni simmetriche ai lati della venatura di indirizzare le aree foglia allo stesso stadio di sviluppo (vedi Discussione).
- Togliere le foglie dalla superficie di polistirolo e li hoNon una piastra di Petri, il 3 strati di carta bagnata Whatman filtro, sigillare la piastra di Petri con Parafilm, e incubare a temperatura ambiente per 36-48 ore per consentire l'espressione dei transgeni consegnato e il potenziale cellula-cellula movimento dei loro prodotti proteici .
4) Imaging di espressione proteica
Il segnale di fluorescenza delle proteine espresse transitoriamente tag è visualizzata mediante microscopia confocale. Si deve prestare attenzione per trovare le impostazioni ottimali per il rilevamento microscopia di ogni proteina testato. Per esempio, le proteine che mostrano limitato accumulo intracellulare con intensità di segnale debole, come ad esempio la localizzazione della proteina plasmodesmal movimento virus del mosaico del tabacco (TMV MP) 1-3,6, deve essere osservata sotto una lente obiettivo 40X, che offre una risoluzione più alta e sensibilità, mentre le proteine che mostrano la distribuzione citoplasmatica con intensità segnale forte, come la connessione YFP, possono essere visualizzati sotto una lente obiettivo 10X con funzione di zoom per una più rapida l'imaging confocale (vedi Figura 1).
Trasporto Symplastic è dedotta dalla comparsa di cluster multicella che contengono il segnale fluorescente. Il numero di tali aggregati e il numero di cellule in ogni cluster è indicativo del grado di cellula-cellula di trasporto. Per ottenere dati affidabili, almeno 100 cluster espressione dovrebbe essere registrate per ogni sistema sperimentale. Per esempio, se la cellula-cellula movimento di una proteina è confrontato in due diversi sfondi genetici (per esempio, di tipo selvatico e piante transgeniche), su un totale di 200 ammassi espressione dovrebbe essere registrato. Soprattutto, esperimenti, i cui risultati devono essere confrontati gli uni agli altri, deve essere effettuata contemporaneamente.
5. Rappresentante Risultati
La figura seguente illustra gli esperimenti di rappresentanza per il rilevamento di trasporto symplastic delle proteine fluorescenti tag. Pannelli A e B mostrano le immagini tipiche confocale che si ottengono microbombardment seguito di una N. foglia benthamiana con un MP TMV-YFP che esprimono costruire. Nel pannello A, movimento symplastic di TMV MP-YFP si osserva basa sulla comparsa di grappoli multicella del segnale YFP. Non tutti i transitoriamente espressa TMV MP-YFP è in grado di muoversi come evidenziato da singole cellule del segnale in alcune microbombardments (pannello B). Statisticamente, in <40% dei glomeruli segnale contati, TMV MP-YFP è in grado di spostarsi tra le celle mentre nel> 60% dei glomeruli, la proteina si muove tra 2-5 cellule, con le due celle diffuso è il più frequente (ca. casi ~ 50%) (Figura 1C).
Le proteine con relativamente piccole dimensioni molecolari in assenza di attività moto innato può diffondersi attraverso il PD per spostare cellula-cellula. Per esempio, YFP libero, o 1xYFP (ca. 27 kDa, pannello D), si diffonde tra le diverse celle nel 30% dei glomeruli contati (pannelli C). Questo non specifici diffusione non si verifica per un dimmer YFP traslazionale, o 2xYFP (54 kDa, e pannello), che è paragonabile per dimensioni a TMV MP-YFP proteina di fusione (57 kDa), e che è completamente cellule autonome (Figura 1C).
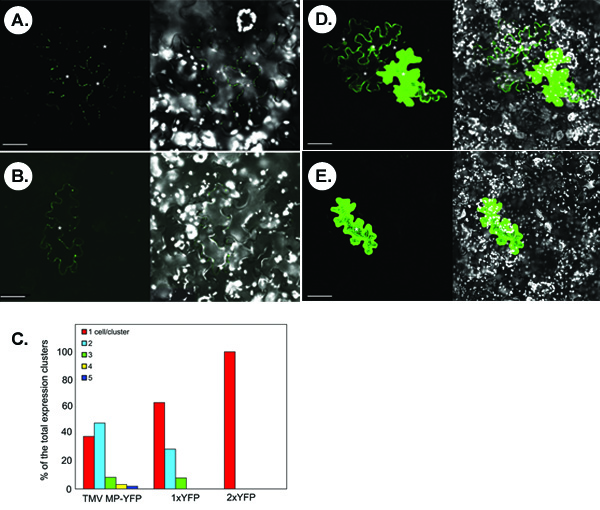
Risultati Figura 1. Tipici ottenuti dal test di trasporto symplastic in N. benthamiana foglia tessuti. (A, B) Visualizzazione del TMV MP-YFP. (C) Quantificazione dei cluster segnale. 1xYFP e 2xYFP, libero YFP e traslazionale YFP dimero, rispettivamente. (D) Visualizzazione 1xYFP. (E) Visualizzazione 2xYFP. In micrografie, i pannelli sinistra mostrano il segnale YFP e pannelli di destra mostrano le immagini fuse di YFP (in verde) e autofluorescenza cloroplasto (in bianco) i segnali. Le immagini sono singole sezioni confocale. Asterischi nei micrografie mostrano le cellule epidermiche che mostra segnali YFP. Bar = 50 micron.
Access restricted. Please log in or start a trial to view this content.
Discussione
La chiave per il successo del saggio di trasporto symplastic è quello di ottenere elevata efficienza di trasformazione, che consente la produzione di cluster segnale statisticamente significativi e facilmente misurabili. Ciò può essere ottenuto utilizzando le foglie raccolte da piante sane, robuste, e la preparazione di particelle di oro rivestite da una preparazione del DNA puro e concentrato.
Utilizzando le foglie in fase di crescita stessa è fondamentale anche per l'affidabilità ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Il nostro lavoro è supportato anche da finanziamenti NIH / NIGMS, NSF, USDA / NIFA e BARD a VC.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Gold microparticles, 1.0 μm in diameter | Bio-Rad | 165-2262 | |
| Gold microparticles, 0.6 μm in diameter | Bio-Rad | 165-2263 | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Tefzel tubing | Bio-Rad | 165-2441 | |
| Helios cartridge preparatory station | Bio-Rad | 165-2420 | |
| Tubing cutter | Bio-Rad | 165-2422 | |
| Helios gene gun | Bio-Rad | 165-2432 | |
| Helium gas regulator | Bio-Rad | 165-2413 |
Riferimenti
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of non-destructive cell-to-cell and systemic movement of plant viruses. Crit Rev Plant Sci. 23, 195-250 (2004).
- Lucas, W. J. Plant viral movement proteins: agents for cell-to-cell trafficking of viral genomes. Virology. 344, 169-184 (2006).
- Epel, B. L. Plant viruses spread by diffusion on ER-associated movement-protein-rafts through plasmodesmata gated by viral induced host beta-1,3-glucanases. Semin Cell Dev Biol. 20, 1074-1081 (2009).
- Zambryski, P. C., Crawford, K. Plasmodesmata: gatekeepers for cell-to-cell transport of developmental signals in plants. Annu Rev Cell Dev Biol. 16, 393-421 (2000).
- Rivero-Lepinckas, L., Crist, D., Scholl, R. Growth of plants and presercation of seeds. Methods Mol Biol. 323, 3-12 (2006).
- Ueki, S., Lacroix, B., Krichevsky, A., Lazarowitz, S. G., Citovsky, V. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nat Protoc. 4, 71-77 (2009).
- Oparka, K. J. Simple, but not branched, plasmodesmata allow the nonspecific trafficking of proteins in developing tobacco leaves. Cell. 97, 743-754 (1999).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11, 309-322 (1999).
- Gisel, A., Barella, S., Hempel, F. D., Zambryski, P. C. Temporal and spatial regulation of symplastic trafficking during development in Arabidopsis thaliana apices. Development. 126, 1879-1889 (1999).
- Kim, I., Cho, E., Crawford, K. M., Hempel, F. D., Zambryski, P. C. Cell-to-cell movement of GFP during embryogenesis and early seedling development in Arabidopsis. Proc Natl Acad Sci USA. 102, 2227-2231 (2005).
- Crawford, K. M., Zambryski, P. C. Non-targeted and targeted protein movement through plasmodesmata in leaves in different developmental and physiological states. Plant Physiol. 125, 1802-1812 (2001).
- Roberts, A. G. Phloem unloading in sink leaves of Nicotiana benthamiana: comparison of a fluorescent solute with a fluorescent virus. Plant Cell. 9, 1381-1396 (1997).
- Guenoune-Gelbart, D., Elbaum, M., Sagi, G., Levy, A., Epel, B. L. Tobacco mosaic virus (TMV) replicase and movement protein function synergistically in facilitating TMV spread by lateral diffusion in the plasmodesmal desmotubule of Nicotiana benthamiana. Mol Plant Microbe Interact. 21, 335-345 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon