Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сотовые к клетке высокомолекулярных транспорта Пробирной В Планта Используя Biolistic Бомбардировка
В этой статье
Резюме
Высокомолекулярных торговли между растительных клеток можно оценить с помощью выражения временно флуоресцентно с метками белок и анализ его внутри-и межклеточных распределение по конфокальной микроскопии.
Аннотация
Здесь мы приведем простой и быстрый протокол для обнаружения и оценки степени клетка-клетка макромолекулярного транспорта в подошвы. В этом протоколе флуоресцентно меченых белков интереса временно выражается в растительной ткани следующие biolistic доставки его ДНК, кодирующей конструкции. Внутри-и межклеточных распределения меченых белков затем анализируется с помощью конфокальной микроскопии. Мы описываем эту технологию в деталях, предоставление шаг за шагом, протоколы анализа и оценки степени symplastic транспортного белка в трех видов растений Arabidopsis thaliana, Nicotiana benthamiana и Н. Tabacum (табак).
протокол
Фон
Symplastic транспорта макромолекул через завода межклеточных соединений, плазмодесмы, представляет интерес для многих фитопатологов и биологов. Например, некоторые вирусные белки, как известно, регулирует plasmodesmal пределы исключения размера, чтобы вирусные движения 1-3. Кроме того, некоторые эндогенных белков, в том числе важных регуляторов развития, предполагается перейти от клетки к клетке, предположительно, через плазмодесмы, функционировать без клеточной автономно 4. Таким образом, надежную методологию для определения и визуализации макромолекулярных транспорта между клеток растений является большим спросом.
1) Рост целевых растений
За высокую эффективность преобразования, здоровые, надежные растения должны быть использованы.
1. Растений Arabidopsis
Расти один Arabidopsis завода по Pro-Mix BX в горшке (10 см х 10 см х 10 см) в среду контролируемый камера с коротким фотопериода (8 ч 130-150 мкЕ м -2 с -1 свет в 23 ° С/16 ч темноте при 20 ° С) и 40-65% относительной влажности в течение от 6 до 8 недель 5. Удобрять их время от времени с помощью коммерчески доступных продуктов, как описано 5. Листья с размером более 15 мм х 35 мм (измерение длины включает черешка), выбранных для экспериментов.
2. Н. benthamiana и Н. Tabacum
Вырастить одного растения на Pro-Mix BX в горшке (20 см х 20 см х 20 см) в среду контролируемой камеры с длинной светового дня (16 ч 130-150 мкЕ м -2 с -1 свет при температуре 23 ° C / 8 ч темноте при 20 ° С) и 40-65% относительной влажности в течение от 7 до 10 недель. Удобрять их время от времени с помощью коммерчески доступных продуктов, как описать. Листья с размером более 50 мм х 70 мм для N. benthamiana, или 100 мм х 125 мм для N. Tabacum (эти измерения длины не включают черешка), выбранных для экспериментов.
2) Подготовка картриджа генной пушки с ДНК, покрытые золотой микрочастиц
Протокол для этой экспериментальной шаг был подробно описан ранее 6. Очень важно использовать хорошо очищенную ДНК плазмиды при высоких концентрациях (~ 1 мкг / мкл), чтобы достичь наивысшей эффективности трансформации для простоты конфокальной микроскопии при анализе на более поздних стадиях эксперимента.
Для этого анализа, важно, чтобы удостовериться, что подготовленный картридж не превращает двух или более смежных ячеек одновременно на высокой частоте, так как количество клеток общения с люминесцентными кластера сигнал используется в качестве индикатора степени транспорта symplastic (т.е. , одной ячейке, содержащей сигнал указывает на отсутствие движения, в то время как кластер многоклеточные сигнал показывает движения). Качество каждого картриджа может быть проверено путем анализа экспрессии белка 16-20 часа после бомбардировки. Наш протокол 6 производит картриджи, которые дают кластеры многоклеточные выражение только в <3% всех выражение событий в этот период времени, тем самым подходящим для этого эксперимента.
3) Biolistic доставки ДНК-покрытием микрочастиц
- Удаление листьев одного и того же стадии развития (то есть с того же размера и того же возраста, см. п. 1) с острым лезвием и сразу же разместить их с абаксиальный стороны вверх на плоскую поверхность пенополистирола. Абаксиальный стороне листа представляет лучший субстрат для обстрела из-за его низкой плотностью трихом и тоньше кутикулы. Arabidopsis листья, из-за их относительно небольшие размеры, должна быть покрыта часть окна сито, а затем фиксируется в сетку с защелки к поверхности пенополистирола. Поддержание Листья плоские повышает эффективность доставки частиц и минимизирует повреждение тканей при microbombardment.
- Вставьте картридж с ДНК покрытием микрочастиц (подготовлен в шаге 1) в пушку. Для Arabidopsis, съемка осуществляется при давлениях 80-110 фунтов на квадратный дюйм для 1-мкм микрочастиц, и 140-160 фунтов на квадратный дюйм для 0,6-мкм микрочастиц. Для Н. benthamiana и табачных изделий, съемка производится при давлении 100-120 фунтов на квадратный дюйм для 1-мкм микрочастиц, и 160-180 фунтов на квадратный дюйм для 0,6-мкм микрочастиц. Для Arabidopsis, мы обычно использует один картридж на лист, потому что каждый лист имеет достаточно поверхность только один выстрел, который распространяется микрочастиц на площади 10-12 мм в диаметре. При больших N. benthamiana и табачных листьев, несколько обстрелов и тот же лист возможны, однако, они должны быть выполнены в симметричной позиции по обе стороны от середины ребра до целевой лист областях, в то же стадии развития (см. Обсуждение).
- Удалите листья с поверхности пенополистирола и разместить их яНе чашку Петри на 3 слоя мокрого ватмане фильтр, печать чашки Петри с парафильмом, и инкубировать при комнатной температуре в течение 36-48 часов, чтобы выражение доставлен трансгенов и потенциальные клетки к ячейке движения их белковых продуктов .
4) Визуализация экспрессии белка
Флуоресцентный сигнал временно выразил меткой белков визуализируется с помощью конфокальной микроскопии. Следует проявлять осторожность, чтобы найти оптимальные настройки микроскопии для обнаружения каждого испытания белка. Например, белки, которые показывают ограниченную внутриклеточного накопления со слабой интенсивностью сигнала, таких как plasmodesmal локализации вируса табачной мозаики движения белка (ВТМ МП) 1-3,6, должны быть соблюдены при 40х объектив, который обеспечивает высокое разрешение и чувствительность, в то время как белки, которые показывают распределение цитоплазматических с сильной интенсивности сигнала, такие как бесплатный YFP, могут быть визуализированы в 10х объективом с конфокальной функция зума для более быстрой визуализации (см. Рисунок 1).
Symplastic транспорта выводится из Появление многоклеточной кластеров, содержащих флуоресцентный сигнал. Количество таких кластеров и количество клеток в каждой группе, свидетельствует о степени клетка-клетка транспорта. Для получения надежных данных, по крайней мере 100 кластеров выражение должно быть записано в каждой экспериментальной системы. Например, если клетка-клетка движения белка сравнивается в двух различных генетических фоны (например, дикого типа и трансгенных растений), из всего 200 кластеров выражение должно быть записано. Важно отметить, что эксперименты, результаты которых должны быть сравнены друг с другом, должны проводиться одновременно.
5. Представитель Результаты
Рисунок ниже иллюстрирует представитель экспериментов для обнаружения symplastic транспорта флуоресцентно меткой белков. Панели А и В показывают типичный конфокальной изображения, которые получаются следующие microbombardment из Н. benthamiana лист с ВТМ MP-YFP экспрессией конструкции. В панели, symplastic движения ВТМ MP-YFP наблюдается на основе возникновения кластеров многоклеточные сигнала, YFP. Не все временно выразил ВТМ MP-YFP в состоянии двигаться, о чем свидетельствует одноклеточных сигнала в некоторых microbombardments (группа В). По статистике, в <40% считали кластеров сигнал, ВТМ MP-YFP не в состоянии передвигаться между клетками, тогда как в> 60% от кластеров, белка перемещается между 2-5 клетки, с двух клеток распространения является наиболее частой (около ~ 50% случаев) (рис. 1в).
Белки с относительно небольшой размер молекулы без врожденной двигательной активности может диффундировать через PD двигаться от клетки к клетке. Например, бесплатный YFP или 1xYFP (около 27 кДа, панель D), спреды между несколькими клетками в 30% считается кластеров (панели C). Это неспецифическая диффузия не происходит для поступательного диммер YFP или 2xYFP (54 кДа, панель E), что сопоставимо по размеру с ВТМ MP-YFP гибридного белка (57 кДа), и который полностью клеточной автономных (рис. 1С).
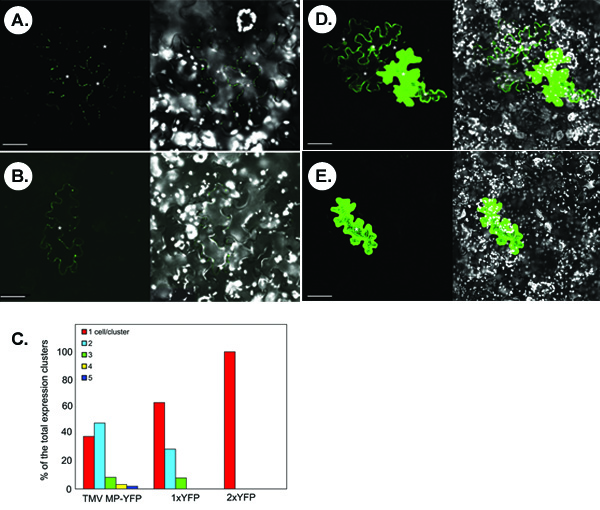
Рисунок 1. Типичные результаты, полученные при анализе symplastic транспорта в Н. benthamiana тканях листа. (А, В) Визуализация ВТМ MP-YFP. (C) Количественный анализ сигнала кластеров. 1xYFP и 2xYFP, бесплатное YFP и трансляционной YFP димера соответственно. (D) Визуализация 1xYFP. (Е) Визуализация 2xYFP. В микрофотографии, левой панели показывают YFP сигнал и правой частях показаны объединены образы YFP (зеленый цвет) и хлоропластов флуоресценции (в белом) сигналы. Изображения одного конфокальной разделов. Звездочки в микрофотографии показывают клеток эпидермиса показывает YFP сигнала. Bars = 50 мкм.
Обсуждение
Ключ для успеха symplastic анализа транспорт для получения высокой эффективности преобразования, что позволяет выпускать статистически значимое и легко поддающийся обнаружению кластеров сигнала. Это может быть достигнуто с помощью листьев собранных от здоровых, надежных растений, а такж...
Раскрытие информации
Благодарности
Наша работа поддержана грантами NIH / NIGMS, NSF, USDA / НИФА и BARD к ВК.
Материалы
| Name | Company | Catalog Number | Comments |
| Gold microparticles, 1.0 μm in diameter | Bio-Rad | 165-2262 | |
| Gold microparticles, 0.6 μm in diameter | Bio-Rad | 165-2263 | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Tefzel tubing | Bio-Rad | 165-2441 | |
| Helios cartridge preparatory station | Bio-Rad | 165-2420 | |
| Tubing cutter | Bio-Rad | 165-2422 | |
| Helios gene gun | Bio-Rad | 165-2432 | |
| Helium gas regulator | Bio-Rad | 165-2413 |
Ссылки
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of non-destructive cell-to-cell and systemic movement of plant viruses. . Crit Rev Plant Sci. 23, 195-250 (2004).
- Lucas, W. J. Plant viral movement proteins: agents for cell-to-cell trafficking of viral genomes. Virology. 344, 169-184 (2006).
- Epel, B. L. Plant viruses spread by diffusion on ER-associated movement-protein-rafts through plasmodesmata gated by viral induced host beta-1,3-glucanases. Semin Cell Dev Biol. 20, 1074-1081 (2009).
- Zambryski, P. C., Crawford, K. Plasmodesmata: gatekeepers for cell-to-cell transport of developmental signals in plants. Annu Rev Cell Dev Biol. 16, 393-421 (2000).
- Rivero-Lepinckas, L., Crist, D., Scholl, R. Growth of plants and presercation of seeds. Methods Mol Biol. 323, 3-12 (2006).
- Ueki, S., Lacroix, B., Krichevsky, A., Lazarowitz, S. G., Citovsky, V. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nat Protoc. 4, 71-77 (2009).
- Oparka, K. J. Simple, but not branched, plasmodesmata allow the nonspecific trafficking of proteins in developing tobacco leaves. Cell. 97, 743-754 (1999).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11, 309-322 (1999).
- Gisel, A., Barella, S., Hempel, F. D., Zambryski, P. C. Temporal and spatial regulation of symplastic trafficking during development in Arabidopsis thaliana apices. Development. 126, 1879-1889 (1999).
- Kim, I., Cho, E., Crawford, K. M., Hempel, F. D., Zambryski, P. C. Cell-to-cell movement of GFP during embryogenesis and early seedling development in Arabidopsis. Proc Natl Acad Sci USA. 102, 2227-2231 (2005).
- Crawford, K. M., Zambryski, P. C. Non-targeted and targeted protein movement through plasmodesmata in leaves in different developmental and physiological states. Plant Physiol. 125, 1802-1812 (2001).
- Roberts, A. G. Phloem unloading in sink leaves of Nicotiana benthamiana: comparison of a fluorescent solute with a fluorescent virus. Plant Cell. 9, 1381-1396 (1997).
- Guenoune-Gelbart, D., Elbaum, M., Sagi, G., Levy, A., Epel, B. L. Tobacco mosaic virus (TMV) replicase and movement protein function synergistically in facilitating TMV spread by lateral diffusion in the plasmodesmal desmotubule of Nicotiana benthamiana. Mol Plant Microbe Interact. 21, 335-345 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены