Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Cell-to-cell Makromolekulare Transport Assay In Planta Verwendung Biolistic Bombardment
In diesem Artikel
Zusammenfassung
Makromolekulare Handel zwischen Pflanzenzellen können durch transiente Expression eines Fluoreszenz-markierten Proteins von Interesse und die Analyse ihrer intra-und interzelluläre Verteilung durch konfokale Mikroskopie beurteilt werden.
Zusammenfassung
Hier stellen wir ein einfaches und schnelles Protokoll zu erkennen und zu beurteilen, das Ausmaß der Zell-Zell-makromolekularen Transport in planta. In diesem Protokoll wird ein fluoreszenzmarkierten-Protein von Interesse vorübergehend in Pflanzengewebe folgenden biolistischen Auslieferung der kodierenden DNA-Konstrukt zum Ausdruck gebracht. Die intra-und interzelluläre Verteilung der markierte Protein wird dann durch konfokale Mikroskopie analysiert. Wir beschreiben diese Technik im Detail und bietet Schritt-für-Schritt-Protokolle Assay und der Beurteilung von symplastisch Transport von Proteinen in drei Pflanzenarten, Arabidopsis thaliana, Nicotiana benthamiana und N. tabacum (Tabak).
Protokoll
Hintergrund
Symplastisch Transport von Makromolekülen durch Anlage interzellulären Verbindungen, die Plasmodesmen, ist von Interesse für viele Pflanzen-Pathologen und Biologen. Zum Beispiel sind mehrere virale Proteine bekannt, plasmodesmal Größenausschlusschromatographie Grenzen zu regulieren, damit virale Bewegung 1-3. Auch sind einige endogene Proteine, darunter wichtige Entwicklungs-Regulatoren, angenommen von Zelle zu Zelle bewegen, vermutlich durch Plasmodesmen, nicht-Zell-autonome 4 Funktionstasten. So ist eine zuverlässige Methode zur Identifizierung und Visualisierung von makromolekularen Transport zwischen Pflanzenzellen sehr gefragt.
1) wachsen Zielpflanzen
Für hohe Transformationseffizienz, sollten gesunde, robuste Pflanzen verwendet werden.
1. Arabidopsis-Pflanzen
Wachsen ein Arabidopsis-Pflanze auf Pro-Mix BX in einem Topf (10 cm x 10 cm x 10 cm) in einer Umgebung, kontrollierten Kammer mit einer kurzen Photoperiode (8 Std. von 130-150 uE m -2 s -1 Licht bei 23 ° C/16 h Dunkelheit bei 20 ° C) und 40-65% relativer Luftfeuchtigkeit für 6 bis 8 Wochen 5. Düngen Sie sie gelegentlich mit handelsüblichen Produkten wie beschrieben 5. Blätter mit der Größe von mehr als 15 mm x 35 mm (der Längenmessung umfasst Blattstiel) sind für die Experimente ausgewählt.
2. N. benthamiana und N. tabacum
Wachsen einer Pflanze auf Pro-Mix BX in einem Topf (20 cm x 20 cm x 20 cm) in einer Umgebung, kontrollierten Kammer mit einer langen Photoperiode (16 hr von 130-150 uE m -2 s -1 Licht bei 23 ° C / 8 h Dunkelheit bei 20 ° C) und 40-65% relativer Luftfeuchtigkeit für 7 bis 10 Wochen. Düngen Sie sie gelegentlich mit handelsüblichen Produkten wie beschreiben. Blätter mit einer Größe größer als 50 mm x 70 mm für N. benthamiana oder 100 mm x 125 mm für N. tabacum (diese Länge Messungen umfassen nicht Blattstiel) sind für die Experimente ausgewählt.
2) Herstellung der Gene Gun Cartridge mit DNA-beschichteten Gold-Mikropartikel
Das Protokoll für diesen experimentellen Schritt wurde im Detail bereits 6 beschrieben. Es ist sehr wichtig, gut gereinigte Plasmid-DNA bei hohen Konzentrationen (~ 1 ug / ul) auf den höchsten Wirkungsgrad bei der die Leichtigkeit der konfokalen Mikroskopie Analyse in den späteren Phasen des Experiments zu erhalten verwenden.
Für diesen Test ist es wichtig festzustellen, dass die vorbereitete Kartusche nicht verwandeln zwei oder mehr benachbarte Zellen gleichzeitig mit hoher Frequenz, weil die Zahl der Zellen assoziieren mit einem Fluoreszenz-Signal-Cluster als ein Indikator für das Ausmaß der symplastisch Verkehr (dh verwendet wird , eine einzelne Zelle mit dem Signal zeigt an, keine Bewegung, während ein multicell Signal-Cluster zeigt Bewegung). Die Qualität der einzelnen Patronen kann durch die Analyse der Expression des Proteins 16-20 Stunden post Beschuss geprüft werden. Unser Protokoll 6 erzeugt Patronen, die multicell Ausdruck Cluster nur in <3% aller Ausdruck Ereignisse in diesem Zeitraum, so geeignet für dieses Experiment ergeben.
3) Biolistic Lieferung von DNA-beschichteten Mikropartikeln
- Entfernen Sie die Blätter der gleichen Entwicklungsstufe (dh mit gleicher Größe und gleichem Alter, siehe Schritt 1) mit einer scharfen Rasierklinge und sofort legen Sie sie mit der abaxialen Seiten nach oben auf eine flache Oberfläche aus Styropor. Die abaxialen Seite des Blattes ist ein besseres Substrat für Bombardements aufgrund seiner geringeren Dichte Trichom und dünner Cuticula. Arabidopsis Blättern, die aufgrund ihrer relativ geringen Größe, mit einem Stück Fenster Siebgewebe sollte abgedeckt werden, und das Netz dann mit Reißzwecken befestigt die Styropor-Oberfläche. Die Aufrechterhaltung Blätter flach erhöht die Effizienz des Teilchens Lieferung und minimiert die Schädigung des Gewebes während microbombardment.
- Setzen Sie die Patrone mit DNA-beschichteten Mikropartikeln (hergestellt in Schritt 1) in der Pistole. Für Arabidopsis, ist der Shooting bei einem Druck von 80-110 psi für 1-um Mikropartikel, und 140-160 psi für 0,6-um Mikropartikel durchgeführt. Für N. benthamiana und Tabak, ist der Shooting bei einem Druck von 100-120 bar für 1-um Mikropartikel, und 160-180 psi für 0,6-um Mikropartikel durchgeführt. Für Arabidopsis, wir verwenden normalerweise eine Patrone pro Blatt, weil jedes Blatt hat genug Fläche nur für eine Aufnahme, die Mikropartikel erstreckt sich über eine Fläche von 10-12 mm im Durchmesser. Bei größeren N. benthamiana und Tabakblättern, mehrere Bombardierungen der selben Blatt sind möglich, jedoch müssen sie bei der symmetrischen Positionen auf jeder Seite der Mittelrippe, die Blattflächen auf derselben Entwicklungsstufe Ziel (siehe Diskussion) durchgeführt werden.
- Entfernen Sie die Blätter aus dem Styropor Oberfläche und sie inicht eine Petrischale auf 3 Schichten nassen Whatman Filterpapier, versiegeln Sie die Petrischale mit Parafilm, und inkubieren Sie bei Raumtemperatur für 36-48 Stunden, um die Expression der Transgene geliefert und das Potenzial von Zelle zu Zelle Bewegung ihrer Eiweiss-Produkte ermöglichen .
4) Imaging of Protein Expression
Das Fluoreszenzsignal des transient exprimiert markierte Proteine visualisiert durch konfokale Mikroskopie. Es sollte darauf geachtet, um eine optimale Mikroskopie Einstellungen für die Erkennung der jeweils getesteten Protein zu finden. Zum Beispiel Proteine, die begrenzte intrazelluläre Akkumulation Show mit schwachen Signalintensitäten, wie die plasmodesmal Lokalisation des Tabak-Mosaik-Virus Bewegung Protein (TMV MP) 1-3,6, sollten unter einem 40x Objektiv, das eine höhere Auflösung und bietet beobachtet werden Empfindlichkeit, während Proteine, die zytoplasmatische Verteilung zeigen, mit starken Signalintensitäten, wie freie YFP, kann unter einem 10x Objektiv mit konfokaler Zoom-Funktion für eine schnellere Bildgebung (siehe Abbildung 1) visualisiert.
Symplastisch Transport aus dem Auftreten von mehrzelligen Cluster, dass die Fluoreszenz-Signal enthalten abgeleitet. Die Zahl solcher Cluster und die Anzahl der Zellen in jedem Cluster ist bezeichnend für das Ausmaß der Zelle zu Zelle zu transportieren. Um zuverlässige Daten, sollte mindestens 100 Ausdruck Cluster pro experimentelles System erfasst werden. Zum Beispiel sollte, wenn die Zelle zu Zelle Bewegung eines Proteins ist in zwei unterschiedlichen genetischen Hintergründen (zB Wildtyp und transgenen Pflanzen), mit einem Gesamtwert von 200 Expressions-Clustern verglichen aufgezeichnet werden. Wichtig ist, dass Versuche, sollten die Ergebnisse, die miteinander verglichen werden, sind gleichzeitig durchgeführt werden.
5. Repräsentative Ergebnisse
Die folgende Abbildung zeigt repräsentative Experimente zum Nachweis von symplastisch Transport von fluoreszenzmarkierten Proteinen. Die Abbildungen A und B zeigen die typische konfokale Bilder, die folgenden microbombardment einer N. gewonnen werden benthamiana Blatt mit einem TMV MP-YFP-exprimierenden konstruieren. In Panel A, symplastisch Bewegung der TMV MP-YFP wird basierend auf dem Aussehen der multicell Cluster der YFP-Signal beobachtet. Nicht alle transient exprimiert TMV MP-YFP ist in der Lage sich zu bewegen, wie Single-Cell-Signal in einigen microbombardments (Panel B) zeigt. Statistisch gesehen, in <40% der gezählten Signal-Cluster ist TMV MP-YFP nicht zwischen den Zellen während bewegen sich in> 60% der Cluster, bewegt sich das Protein zwischen 2-5 Zellen, wobei die beiden Zellen verteilt die häufigste (ca. ~ 50% der Fälle) (Abbildung 1C).
Die Proteine mit relativ kleinen Molekülgröße, ohne angeborene Bewegung Aktivität kann durch PD diffuse, um von Zelle zu Zelle bewegen. Zum Beispiel, breitet sich kostenlos YFP oder 1xYFP (ca. 27 kDa, Panel D), zwischen mehreren Zellen in 30% der gezählten Cluster (Panels C). Diese unspezifische Diffusion nicht für eine translationale YFP Dimmer oder 2xYFP (54 kDa, Panel E), die in der Größe vergleichbar ist, TMV MP-YFP-Fusionsprotein (57 kDa), und die vollständig zellautonome auftreten (Abb. 1C).
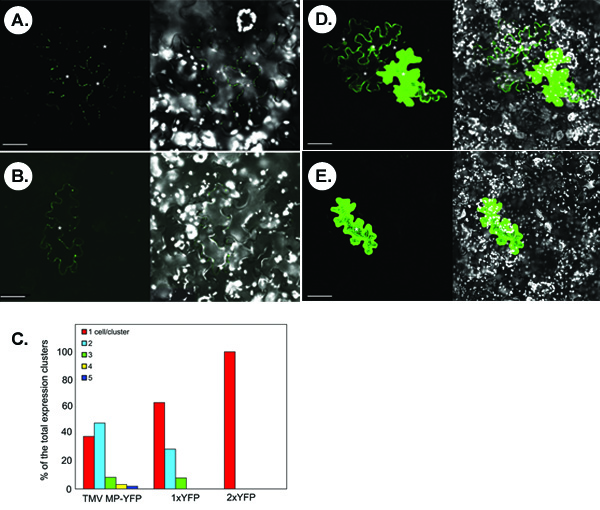
Abbildung 1. Typische Ergebnisse aus der symplastisch Transport-Assay in N. erhalten benthamiana Blattgewebe. (A, B) Visualisierung von TMV MP-YFP. (C) Quantifizierung der Signal-Cluster. 1xYFP und 2xYFP, frei YFP und translationale YFP Dimer bzw.. (D) Visualisierung von 1xYFP. (E) Visualisierung von 2xYFP. In Aufnahmen zeigen die linken Panels der YFP-Signal und das Recht Tafeln zeigen fusionierten Bilder von YFP (in grün) und Chloroplasten-Autofluoreszenz (in weiß) Signale. Die Bilder werden einzelne konfokale Schnitte. Sternchen in den Aufnahmen zeigen die Epidermiszellen zeigt YFP-Signal. Bars = 50 um.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Der Schlüssel für den Erfolg der symplastisch Transport-Assay ist eine hohe Transformationseffizienz, die Produktion von statistisch signifikant und leicht nachweisbaren Signal-Cluster ermöglicht zu erhalten. Dies kann erreicht werden mit den Blättern von gesunden, robusten Pflanzen geerntet, und die Vorbereitung Goldpartikel durch eine reine und konzentrierte DNA-Präparation beschichtet werden.
Mit den Blättern an der gleichen Wachstumsphase ist auch entscheidend für den Test Zuverl?...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Unsere Arbeit wird durch Zuschüsse von NIH / NIGMS, NSF, USDA / NIFA und BARD zu VC unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Gold microparticles, 1.0 μm in diameter | Bio-Rad | 165-2262 | |
| Gold microparticles, 0.6 μm in diameter | Bio-Rad | 165-2263 | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Tefzel tubing | Bio-Rad | 165-2441 | |
| Helios cartridge preparatory station | Bio-Rad | 165-2420 | |
| Tubing cutter | Bio-Rad | 165-2422 | |
| Helios gene gun | Bio-Rad | 165-2432 | |
| Helium gas regulator | Bio-Rad | 165-2413 |
Referenzen
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of non-destructive cell-to-cell and systemic movement of plant viruses. Crit Rev Plant Sci. 23, 195-250 (2004).
- Lucas, W. J. Plant viral movement proteins: agents for cell-to-cell trafficking of viral genomes. Virology. 344, 169-184 (2006).
- Epel, B. L. Plant viruses spread by diffusion on ER-associated movement-protein-rafts through plasmodesmata gated by viral induced host beta-1,3-glucanases. Semin Cell Dev Biol. 20, 1074-1081 (2009).
- Zambryski, P. C., Crawford, K. Plasmodesmata: gatekeepers for cell-to-cell transport of developmental signals in plants. Annu Rev Cell Dev Biol. 16, 393-421 (2000).
- Rivero-Lepinckas, L., Crist, D., Scholl, R. Growth of plants and presercation of seeds. Methods Mol Biol. 323, 3-12 (2006).
- Ueki, S., Lacroix, B., Krichevsky, A., Lazarowitz, S. G., Citovsky, V. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nat Protoc. 4, 71-77 (2009).
- Oparka, K. J. Simple, but not branched, plasmodesmata allow the nonspecific trafficking of proteins in developing tobacco leaves. Cell. 97, 743-754 (1999).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11, 309-322 (1999).
- Gisel, A., Barella, S., Hempel, F. D., Zambryski, P. C. Temporal and spatial regulation of symplastic trafficking during development in Arabidopsis thaliana apices. Development. 126, 1879-1889 (1999).
- Kim, I., Cho, E., Crawford, K. M., Hempel, F. D., Zambryski, P. C. Cell-to-cell movement of GFP during embryogenesis and early seedling development in Arabidopsis. Proc Natl Acad Sci USA. 102, 2227-2231 (2005).
- Crawford, K. M., Zambryski, P. C. Non-targeted and targeted protein movement through plasmodesmata in leaves in different developmental and physiological states. Plant Physiol. 125, 1802-1812 (2001).
- Roberts, A. G. Phloem unloading in sink leaves of Nicotiana benthamiana: comparison of a fluorescent solute with a fluorescent virus. Plant Cell. 9, 1381-1396 (1997).
- Guenoune-Gelbart, D., Elbaum, M., Sagi, G., Levy, A., Epel, B. L. Tobacco mosaic virus (TMV) replicase and movement protein function synergistically in facilitating TMV spread by lateral diffusion in the plasmodesmal desmotubule of Nicotiana benthamiana. Mol Plant Microbe Interact. 21, 335-345 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten