É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A célula-célula Assay Transporte Macromoleculares Na Planta Utilizando Bombardeio biobalística
Neste Artigo
Resumo
Tráfico macromolecular entre células vegetais pode ser avaliado por transitoriamente expressar uma proteína fluorescente-tag de interesse e análise de sua distribuição intra-e intercelular por microscopia confocal.
Resumo
Aqui, apresentamos um protocolo simples e rápida para detectar e avaliar a extensão da célula-célula de transporte macromolecular na planta. Neste protocolo, uma proteína fluorescente etiquetado de interesse é transitoriamente expressa no tecido vegetal após a entrega biobalística de seu DNA de codificação de construir. A distribuição intra-e intercelular da proteína com a tag é então analisada por microscopia confocal. Descrevemos esta tecnologia em detalhes, proporcionando passo-a-passo protocolos para análise e avaliar a extensão do transporte de proteínas simplástico em três espécies de plantas, Arabidopsis thaliana, Nicotiana benthamiana e N. tabacum (tabaco).
Protocolo
Fundo
Simplástico transporte de macromoléculas através de conexões intercelulares de plantas, o plasmodesmos, é de interesse para muitos fitopatologistas e biólogos. Por exemplo, várias proteínas virais são conhecidas para regular os limites de exclusão plasmodesmal tamanho para permitir o movimento viral 1-3. Além disso, algumas proteínas endógenas, entre eles importantes reguladores do desenvolvimento, são assumidos para se deslocar de célula para célula, presumivelmente através de plasmodesmos, a função não-celular-autônoma 4. Assim, uma metodologia confiável para identificar e visualizar transporte macromolecular entre células vegetais é muito procurada.
1) Deixar crescer as plantas alvo
Para a eficiência de transformação de alta, saudável, plantas robustas devem ser usados.
1. Plantas de Arabidopsis
Crescer uma planta Arabidopsis na Pro-Mix BX em uma panela (10 cm x 10 cm x 10 cm) em uma câmara de ambiente controlado com fotoperíodo curto (8 horas de 130-150 μE m -2 s -1 de luz a 23 ° C/16 h escuro a 20 ° C) e 40-65% de umidade relativa de 6 a 8 semanas 5. Fertilizá-los ocasionalmente com produtos comercialmente disponíveis como descrito em 5. Folhas com o tamanho maior que 15 mm x 35 mm (a medida do comprimento inclui pecíolo) são selecionados para os experimentos.
2. N. benthamiana e N. tabacum
Crescer uma planta na Pro-Mix BX em uma panela (20 cm x 20 cm x 20 cm) em uma câmara de ambiente controlado com fotoperíodo longo (16 h de 130-150 μE -2 s m -1 luz a 23 ° C / 8 hr escuro a 20 ° C) e 40-65% de umidade relativa por 7 a 10 semanas. Fertilizá-los ocasionalmente com produtos comercialmente disponíveis como descrever. Folhas com tamanho maior do que 50 mm x 70 mm para N. benthamiana, ou 100 mm x 125 mm para N. tabacum (estas medidas de comprimento não incluem pecíolo) são selecionados para os experimentos.
2) Preparação do cartucho de Gene Gun com DNA revestido de ouro Micropartículas
O protocolo experimental para esta etapa já foi descrito em detalhes anteriormente 6. É muito importante usar bem DNA plasmidial purificado em altas concentrações (~ 1 mg / mL) para obter a maior eficiência de transformação para a facilidade de análise de microscopia confocal durante os últimos estágios do experimento.
Para este ensaio, é importante verificar que o cartucho preparado não transforma duas ou mais células adjacentes ao mesmo tempo em alta freqüência, porque o número de células associar com um cluster de sinal fluorescente é utilizado como um indicador da extensão do transporte simplástico (ie , uma única célula que contém o sinal indica que não há movimento, enquanto um cluster sinal multicell indica movimento). A qualidade do cartucho de cada um pode ser verificado através da análise da expressão da proteína bombardeio pós 16-20 horas. Nosso protocolo 6 produz cartuchos que produzem cachos expressão multicell apenas em <3% de todos os eventos de expressão neste espaço de tempo, portanto, adequado para este experimento.
3) Entrega de biobalística DNA revestido por Micropartículas
- Retire as folhas do mesmo estágio de desenvolvimento (ou seja, com o mesmo tamanho e mesma idade, consulte a etapa 1) com uma lâmina afiada e imediatamente colocá-los com os lados abaxial voltada para cima sobre uma superfície plana de isopor. O lado abaxial da folha representa um melhor substrato para bombardeio, devido à sua menor densidade de tricomas e mais fino cutícula. Folhas de Arabidopsis, por causa de seu tamanho relativamente pequeno, deve ser coberto com um pedaço de malha de tela da janela, ea malha então fixado com pinos à superfície de isopor. Manutenção de folhas planas aumenta a eficiência da entrega de partículas e minimiza os danos ao tecido durante microbombardment.
- Insira o cartucho com DNA revestido por micropartículas (preparada no passo 1) para a arma. Para Arabidopsis, o tiroteio é realizada com pressões de 80-110 psi para uma mícrons micropartículas, e 140-160 psi para 0,6 mM-micropartículas. Para N. benthamiana e tabaco, o tiro é realizado sob pressões de 100-120 psi para uma mícrons micropartículas, e 160-180 psi para 0,6 mícrons micropartículas. Para Arabidopsis, que geralmente utilizam um cartucho por folha, pois cada folha tem superfície suficiente apenas para um único tiro, que se espalha micropartículas em uma área de 10-12 mm de diâmetro. N. com maior benthamiana e folhas de tabaco, bombardeios múltiplo da mesma folha são possíveis, no entanto, devem ser feitas nas posições simétricas em cada lado da nervura central para direcionar a área foliar no mesmo estágio de desenvolvimento (ver Discussão).
- Retire as folhas da superfície de isopor e coloque-os inão um prato de Petri em 3 camadas de papel de filtro Whatman molhada, selar a placa de Petri com Parafilm e incube-lo em temperatura ambiente por 36-48 horas para permitir a expressão dos transgenes entregues e potencial de célula a célula-movimento de seus produtos protéicos .
4) Imagem de expressão da proteína
O sinal fluorescente das proteínas expressas transitoriamente tag é visualizado por microscopia confocal. Cuidados devem ser tomados para encontrar as configurações de microscopia ideal para a detecção de cada proteína testada. Por exemplo, as proteínas que apresentam acúmulo intracelular limitada com intensidades de sinal fraco, como a localização plasmodesmal do Tabaco proteína movimento mosaic virus (TMV MP) 1-3,6, deve ser observado sob uma lente objetiva de 40X, o que proporciona maior resolução e sensibilidade, enquanto que as proteínas que mostram a distribuição citoplasmática com intensidades de sinal forte, como YFP livre, pode ser visualizada sob uma lente objetiva de 10X, com função de zoom de imagem confocal para uma mais rápida (ver Figura 1).
Transporte simplástico é inferida a partir do aparecimento de clusters multicell que contêm o sinal fluorescente. O número desses agregados eo número de células em cada cluster é um indicativo da extensão da célula a célula-transporte. Para obter dados fiáveis, pelo menos 100 grupos de expressão devem ser registrados por cada sistema experimental. Por exemplo, se o movimento célula a célula de uma proteína é comparada em dois diferentes backgrounds genéticos (por exemplo, tipo selvagem e plantas transgênicas), de um total de 200 clusters de expressão deve ser gravado. Importante, experimentos, cujos resultados devem ser comparados uns com os outros, devem ser realizadas simultaneamente.
5. Resultados representante
A figura abaixo ilustra experimentos representativos para a detecção de transporte simplástico de proteínas fluorescentes marcados. Os painéis A e B mostram as imagens típicas confocal que são obtidos microbombardment a seguir de um N. benthamiana folha com um TMV MP-YFP expressando construir. Um movimento no painel, simplástico de TMV MP-YFP é observado com base na aparência dos clusters multicell do sinal YFP. Nem todos os TMV transitoriamente expressa MP-YFP é capaz de se mover como evidenciado por uma única célula do sinal em alguns microbombardments (painel B). Estatisticamente, em <40% dos clusters sinal contados, TMV MP-YFP é incapaz de se mover entre as células enquanto que em> 60% dos clusters, a proteína se move entre as células 2-5, com a propagação de duas células, sendo mais frequente (ca. ~ casos 50%) (Figura 1C).
As proteínas com relativamente pequeno tamanho molecular, sem a atividade do movimento inato pode difundir através PD para mover de célula para célula. Por exemplo, YFP livre, ou 1xYFP (ca. 27 kDa, painel D), se espalha entre várias células em 30% dos clusters contados (painéis C). Esta difusão não-específica não ocorre por um dimmer YFP translacional, ou 2xYFP (54 kDa, E painel), que é comparável em tamanho a TMV proteína de fusão MP-YFP (57 kDa), e que é completamente células autónomas (Figura 1C).
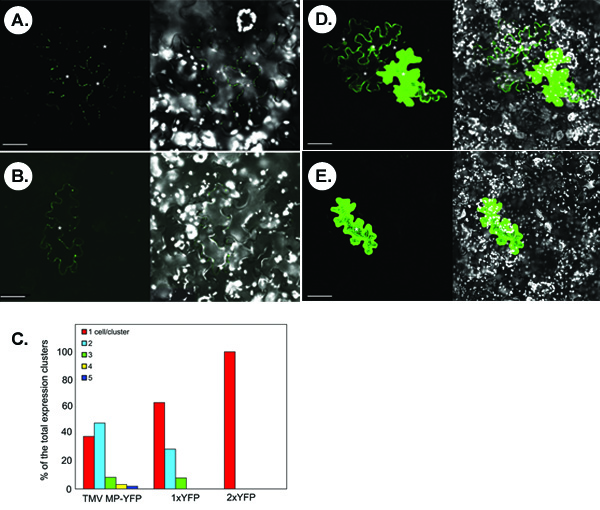
Figura 1. Os resultados típicos obtidos a partir do ensaio de transporte simplástico em N. tecidos benthamiana folha. (A, B) Visualização de TMV MP-YFP. (C) A determinação quantitativa de grupos de sinal. 1xYFP e 2xYFP, livre YFP e translacional YFP dímero, respectivamente. (D) Visualização de 1xYFP. (E) Visualização de 2xYFP. Em micrografias, os painéis esquerda mostram o sinal YFP e os painéis da direita mostram imagens mesclada de YFP (em verde) e autofluorescência cloroplasto (em branco) sinais. As imagens são única seções confocal. Asteriscos no micrografias mostram que as células epidérmicas mostrando sinal YFP. Barras = 50 mm.
Access restricted. Please log in or start a trial to view this content.
Discussão
A chave para o sucesso do ensaio de transporte simplástico é a obtenção de alta eficiência de transformação, que permite a produção de aglomerados de sinal estatisticamente significativo e facilmente detectável. Isto pode ser conseguido usando as folhas colhidas de plantas saudáveis e robustas, e preparar partículas de ouro revestidas por uma preparação de DNA puro e concentrado.
Usando as folhas na fase de crescimento mesmo também é vital para a confiabilidade do ensai...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Nosso trabalho é suportado por concessões do NIH / NIGMS, NSF, USDA / Nifa e BARD para VC.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Gold microparticles, 1.0 μm in diameter | Bio-Rad | 165-2262 | |
| Gold microparticles, 0.6 μm in diameter | Bio-Rad | 165-2263 | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Tefzel tubing | Bio-Rad | 165-2441 | |
| Helios cartridge preparatory station | Bio-Rad | 165-2420 | |
| Tubing cutter | Bio-Rad | 165-2422 | |
| Helios gene gun | Bio-Rad | 165-2432 | |
| Helium gas regulator | Bio-Rad | 165-2413 |
Referências
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of non-destructive cell-to-cell and systemic movement of plant viruses. Crit Rev Plant Sci. 23, 195-250 (2004).
- Lucas, W. J. Plant viral movement proteins: agents for cell-to-cell trafficking of viral genomes. Virology. 344, 169-184 (2006).
- Epel, B. L. Plant viruses spread by diffusion on ER-associated movement-protein-rafts through plasmodesmata gated by viral induced host beta-1,3-glucanases. Semin Cell Dev Biol. 20, 1074-1081 (2009).
- Zambryski, P. C., Crawford, K. Plasmodesmata: gatekeepers for cell-to-cell transport of developmental signals in plants. Annu Rev Cell Dev Biol. 16, 393-421 (2000).
- Rivero-Lepinckas, L., Crist, D., Scholl, R. Growth of plants and presercation of seeds. Methods Mol Biol. 323, 3-12 (2006).
- Ueki, S., Lacroix, B., Krichevsky, A., Lazarowitz, S. G., Citovsky, V. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nat Protoc. 4, 71-77 (2009).
- Oparka, K. J. Simple, but not branched, plasmodesmata allow the nonspecific trafficking of proteins in developing tobacco leaves. Cell. 97, 743-754 (1999).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11, 309-322 (1999).
- Gisel, A., Barella, S., Hempel, F. D., Zambryski, P. C. Temporal and spatial regulation of symplastic trafficking during development in Arabidopsis thaliana apices. Development. 126, 1879-1889 (1999).
- Kim, I., Cho, E., Crawford, K. M., Hempel, F. D., Zambryski, P. C. Cell-to-cell movement of GFP during embryogenesis and early seedling development in Arabidopsis. Proc Natl Acad Sci USA. 102, 2227-2231 (2005).
- Crawford, K. M., Zambryski, P. C. Non-targeted and targeted protein movement through plasmodesmata in leaves in different developmental and physiological states. Plant Physiol. 125, 1802-1812 (2001).
- Roberts, A. G. Phloem unloading in sink leaves of Nicotiana benthamiana: comparison of a fluorescent solute with a fluorescent virus. Plant Cell. 9, 1381-1396 (1997).
- Guenoune-Gelbart, D., Elbaum, M., Sagi, G., Levy, A., Epel, B. L. Tobacco mosaic virus (TMV) replicase and movement protein function synergistically in facilitating TMV spread by lateral diffusion in the plasmodesmal desmotubule of Nicotiana benthamiana. Mol Plant Microbe Interact. 21, 335-345 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados